Los tumores benignos de la vaina del nervio periférico incluyen neurofibromas, schwannomas y los perineuromas menos frecuentes. Se han reconocido nuevos casos que muestran características de más de un tipo histológico en los últimos años, originándose la gran mayoría en los nervios periféricos de la extremidad y el tronco. La patogénesis es pobremente comprendida y la inmunohistoquímica es esencial para confirmar el diagnóstico. Los tumores híbridos que afectan el tracto gastrointestinal son extremadamente raros. A continuación presentamos un caso de schwannoma/perineurioma del estómago.
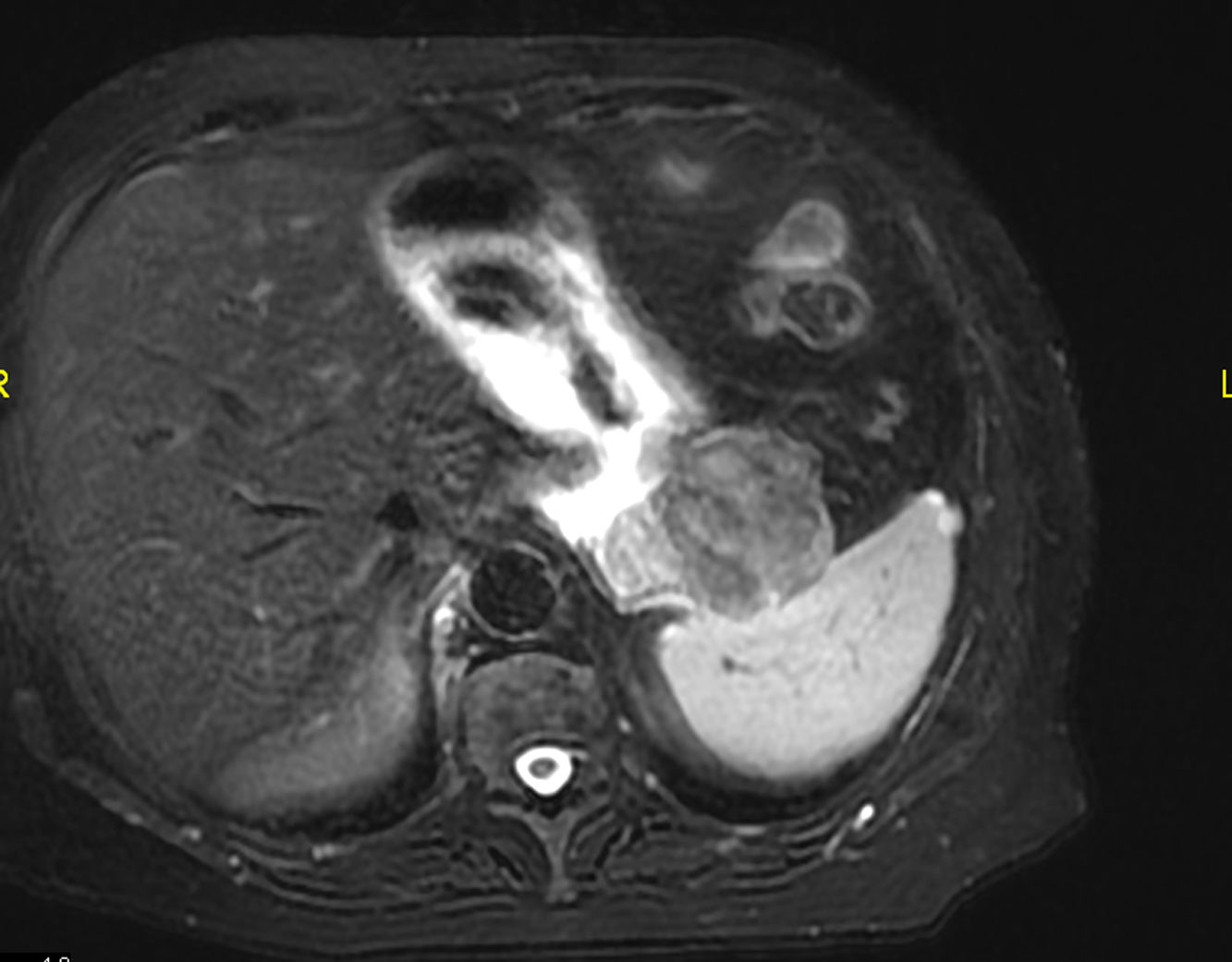
Una mujer caucásica de 76 años fue remitida a nuestro departamento con una historia de 2 meses de dolor abdominal, apetito y pérdida de peso. Los antecedentes médicos incluyeron apendicectomía, tiroidectomía por bocio multinodular y fibrilación auricular. Del examen físico no se obtuvieron datos relevantes ni se identificaron signos de neurofibromatosis. Los niveles de hemoglobina eran de 8,5g/dl y los marcadores de tumores comunes estaban dentro del rango normal. La esofagogastroduodenoscopia fue negativa. La tomografía computarizada de detectores múltiples reveló una masa exofítica isodensa de 7×6,5cm surgiendo de la curvatura mayor del estómago, y colindando con la cola pancreática y el hilio esplénico. En la resonancia magnética, la imagen parecía irregular, principalmente hipointensa, tanto en T1 como en T2, con realce homogéneo después de la administración de contraste (fig. 1). No se detectaron signos de hemorragia, degeneración quística o necrosis.
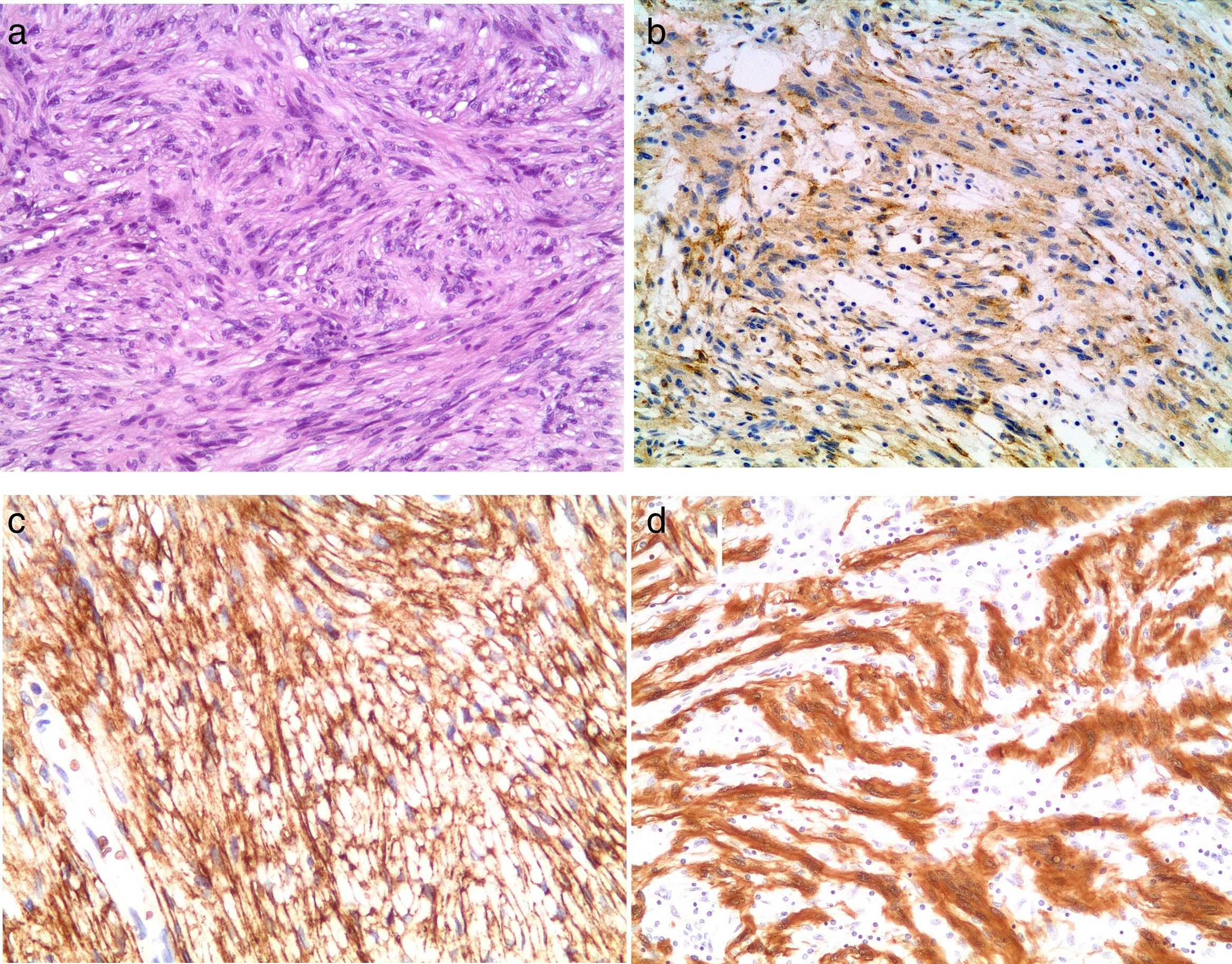
Se asumió el presunto diagnóstico de tumor mesenquimal gástrico. El paciente se sometió a una resección segmentaria del estómago con esplenopancreatectomía distal. Durante el período postoperatorio se produjo un absceso subfrénico izquierdo, que requirió drenaje percutáneo con guía TC y tratamiento antibiótico, por lo que el paciente fue dado de alta 12 días después. Macroscópicamente, el tumor era una lesión nodular de 7×4×4cm, lesión muy bien circunscrita, con consistencia firme y superficie de corte blanquecina. Microscópicamente el tumor mostró un crecimiento estoriforme y estructuras arquitectónicas dominantes del estroma colagenoso típicas del perineuroma, pero también se observaron muchas células fusiformes estrechamente entremezcladas con núcleos ahusados y citoplasma eosinófilo típicos de schwannoma (fig. 2a). No se observó una atipia nuclear significativa, actividad mitótica o necrosis en ninguno de los componentes. El análisis inmunohistoquímico reveló que el componente fascicular era difusamente positivo para S100 (fig. 2b), mientras que la proliferación de células era positiva para el antígeno de membrana epitelial (AME) (fig. 2c) y Glut-1 (fig. 2d). Otros marcadores como CD34, actina de músculo liso, desmina, DOG-1 y CD-117 fueron negativos, de acuerdo con el diagnóstico de schwannoma/perineuroma híbrido gástrico. El paciente actualmente está vivo, sin evidencia de recurrencia 3 años después de la cirugía.
Los tumores benignos de la vaina del nervio periférico incluyen un espectro de lesiones con características clinicopatológicas bien definidas que permiten un diagnóstico claro. Aquellos que involucran el tracto gastrointestinal son raros, representando solo ≤5% de todos los tumores mesenquimatosos, y diagnóstico diferencial con tumores del estroma gastrointestinal. Los TEGI o tumores de músculo liso pueden ser difíciles sin escisión quirúrgica1. Gracias a los avances de la biología molecular, un subconjunto de tumores que revelan características morfológicas de superposición entre diferentes entidades, han sido progresivamente descritos e incluidos en la 4.ª edición de la Clasificación de Tumores y Tejidos Blandos de la Organización Mundial de la Salud2. Estos muestran una transición abrupta y/o una mezcla interna del tipo de células, y se han denominado tumores «híbridos» de la envoltura del nervio periférico2–5. La patogénesis de estas lesiones es poco conocida, pero podría estar asociada con un cambio microambiental localizado o una alteración genética clonal en células tumorales primitivas3. Los tumores que ocurren en el tracto gastrointestinal pueden ser extremadamente difíciles de clasificar y constituir un tremendo desafío para el diagnóstico. El análisis inmunohistoquímico es esencial para confirmar la doble diferenciación de estos tumores, sugiriéndose que el uso rutinario de inmunohistoquímica puede aumentar su frecuencia6. La coexistencia de posibles tumores benignos de la vaina del nervio periférico con características distintas de schwannoma y perineuroma ha sido ya reportada en el pasado, pero la ocurrencia extraneural es extremadamente rara.
Los schwannomas típicamente muestran una expresión fuerte y difusa de la proteína S100. El antígeno de la membrana epitelial es el marcador más comúnmente utilizado, el cual pigmenta la mayoría de los perineuromas, con otros marcadores como claudina-1 y Glut-15,7-9. Ninguno de estos marcadores es completamente específico para la diferenciación perineural, y son mejor utilizados como parte de un panel de anticuerpos múltiples1,5,10. El diagnóstico diferencial incluye tumores del estroma gastrointestinal, otros tumores benignos de la parte externa del nervio periférico y tumores de la vaina del nervio periférico de bajo grado de malignidad2–5. El diagnóstico del tumor híbrido de la vaina del nervio periférico se realiza en presencia de 2 áreas histológicas distintas y se confirma mediante diferentes patrones de tinción HIC de los 2 componentes. Hasta donde sabemos, solo se ha documentado otro caso en el estómago8. En cuanto al tratamiento, la extirpación quirúrgica completa es de carácter curativo, ya que dichos tumores suelen ser benignos, sin embrago se han reportado 3 casos de recidiva después de una resección incompleta y 2 casos de transformación maligna11.