La existencia de un conglomerado de ganglios linfáticos en la zona periportal puede presentarse en pacientes con neoplasias hematológicas y abdominales y por causas infecciosas1,2. Habitualmente no producen síntomas, pero pueden causar hipertensión portal o ictericia obstructiva2–5. El diagnóstico es complejo y puede requerir la realización de una laparotomía2. Presentamos el caso de un paciente con infección por el VIH y linfoma de Burkitt que presentó un cuadro de adenopatías periportales y fiebre causado por tuberculosis (TB).
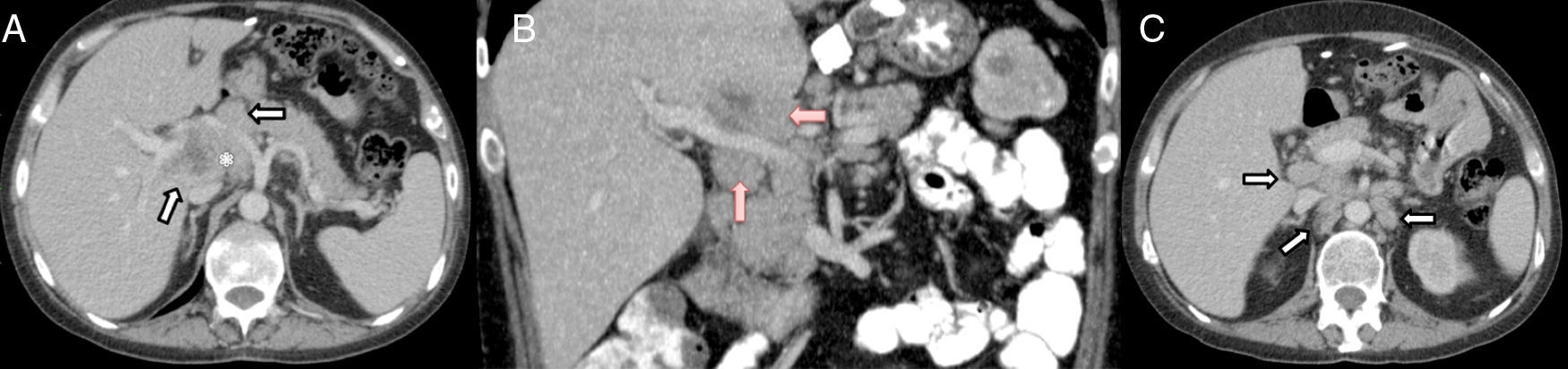
Se trata de un varón de 37 años, intervenido en 2012 de obesidad mórbida en otro centro (banda gástrica). Fue diagnosticado en abril de 2014 de infección por el VIH y linfoma Burkitt estadio iv-B tratado con quimioterapia esquema R-CODOX-M/R-IVAC, del 24 de abril al 8 de julio de 2014, alcanzando la remisión completa. Ingresa en octubre de 2014 por cuadro de fiebre (hasta 39,5°C) y tiritona, sin focalidad infecciosa de 10 días de evolución. Fue tratado con cefuroxima y posteriormente levofloxacino, sin resolución del cuadro, por lo que se decide su hospitalización. La exploración física es normal y no presenta otra sintomatología. El hemograma mostraba leucocitos: 5.700/mm3, porcentaje de polimorfonucleares, actividad de protrombina 63% y plaquetas 84.300μl. El estudio bioquímico era normal y en el perfil hepático destacaba GGT (231U/l) y fosfatasa alcalina (171U/l). En la TAC abdominal se observa un conglomerado adenopático, mal definido, en hilio hepático, que rodea la arteria hepática y la vena porta. El área central es hipodensa compatible con una zona de necrosis. También existen múltiples adenopatías en el hilio hepático, la zona interaortocava y lateroaróticas izquierdas (fig. 1). Los hemocultivos y urocultivos seriados fueron estériles. La ecocardiografía transtorácica y el estudio del fondo de ojo fueron normales. Ante la imposibilidad de punción percutánea radiológica por la localización de las lesiones, se decide abordaje laparoscópico, pero ante los hallazgos intraoperatorios (gran circulación periportal) se realiza una laparotomía subcostal derecha, donde observamos múltiples ganglios linfáticos periportales de gran tamaño (>2cm); el más grande comprime posteriormente la vena porta izquierda (3cm) en el territorio de la arteria hepática y tronco celiaco. No hay ascitis y el parénquima hepático es normal. Se practica exéresis de ganglio de 2cm en la región periportal izquierda (grupo 12a). El postoperatorio transcurre sin incidencias, aunque la fiebre persiste.
TAC plano axial (A) y coronal (B) con CIV. Conglomerado adenopático, mal definido, en hilio hepático, que rodea la arteria hepática (flechas blancas en A) y la vena porta (flechas rojas en B). Área central hipodensa que corresponde a necrosis (asterisco en A). TAC plano axial con CIV (C). Múltiples adenopatías en hilio hepático, zona interaortocava y lateroaróticas izquierdas (flechas).
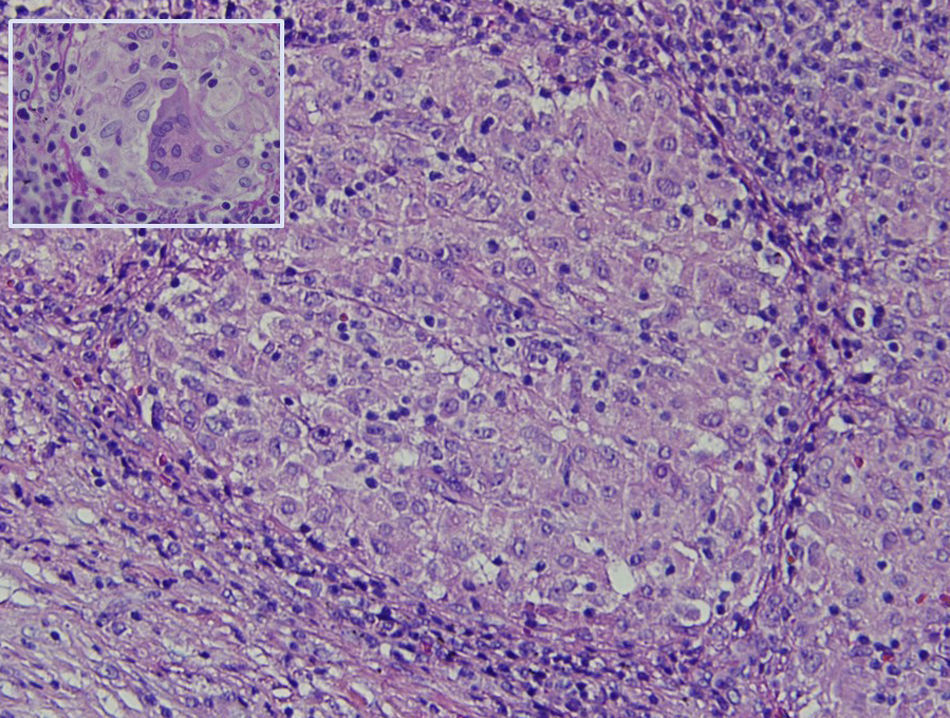
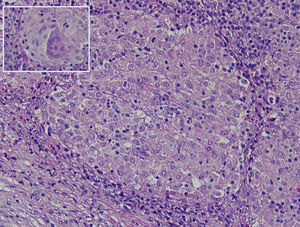
La histología muestra linfadenitis granulomatosa no necrosante, presencia de histiocitos mononucleados de citoplasma epiteloide delimitando granulomas sólidos sin necrosis central (fig. 2). Las técnicas de PAS, Grocott, Job-Fite y auramina son negativas. El estudio inmunohistoquímico realizado (CD79a, CD3, BCL-2, BCL-6, CD10 y Ki67) muestra escasa población linfoide ganglionar, mayoritariamente T, sin población linfoide neoplásica con CD10 negativo. El inmunofenotipo ganglionar confirma que los linfocitos son la población predominante (TCD4 y 8, y linfocitos NK), y no hay celularidad B. En el estudio microbiológico del ganglio extirpado se observa crecimiento de Stenotrophormona maltophila. También realizamos PCR del ganglio linfático, donde existe amplificación de Mycobacterium tuberculosis. Se inicia tratamiento con rifampicina, isoniazida, pirazinamida y etambutol, con desaparición de la fiebre. En el seguimiento efectuado en consulta se ha comprobado la resolución completa del cuadro clínico.
Granuloma no caseificante formado por agregación microscópica de macrófagos que se transforman en células epiteliales-like rodeadas por leucocitos mononucleares (linfocitos y células plasmáticas) (20 x). Recuadro: células epiteloides fusionadas formando una célula multinucleada gigante (hematoxilina-eosina) (40 x).
La TB es una enfermedad infecciosa que afecta primordialmente al sistema respiratorio, pero puede afectar a otros órganos: sistema gastrointestinal, peritoneo, ganglios linfáticos, etc.2,3,6-8. Su incidencia está creciendo por la aparición de cepas resistentes al tratamiento antituberculoso y a la afectación de pacientes positivos para el VIH7,9. La TB intraabdominal supone el 1-3% del total de casos de TB; de ellos solo un 15% tiene TB pulmonar concomitante, aunque esta tasa es superior en los pacientes positivos para el VIH, y 2/3 presentan afectación ganglionar2,6,7. La TB hepatobiliopancreática es infrecuente y suele ocurrir en pacientes con TB miliar3,4. La existencia de linfadenitis tuberculosa periportal (LTP) aislada solo ocurre en un 20% de los pacientes con TB hepatobiliopancreática3–5,7.
La LTP puede producirse por extensión desde órganos vecinos, por vía linfática, intestinal o hematógena2–4,7,9. Se sospecha que cuando no existen focos activos de TB en las zonas circundantes o afectación miliar puede aparecer por reactivación de focos de TB latentes en los ganglios periportales4.
Los signos y síntomas más habituales que presentan los enfermos con LTP son dolor epigástrico, fiebre, pérdida de peso, fatiga y masa abdominal2,3,7,9. La LTP puede causar excepcionalmente hipertensión portal extrahepática y provocar en casos extremos trombosis portal4–6,10. En nuestro caso, el paciente presentaba trombocitopenia y esplenomegalia como signos indirectos de hipertensión portal. La asociación de la infección por el VIH, LTP e hipertensión portal es muy infrecuente10. La LTP también pueden provocar ictericia obstructiva por compresión directa2,6–9.
El diagnóstico de LTP es difícil y raramente se consigue preoperatoriamente3,5,7. Entre los métodos de imagen la TAC es la más sensible, aunque también se ha utilizado la ecografía y la resonancia abdominal2,7. En la TAC los ganglios linfáticos se observan grandes, hetereogéneos, sin calcificaciones, con márgenes mal definidos y suelen presentarse con mayor frecuencia como un conglomerado1,2,7,9. Si se administra contraste muestran un realce periférico y una zona central de baja densidad, pero este hecho no ocurre en los pacientes con sida o inmunodeprimidos debido a la menor disminución de reacción inflamatoria que presentan1,2,7. La desaparición de las adenopatías tras el tratamiento antituberculoso se considera también diagnóstico5.
El diagnóstico diferencial de LTP se plantea especialmente con los linfomas intraabdominales1. En estos pacientes los ganglios linfáticos son más homogéneos, sin realce periférico, y es típica la existencia de afectación vascular2,7. Los ganglios mesentéricos y periportales están más frecuentemente afectos en los pacientes con TB1. Otras enfermedades que hay que descartar son la presencia de adenopatías metastásicas o enfermedades infecciosas, como la enfermedad de Whipple2.
Si se puede realizar una punción dirigida por ecografía o TAC de los ganglios linfáticos periportales se puede llegar a un diagnóstico de LTP con una sensibilidad cercana al 80%2,5,9. Pero cuando la muestra es insuficiente o la cercanía a grandes vasos hace arriesgada la punción, la cirugía es obligatoria para obtener un diagnóstico2. Se han realizado por abordaje laparoscópico pero puede ser muy complejo y arriesgado2.
El estudio histológico de los ganglios periportales en la LTP muestra habitualmente inflamación granulomatosa crónica con necrosis central4. Una vez realizado el diagnóstico, la instauración de un tratamiento antituberculoso adecuado suele habitualmente solucionar el cuadro clínico, con disminución significativa de los ganglios periportales2.
En conclusión, la LTP es una entidad de difícil diagnóstico en ausencia de otro foco de tuberculosis, especialmente si sucede en un paciente diagnosticado previamente de linfoma de Burkitt. La punción de los ganglios periportales puede evitar la laparotomía, pero habitualmente no es factible y se requiere la intervención quirúrgica. La instauración del tratamiento antituberculoso suele acompañarse de la regresión de las lesiones.