La prevalencia de sialorrea en pacientes con parálisis cerebral es del 10-58%. Puede tratarse con aplicación de toxina botulínica en glándulas salivales o con técnicas quirúrgicas que disminuyen definitivamente la producción salival. En México no existen estudios sobre la utilidad de la cirugía para manejar la sialorrea.
ObjetivoEvaluar la eficacia de la resección de glándulas submandibulares, para disminuir la sialorrea en pacientes pediátricos con parálisis cerebral y con resultados desfavorables con toxina botulínica.
Material y métodosEnsayo clínico experimental, autocontrolado, longitudinal y prospectivo. Se realizó evaluación prequirúrgica del grado de sialorrea y posquirúrgicas a 8, 16 y 24 semanas, con una clasificación validada. Se aplicó una prueba de medidas repetidas no paramétrica, para buscar significación estadística con p<0.05. Se analizan también las complicaciones observadas y los cambios en la composición salival.
ResultadosSe operó a 3 pacientes con sialorrea severa y a 2 con profusa, con edad media de 10.8 años. Los 5 mejoraron en severidad y frecuencia, con disminución promedio del 76.75 y del 87.5%, respectivamente. El mejor resultado se observó a los 6 meses, con diferencia estadísticamente significativa entre el preoperatorio y el postoperatorio (p=0.0039, IC 95%). No se observaron complicaciones importantes, deterioro dental ni cambios importantes en la composición salival.
ConclusionesLa resección de glándulas submandibulares es efectiva para controlar la sialorrea en pacientes pediátricos con parálisis cerebral, con reducción superior al 80%. Tiene una tasa baja de complicaciones, a diferencia de otras técnicas. Generó una disminución suficiente y evidenciable de la sialorrea en reposo, sin necesidad de trabajar con otras glándulas salivales mayores.
Sialorrhoea has a prevalence of between 10% and 58% in patients with cerebral palsy. Amongst the invasive treatments, botulinum toxin-A injections in submandibular and parotid glands and various surgical techniques are worth mentioning. There are no studies in Mexico on the usefulness of surgery to manage sialorrhoea.
ObjectiveTo evaluate the usefulness of submandibular gland resection in improving sialorrhoea in patients with cerebral palsy and with a poor response to botulinum toxin.
Material and methodsExperimental, clinical, self-controlled, prospective trial was conducted to evaluate the grade of sialorrhoea before surgery, and 8, 16 and 24 weeks after. Statistical analysis was performed using a non-parametric repetitive measure assessment, considering a p < 0.05 as significant. Complications and changes in salivary composition were evaluated.
ResultsSurgery was performed on 3 patients with severe sialorrhoea, and 2 with profuse sialorrhoea, with mean age of 10.8 years. The frequency and severity of sialorrhoea improved in the 5 patients, with mean of 76.7 and 87.5% improvement, respectively. The best results were seen after 6 months of surgery, with a statistically significant difference between the preoperative stage and 6 months after the procedure (p = 0.0039, 95% CI). No significant differences were observed in complications, increase in periodontal disease or cavities, or salivary composition.
ConclusionsSubmandibular gland resection is an effective technique for sialorrhoea control in paediatric patients with cerebral palsy, with a reduction in salivary flow greater than 80%. It has a low chance of producing complications compared to other techniques. It led to an obvious decrease in sialorrhoea without the need to involve other salivary glands in the procedure.
La sialorrea se define como la pérdida involuntaria y pasiva de saliva desde la boca por inhabilidad para manejar las secreciones orales, y su presencia se considera normal hasta los 2 años de edad, cuando la función motora oral alcanza un mayor desarrollo. Ocasionalmente, niños de hasta 4 años la presentan, sobre todo en relación con la salida de dientes, pero siempre después de los 4 años se considera anormal1.
Después de los 6 años de edad es frecuente encontrar la sialorrea en quienes presentan desórdenes neuromusculares como: parálisis cerebral infantil, esclerosis lateral amiotrófica, enfermedad de Parkinson, parálisis facial y evento vascular cerebral, entre otros, que dan por resultado incoordinación durante la fase oral de la deglución y acúmulo de saliva en la porción anterior de la boca, con posterior derrame2.
La saliva es una mezcla compleja de macromoléculas y electrólitos que es secretada por 3 pares de glándulas salivales mayores (parótidas, submandibulares y sublinguales) y un gran número de glándulas salivales menores, distribuidas en la mucosa de la cavidad oral y orofaringe principalmente. Las funciones de la saliva son variadas e incluyen: lubricación, protección, amortiguación ácido-base, mantenimiento de la integridad dental, actividad antibacterial, percepción de sabores y digestión3–9.
El conjunto de glándulas genera una producción aproximada de saliva de 1ml por gramo de tejido glandular por minuto; cantidad que aumenta y disminuye según se generen estímulos olfatorios y gustatorios a lo largo del día. En promedio, la producción salival sin estimulación es de 0.3ml/min, mientras que con estimulación es de 7ml/min, con lo que es posible calcular que una persona produce entre 1 y 1.5 l de saliva al día (si consideramos un flujo promedio de 1ml por minuto). En reposo, el 70% de la secreción salival proviene de la glándula submandibular, con la parótida que aporta el 25% aproximadamente. Durante el proceso de alimentación esta relación se invierte, es la parótida la mayor productora de saliva10,11.
El control fisiológico de la salivación es mantenido por la actividad del sistema autonómico. La estimulación de las células acinares por el sistema parasimpático genera un aumento en los niveles de fluido secretado, con una saliva más líquida y abundante, mientras que los estímulos adrenérgicos por el sistema simpático, a través de la noradrenalina, generan una producción salival más espesa y con una proporción mayor de proteínas y macromoléculas secretadas, especialmente amilasa12–14.
La parálisis cerebral es la causa más frecuente de discapacidad en edad pediátrica, con una incidencia en México de 6 por 1,000 nacidos vivos y 12,000 casos nuevos por año.
Durante los últimos 5 años el Instituto Nacional de Rehabilitación ha registrado un promedio de 250 ingresos anuales de pacientes pediátricos con parálisis cerebral. La prevalencia de sialorrea en niños con parálisis cerebral infantil es variable. Crysdale15 estimó que del 10 al 15% presentan una sialorrea severa, Tahmassebi y Curzon16 reportaron un estimado del 58% y Sullivan et al.17 estimaron un 28%. Este signo genera una importante alteración en la calidad de vida del enfermo y de su familia, por las fuertes implicaciones médicas, psicológicas y económicas que conlleva para el paciente, familia e institución.
Existen diversos tipos de tratamiento conservador para la sialorrea severa y profusa; de estos, se considera que el entrenamiento motor oral debe ser el manejo inicial durante al menos 6 meses. Este programa mejora el cierre de los labios, los movimientos de la lengua y el cierre de la mandíbula. Otras técnicas no invasivas son la retroalimentación y las estrategias de modificación de conducta con refuerzos positivos o negativos, que no han dado resultados más que en casos leves. Dado que la salivación es producida en mayor medida por un estímulo parasimpático, se han usado agentes anticolinérgicos como la atropina, benztropina y escopolamina para disminuir su producción. Todos han sido parte de ensayos terapéuticos en los que no se ha mostrado una eficacia marcada, además de que producen efectos adversos importantes como estreñimiento, xerostomía, retención urinaria, visión borrosa o glaucoma, entre otros18.
Dentro de las alternativas terapéuticas invasivas se encuentran la aplicación de toxina botulínica en las glándulas submandibulares o parótidas y diversas técnicas quirúrgicas encaminadas a disminuir de manera definitiva la producción salival. En la actualidad la cirugía se reserva para casos refractarios a toxina botulínica; sin embargo, en diversos centros se elige como primera opción19–21.
La toxina botulínica es producida por el Clostridium botulinum, una bacteria anaerobia formadora de esporas, cuyo hábitat natural es la tierra. Esta toxina es una cadena polipeptídica sencilla que consiste en una cadena pesada de 100 kd, unida por un solo puente disulfuro a una cadena ligera de 50 kd. La cadena ligera es una endopeptidasa que contiene cinc y que tiene la capacidad de unirse a sitios específicos de la proteína soluble N-ethylmaleimide sensitive fusion atachment protein receptor (SNARE, por sus siglas en inglés), la cual es un complejo de fusión sináptica esencial para la fusión de vesículas y posterior liberación de acetilcolina a la hendidura sináptica. Como resultado de la unión de la toxina a la proteína SNARE, la liberación de acetilcolina se bloquea y da por resultado una parálisis flácida temporal si hablamos de uniones neuromusculares o una denervación parasimpática a nivel neuroglandular22–24. Existen 7 diferentes tipos antigénicos de toxina botulínica, a los cuales se han asignado letras de la A a la G. Cada tipo tiene afinidad por un diferente subsitio de la proteína SNARE, por ejemplo: la tipo A se une a la proteína de transporte SNAP-23, mientras que la tipo B se una a la proteína de transporte sinaptobrevina conocida también como vesicle-associated membrane protein (VAMP, por sus siglas en inglés)25–27.
En el ser humano solo los tipos A y B de toxina botulínica han sido utilizados de manera terapéutica. En 1997 apareció el primer trabajo que mencionaba los beneficios generados por la aplicación de toxina botulínica tipo A en las glándulas salivales, para disminuir la sialorrea en pacientes con esclerosis lateral amiotrófica28. Desde entonces, diversos estudios han probado su utilidad en pacientes con sialorrea severa, generada por causas diversas. La desventaja de la toxina es que sus efectos son benéficos a corto plazo y requiere de nuevas aplicaciones en periodos de 3 a 6 meses, para mantener el control del padecimiento. Aunque la mayoría de los estudios basados en su aplicación guiada por ultrasonido han mostrado un perfil de seguridad aceptable, aún no se cuenta con estudios a largo plazo que determinen si existe la posibilidad de efectos adversos con dosis repetitivas, además de que los niños requieren de anestesia general cada vez que se va a realizar el procedimiento29–34.
La cirugía es el último escalón en el tratamiento. Generalmente se debe esperar hasta los 6 años de edad para permitir una madurez neurológica completa. La indicación de tratamiento quirúrgico se establece: cuando la sialorrea es tan severa que las medidas conservadoras no pueden controlarla, cuando el apego del paciente al tratamiento conservador es poco probable, por un déficit motor o intelectual graves y un pobre apoyo familiar, o en niños mayores de 6 años en quienes el tratamiento conservador no fue suficiente, a juicio de sus familiares19. Dado que las glándulas submandibulares son responsables de producir aproximadamente el 70% de la saliva de reposo (las glándulas parótidas producen saliva sobre todo durante la alimentación), las técnicas quirúrgicas se enfocan, principalmente, en manejar estas. Se han propuesto distintas técnicas quirúrgicas para solucionar la sialorrea severa y profusa. En 1967, Wilkie y Brody35 realizaron en 123 pacientes la recolocación de los conductos parotídeos hacia las fosas amigdalinas tras amigdalectomía, realizando en un segundo tiempo escisión de las glándulas submandibulares. Tras un seguimiento a 10 años, reportaron un buen control en el 90% de sus pacientes, aunque con complicaciones importantes en 43 de ellos, incluyendo: dehiscencia de la herida, estenosis de conductos parotídeos, mala higiene oral y aumento de las infecciones dentales y gingivales. La recolocación bilateral de los conductos submandibulares hacia la base de la lengua, tras la línea de papilas circunvaladas, fue descrita primero por Laage-Hellman36 en 1969. Crysdale et al.37,38 realizaron este procedimiento a 522 pacientes desde 1978. A partir de 1988 añadieron la resección concomitante de las glándulas sublinguales a su procedimiento, con lo que consiguieron disminuir en gran medida el desarrollo de ránulas. Ambos subgrupos mostraron una efectividad importante en el control de la sialorrea (75 a 85% de éxito) y, dado que se realiza por un abordaje intraoral, no deja cicatrices. En 1979 Dundas y Peterson39 reportaron que con la ligadura bilateral de conductos parotídeos junto con escisión de glándulas submandibulares obtuvieron un buen control en 9 de 14 casos, aunque 2 de ellos presentaron xerostomía y 4 aumento de enfermedades gingivales. Estudios que reportaron resultados con ligadura de 4 conductos, en general, mostraron resultados más inciertos y con más complicaciones40,41.
En 2009 se publicó un metaanálisis con el objetivo de revisar la literatura existente desde 1963 a 2008, sobre el manejo quirúrgico de la sialorrea en el paciente pediátrico20. Este prestó atención a la eficacia de las diferentes técnicas (neurectomía timpánica, resección de glándulas submaxilares, recolocación de conductos de Wharton, resección de glándulas sublinguales, ligadura de conductos de Wharton, recolocación de conductos de Stenon, ligadura de conductos de Stenon o cualquier combinación de estas).
De 325 artículos, 50 cumplieron los criterios de selección (47 serie de casos, 2 de cohorte y un estudio prospectivo). El porcentaje combinado de éxito de los procedimientos fue de 81.6%. El procedimiento más reportado fue la recolocación de conductos de Wharton (21 estudios). La resección de glándulas submandibulares y recolocación de los conductos parotídeos presentaron los índices de éxito subjetivo más altos 87.8% (8 estudios) y la técnica de menor éxito fue la ligadura de 4 conductos con 64.1% (4 estudios).
Comparando los intervalos de confianza, la resección de glándulas submandibulares con reenrutamiento de conductos parotídeos (n=8 estudios; IC 95%: 80.5-95.1%; p<0.001) fue estadísticamente superior al reenrutamiento de conductos de Wharton con resección de glándulas sublinguales (estimado de éxito subjetivo, 71.5%; n=21 estudios; IC 95%: 63.6-79.4%; p<0.001); sin embargo, por el poder estadístico de estos y la variabilidad en el número de estudios con estas 2 técnicas, no es posible establecer un criterio de selección definitivo entre una y la otra. La resección de glándulas submaxilares con ligadura de conductos parotídeos fue la tercera técnica con mejores resultados en cuanto a efectividad. Cualquiera de estas 3 técnicas genera resultados favorables.
Una de las preocupaciones más comunes al manejar la sialorrea de manera quirúrgica es que se ha señalado un aumento en la placa dentobacteriana, caries dentales y enfermedad periodontal en estos pacientes, por la disminución importante de la saliva y su función protectora. Este tema es aún debatido y la propuesta actual es que los pacientes que sean manejados quirúrgicamente reciban valoraciones odontológicas periódicas, para prevenir esta complicación29.
En cuanto a las complicaciones con las técnicas quirúrgicas mencionadas, un estudio realizado por Greensmith et al.19 en el 2005, el primero con seguimiento a 5 años, reportó que de 67 pacientes operados por reenrutamiento de conductos de Wharton y resección de sublinguales, 13 pacientes (18%) presentaron complicaciones, que incluyeron: sangrado menor en un paciente y mayor en 3, edema lingual obstructivo de vía aérea en 2, un absceso submandibular, una lesión parcial del nervio lingual y una neumonía por aspiración. Al igual que en los estudios de Crysdale et al.37,38 no se presentaron ránulas, a diferencia de cuando respetaban las glándulas sublinguales.
Estos resultados fueron comparables con los de una serie más pequeña realizada por Uppal et al.42 y con los problemas encontrados en las grandes series de pacientes de Crysdale et al.37,38. En general, estos autores consideraron que, en pacientes que no alcanzan el éxito esperado tras la cirugía, es posible practicar la ligadura de un conducto parotídeo con buenos resultados, aunque con un aumento en la prevalencia de enfermedad dental y periodontal. El manejo quirúrgico de la sialorrea tiene varios años de desarrollo y actualmente se considera el estándar de oro para su tratamiento; sin embargo, estudios con las características aquí propuestas no han sido comunicados en el medio nacional ni internacional, basado esto en una revisión bibliográfica de 20 años a la fecha.
ObjetivoGeneralEvaluar la severidad y frecuencia de la sialorrea, de acuerdo con la escala validada de Thomas Stonell y Greenberg43, antes y después de la resección de las glándulas submandibulares en pacientes pediátricos con parálisis cerebral, en quienes los resultados con la aplicación de toxina botulínica tipo A no fueron favorables.
Específicos- •
Describir las complicaciones generadas por la resección quirúrgica de las glándulas submandibulares, en pacientes pediátricos con parálisis cerebral.
- •
Describir si la resección glandular y la disminución en la salivación se relacionan con un aumento en el número de caries dentales.
- •
Describir si existen cambios significativos en los componentes electrolíticos, proteicos y enzimáticos de la saliva, tras la resección de las glándulas submandibulares.
Se realizó un ensayo clínico experimental, autocontrolado, longitudinal y prospectivo en el que se valoraron los resultados obtenidos, con la resección de glándulas submandibulares en pacientes con sialorrea severa, que no respondieron adecuadamente a la aplicación previa de toxina botulínica tipo A, en el periodo de 2 años comprendido entre el 1 de enero de 2012 y el 31 de diciembre de 2013.
Se incluyó a pacientes del Servicio de Rehabilitación Pediátrica del Instituto Nacional de Rehabilitación, de entre 6 y 15 años de edad, con al menos 2 aplicaciones de toxina botulínica y respuesta mínima en las escalas de intensidad y frecuencia (mejoría menor o igual a un grado en la escala validada de Thomas-Stonell y Greenberg) (ver tabla 1). Se excluyó a pacientes con discrasias sanguíneas, enfermedades neuromusculares concomitantes, aplicación de toxina antes de 6 meses, falta de autorización del representante legal o del tutor para la realización del procedimiento quirúrgico o uso de medicamentos condicionantes de sialorrea.
Escala de Thomas-Stonell y Greenberg para la valoración de la frecuencia y severidad de la sialorrea
| Sialorrea | Puntaje |
|---|---|
| Severidad | |
| 1. Seco (sin escurrimiento salival) | 1 |
| 2. Leve (solo labios húmedos) | 2 |
| 3. Moderado (labios y barbilla húmedos) | 3 |
| 4. Severo (humedad de la ropa) | 4 |
| 5. Profuso (la ropa, manos, bandejas, objetos a su alcance están mojados) | 5 |
| Frecuencia | |
| 6. Nunca tiene escurrimiento | 1 |
| 7. Ocasionalmente tiene escurrimiento | 2 |
| 8. Frecuentemente tiene escurrimiento | 3 |
| 9. Constantemente tiene escurrimiento | 4 |
Tomada de: Thomas-Stonell y Greenberg43.
Se eliminó a los pacientes que mostraran ausentismo a las consultas médicas antes y después del procedimiento quirúrgico o fallecieran por causas no asociadas al procedimiento quirúrgico.
Se seleccionó a los candidatos adecuados para el manejo quirúrgico que cumplieran con los criterios mencionados (n=5) y, tras permitir un periodo de lavado del fármaco (toxina botulínica tipo A) de 6 meses como mínimo, se realizó una evaluación prequirúrgica del grado de sialorrea, así como evaluaciones posquirúrgicas a 8, 16 y 24 semanas, basadas en la clasificación validada de Thomas-Stonell y Greenberg43. Se realizó también un análisis de composición salival a las 24 semanas después del procedimiento por estudios de química básica. Para realizar un comparativo, se midieron las concentraciones de diversos electrólitos, enzimas y proteínas en los 5 pacientes operados y en 2 controles sanos elegidos aleatoriamente de un grupo de niños sanos del mismo rango de edad.
El análisis incluyó: sodio en mEq/l, potasio en mEq/l, calcio en mEq/l, cloro en mEq/l, bicarbonato en mEq/l, proteínas totales en mg/ml y amilasa salival en U/ml. Se compararon los valores de los 2 controles con los conocidos como normales de acuerdo con la literatura6,14 para asegurar el adecuado muestreo y, posteriormente, se compararon los valores posquirúrgicos a 24 semanas de cada paciente con los de los 2 controles.
Para el análisis estadístico se determinaron las medidas de tendencia central y de dispersión. Para valorar el efecto del tratamiento en severidad y frecuencia de acuerdo con la escala validada de Thomas-Stonell y Greenberg43, se aplicó una prueba no paramétrica de medidas repetidas (Friedman con prueba de Dunn para comparación múltiple) tomando la etapa prequirúrgica de cada paciente como estado basal, para comparar este estado con el efecto del tratamiento a 4 y 6 meses. Se realizó un análisis de varianza para detectar significación en las variaciones electrolíticas de la composición salival, entre los 5 casos operados y los 2 controles sanos. El análisis de los datos se realizó con el programa SPSS v19, tomando como significación estadística al valor de p<0.05 (IC del 95%).
En cuanto a las consideraciones éticas, se trata de un estudio con riesgo mínimo de acuerdo con el artículo 17 del capítulo 2.° «De los aspectos éticos de la investigación en seres humanos. Aspectos generales» incluido en el Reglamento de la Ley General de Salud en Materia de Investigación para la Salud. Y fue aceptado por el Comité de Ética e Investigación del Instituto Nacional de Rehabilitación.
ResultadosEl procedimiento quirúrgico se realizó en 5 pacientes, de los cuales 3 presentaban sialorrea severa y 2 profusa, a 6 meses de la última aplicación de toxina botulínica tipo A.
La edad de los pacientes fue de 9 a 13 años, con una moda de 11 años y una media de 10.8 años de edad. Los diagnósticos de base de estos pacientes eran: parálisis cerebral con doble hemiparesia espástica, parálisis cerebral atáxica, parálisis cerebral con cuadriparesia espástica, disparesia mixta y encefalopatía fija con retraso mental grave, microcefalia y epilepsia. Los pacientes presentaban coeficiente intelectual de 42, 47 y 70, con 2 pacientes con coeficiente intelectual normal y en todos se corroboró una escala para clasificación de función motora gruesa para parálisis cerebral de Palisano de II o mejor. El número de aplicaciones de toxina que recibieron previamente al manejo quirúrgico fue de 2 aplicaciones por glándula en 4 pacientes y de 3 aplicaciones en el otro paciente. La primera aplicación siempre se realizó con 20 UI por glándula submandibular, distribuidos en 3 sitios distintos y la segunda y tercera aplicación (en un caso) con 40 UI por glándula con la misma técnica. La respuesta a la toxina botulínica se consideró como mala, tomando en cuenta un efecto que generara mejoría de un punto o menor en las escalas de severidad y frecuencia de Thomas-Stonell y Greenberg43, cuando el efecto tuviera una duración menor a los 2 meses o cuando fuera reducido entre la primera y la segunda aplicación, aun con el aumento de la dosis al doble (ver tabla 2).
Características de los pacientes y severidad de sialorrea en estado basal, con el uso de toxina botulínica y después de la resección de las glándulas submandibulares a 2, 4 y 6 meses
| Px | Edad | CI/Pal | Diagnóstico | Severidad/frecuencia de sialorrea | ||||
|---|---|---|---|---|---|---|---|---|
| Pretoxina | Postoxina | 8 sem | 16 sem | 24 sem | ||||
| 1 | 9 | 72/2 | PC + hemiparesia espástica derecha | 5/4 | 4/3 | 3/2 | 2/1 | 2/1 |
| 2 | 11 | Normal/3 | PC atáxica | 4/4 | 4/3 | 2/1 | 2/1 | 2/1 |
| 3 | 13 | 40/4 | PC + cuadriparesia espástica + epilepsia | 4/3 | 4/3 | 1/2 | 2/2 | 2/2 |
| 4 | 10 | 42/2 | PC + encefalopatía fija + retraso mental grave + microcefalia + epilepsia | 5/4 | 4/3 | 3/1 | 1/1 | 1/1 |
| 5 | 11 | Normal/3 | PC + disparesia mixta | 4/4 | 3/3 | 1/2 | 1/2 | 1/2 |
CI: coeficiente intelectual; Dx: diagnóstico; Pal: escala de Palisano; PC: parálisis cerebral; Px: paciente.
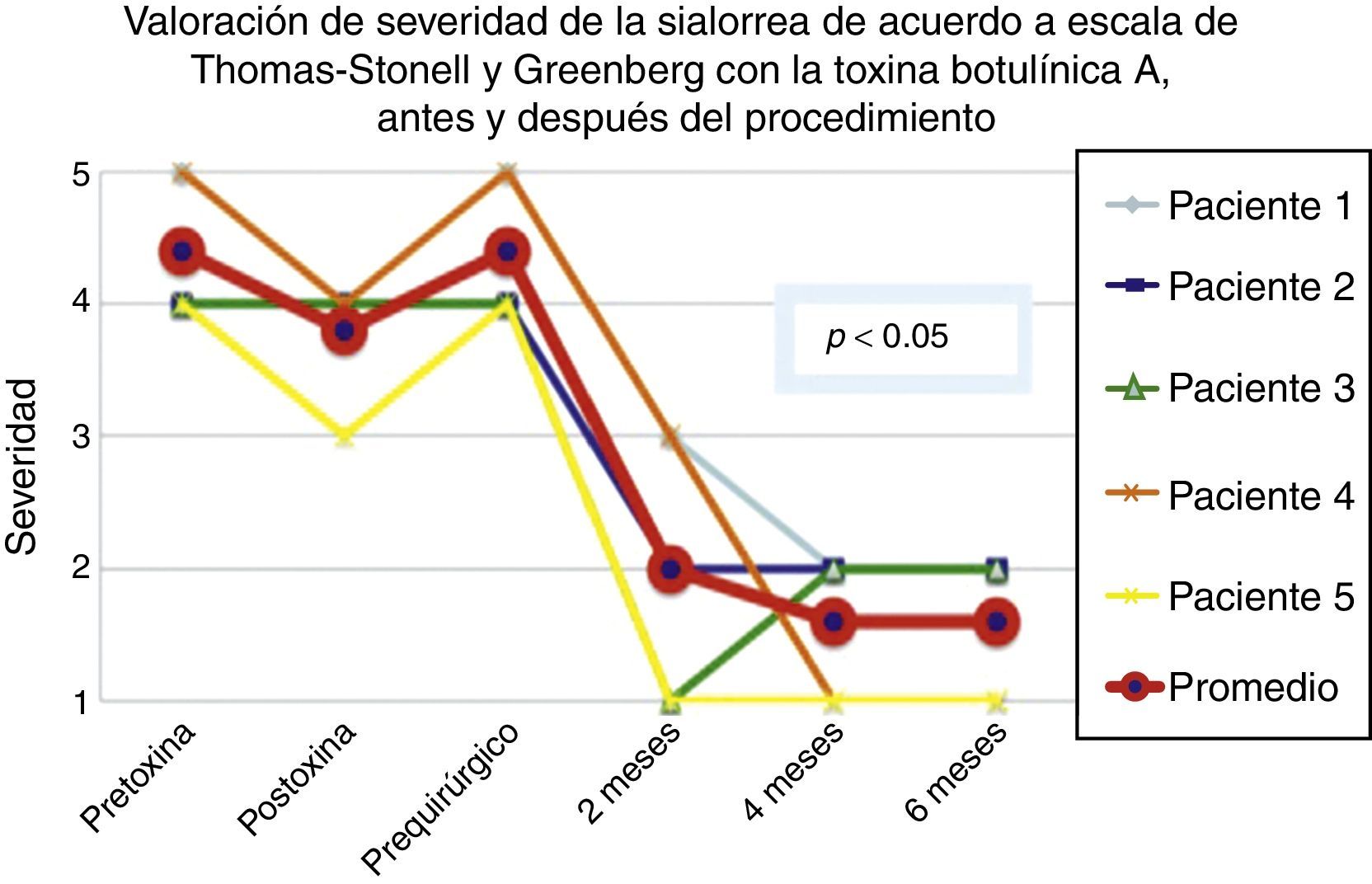
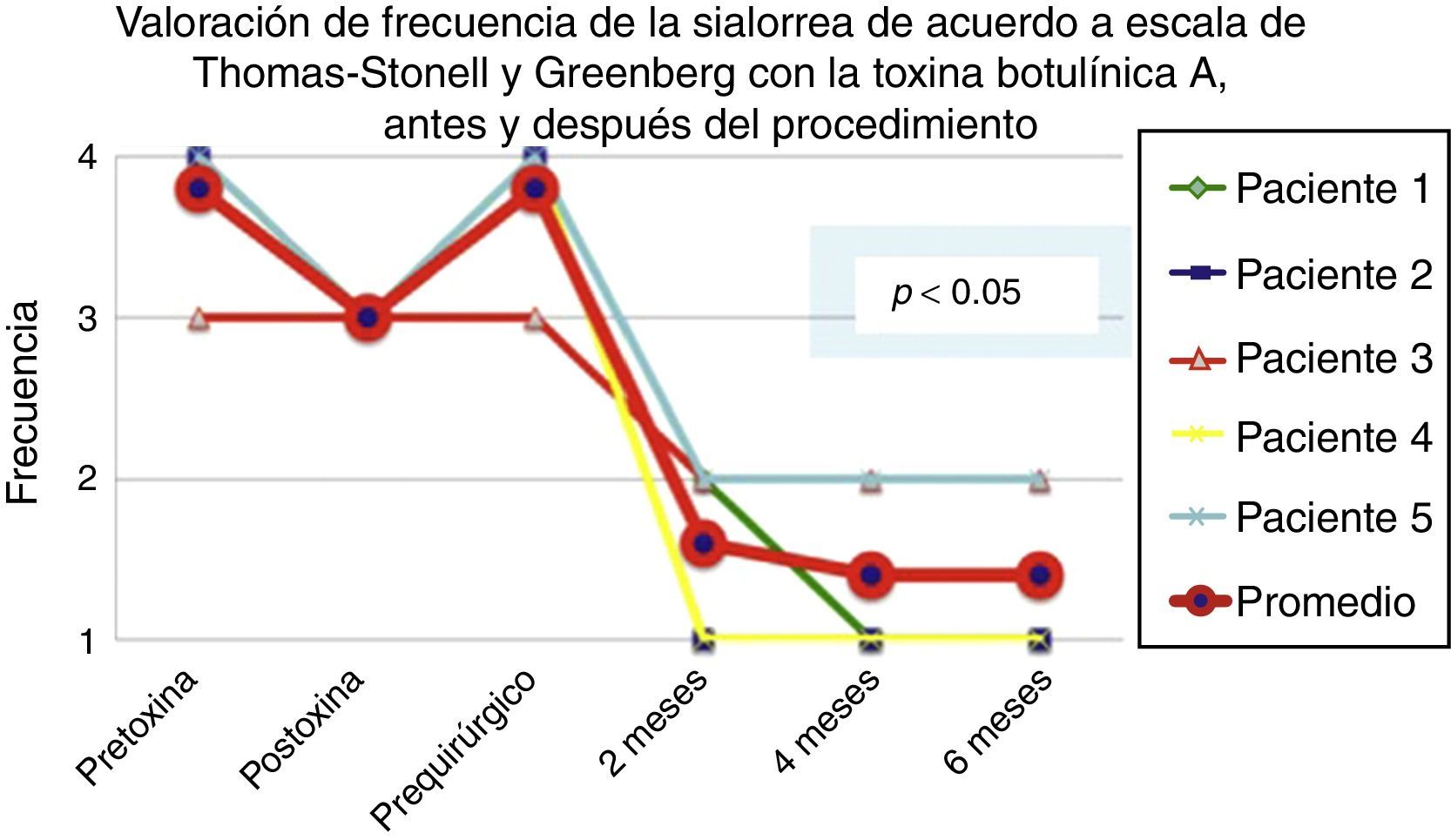
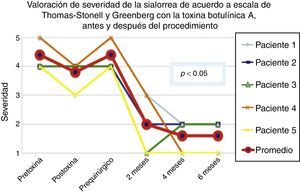
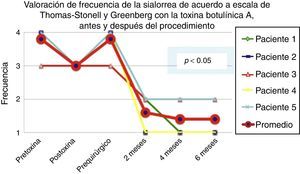
De acuerdo con las escalas fue evidente que tras 6 meses de la última aplicación de toxina botulínica los pacientes regresaron al estado basal, tal y como se muestra en la etapa prequirúrgica de las figuras 1 y 2 para severidad y frecuencia, respectivamente.
Comparativo de la mejoría presentada por los 5 pacientes operados en cuanto a severidad de la sialorrea, previo a la primera aplicación de toxina (estado equiparable al prequirúrgico), con el máximo efecto de la toxina y tras 2, 4 y 6 meses del postoperatorio.
Grado 1: seco. Grado 2: leve (solo labios húmedos). Grado 3: moderado (labios y barbilla húmedos). Grado 4: severo (humedad de la ropa). Grado 5: profuso (la ropa, manos, bandejas, objetos a su alcance están mojados).
Comparativo de la mejoría presentada por los 5 pacientes operados en cuanto a frecuencia de la sialorrea previo a la primera aplicación de toxina (estado equiparable al prequirúrgico), con el máximo efecto de la toxina y tras 2, 4 y 6 meses del postoperatorio.
Grado 1: nunca tiene escurrimiento. Grado 2: ocasionalmente tiene escurrimiento. Grado 3: frecuentemente tiene escurrimiento. Grado 4: constantemente tiene escurrimiento.
La mejoría de los 5 pacientes considerados fue sustancial, con una mejoría promedio en cuanto a severidad y frecuencia de sialorrea de 2 a 3 grados en la escala respectiva, lo que implica una disminución promedio para los 5 pacientes en la severidad de la sialorrea del 76.75% y en la frecuencia de sialorrea del 87.5%, con un 82.1% de efectividad considerando la suma de promedios de mejoría en severidad y frecuencia (ver figs. 3 y 4 para severidad y figs. 5 y 6 para frecuencia).
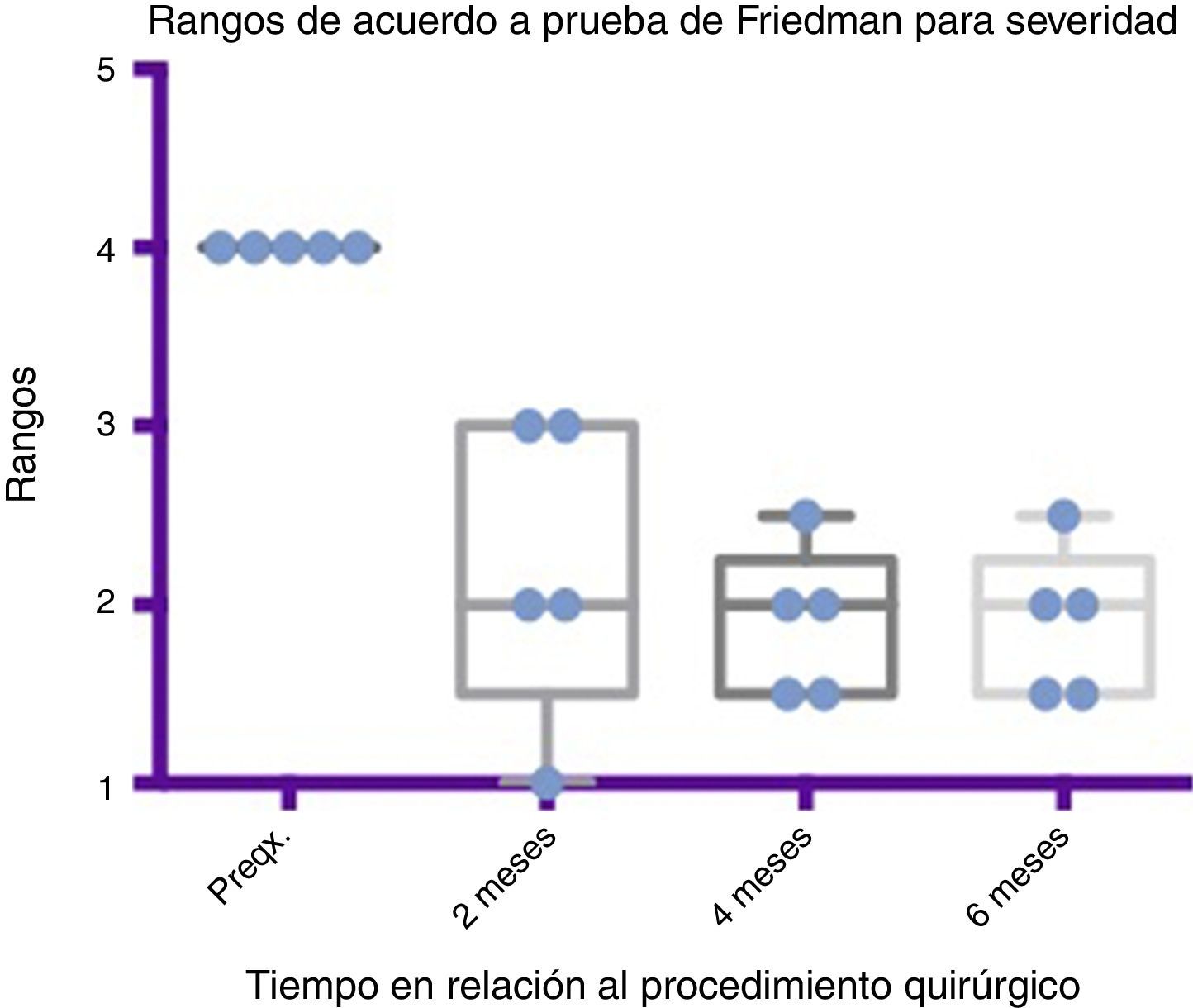
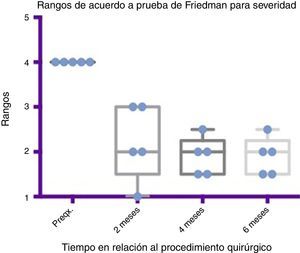
Comparativo por rangos de la mejoría presentada en severidad de acuerdo con la prueba de Friedman. Se muestran mínimos y máximos de cada periodo así como las medias.
Grado 1: seco. Grado 2: leve (solo labios húmedos). Grado 3: moderado (labios y barbilla húmedos). Grado 4: severo (humedad de la ropa). Grado 5: profuso (la ropa, manos, bandejas, objetos a su alcance están mojados).
Preqx=prequirúrgico.
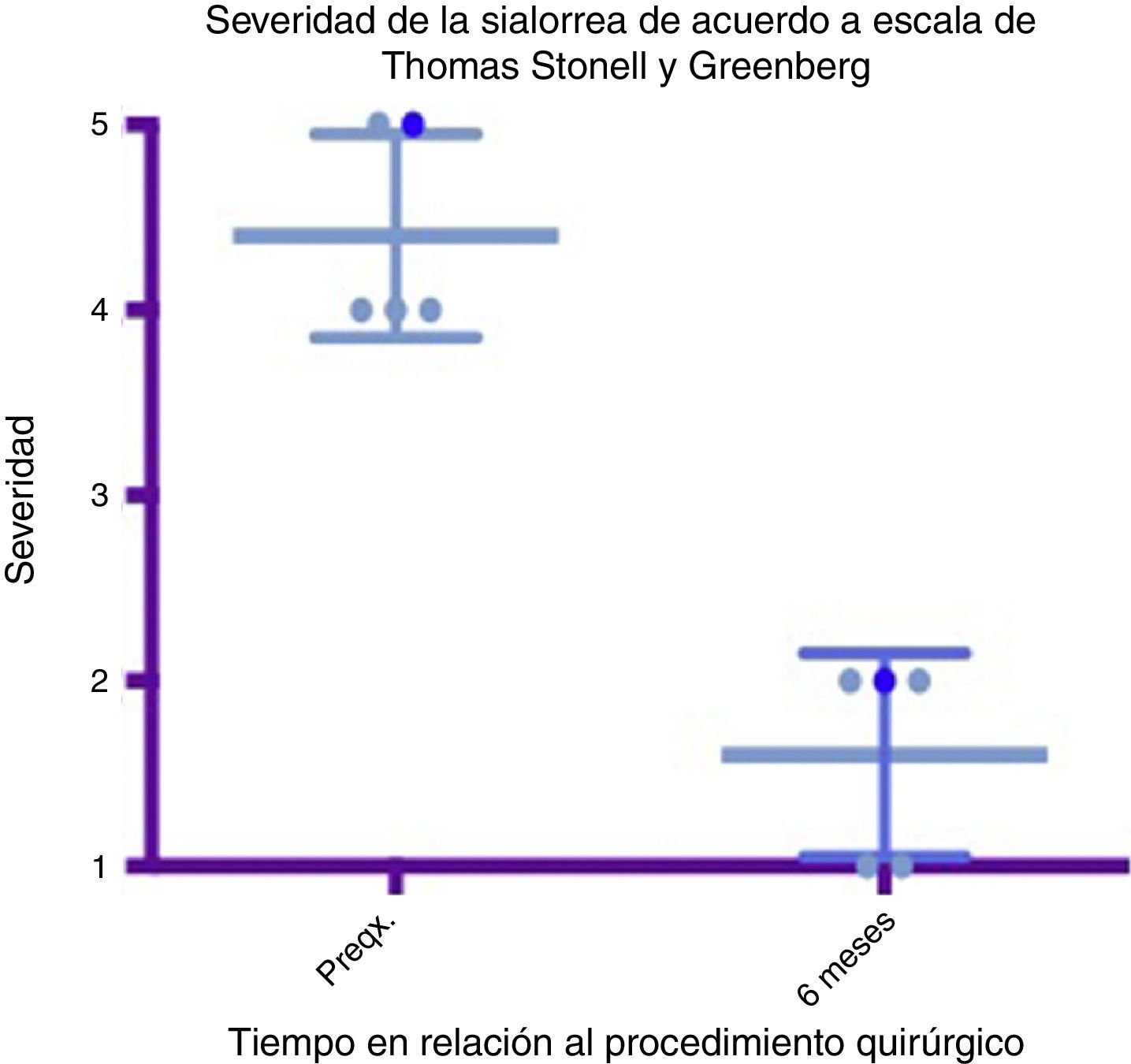
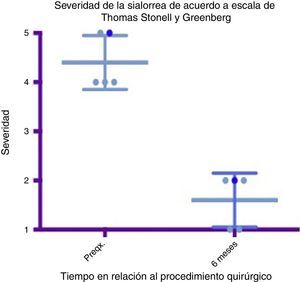
Diagrama de caja y bigotes que muestra un comparativo de severidad entre la etapa prequirúrgica y los 6 meses del postoperatorio, tomando en cuenta medias y desviaciones estándares.
Grado 1: seco. Grado 2: leve (labios húmedos). Grado 3: moderado (labios y barbilla húmedos). Grado 4: severo (humedad de ropa). Grado 5: profuso (ropa, manos, objetos a su alcance están mojados).
Preqx=prequirúrgico.
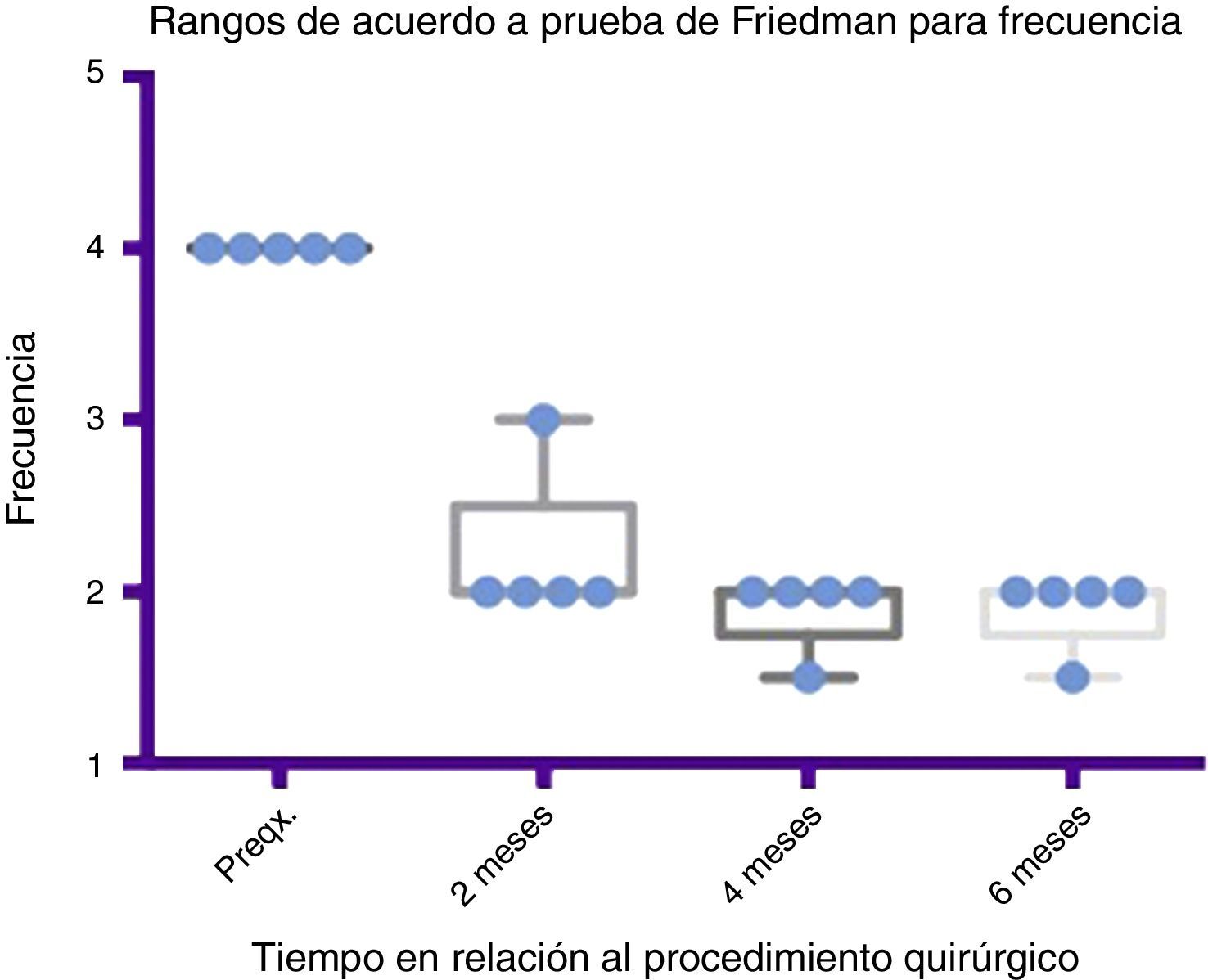
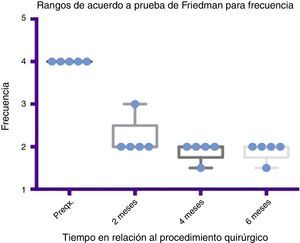
Comparativo por rangos de la mejoría presentada en frecuencia de acuerdo con la prueba de Friedman. Se muestran mínimos y máximos de cada periodo así como las medias.
Grado 1: nunca tiene escurrimiento. Grado 2: ocasionalmente tiene escurrimiento. Grado 3: frecuentemente tiene escurrimiento. Grado 4: constantemente tiene escurrimiento.
Preqx=prequirúrgico.
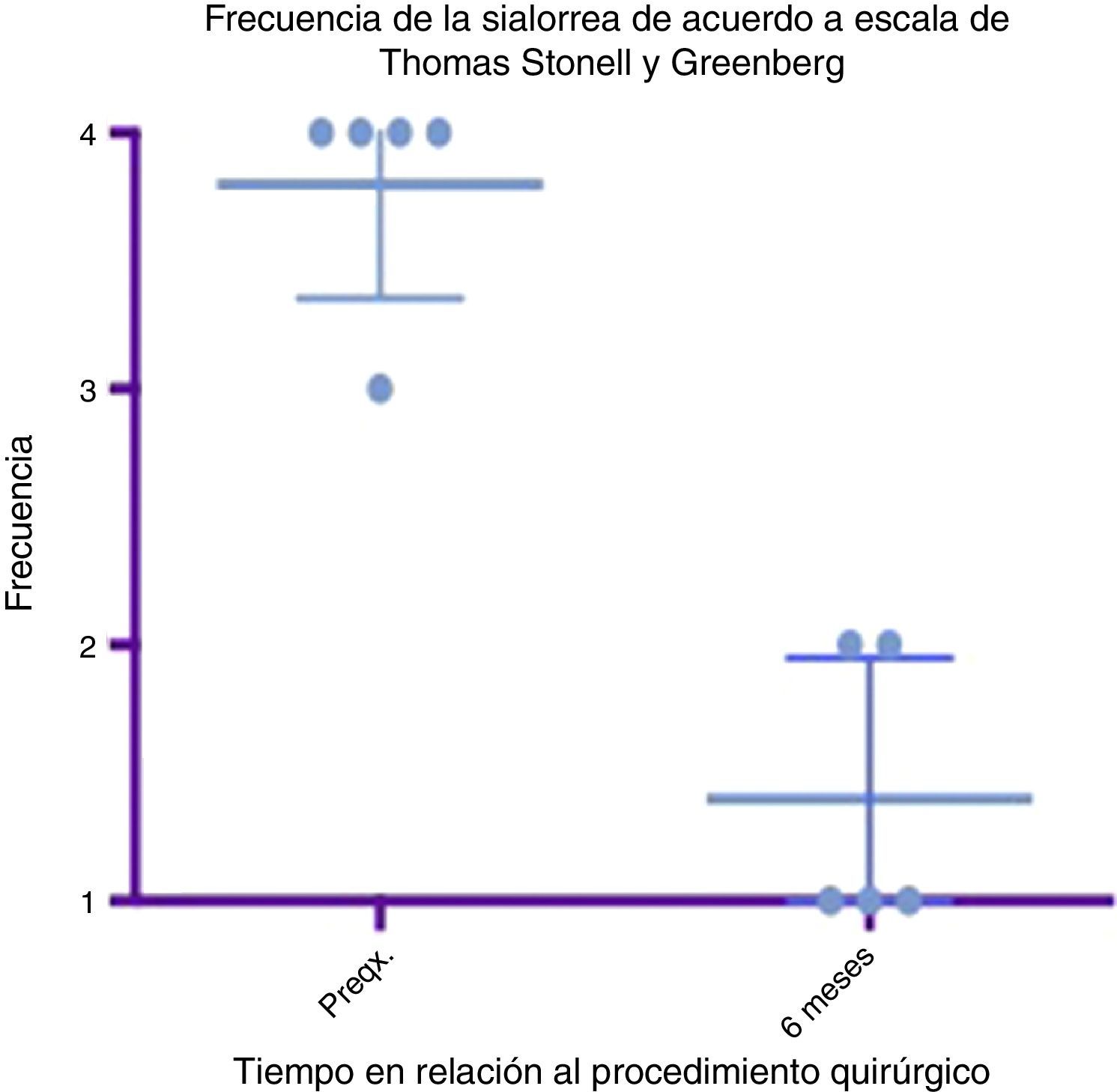
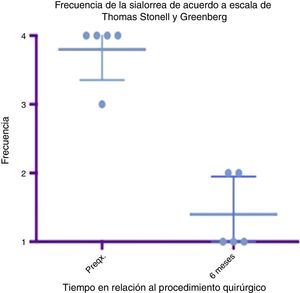
Diagrama de caja y bigotes que muestra un comparativo de la respuesta encontrada entre la etapa prequirúrgica y los 6 meses del postoperatorio, tomando en cuenta medias y desviaciones estándares.
Grado 1: nunca tiene escurrimiento. Grado 2: ocasionalmente tiene escurrimiento. Grado 3: frecuentemente tiene escurrimiento. Grado 4: constantemente tiene escurrimiento.
Preqx=prequirúrgico.
El máximo resultado se observó tras los 6 meses del procedimiento quirúrgico. En las primeras semanas tras la cirugía se observó cierta persistencia de la sialorrea, la cual estaba probablemente relacionada con el dolor. Aproximadamente a la tercera semana del postoperatorio el beneficio era ya evidente y se mantuvo a lo largo de los siguientes meses, salvo en un paciente, que al cuarto mes empeoró un escalón en la escala de severidad, aunque se mantuvo bien en cuanto a la frecuencia.
Por medio de la prueba de Friedman se observó que existe una diferencia estadísticamente significativa entre la etapa prequirúrgica y la posquirúrgica, particularmente a los 4 y 6 meses, con una p=0.0039. Por otro lado, al realizar el análisis de varianza se obtiene además un análisis de rangos que muestra evidente diferencia, desde la etapa prequirúrgica hasta la primera medición realizada a los 2 meses, la cual es sostenida e inclusive mejora discretamente en las mediciones posteriores (ver fig. 3 y fig. 5).
Un gráfico de caja y bigotes que compara las medias y las desviaciones estándar entre la etapa prequirúrgica y a los 6 meses del postoperatorio evidencia una diferencia muy importante entre las medias, tanto en el análisis de severidad como de frecuencia, además de que estas desviaciones nunca se cruzan, lo que implica un cambio significativo entre estas etapas (ver figs. 4 y 6). En cuanto a las complicaciones y eventos adversos, en uno de los pacientes se observó una paresia transitoria del depresor del labio inferior en el lado izquierdo, probablemente causada por estimulación de la rama marginal del facial, ya fuera por difusión eléctrica de la energía generada por el cauterio monopolar, ya fuera por la tracción del colgajo cervical superior. Esta se resolvió tras 14 días del procedimiento sin dejar secuela alguna, sin necesidad de esteroides ni otros medicamentos. Por lo demás no se observó ninguna complicación. El sangrado promedio en los procedimientos fue cuantificado en 50ml. A 6 meses no se observó deterioro alguno en el estado dental de los pacientes. El dolor en el postoperatorio fue escaso o leve en 3 de los pacientes y se resolvió en los primeros 5 a 7 días, 2 de los pacientes presentaron dolor moderado los primeros 7 días y a uno le tomó este tiempo regresar a su alimentación normal. El dolor mejoró mucho con AINE a partir del séptimo día, hasta desaparecer por completo en 10 días (ver tabla 3).
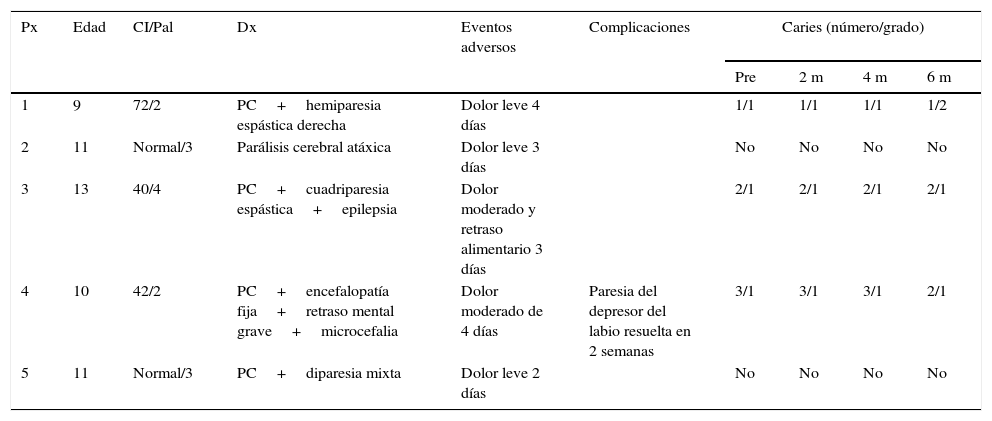
Características de los pacientes, eventos adversos y complicaciones presentadas tras el procedimiento quirúrgico y grado de caries observados antes y después del procedimiento
| Px | Edad | CI/Pal | Dx | Eventos adversos | Complicaciones | Caries (número/grado) | |||
|---|---|---|---|---|---|---|---|---|---|
| Pre | 2 m | 4 m | 6 m | ||||||
| 1 | 9 | 72/2 | PC+hemiparesia espástica derecha | Dolor leve 4 días | 1/1 | 1/1 | 1/1 | 1/2 | |
| 2 | 11 | Normal/3 | Parálisis cerebral atáxica | Dolor leve 3 días | No | No | No | No | |
| 3 | 13 | 40/4 | PC+cuadriparesia espástica+epilepsia | Dolor moderado y retraso alimentario 3 días | 2/1 | 2/1 | 2/1 | 2/1 | |
| 4 | 10 | 42/2 | PC+encefalopatía fija+retraso mental grave+microcefalia | Dolor moderado de 4 días | Paresia del depresor del labio resuelta en 2 semanas | 3/1 | 3/1 | 3/1 | 2/1 |
| 5 | 11 | Normal/3 | PC+diparesia mixta | Dolor leve 2 días | No | No | No | No | |
CI: coeficiente intelectual; Dx: diagnóstico; Pal: escala de Palisano; PC: parálisis cerebral; Px: paciente.
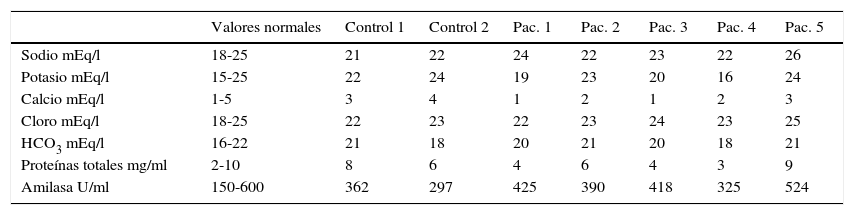
En cuanto a cambios en la cantidad o severidad de las caries, solo un paciente tuvo un aumento de grado de caries en una pieza dental. Salvo este caso no se observaron cambios a 6 meses del postoperatorio del estado basal. La valoración odontológica regular y, por ende, la mayor atención al cuidado dental, inclusive generó una discreta mejoría en el estado dental general. Por otro lado, se analizó la composición salival en los 5 pacientes en un periodo entre los 6 y los 8 meses del postoperatorio y en 2 sujetos sanos, estos últimos para verificar la ausencia de errores en el muestreo y para compararlos con los 5 pacientes postoperados, como si fuesen controles. Los valores de los pacientes no mostraron diferencias significativas con los 2 controles, todos los valores se mantuvieron en rangos de normalidad a pesar de la ausencia de saliva submandibular. El único electrólito que mostró una tendencia al cambio fue el calcio que, en general, se observó tendiente a los límites bajos de la normalidad. Esto último es esperable, considerando que la saliva producida por las glándulas submandibulares tiene un contenido de calcio discretamente mayor que el de las parótidas y sublinguales (ver tabla 4).
Valores de electrólitos, proteínas y amilasa salival encontrados en los casos a 24 meses de la cirugía y en los controles sanos
| Valores normales | Control 1 | Control 2 | Pac. 1 | Pac. 2 | Pac. 3 | Pac. 4 | Pac. 5 | |
|---|---|---|---|---|---|---|---|---|
| Sodio mEq/l | 18-25 | 21 | 22 | 24 | 22 | 23 | 22 | 26 |
| Potasio mEq/l | 15-25 | 22 | 24 | 19 | 23 | 20 | 16 | 24 |
| Calcio mEq/l | 1-5 | 3 | 4 | 1 | 2 | 1 | 2 | 3 |
| Cloro mEq/l | 18-25 | 22 | 23 | 22 | 23 | 24 | 23 | 25 |
| HCO3 mEq/l | 16-22 | 21 | 18 | 20 | 21 | 20 | 18 | 21 |
| Proteínas totales mg/ml | 2-10 | 8 | 6 | 4 | 6 | 4 | 3 | 9 |
| Amilasa U/ml | 150-600 | 362 | 297 | 425 | 390 | 418 | 325 | 524 |
HCO3: bicarbonato; Pac.: paciente.
En el metaanálisis realizado en 2009 por Reed et al.20 sobre manejo quirúrgico de la sialorrea, se observó un porcentaje combinado de éxito con las diversas técnicas de 81.6%. El procedimiento más reportado fue la recolocación de conductos de Wharton en la base de la lengua; sin embargo, los resultados más efectivos se observaron con la resección de glándulas submandibulares y recolocación de los conductos parotídeos en los lechos amigdalinos (índices de éxito subjetivo: 87.8%). La resección de glándulas submaxilares con ligadura de conductos parotídeos fue la tercera técnica con mejores resultados, en cuanto a efectividad. Por el poder de los estudios y la variabilidad en el número de estudios con estas técnicas, se concluyó: que no es posible establecer un criterio de selección definitivo entre una técnica y la otra.
La resección de las glándulas submandibulares por vía cervical es una técnica quirúrgica bien conocida por el otorrinolaringólogo, considerando el manejo de la inflamación aguda y crónica, así como la oncológica que puede ocurrir en esta glándula. Trabajar con una técnica conocida ayuda a minimizar la posibilidad de complicaciones generadas durante el procedimiento quirúrgico en centros que comienzan a trabajar en el manejo de la sialorrea.
La eficacia promedio obtenida con la sola resección de glándulas submandibulares en nuestros 5 pacientes fue del 82.1%, lo cual es equiparable a lo obtenido con las mejores técnicas, y el quinto paciente que operamos parecía encaminarse hacia un resultado equiparable. La mejoría tanto en severidad como en frecuencia al comparar el estado de sialorrea basal con el estado a 6 meses fue importante, con una diferencia estadísticamente significativa, con una p=0.0039 en ambos análisis y un IC del 95%. Al utilizar esta técnica sola, no obtenemos el detrimento de la producción de saliva estimulada que se tiene en los procedimientos que involucran a los conductos de Stenon de las glándulas parótidas, como son la ligadura o reenrutamiento, pero eliminamos la posibilidad de sialoceles parotídeos, fístulas salivales y el mayor dolor asociados a estas técnicas31–33.
Es importante considerar que dejar al paciente con una sequedad de boca importante tendrá sus propias consecuencias, especialmente en la alimentación con sólidos, y que mantener buena lubricación de la cavidad oral es un factor protector para la formación de caries y enfermedad periodontal. Por estos motivos, consideramos el ser conservadores y resecar solo las glándulas submandibulares, con lo que eliminaríamos un 70% teórico de la salivación de reposo y consideramos apropiado realizar en un segundo tiempo quirúrgico la ligadura de conductos parotídeos en pacientes que no respondieran al primer procedimiento, cosa que no ha sido necesaria. Uno de nuestros pacientes tuvo una respuesta discretamente menos favorable que los otros; sin embargo, luego del procedimiento se le inició de nuevo terapia orolinguofacial y deglutoria y se observó que, aunque esta en un principio no fue útil, ahora con el efecto logrado por el procedimiento el paciente logró controlar el restante de sialorrea que mantenía y los cuidadores se sintieron satisfechos con el resultado.
Como se comentó previamente, no se observó un aumento en el número de caries o enfermedad periodontal en los pacientes operados. Es importante comentar que durante su participación en el estudio los pacientes mejoraron la atención a la higiene dental, y consideramos que esto es suficiente para evitar el aumento en la placa dentobacteriana, caries y enfermedad periodontal evidenciada en otros estudios.
En cuanto a los cambios en la composición salival no se observaron alteraciones importantes a nivel electrolítico, proteico o enzimático; por lo que consideramos que la resección de glándulas submandibulares respeta en buena medida la producción fisiológica de saliva.
Los resultados preliminares de este estudio demuestran que la sialadenectomía submandibular en manos experimentadas es un procedimiento con un buen perfil de seguridad y un potencial de complicaciones bajo. Su utilidad para el manejo de sialorrea profusa en pacientes con parálisis cerebral es mucha, pues reduce de manera relevante tanto la severidad como la frecuencia. Es importante continuar este estudio para obtener más datos sobre seguridad y efectividad, dado que la muestra en este estudio piloto es pequeña y, por lo tanto, no significativa.
El buen resultado en pacientes pediátricos con parálisis cerebral señala que esta técnica puede ser igualmente útil, en otras enfermedades neurológicas que condicionen sialorrea como lo son: esclerosis lateral amiotrófica, enfermedad de Parkinson o las secuelas de evento vascular cerebral, por lo que se propone que se realicen estudios de las características de este, pero en ese otro tipo de pacientes.
ConclusionesLa resección de glándulas submandibulares es una técnica efectiva para el control de la sialorrea en pacientes pediátricos con parálisis cerebral, con resultados que rondan el 80% de efectividad.
Es una técnica con una tasa baja de complicaciones, a diferencia de las técnicas que involucran a la glándula parótida, donde el dolor es más severo por la posibilidad de sialoceles, y las técnicas de recolocación de conductos a la base de la lengua, en las que el edema puede comprometer la vía aérea y el retorno a una alimentación normal puede ser más largo.
Resecar las glándulas submandibulares generó una disminución suficiente y evidenciable de la sialorrea, sin la necesidad de trabajar con las otras glándulas salivales mayores. Este beneficio fue especialmente evidenciable con la salivación de reposo, que es la que más aqueja a estos pacientes.
Ningún paciente presentó aumento de enfermedades dentales, sequedad de boca o problemas durante la alimentación con sólidos: consideramos que la salivación parotídea no fue afectada con el procedimiento quirúrgico.
Es necesario ampliar nuestra experiencia para obtener adecuados parámetros de seguridad y eficacia de la técnica, pero los resultados en estos primeros 5 pacientes son alentadores, para considerar esta técnica como el estándar de manejo en nuestro centro.
Sería igualmente útil probar la efectividad y seguridad de otras técnicas de probada eficacia en nuestros pacientes y contrastarlas con la que utilizamos actualmente, para evaluar cuál es en realidad la mejor técnica disponible para el manejo de la sialorrea.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Agradecimiento a la Dra. Olga Beltrán Rodríguez-Cabo y al Dr. Mario Sergio Dávalos Fuentes por su colaboración en el estudio.