El linfoma gástrico no Hodking es un tumor poco frecuente el cual representa aproximadamente el 7% de todas las neoplasias malignas del estómago y 2% de todos los linfomas. Siendo la localización gástrica la más frecuente de los linfomas MALT (linfoma de tejido linfoide asociado a mucosa), presentándose con mayor frecuencia en el antro gástrico en el 41% de los casos, y el 33% puede ser multifocal. El riesgo de perforación espontánea por un linfoma MALT gástrico es del 4-10%. El objetivo de este artículo es presentar el caso de una complicación rara en un paciente inmunosuprimido, y hacer una revisión del tema.
Caso clínicoPaciente masculino de 24 años portador de virus de la inmunodeficiencia humana, el cual inició con signos y síntomas de abdomen agudo de 72 horas de evolución y fiebre. Acude a Urgencias en donde se le realiza tomografía de abdomen la cual muestra líquido libre en cavidad, y engrosamiento de paredes gástricas. Se somete a laparotomía, encontrando ausencia de pared anterior de estómago sellada con lóbulo izquierdo del hígado, colon y epiplón. Se realiza gastrectomía total con esofagostoma y sonda de yeyunostomía.
ConclusionesLa perforación gástrica por un linfoma MALT es muy rara con una alta mortalidad, hay poca información reportada sobre esta complicación, se debe de tener una alta sospecha para poder ofrecer un tratamiento oportuno para una complicación de este tipo
Gastric non-Hodgkin lymphoma is a rare tumour that represents approximately 7% of all stomach cancers and 2% of all lymphomas. The most frequent location of gastric MALT (mucosa associated lymphoid tissue) lymphomas is in the antrum in 41% of the cases, and 33% can be multifocal. The risk of spontaneous perforation of a gastric MALT lymphoma is 4-10%.
Clinical case24 year old male patient carrying the Human Immunodeficiency Virus, who began with signs and symptoms of acute abdomen and fever 72 hours before arriving in the emergency room. A computed tomography was performed that showed free fluid in the cavity, and gastric wall thickening. The patient underwent a laparotomy, finding absence of the anterior wall of the stomach, sealed with the left lobe of the liver, colon and omentum. Total gastrectomy, with oesophagosty and jejunostomy tube, was performed.
ConclusionsGastric perforation secondary to a MALT lymphoma is rare, with high mortality. There is limited information reported of this complication and should be highly suspected in order to provide appropriate treatment for a complication of this type.
El linfoma de tejido linfoide asociado a la mucosa (MALT por sus siglas en inglés) gástrica es una enfermedad rara1, fue descrito por primera vez en 1983 por Isaacson y Wright2; se encuentra clasificado dentro de los linfomas no Hodking de células B, extranodal y encuadrado dentro de los linfomas de la zona marginal, por lo que puede diseminarse a nodos linfáticos y de otros órganos durante su evolución1,2. Este representa aproximadamente el 7% de todas las neoplasias malignas del estómago, y el 2% de todos los linfomas2. Siendo la localización gástrica la más frecuente de los linfomas MALT, presentándose con mayor frecuencia en el antro gástrico en un 41% de los casos, y en el 33% puede ser multifocal3.
La edad de presentación más frecuente es a partir de los 50 años, con predominio de los varones sobre las mujeres de 1.7: 1. En el momento de su diagnóstico es un tumor de bajo grado en un 70-85% de los casos1,4.
El riesgo de perforación espontánea por un linfoma MALT gástrico es del 4-10% puede presentarse de forma espontánea de urgencia o como complicación de quimio o radioterapia; pero la ausencia completa de la pared anterior del estómago como en este reporte de caso es una presentación aún más rara4,5.
Existe estrecha relación entre la infección por el Helicobacter pilory (H. pilory) y el desarrollo de linfoma MALT gástrico, demostrado por diferentes estudios.
El riesgo de perforación gástrica puede presentarse de forma espontánea de urgencia o como complicación de quimio o radioterapia6; pero la ausencia completa de la pared anterior del estómago como en el caso de nuestro paciente es raro por lo que nuestro objetivo es realizar una revisión de los pocos reportes de esta complicación, y el adecuado manejo de esta patología.
Caso clínicoPaciente masculino de 24 años de edad, antecedentes de importancia como portador de VIH desde el nacimiento en control por el servicio de Infectología con última carga viral para VIH de 163 copias/ml, CD4 19cel/AL en tratamiento con tenofovir/entricitabina y efavirenz, tuberculosis pulmonar hace 3 años, niega otras enfermedades o cirugías previas.
Inició su padecimiento actual 72 horas previas a su ingreso en Urgencias con dolor abdominal de inicio súbito en epigastrio con irradiación a dorso, de tipo quemante, constante e incapacitante, EVA 9/10, con náuseas sin llegar al vómito, fiebre no cuantificada, sin automedicarse, se mantuvo durante 2 días con el dolor hasta que no vio mejoría por lo decide acudir a Urgencias para recibir atención.
Exploración física: tensión arterial 110/70 mmHg, frecuencia cardiaca 117 por minuto, frecuencia respiratoria 18 por minuto, temperatura 37.5°C. Paciente caquéctico, palidez de tegumentos, deshidratado, neurológicamente integro con fascies de dolor, orientado en tiempo y espacio, área cardiaca rítmica, taquicardia sin soplos ni agregados, campos pulmonares bien ventilados sin estertores ni sibilancias. Abdomen a la auscultación con ruidos peristálticos disminuidos, timpánico a la percusión, con rigidez involuntaria en madera, dolor a la palpación superficial en todos los cuadrantes, se palpa plastrón en epigastrio y mesogastrio, rebote positivo, con datos francos de irritación peritoneal.
Laboratorios a su ingreso: leucocitos 4.0 miles/Ul, hemoglobina 6.2 g/dl, hematocrito 21.7%, plaquetas 254 miles/Ul, neutrófilos 84.9%, linfocitos 8.8%, TP 12.9, glucosa 81 mg/dl, creatinina 0.9 mg/dl, K 4.5 mmol/l, Na 122 mmol/l, deshidrogenasa láctica 493 U/l. Gasometría arterial: pH 7.35, PCO2 29, PO2 76, HCO3 17, CO2 18, EB-6.1, SatO2 95.5% sin apoyo de oxígeno suplementario.
La evaluación por medio de la escala de APACHE II mostró ser de 15 puntos con mortalidad del 25%.
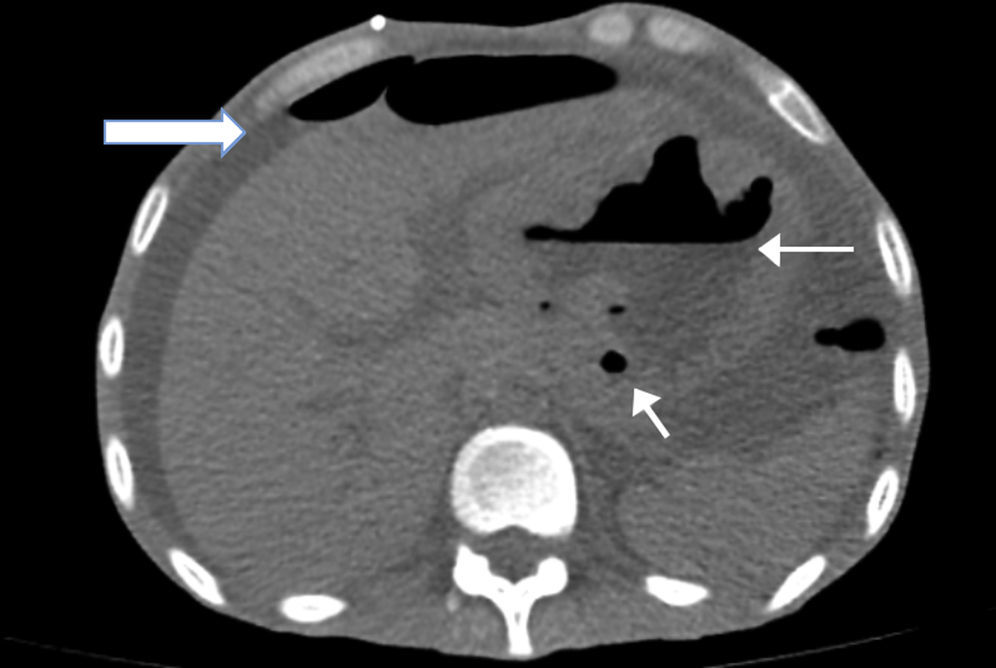
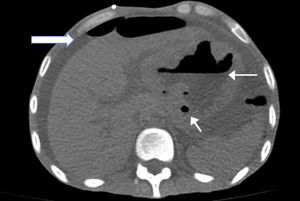
Se le tomó una tomografía simple de abdomen en donde se apreciaba engrosamiento de la pleura izquierda con un pequeño derrame, abdomen con líquido libre en toda la cavidad abdominal, estómago con paredes engrosadas en donde se aprecia el lóbulo hepático izquierdo adherido al estómago (fig. 1).
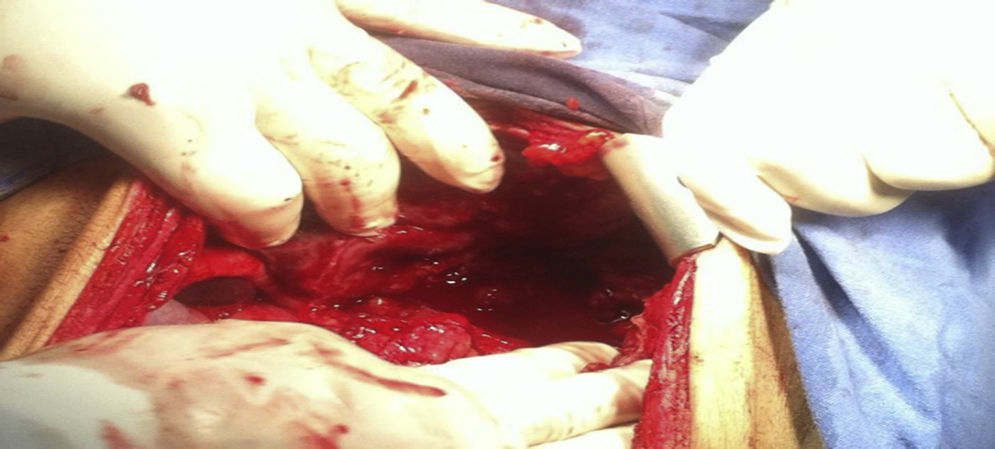
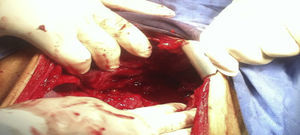
Se decide someter a laparotomía de urgencia en donde se encuentran 600 cc de líquido libre inflamatorio en cavidad, sin datos de sangrado activo, un plastrón que involucraba hígado, estómago y colon, al disecarlo se encuentra ausencia de la pared anterior gástrica desde 3 cm por debajo de la unión esofagogástrica hasta píloro, los pliegues de la mucosa gástrica estaban engrosados e indurados, adenopatías inflamatorias en curvatura mayor y menor de aproximadamente 0.5 cm, colon transverso dilatado aproximadamente 5 cm de diámetro (fig. 2) ante estos hallazgos se decide realizar gastrectomía total con esofagostoma más colocación de sonda de yeyunostomía.
El paciente pasa a la Unidad de Terapia Intensiva con apoyo de aminas presoras, presentando falla orgánica múltiple secundaria a sepsis abdominal, y 24 horas después fallece.
Posteriormente se obtiene el cultivo de líquido peritoneal donde se reporta Gram con levaduras, escasos polimorfonucleares y Candida albicans. Citoquímico de líquido peritoneal de aspecto turbio, leucocitos 10,710 mm3, polimorfonucleares 90% con crenocitos, piocitos, bacterias y mononucleares 10%.
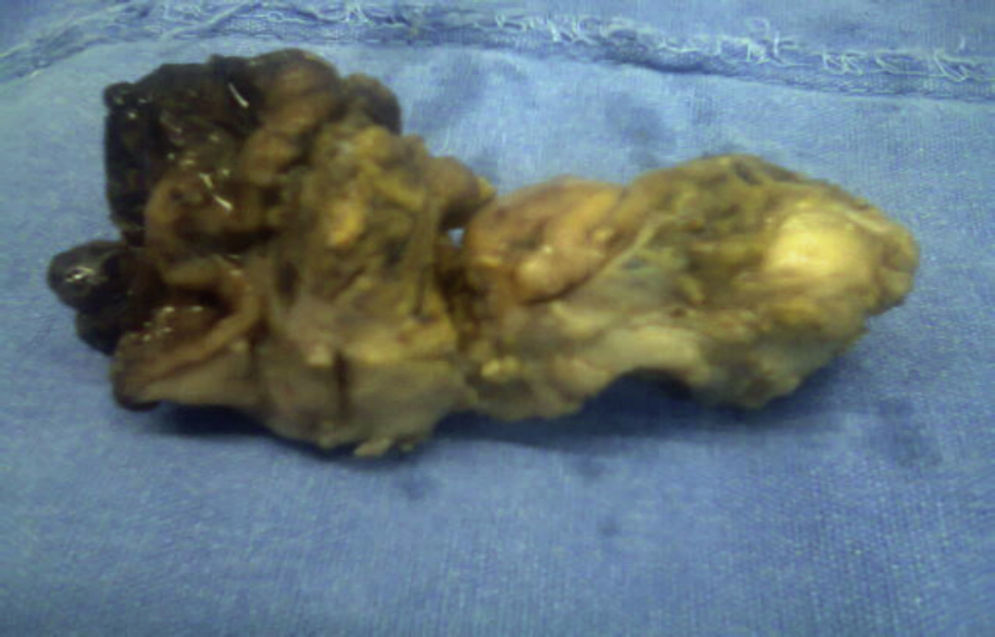
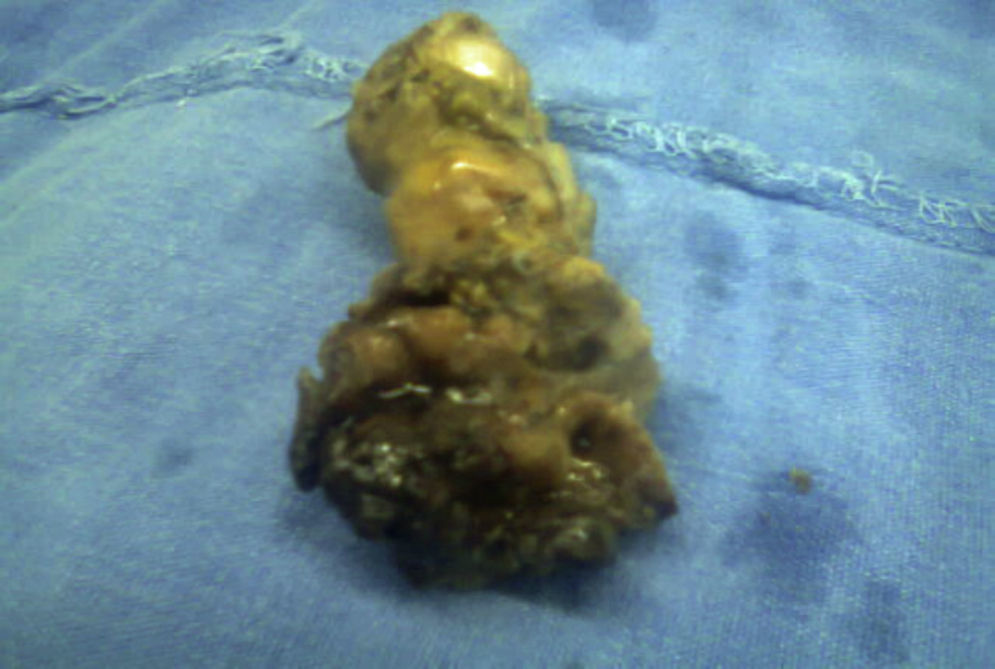
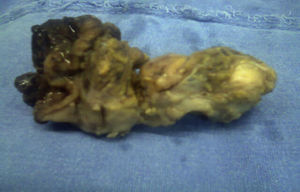
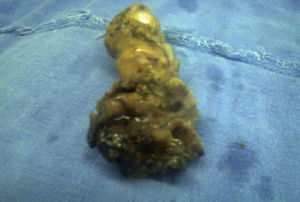
El resultado histopatológico de la pieza reportó imagen histológica con lesión linfoproliferativa maligna de alto grado en relación a linfoma MALT, inmunohistoquímica positiva para CD20++, CD21+++, y CD35++, negativo para CD10, y CD5 (figs. 3 y 4).
La perforación gástrica espontánea secundaria a un linfoma es una complicación rara, y solo encontramos el reporte de un caso con este tipo de complicaciones que fue reportado por Ayako y Kitsukawa7, en donde la presentación inicial es por úlceras gástricas a consecuencia del tumor; en nuestro caso el paciente nunca presentó sintomatología gástrica, ni se realizó nunca una endoscopia durante su vida, por lo que realizar un diagnóstico previo resulta muy complicado.
El linfoma MALT gástrico es una neoplasia que produce escasas manifestaciones clínicas en sus estadios iniciales, y puede incluso ser asintomático; muchas veces se confunden con cáncer gástrico; suele ocasionar un cuadro dispéptico, con predominio de dolor epigástrico, con o sin ritmo ulceroso, sensación de plenitud, náuseas y vómitos. Los tumores avanzados producen un cuadro similar al del carcinoma gástrico, con pérdida de peso, fatiga, anorexia, sangrado digestivo, y en 10-20% de los casos es posible palpar un tumor abdominal1,2,4,7.
El diagnóstico de linfoma MALT se basa en la gastroscopia, con toma de biopsias, un hallazgo característico pero no patognomónico de los linfomas MALT son paredes gástricas engrosadas, las cuales se aprecian claramente en la tomografía que se tomó a su ingreso. Además se puede observar la presencia de ulceraciones, con pliegues engrosados y/o tumores irregulares o polipoideos. El hallazgo de estas lesiones junto a úlceras múltiples, estrelladas y en ocasiones confluentes (que incluso pueden rebasar el píloro y afectar al duodeno), es sugestivo de lesión linfomatosa. Ante la simple sospecha de la existencia del linfoma MALT, se deberán tomar numerosas muestras desde el antro hasta el fórnix, mapeando la totalidad de la mucosa gástrica1,2,8.
El diagnóstico histológico se demuestra mediante técnicas de inmunohistoquímica, Southern Blot y de PCR para detectar la monoclonalidad de linfocitos B, particularmente, en el diagnóstico diferencial con los seudolinfomas. Las células tumorales son linfocitos B de tamaño pequeño-mediano, con citoplasma poco abundante y núcleo de forma irregular, denominados linfocitos centrocitoides y son menos frecuentes los de forma de linfocitos pequeños o de tipo monocitoides; en una misma lesión puede haber un claro predomino de una forma celular, o coexistir varias de ellas. Se considera como el rasgo morfológico más característico de linfoma MALT, la presencia de lesión linfoepitelial, consistente en la invasión de la cripta por agregados de linfocitos centrocitoides. Otros hallazgos histológicos son la moderada atipia celular de los linfocitos tumorales y la presencia de linfocitos con cuerpos de Dutcher, si bien su ausencia no descarta el diagnóstico1,3,4,8.
Los estudios inmunohistológicos muestran positividad a: CD20, CD21, CD35 e IgM, y negatividad a: CD5, CD10, CD23 y ciclina D1(-). La presencia de monoclonalidad no equivale a malignidad, pudiendo haber monoclonalidad sin linfoma o persistir esta durante un tiempo tras la desaparición del tumor1,2,4,8.
La división en linfomas de bajo y alto grado se hace según la proporción de células blásticas en la lesión. La clasificación del tumor en alto o bajo grado es importante, ya que el alto grado conlleva un cuadro clínico más agresivo y un peor pronóstico. El diagnóstico histológico del grado puede ser difícil en determinados pacientes, ya que ambos grados pueden coexistir en una misma lesión o en diferentes lesiones multifocales, habiéndose descrito la transformación evolutiva de bajo a alto grado en los linfomas MALT. Se considera que la presencia de islotes de más de 20 células transformadas, o una proporción superior al 15-20% de células de alto grado tiene importancia clínica. En determinados linfomas de alto grado no se aprecia ningún signo de lesión de bajo grado, por lo que estos tumores pueden considerarse de alto grado «de novo». No obstante, este dato carece de valor pronóstico ya que no existen diferencias clínicas con los linfomas que progresan de bajo a alto grado1,2,8.
Disponemos de varias posibilidades terapéuticas para los linfomas MALT gástricos, que incluyen: tratamiento para erradicación de la infección por H. pilory; tratamiento quirúrgico; tratamiento oncológico no quirúrgico con quimio y/o radioterapia. Estas modalidades de tratamiento pueden complementarse entre sí. En el caso de los linfomas de bajo grado no se han encontrado diferencias significativas en la supervivencia tras tratamiento para erradicación, cirugía, quimioterapia, y cirugía más quimioterapia o radioterapia1,2,9. La supervivencia de pacientes operados con fines curativos a 5 años es del 93.7% en estadio I, estadio II 55% y estadio III 25%1,6,9. Cuando la cirugía es de tipo paliativo la supervivencia es de 37.1% a 5 años, mientras que la supervivencia de pacientes operados con ganglios negativos es de 92.3% a 5 años y con ganglios positivos es de 41.3% y en ambos a 5 años1,6,9.
En los tumores de bajo grado se demostró que la erradicación del H. pylori conduce a la remisión tumoral, al interrumpir el estímulo inmunológico que mantiene su crecimiento, al parecer es permanente pero se confirma hasta 5 años sin datos de actividad tumoral.
El tratamiento de primera línea recomendado para las etapas clínicas I y II es para tratar la infección por H. pylori que supone la combinación de cualquier inhibidor de la bomba de protones junto a amoxicilina y claritromicina, sustituyendo la primera por metronidazol y en caso de alergia a la primera, se debe sustituir por metronidazol. El control de la infección por H. pylori se hace por endoscopia; si se confirma que existe todavía infección H. pylori o el paciente continúa con síntomas y es negativo para H. pylori se debe considerar radioterapia o rituximab en caso de que haya contraindicación para radioterapia.
Para etapas clínicas III y IV en donde el paciente presente sangrado, sintomatología, enfermedad avanzada, afección de algún órgano y muestre datos de progresión de la enfermedad si existe alguno de los anteriores se da manejo con terapia inmunológica, quimioterapia o radioterapia locorregional6,9. Los esquemas de quimioterapia más utilizados son bendamustina más rituximab, R-CHOP (rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona), y RCVP (rituximab, ciclofosfamida, vincristina y prednisona)1,6,9.
Recientemente, la resección quirúrgica era el tratamiento empleado para el maltoma. Actualmente la indicación de la cirugía sería el fracaso confirmado del tratamiento para erradicación o el linfoma de alto grado, limitado a las paredes del estómago. Aunque los resultados de la cirugía gástrica siguen siendo buenos con mortalidad menor al 3%, la tendencia ideal es emplear tratamientos no quirúrgicos.
Las indicaciones de cirugía de urgencia para un linfoma MALT son la perforación con una incidencia del 4-10%, obstrucción pilórica y en algunos casos la hemorragia con una prevalencia del 19%7,9 siendo más frecuente esta última. La perforación gástrica espontánea representa una complicación muy seria con una alta mortalidad1,8,9.
El estadio es el principal factor pronóstico, también se dice que los tumores menores de 5 cm tienen una supervivencia del 100% a 5 años, mientras que si son mayores de 10 cm esta solo alcanza un 20%9–11.
ConclusionesEl linfoma MALT representa el 50% de los linfomas gástricos y se desarrolla secundario a una infección por H. pylori como resultado de una gastritis crónica, sin embargo en nuestro caso el paciente negó antecedentes de enfermedad acido péptica, finalmente el paciente comenzó con una perforación gástrica importante siendo una de las complicaciones más raras y mortales, motivo por el cual se decide reportar este caso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.