La cirugía colorrectal ha evolucionado desde el advenimiento de la sutura mecánica y el abordaje de mínima invasión. El inicio de la cirugía robótica obedece a la satisfacción de necesidades del binomio médico-paciente, migrando al área de la cirugía colorrectal. Reportamos la experiencia inicial en el abordaje de la patología colorrectal asistida por robot y analizamos el papel actual de esta plataforma.
Material y métodosEstudio retrospectivo de 5 pacientes con patología colorrectal intervenidos con la plataforma Da Vinci durante un año, en la fase inicial de la curva de aprendizaje. Se describe y analiza el género, la edad, el diagnóstico y la indicación quirúrgica, la cirugía realizada, el tiempo quirúrgico y el de consola, la conversión, el sangrado, las complicaciones postoperatorias, y los días de estancia hospitalaria. Se realiza un análisis de la bibliografía sobre el papel que desempeña la cirugía asistida por robot. Se usan porcentajes como medida de resumen para las variables cualitativas.
ResultadosCinco pacientes, 3 masculinos y 2 femeninos, con una edad promedio de 62.2 años; se realizan 2 resecciones anteriores bajas con anastomosis colorrectal, una de ellas extendida con ileostomía en asa de protección, un procedimiento Frykman-Goldberg, y 2 hemicolectomías izquierdas con anastomosis primaria. El tiempo quirúrgico promedio fue de 6h y el de consola de 4h y 20min. Ningún paciente requirió conversión, y la estancia hospitalaria promedio fue de 5 días.
ConclusiónA nivel mundial diversos centros quirúrgicos emplean la cirugía asistida por robot sobre la base de ventajas teóricas, las cuales se han confirmado en la práctica mediante diferentes estudios. Reportamos los primeros casos de cirugía colorrectal en México, con resultados prometedores. Hay suficiente evidencia para respaldar y recomendar su uso en nuestras instituciones como una opción factible y segura.
Colorectal surgery has advanced notably since the introduction of the mechanical suture and the minimally invasive approach. Robotic surgery began in order to satisfy the needs of the patient-doctor relationship, and migrated to the area of colorectal surgery. An initial report is presented on the experience of managing colorectal disease using robot-assisted surgery, as well as an analysis of the current role of this platform.
Material and methodsA retrospective study was conducted in order to review five patients with colorectal disease operated using a robot-assisted technique over one year in the initial phase of the learning curve. Gender, age, diagnosis and surgical indication, surgery performed, surgical time, conversion, bleeding, post-operative complications, and hospital stay, were analysed and described. A literature review was performed on the role of robotic assisted surgery in colorectal disease and cancer.
ResultsThe study included 5 patients, 3 men and 2 women, with a mean age of 62.2 years. Two of them were low anterior resections with colorectal primary anastomoses, one of them extended with a loop protection ileostomy, a Frykman-Goldberg procedure, and two left hemicolectomies with primary anastomoses. The mean operating time was 6hours and robot-assisted 4hours 20minutes. There were no conversions and the mean hospital stay was 5 days.
ConclusionThis technology is currently being used worldwide in different surgical centres because of its advantages that have been clinically demonstrated by various studies. We report the first colorectal surgical cases in Mexico, with promising results. There is enough evidence to support and recommend the use of this technology as a viable and safe option.
El área de la cirugía colorrectal ha evolucionado notablemente desde el advenimiento de la sutura mecánica y posteriormente con el abordaje de mínima invasión. El inicio de la cirugía asistida por robot obedece a la satisfacción de necesidades del binomio médico-paciente, migrando al área de la cirugía colorrectal, siendo áreas prometedoras que requieren de una mayor evidencia. A continuación se describe con base en una revisión de la literatura, el papel de la cirugía asistida con robot en el campo de la cirugía colorrectal de mínima invasión y nuestra experiencia inicial en un centro privado de tercer nivel de atención.
El inicio de la cirugía asistida por robot ha marcado una nueva era en la historia de la cirugía y sobre todo en los procedimientos de mínima invasión. En 1985 la National Aeronautics and Space Administration (NASA) desarrolló el primer robot telemanipulado a instancias del departamento de Defensa de los Estados Unidos de América con el objetivo de disminuir el número de defunciones en la guerra de Vietnam1,2.
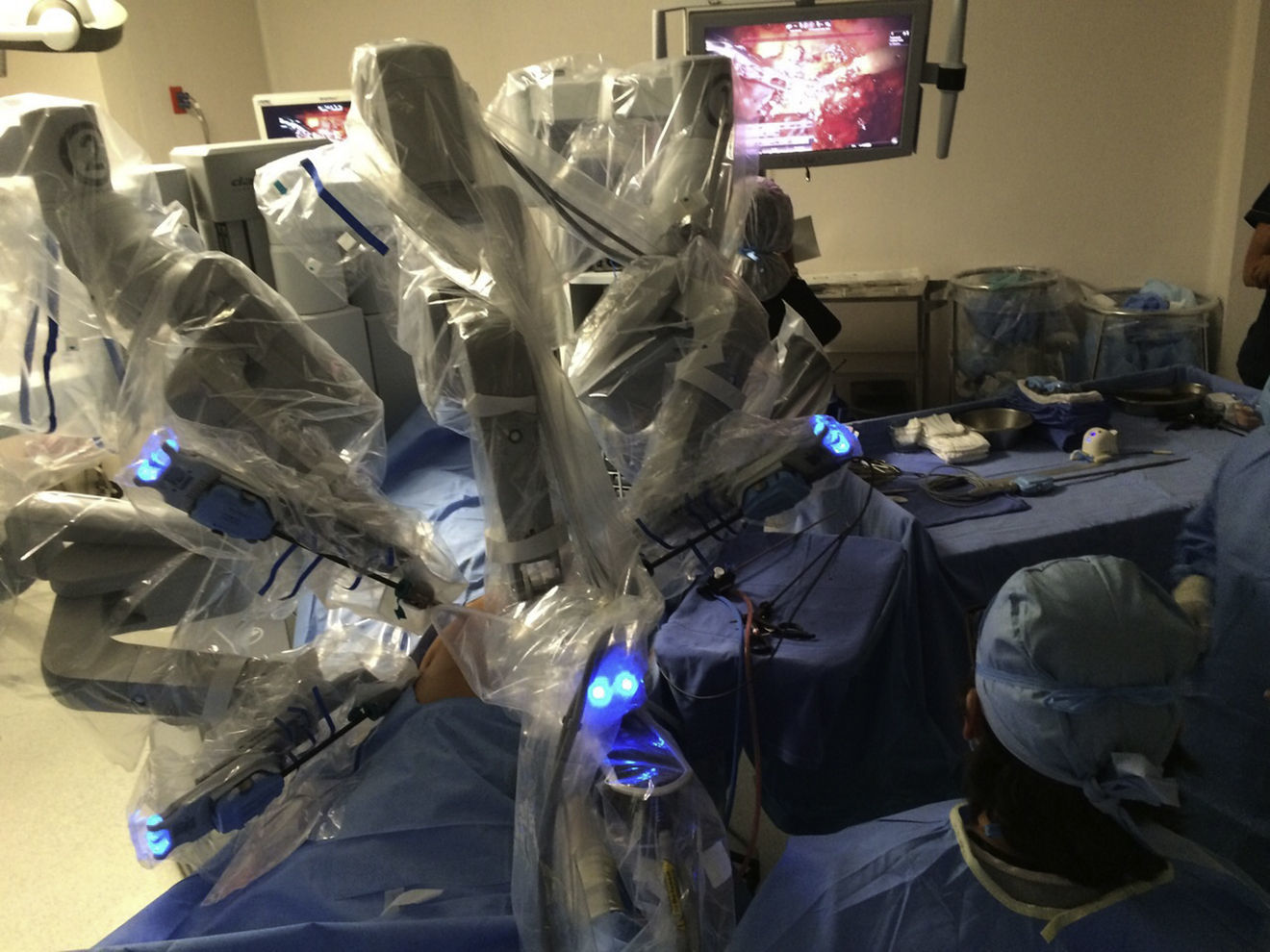
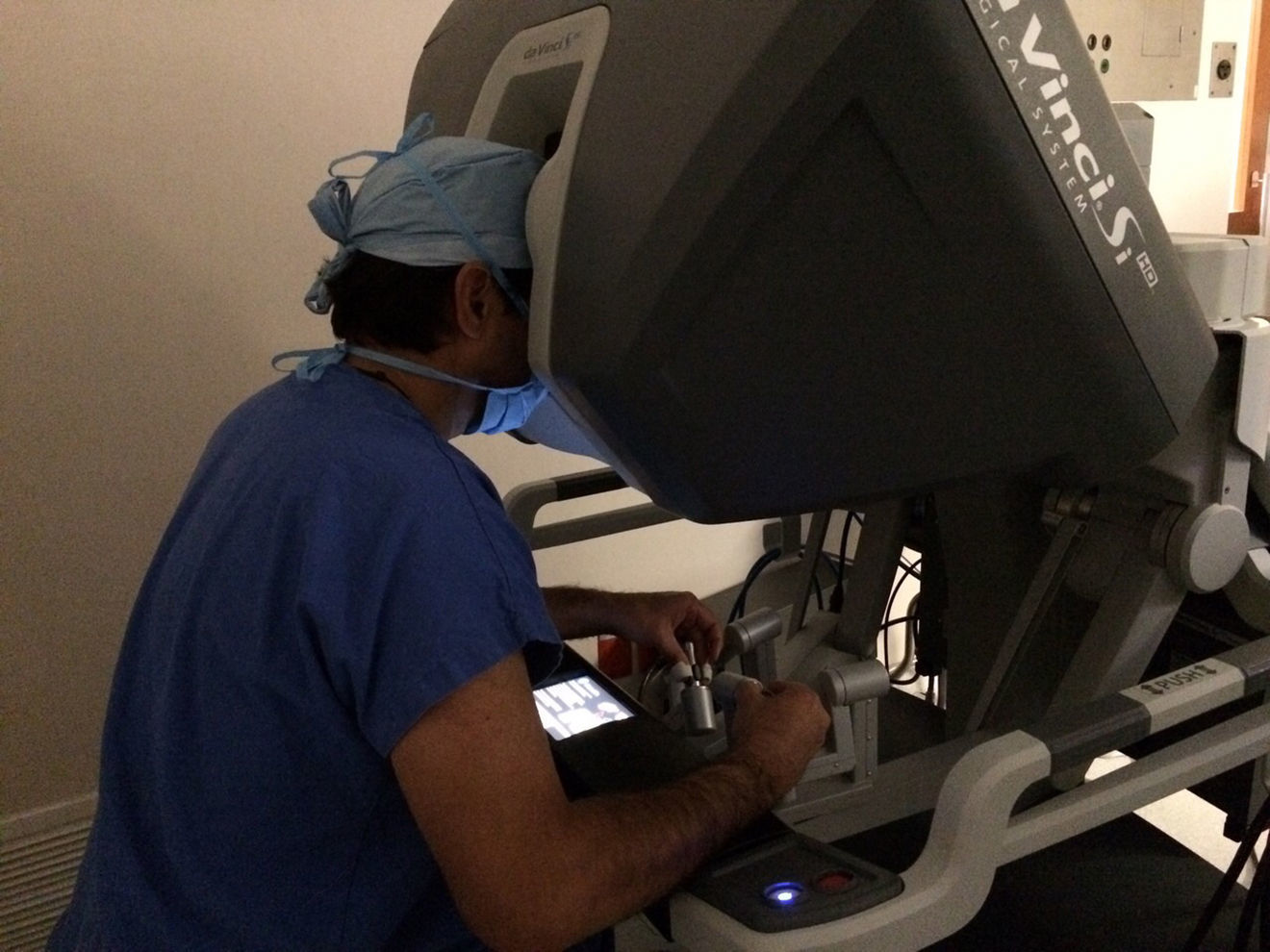
El modelo inicial del sistema Da Vinci fue lanzado en el año 1999, teniendo a la fecha una serie de mejoras y llegando a la versión «Xi» con un mejor rendimiento. El sistema Da Vinci consiste en una consola y un robot que cuenta con 4 brazos robóticos interactivos conectados a la consola controlada por el cirujano (fig. 1). Uno de los brazos lleva la cámara endoscópica, la cual tiene 2 lentes que proporcionan una imagen 3D con visión estereoscópica de alta definición. Los otros 3 brazos se utilizan para adaptar los instrumentos (fig. 2).
Otra de las ventajas del sistema Da Vinci es que permite al cirujano controlar los movimientos de la cámara, y además el sistema filtra y descifra los movimientos de la mano del cirujano en movimientos estables y precisos, eliminando así el temblor fisiológico.
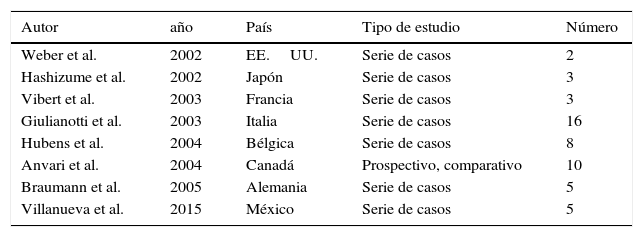
En el año 2000 la Federal Drug and Administration (FDA) aprobó el uso del sistema robótico Da Vinci para el tratamiento quirúrgico. Este abordaje revolucionario alcanzó el área de la cirugía colorrectal en el año 2002, cuando se realizó la primera hemicolectomía derecha3. Aunque ha transcurrido más de una década desde el primer reporte de cirugía laparoscópica asistida con robot en cirugía colorrectal, el papel de esta técnica continúa en desarrollo3. Al igual que nosotros, diversos autores a nivel mundial reportan su experiencia y resultados iniciales desde hace varios años3-9 (tablas 1 y 2).
Primeros reportes de cirugía robótica en el área de cirugía colorrectal en el mundo
| Autor | año | País | Tipo de estudio | Número |
|---|---|---|---|---|
| Weber et al. | 2002 | EE.UU. | Serie de casos | 2 |
| Hashizume et al. | 2002 | Japón | Serie de casos | 3 |
| Vibert et al. | 2003 | Francia | Serie de casos | 3 |
| Giulianotti et al. | 2003 | Italia | Serie de casos | 16 |
| Hubens et al. | 2004 | Bélgica | Serie de casos | 8 |
| Anvari et al. | 2004 | Canadá | Prospectivo, comparativo | 10 |
| Braumann et al. | 2005 | Alemania | Serie de casos | 5 |
| Villanueva et al. | 2015 | México | Serie de casos | 5 |
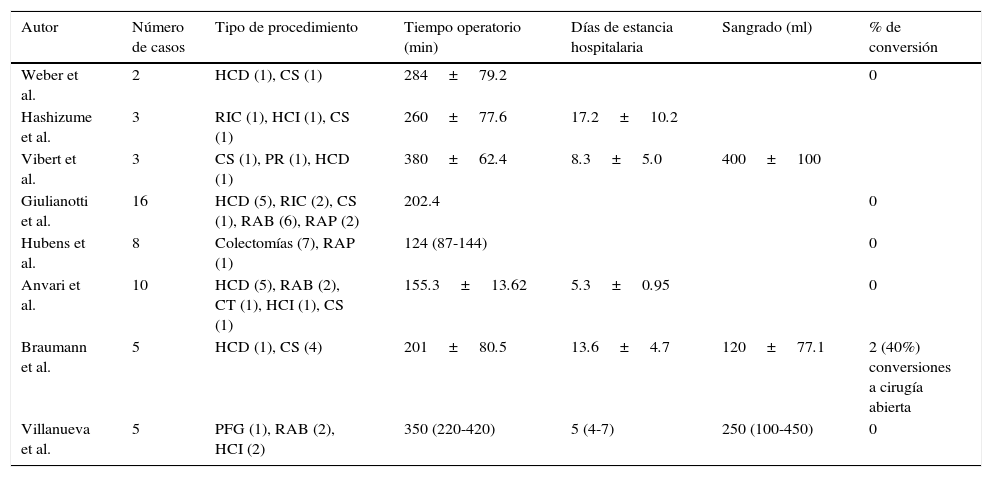
Resultados de los primeros reportes de cirugía robótica en el área de cirugía colorrectal en el mundo
| Autor | Número de casos | Tipo de procedimiento | Tiempo operatorio (min) | Días de estancia hospitalaria | Sangrado (ml) | % de conversión |
|---|---|---|---|---|---|---|
| Weber et al. | 2 | HCD (1), CS (1) | 284±79.2 | 0 | ||
| Hashizume et al. | 3 | RIC (1), HCI (1), CS (1) | 260±77.6 | 17.2±10.2 | ||
| Vibert et al. | 3 | CS (1), PR (1), HCD (1) | 380±62.4 | 8.3±5.0 | 400±100 | |
| Giulianotti et al. | 16 | HCD (5), RIC (2), CS (1), RAB (6), RAP (2) | 202.4 | 0 | ||
| Hubens et al. | 8 | Colectomías (7), RAP (1) | 124 (87-144) | 0 | ||
| Anvari et al. | 10 | HCD (5), RAB (2), CT (1), HCI (1), CS (1) | 155.3±13.62 | 5.3±0.95 | 0 | |
| Braumann et al. | 5 | HCD (1), CS (4) | 201±80.5 | 13.6±4.7 | 120±77.1 | 2 (40%) conversiones a cirugía abierta |
| Villanueva et al. | 5 | PFG (1), RAB (2), HCI (2) | 350 (220-420) | 5 (4-7) | 250 (100-450) | 0 |
CS: colostomía de sigmoides; CT; colectomía total; HCD: hemicolectomía derecha; HCI: hemicolectomía izquierda; PFG: procedimiento de Frykman-Goldberg; PR: proctectomía; RAB: resección anterior baja; RAP: resección abdominoperineal; RH: reversión Hartmann; RIC: resección ileocecal; S: sigmoidectomía.
En la actualidad ha demostrado ventajas sobre la cirugía laparoscópica, siendo las principales: una plataforma estable, mejor visión (3D HD) y mejor acceso a espacios reducidos, que han hecho del robot una herramienta atractiva para muchas especialidades, específicamente en los procedimientos del recto extraperitoneal y la pelvis1,10-12.
Material y métodosEstudio retrospectivo en el que se revisaron los expedientes clínicos de 5 pacientes con patología colorrectal intervenidos mediante la plataforma Da Vinci durante un año, en la fase inicial de la curva de aprendizaje. Se describen el género, la edad, el diagnóstico y la indicación quirúrgica, la cirugía realizada, el tiempo quirúrgico, el tiempo de consola, la conversión, el sangrado, las complicaciones postoperatorias y los días de estancia hospitalaria. Además se realiza una revisión de la bibliografía sobre el papel que desempeña la cirugía asistida por robot.
ResultadosSe intervinieron 5 pacientes, 3 masculinos y 2 femeninos, con una edad promedio de 62.2 años. Se realizaron: a) una hemicolectomía izquierda con anastomosis primaria por una enfermedad diverticular complicada Hinchey IIB, con un tiempo quirúrgico de 5h, de las cuales 3h y 30min correspondieron a la consola, y hemorragia de 150cc sin complicaciones; b) una resección anterior baja extendida con anastomosis colorrectal e ileostomía de protección en asa por cáncer de recto medio tras quimioterapia y radioterapia, con una duración de 6h, de las cuales 4h y 20min fueron de consola, y hemorragia de 400cc; c) procedimiento de Frykman-Goldberg con histerectomía por prolapso rectal completo y uterino, con una duración de 7h, de las cuales 3h y 30min fueron para la rectopexia y sigmoidectomía —con 3h de consola— y 3h para el procedimiento ginecológico, con hemorragia de 450cc; d) hemicolectomía izquierda más anastomosis colorrectal por adenocarcinoma en unión recto-sigmoidea con una duración de 3h y 40min —con 3h de consola— y hemorragia de 100cc, y e) resección anterior baja con resección de íleon terminal e ileostomía de protección por un adenocarcinoma en unión recto-sigmoidea fistulizado a íleon, con una duración de 6h 20min, con 4h y 20min de consola, y hemorragia de 150cc, con ileostomía terminal por resección de íleo terminal. El tiempo quirúrgico promedio de los 5 pacientes fue de 5h y 50min, con un tiempo de consola de 3h y 50min, y una hemorragia promedio de 250cc. Ningún paciente requirió de conversión y la estancia hospitalaria media fue de 5 días13 (tabla 3).
Características generales de los pacientes
| Número de paciente | Genero/edad | Diagnóstico | Tiempo quirúrgico (h) | Cirugía realizada | Tiempo de consola (h) | Conversión | Complicación | DEIH | Sangrado (ml) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | M/58 | Enfermedad diverticular complicada Hinchey IIB | 5:00 | HCI+CRATTM | 3:30 | No | No | 7 | 150 |
| 2 | F/67 | Prolapso rectal y uterino | 7:00 | PFG+HTA | 3:00 | No | No | 5 | 450 |
| 3 | F/55 | Adenocarcinoma tercio medio del recto | 6:00 | RAB extendida+CRATTM+ileostomía de protección en asa | 4:20 | No | No | 5 | 400 |
| 4 | M/58 | Adenocarcinoma unión recto-sigmoidea | 3:40 | HCI+CRATTM | 3:00 | No | No | 4 | 100 |
| 5 | M/73 | Adenocarcinoma unión recto-sigmoidea con fistula coloileal | 6:20 | RAB+CRATTM+resección íleon terminal+ileostomía de protección | 4:20 | No | No | 4 | 150 |
| Promedio | 62.2 | 5:50 | 3:50 | 0 | 0 | 5 | 250 |
CRATTM: anastomosis colorrectal término-terminal mecánica; DEIH: días de estancia intrahospitalaria; F: femenino; HCI: hemicolectomía izquierda; HTA: histerectomía abdominal; M: masculino; PFG: procedimiento de Frykman-Goldberg; RAB: resección anterior baja.
El campo de la cirugía colorrectal ha evolucionado notablemente con el advenimiento de la sutura mecánica y las técnicas mínimamente invasivas. Algunas series de cirugía colorrectal mínimo invasivas demuestran mejoras en comparación con la técnica abierta. Los beneficios hasta ahora demostrados incluyen: estancia hospitalaria corta, retorno rápido a las actividades cotidianas, mejor estética, menor índice de hernias, menos dolor postoperatorio, menor riesgo de sangrado e íleo14-16. Sin embargo, el abordaje mínimamente invasivo requiere amplia experiencia quirúrgica, así como la superación de una larga curva de aprendizaje y ayudantes capacitados; además existe pérdida de la visión de profundidad, disminución del sentido táctil y limitación del rango de movimientos, por lo que su adopción no se ha generalizado17.
El estudio Colon Cancer Laparoscopic or Open Resection (The COLOR Trial) concluye que la colectomía laparoscópica se asocia con menor pérdida sanguínea, recuperación temprana de la función intestinal, menor uso de analgésicos y estancia hospitalaria corta; sin embargo, el tiempo operatorio es más largo, con hasta casi un 20% de conversiones a cirugía abierta18.
Según el metaanálisis de 4 estudios controlados aleatorizados de pacientes con cáncer de colon asignados al azar para colectomía abierta o laparoscópica, se concluyó que la cirugía laparoscópica de colon es oncológicamente segura y viable19,20.
En cuanto al cáncer de recto, la resección mesorrectal total laparoscópica tiene una curva de aprendizaje más larga21, aproximadamente de 50 a 70 casos20-22. La función vesical parece no alterarse, sin embargo existe una alta incidencia de disfunción sexual por la lesión inadvertida de los nervios autónomos a consecuencia de la resección del mesorrecto, falta de visión 3D, y menor movilidad de los instrumentos, sobre todo en la pelvis, probablemente porque cada vez se realiza con mayor frecuencia el abordaje laparoscópico23.
La viabilidad y seguridad de la cirugía laparoscópica rectal es poco clara, especialmente con el margen circunferencial, según los datos del estudio Conventional versus Laparoscopic-Assisted Surgery in Colorectal Cancer (CLASICC)19. Dicho estudio reporta mayor número de conversiones al usar el abordaje laparoscópico, mayor morbimortalidad cuando se realiza conversión a cirugía abierta, sin diferencia en la recurrencia local a los 3 años19,24,25. Las causas de conversión son los tumores voluminosos y la complejidad técnica15,25. Es aquí donde el robot toma gran valor ya que elimina algunas de estas dificultades técnicas que se presentan durante la disección de los tumores rectales tratados mediante laparoscopia, principalmente el acceso a regiones estrechas como es la pelvis. Con respecto al colon derecho, tras 10 años mostró mayor propensión a la recurrencia local en comparación con el cáncer de colon izquierdo (p=0.019)19.
Finalmente, el estudio coreano compara la cirugía abierta contra la cirugía laparoscópica en cáncer rectal medio o bajo después de la quimioterapia neoadyuvante. En este estudio existe un porcentaje de conversión del 1.2% comparado con el 34% del estudio CLASICC. El bajo grado de conversión es atribuido a la mayor experiencia de los cirujanos26.
En nuestros casos no tuvimos ninguna conversión a cirugía abierta o a laparoscópica; se lograron hacer todos los procedimientos quirúrgicos completamente con robot gracias a la visión 3D y de alta definición y movilidad que dan los instrumentos robóticos por medio de la tecnología Endowrist. Con respecto a los márgenes quirúrgicos, todos nuestros especímenes que obtuvimos tenían márgenes libres de lesión y cosecha de ganglios adecuada. No tuvimos ninguna complicación en nuestros casos.
Evidencia en cirugía colorrectal asistida por robotLa cirugía colorrectal asistida por robot ha ganado interés en el mundo entero. La primera publicación fue realizada por Weber et al.3 en el 2002, y desde entonces el número de publicaciones va en aumento.
Existe un creciente entusiasmo de la cirugía asistida por robot, a menudo sin el soporte de datos apropiados sobre su costo-efectividad. Se considera que este abordaje proporciona mejores resultados en cuanto a continencia y función sexual por la disminución de la tasa de lesión de los plexos autonómicos pélvicos27,28. En estos momentos se realiza el estudio RObotic versus LAparoscopic Resection for Rectal Cancer (ROLARR), que es un estudio multicéntrico, controlado, prospectivo, aleatorizado, no ciego, de grupos paralelos de cirugía asistida por robot versus cirugía laparoscópica para el tratamiento curativo del cáncer de recto. En él se analizan la tasa de conversión a cirugía abierta, el compromiso patológico del margen circunferencial, la recurrencia local a los 3 años, el periodo libre de enfermedad, la supervivencia global, la morbilidad, la mortalidad, la calidad de vida y el costo-efectividad de ambos abordajes; aún se está en espera de los resultados29.
La curva de aprendizaje en cirugía colorrectal asistida por robot es más corta y se logra después de 15-20 casos. Se ha visto que el periodo de habilidad óptimo se alcanza después de los 25 casos30-32.
La cirugía asistida por robot es superior, segura y factible en áreas estrechas como la pelvis, con vista tridimensional y ampliación de las imágenes (zoom), elimina el temblor presente en la cirugía abierta y laparoscópica, cuenta con 7 grados más de movimientos que la muñeca, lo que representa menor fatiga del cirujano tras la realización del procedimiento, aunado a la consola ergonómica, lo que permite realizar los procedimientos quirúrgicos con mayor facilidad, mejores resultados patológicos y funcionales, con menor número de complicaciones y conversiones, menor dolor postoperatorio y menos días de estancia hospitalaria, menor tiempo de recuperación de la función intestinal, del primer flato y del inicio de la vía oral. Los centros de concentración tienen menor tasa de sangrado e íleo postoperatorio. La doble consola permite a los alumnos participar en el procedimiento quirúrgico y cuenta con simuladores que pueden ser conectados a la consola para practicar las distintas habilidades antes de realizar los procedimientos. Las desventajas de la cirugía asistida por robot son los altos costos para la compra y mantenimiento del equipo y que para realizar los procedimientos hay que rebasar una curva de aprendizaje, aumentando los tiempos quirúrgicos en los primeros casos1,12,25,33-39.
La selección del paciente es de vital importancia, especialmente en las primeras etapas de la curva de aprendizaje. Se sugiere elegir pacientes con tumores menores a 7cm, riesgo quirúrgico ASA 1-3, IMC <30, menores de 75 años, sin cirugía pélvica o abdominal previa, con tumores T1/T2 localizados en o justo por encima de la reflexión peritoneal del recto, sin quimio-radioterapia neoadyuvante y capaces de tolerar la posición de Trendelenburg30-32,40. Se debe ser precavido en la enfermedad diverticular complicada, ya que puede ser técnicamente más demandante.
En nuestros pacientes el tiempo quirúrgico promedio fue de 6h, siendo mayor comparado con la cirugía abierta, y no tan significativo comparado con la cirugía laparoscópica. Cabe mencionar que en la cirugía robótica se incrementa el tiempo quirúrgico, sobre todo al inicio, pero se obtienen mejores resultados en el procedimiento quirúrgico. Estos tiempos son parte de la primera parte de la curva de aprendizaje, por lo que se espera que disminuyan significativamente con los casos subsecuentes. La estancia promedio fue de 5 días. El sangrado promedio fue de 250cc, lo cual es menor que en cirugía abierta o laparoscópica y tomando en cuenta el tipo de procedimientos quirúrgicos que se realizaron. No tuvimos ninguna conversión a cirugía abierta o a laparoscópica; se lograron hacer todos los procedimientos quirúrgicos completamente con robot gracias a la visión 3D y de alta definición y movilidad que dan los instrumentos robóticos por medio de la tecnología Endowrist. Con respecto a los márgenes quirúrgicos, todos nuestros especímenes que obtuvimos tenían márgenes libres de lesión y cosecha de ganglios adecuada. No tuvimos ninguna complicación en nuestros casos. Estos resultados concuerdan con los de los estudios antes mencionados, y se espera que mejoren ya que estos son los primeros casos de la curva de aprendizaje.
Consideraciones anestésicas en cirugía robóticaDesde el punto de vista anestésico, nos enfrentamos con diversos retos para mantener al paciente en adecuadas condiciones transoperatorias. El principal es el neumoperitoneo prolongado, pues produce un incremento en la presión intraabdominal que genera efectos mecánicos comprimiendo los grandes vasos, como sucede en la vena cava inferior, disminuyendo la precarga. Además, tiene repercusión directa sobre el flujo sanguíneo renal, ocasionando que los pacientes durante estos procedimientos presenten oliguria o incluso anuria. La elevación del ácido carbónico produce aumento de las resistencias arteriales, teniendo como consecuencia indirecta una caída del gasto cardiaco. La disminución en el retorno venoso junto con los factores de riesgo propios de cada paciente aumentan las posibilidades de que se presente un evento de trombosis venosa profunda.
Los pacientes sometidos a este tipo de procedimientos generalmente se encuentran en posición de Trendelenburg forzado; ello limita la distensibilidad pulmonar, además de que el efecto de masa abdominal, también limita los movimientos diafragmáticos, favoreciendo mayor absorción de CO2 y la aparición de atelectasias.
Para aminorar los efectos adversos del neumoperitoneo prolongado, el objetivo primordial es tratar de mantener la presión intraabdominal entre 12-15mmHg. Ventilatoriamente, debemos mantener la normocapnia o hipercapnia leve con la finalidad de que no se produzca un estado de acidemia; en lo posible, no se debe exceder de 30cmH2O de presión pico para evitar cualquier posible barotrauma. La formación de atelectasias, que podrían comprometer la adecuada oxigenación en el periodo transoperatrio y provocar eventos respiratorios adversos en el periodo postoperatorio, se pueden disminuir utilizando fracciones inspiradas de oxígeno entre 50 y 70%; el uso de PEEP precedido por maniobras de reclutamiento pulmonar es de vital importancia.
Se recomienda el uso de profilaxis antibiótica de acuerdo con el tipo de procedimiento a realizar. Debe llevarse a cabo la monitorización de la temperatura y su control con métodos de calor forzado debido a que el tiempo de exposición sigue siendo aún muy prolongado. La hipotermia altera la farmacocinética de nuestros medicamentos, y tiene repercusiones directas sobre los procesos enzimáticos, además de que aumenta el consumo de O2 en el postoperatorio. Recomendamos también mantener al paciente con un bloqueo neuromuscular profundo desde el inicio del procedimiento hasta concluido este, con la finalidad de llevar a cabo las maniobras ventilatorias, facilitar la visión y evitar cualquier movimiento en el abordaje del sitio quirúrgico. Por último, pero no por ello menos importante, las medidas antitrombóticas deben efectuarse en todos los paciente, adecuándose a sus características y requerimientos.
ConclusiónA nivel mundial diversos centros quirúrgicos emplean la cirugía asistida por robot sobre la base de ventajas teóricas, las cuales se han confirmado en la práctica mediante diferentes estudios. La cirugía asistida por robot es un servicio de salud costoso, por lo que amerita una evaluación minuciosa. El estudio ROLARR es un ensayo pragmático, que proporcionará una evaluación completa de ambos procedimientos quirúrgicos para la resección curativa del cáncer recto-sigmoideo. Reportamos los primeros casos de cirugía colorrectal en México, con resultados prometedores. Hay suficiente evidencia para respaldar y recomendar el uso del robot en estos casos, y así adoptar esta nueva tecnología en nuestras instituciones como una opción factible y segura.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener algún conflicto de intereses.