La recuperación biológica de aloinjertos de piel humana se considera que es el estándar de oro para los procesos de preservación de bancos de tejidos; sin embargo, no existen criterios de asignación para los aloinjertos de piel con elementos celulares vivos.
Reportamos la experiencia de 5 años en el uso de aloinjertos de piel humana en pacientes adultos quemados, del Banco de Piel y Tejidos, del Instituto Nacional de Rehabilitación.
Materiales y métodosLos aloinjertos de piel humana fueron obtenidos a partir de donadores multiorgánicos, procesados y preservados en congelación a -80°C durante 12 meses. La asignación de los aloinjertos se realizó en referencia al grupo sanguíneo, historia clínica, grado de la quemadura, y la extensión con un promedio de 40% de superficie corporal afectada y con consentimiento informado.
ResultadosHasta el momento el Banco de Piel y Tejidos ha procesado más de 125,000cm2 de aloinjertos de piel humana. Se han realizado 34 implantes quirúrgicos en 21 pacientes quemados. El promedio de superficie corporal quemada fue del 59.2%. El 67.7% de los receptores de aloinjertos de piel humana tuvieron el mismo grupo sanguíneo que el donante. El 66.6% de los receptores de aloinjertos de piel humana sobrevivió después de 126 días de estancia hospitalaria.
ConclusiónSe propone considerar el grupo sanguíneo del receptor como un criterio para la asignación de tejido; y el uso de aloinjertos de piel humana en pacientes con más del 30% de la superficie corporal quemada (de acuerdo a la «regla de los 9»).
The biological recovery of human skin allografts is the gold standard for preservation in Skin Banks. However, there is no worldwide consensus about specific allocation criteria for preserved human skin allografts with living cells.
A report is presented on the results of 5 years of experience of using human skin allografts in burned patient in the Skin and Tissue Bank at the “Instituto Nacional de Rehabilitacion”
Material and methodsThe human skin allografts were obtained from multi-organ donors. processed and preserved at -80°C for 12 months. Allocation criteria were performed according to blood type match, clinical history, and burned body surface.
ResultsUp to now, the Skin and Tissue Bank at ‘Instituto Nacional de Rehabilitacion” has processed and recovered 125,000cm2 of human skin allografts. It has performed 34 surgical implants on 21 burned patients. The average of burn body surface was 59.2%. More than two-thirds (67.7%) of recipients of skin allografts were matched of the same to type blood of the donor, and 66.6% survived after 126 days hospital stay.
ConclusionIt is proposed to consider recipient's blood group as allocation criteria to assign tissue; and use human skin allografts on patiens affected with burns over 30% of body surface (according the “rule of the 9”).
La recuperación biológica es el estándar de oro en los procesos de preservación tisular en los bancos de tejidos1. El control de calidad, la certificación sanitaria y la estabilidad biológica de los aloinjertos con fines de trasplante repercute de manera directa en los resultados terapéuticos del implante exitoso de tejidos para procesos quirúrgicos de reconstrucción o remplazo tisular.
Durante el último lustro, el Banco de Piel y Tejidos del Instituto Nacional de Rehabilitación (BPyT-INR) ha desarrollado un programa de investigación tecnológica aplicada a la recuperación, preservación e implante de tejidos con fines de trasplante, tales como: piel, dermis profunda, válvulas cardiacas, tendones y tejido óseo. En ellos, el centro fundamental de los procesos está enfocado a mantener los elementos celulares vivos, ricos en factores de crecimiento.
En el caso específico de los aloinjertos de piel humana, diversos procesos de preservación han sido descritos, entre los cuales se encuentran la radiación gamma y la esterilización por métodos químicos1,2; sin embargo, recientemente se ha aceptado como el método con mejores resultados terapéuticos, la recuperación biológica y la desinfección química controlada3–5. El método propuesto y desarrollado en el BPyT-INR, método BanPiel-INR, está fundamentado en la preservación de la viabilidad celular y la desinfección isotónica controlada en instalaciones de clase 100. Lo anterior permite obtener aloinjertos de piel viable con fines de trasplante6. Sin embargo, no existen reportes de la experiencia del banco respecto a la distribución ni de los criterios de asignación de aloinjertos vivos de piel en México. Desde el punto de vista inmunológico, la piel recuperada de donantes cadavéricos se usa como cubierta temporal sin criterios establecidos de asignación.
En el presente artículo se reportan los primeros datos de un programa de recuperación de piel en los Hospitales e Institutos Nacionales de Salud del Sistema Federal en México, así como la experiencia clínica de los receptores.
Materiales y métodosDonantes y tejidos. Los aloinjertos de piel y otros tejidos fueron obtenidos a partir de donantes multiorgánicos bajo consentimiento informado de los familiares de acuerdo con la Ley General de Salud en materia de donación de órganos y tejidos, con fines de trasplante.
El protocolo de procuración de tejidos fue autorizado por el Comité Interno de Investigación del Instituto Nacional de Rehabilitación (número de registro INR-CII-14B-2011) y financiado por el programa de los Fondos Sectoriales de Investigación en Salud (Proyecto Fosis: 2011-161624) como programa multicéntrico de hospitales generadores de órganos y tejidos con fines de trasplante.
Los criterios de inclusión para ser donante de piel se resumen en la tabla 1 y se tomaron de los criterios vigentes de la Sociedad Europea de Bancos de Tejidos. En todos los donantes se registraron los datos epidemiológicos, como: edad, género, grupo sanguíneo, factor Rh, y tiempo de pinzamiento de la aorta para documentar el tiempo de isquemia caliente.
Criterios de inclusión para la obtención de aloinjertos de piel humana
| Criterios de inclusión para candidatos a donación de piel | Criterios de exclusión para los candidatos a donación de piel |
|---|---|
| Muerte encefálica certificada para donante cadavérico o certificación de pérdida de la vida | Hiperglucemia + septicemia |
| Serología negativa para virus de la inmunodeficiencia humana 1 y 2, virus de la hepatitis B, virus de la hepatitis C, virus linfotrópico humano y reacción luética | Causa de muerte desconocida |
| Sin antecedentes significativos de enfermedad que afecte la piel | Antecedentes de toxicomanía |
| Sin proceso séptico descontrolado | Tatuajes recientes menores de 3 años |
| Sin historial clínico de enfermedades autoinmunes | Lesión dérmica sospechosa de neoplasia |
| Rango de edad 18-75 años (mayores de 75 previa valoración) | Septicemia descontrolada |
| Estabilidad hemodinámica relativa |
Procuración quirúrgica de aloinjertos de piel. La procuración de piel y tejidos se realizó en la sala quirúrgica inmediatamente después de la procuración de órganos con fines de trasplante. Previa descontaminación superficial durante 30 minutos y colocación de campos estériles se realiza ablación de aloinjertos de piel de grosor medio (0.5mm/7.5cm de ancho), con dermatomo (Acculan TIIIi, B Braun-Aesculap, Alemania). Las láminas de piel se mantuvieron en solución de lavado (Sol *BPYT-1, pH 7.5) durante 30 minutos y posteriormente se colocaron en medio de trasporte (Sol *BPYT-2-Piel) con antibiótico-antimicótico (PPA Biotech, EE. UU.).
Almacenamiento en BPyT. Una vez registrado el tejido en el BPyT se realizó el proceso de recuperación biológica de piel acorde al protocolo6 y del Manual de Procesos estandarizado en nuestras instalaciones (PR-DQ17- ISO-9001-2008) certificado 2012 y con número de licencia sanitaria 14TR0901200067. Los aloinjertos de piel fueron procesados de acuerdo al protocolo de rutina en el BPyT-INR y se congelaron a -80° C en solución de criopreservación (*Sol Cryo-Piel). Todos los tejidos se mantuvieron en cuarentena hasta su certificación microbiológica y sanitaria para su uso. Los certificados de control de calidad se emitieron para documentar crecimiento bacteriano, ausencia de virus de inmunodeficiencia humana tipo 1 y 2 (HIV-1, y 2), citomegalovirus, virus de hepatitis B y C, y Treponema pallidum. La identificación de patógenos se realizó basado en las pruebas de detección de ácidos nucleicos (NATS), en la modalidad de tiempo real (RT-PCR), usando los protocolos recomendados por el fabricante en la plataforma Rotor Gene 3000 (Corbbet Research, Australia).
Criterios generales de asignación de aloinjertos de piel. Los criterios para la asignación de tejidos para pacientes quemados se basaron en los criterios generales para la asignación de órganos. Cada paciente fue documentado con: 1) el consentimiento informado firmado del uso de un aloinjerto, con elementos celulares vivos; 2) solicitud autorizada por el responsable de la unidad de quemados, especificando el grupo sanguíneo de receptor y el volumen solicitado, y 3) la historia clínica del receptor.
Como criterios específicos para la asignación de aloinjertos de piel humana se consideraron: 1) compatibilidad con el grupo sanguíneo del receptor; 2) grado de quemadura y superficie corporal quemada, y 3) presencia de infección superficial asociada.
Descongelación de aloinjertos de piel. Previa recepción de la historia clínica y solicitud de los aloinjertos se programó la descongelación gradual de los aloinjertos humanos de piel en condiciones de esterilidad y en campana de flujo laminar (Herasafe 120, Kendro; Alemania). Una vez descongelados los tejidos se mantuvieron en solución fisiológica con amortiguadores de fosfatos (PBS-pH 7.5) y en presencia de coctel de antibióticos, tomado del esquema individual de cada receptor. En este último punto se tomaron muestras de control microbiológico, para certificar el proceso de descongelación de tejido y para descartar un proceso de contaminación del tejido.
Seguimiento de pacientes receptores. Los pacientes injertados recibieron monitorización clínica en la unidad de cuidados intensivos para quemados. Se documentó la evolución clínica y la estancia hospitalaria de cada uno de los receptores. El seguimiento extrahospitalario de los receptores se realiza cada 6 meses, con objeto de evaluación a largo plazo de las zonas de implante.
Análisis de datos. Los datos fueron capturados en una matriz de Excell M-Office y se analizaron medidas de análisis descriptivo para conocer la población receptora.
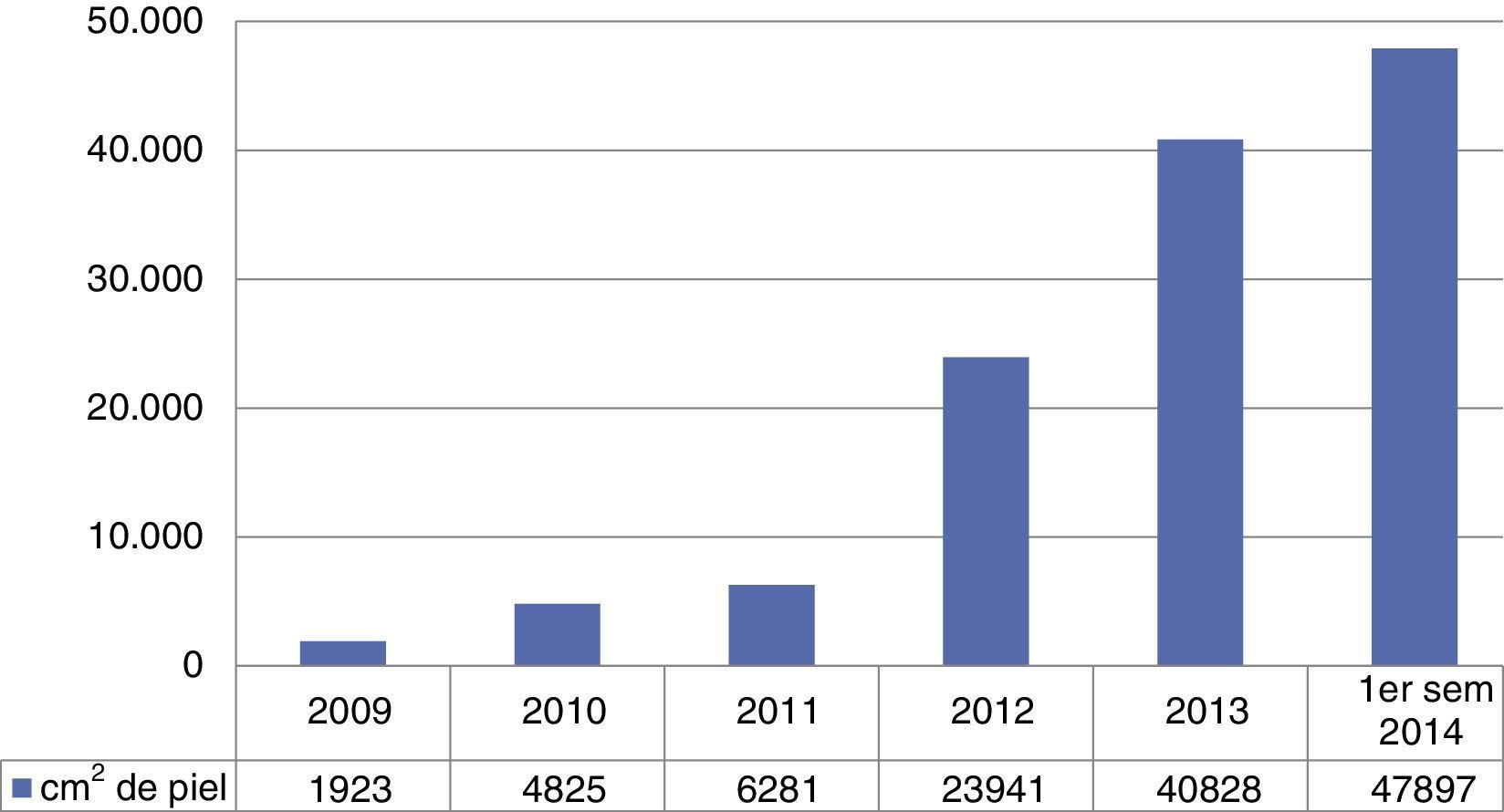
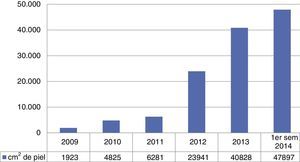
ResultadosVolumen de piel procesada por el método Banco de Piel y Tejidos del Instituto Nacional de RehabilitaciónDurante el periodo del 1 de enero del 2009 al 31 de diciembre del 2014 se han procurado, recuperado y congelado 140,351cm2 de aloinjertos de piel humana, de grosor medio (0.5mm) en nuestras instalaciones. Para el análisis preliminar de la viabilidad celular se utilizaron métodos cuantitativos, basados en el metabolismo de fluoróforos vitales insolubles cm2 de cada lote de láminas, que ha demostrado la presencia de células vivas en todos los tejidos, en un porcentaje mayor al 75%. El volumen de procesamiento de aloinjertos de piel humana por año se ilustra en la fig. 1, en la cual se muestra un volumen de proceso en 2009 con 1,923cm2, en 2010 con 4,825cm2, en 2011 con 6,281cm2, en 2012 con 23,941cm2, en 2013 con 40,828cm2, y en 2014 con 62,553cm2.
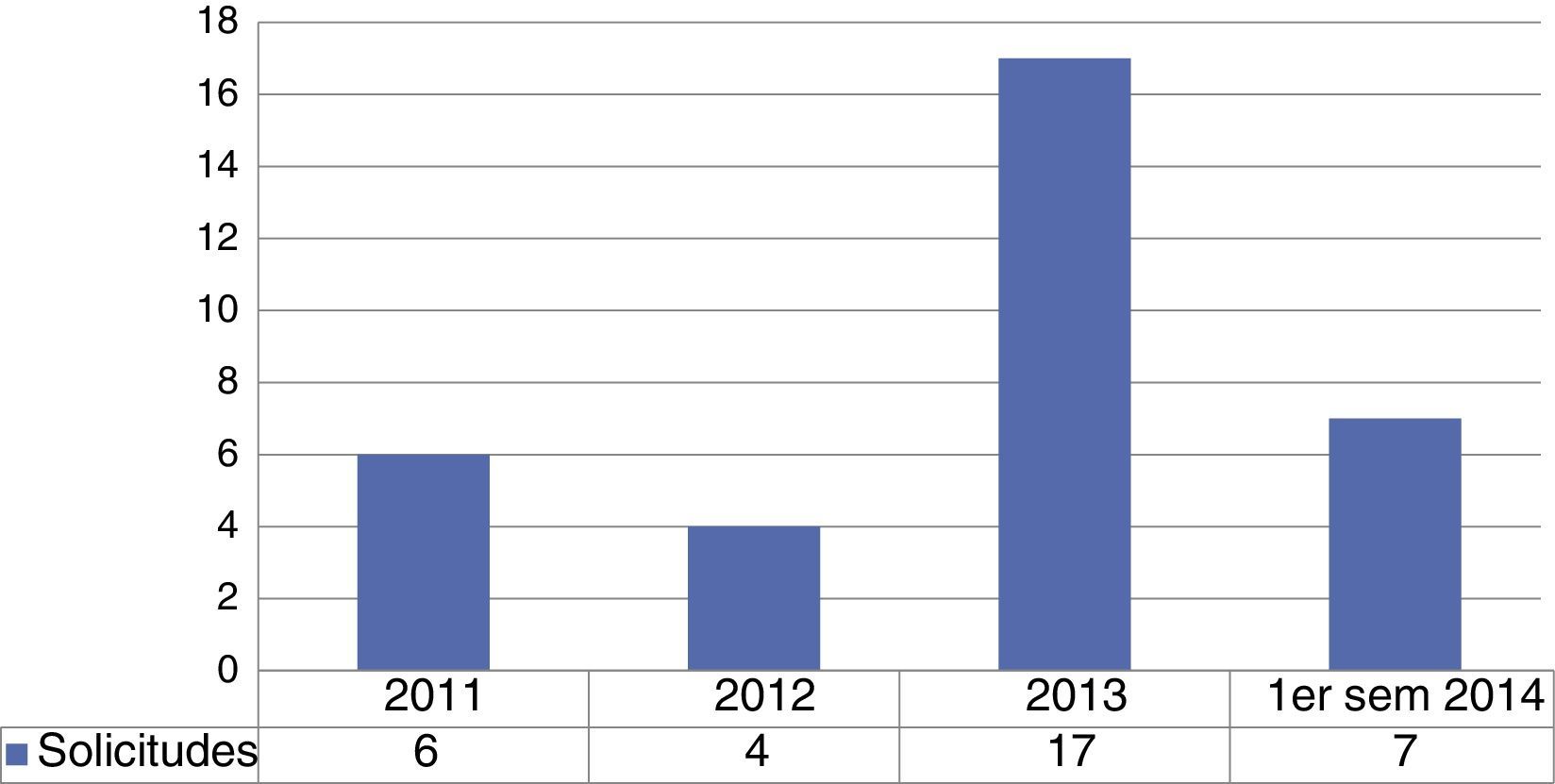
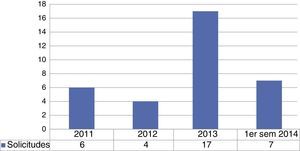
Receptores de aloinjertos de piel humana preservados en el Banco de Piel y Tejidos del Instituto Nacional de RehabilitaciónDurante el periodo antes descrito, se recibieron un total de 34 requerimientos de tejidos con rango 238-6,000cm2 y con un total de 57,937.5cm2 de piel. La distribución por institución, muestra un 97.1% en el Centro Nacional de Atención a Quemados (CENIAQ) y el 2.9% al servicio de Cirugía Plástica del Hospital General de México. Las asignaciones de aloinjertos de piel humana para implante quirúrgico se realizaron a partir de 2011 con un número de 6 en 2011; 4 en 2012; 17 en 2013 y 7 en el primer semestre del 2014 (fig. 2).
Número de implantes quirúrgicos aloinjertos de piel humana preservados en el Banco de Piel y Tejidos.*
Pie de figura 2. sem: semestre.
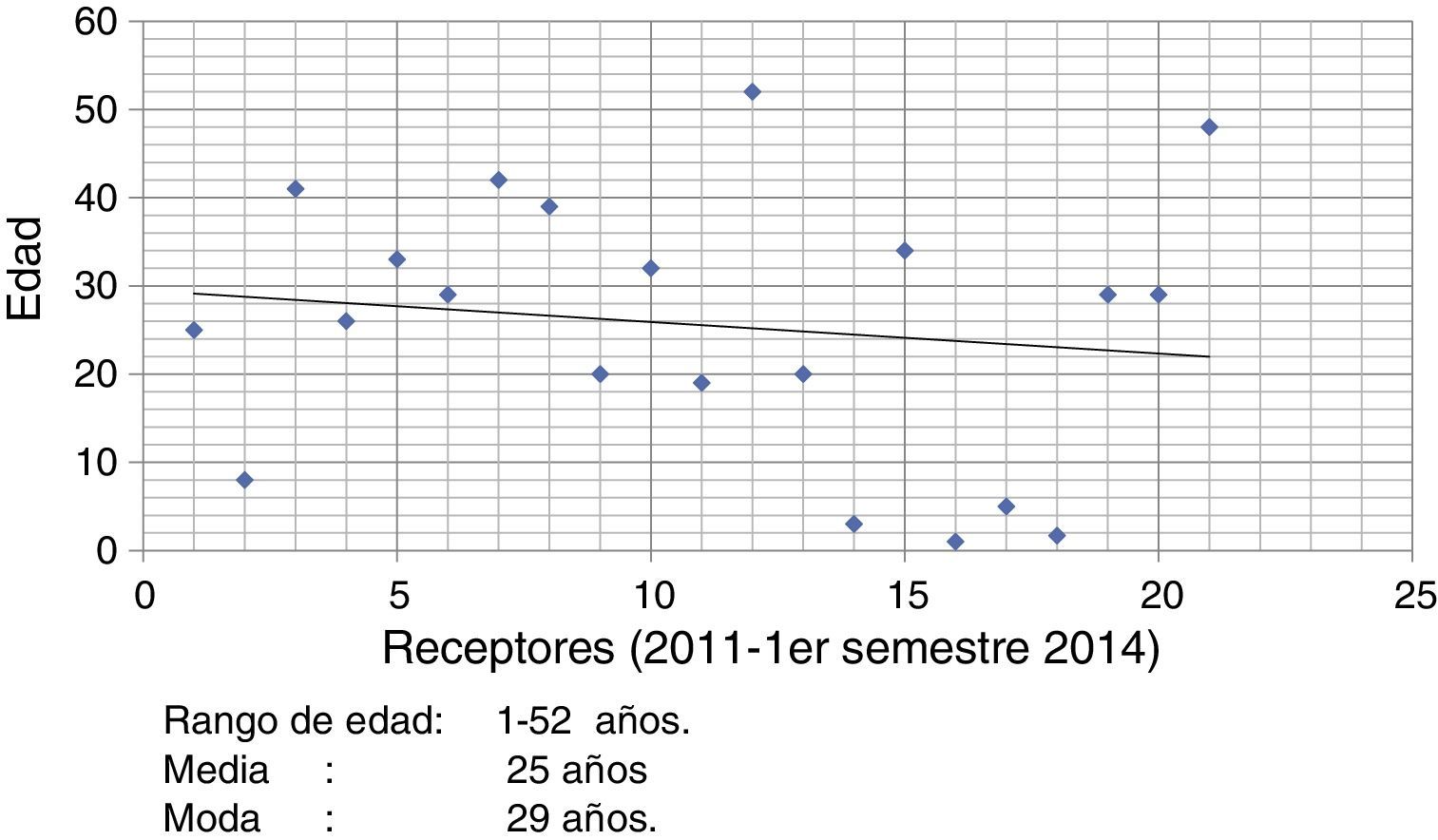
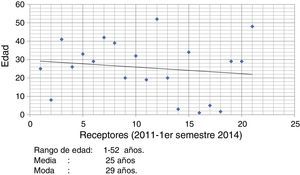
Del número total de receptores (n=21) el rango de edad fue 1-52 años con una edad promedio de 25 años y una moda de 29 años (fig. 3). La distribución por género fue de 44.2% para receptores femeninos y de 55.8% para receptores masculinos.
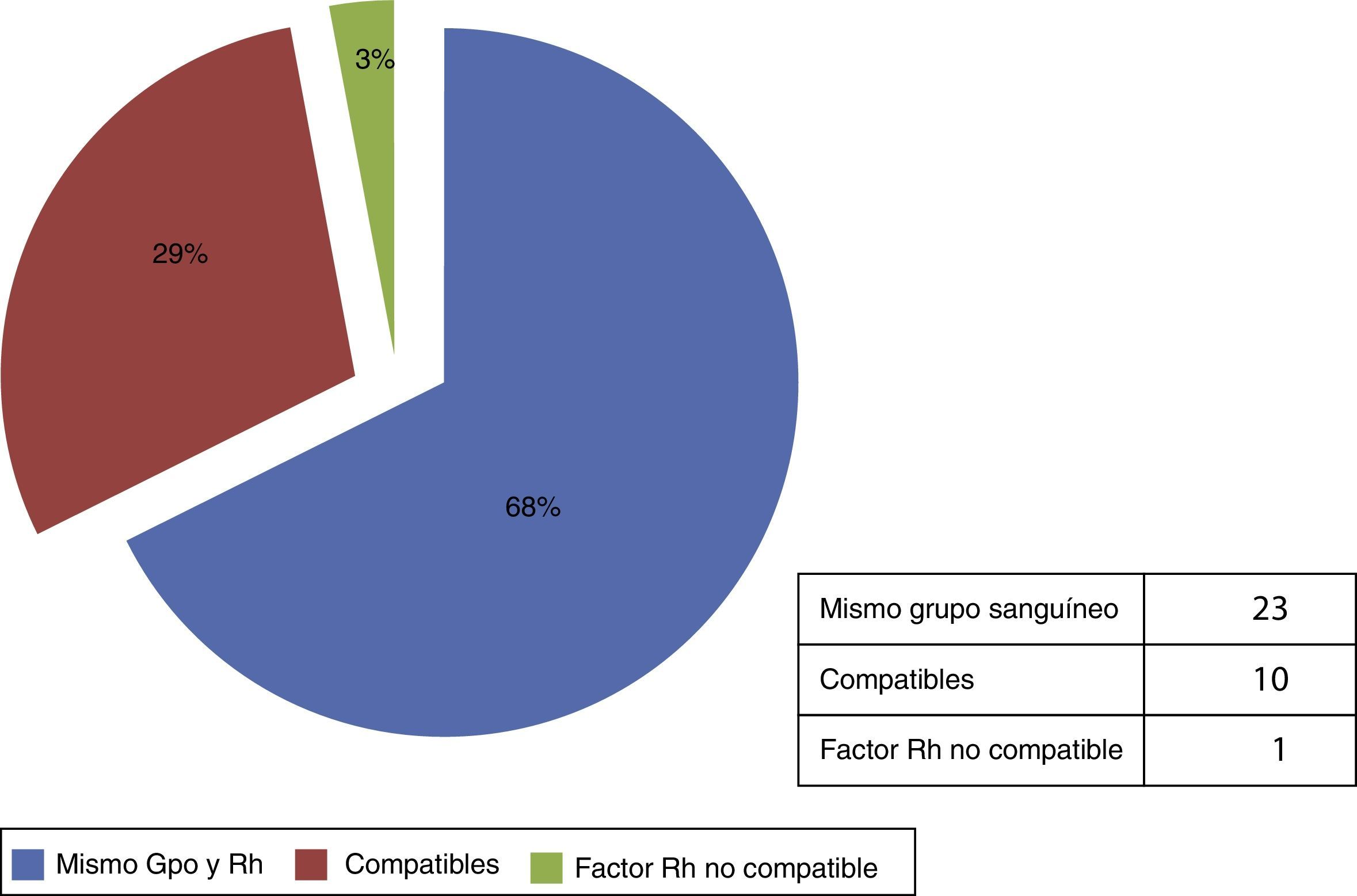
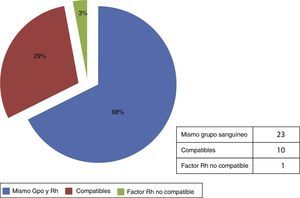
Distribución de tejido en base al grupo sanguíneo y factor RhTomando como criterio de asignación el grupo sanguíneo y el factor Rh, en total fueron 34 requerimientos, de los cuales 23 fueron con el mismo grupo sanguíneo (68%); 10 requerimientos fueron compatibles (29%) y un requerimiento fue no compatible con el factor Rh (3%) (fig. 4).
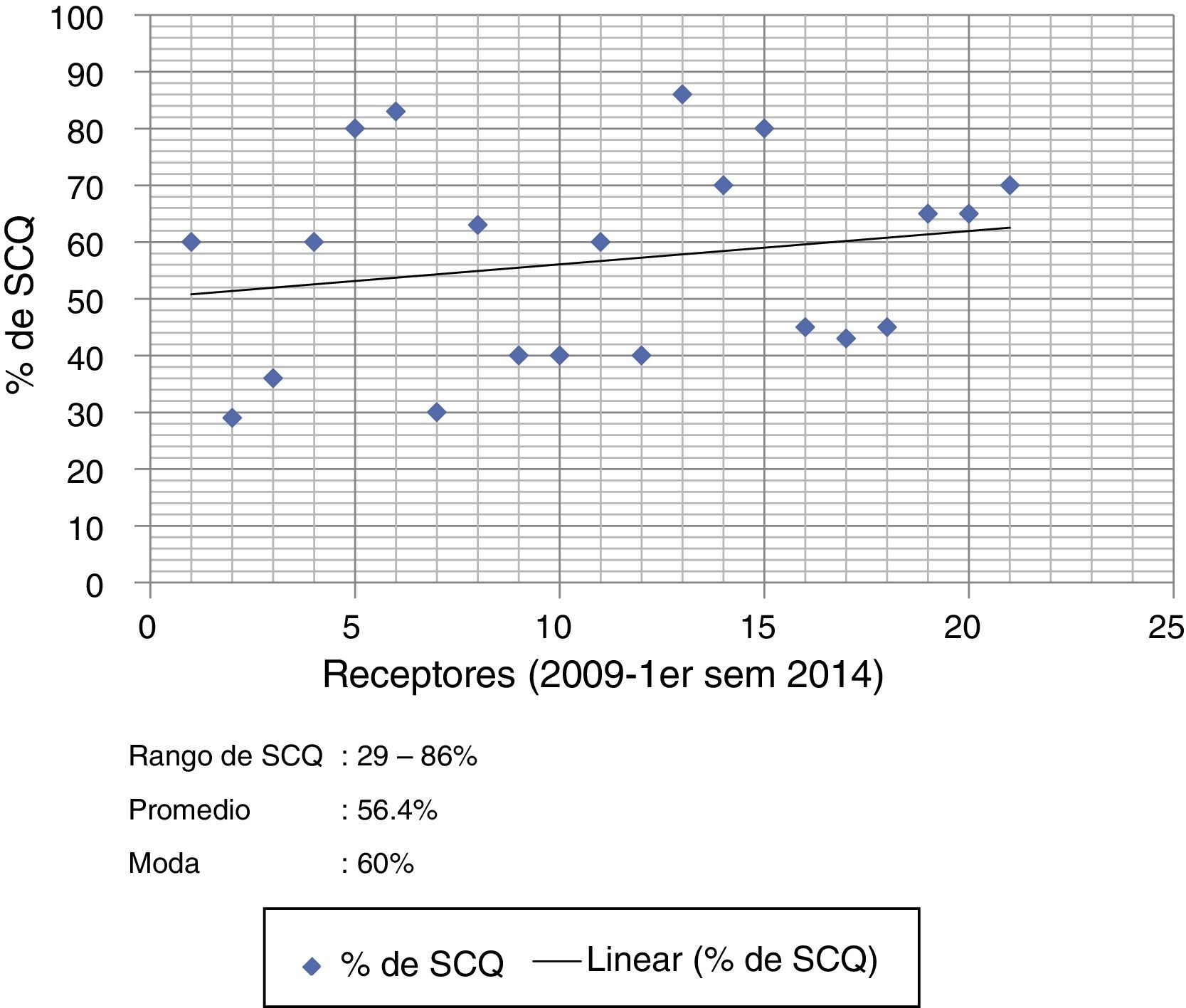
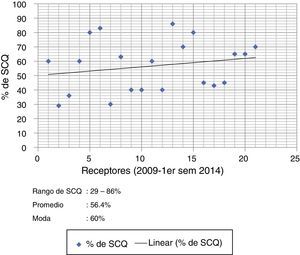
Distribución de tejido con base en el diagnóstico y la superficie corporal quemada del pacienteEl diagnóstico de ingreso más frecuente en la distribución de aloinjertos de piel humana fueron las quemaduras por fuego directo 76.1% (n=16); 14.5% (n=3) para escaldadura y el resto 9.4% para otros. La distribución de aloinjertos de piel humana en relación con la superficie corporal en receptores grandes quemados fue de la siguiente forma: 21 pacientes (rango de 29-86% de superficie corporal quemada) con un promedio de 56.4% de superficie corporal quemada, y una moda de 60% de superficie corporal quemada (fig. 5).
Distribución de aloinjertos de piel humana y la superficie corporal quemada del receptor.
Pie de figura 5. SCQ: superficie corporal quemada.
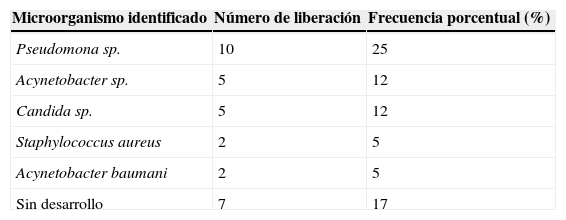
El 66.6% de receptores (n=21) se reportó como colonizado y el 33.4% como no colonizado al momento de la colocación de aloinjertos. La frecuencia de microorganismos se ilustra en la tabla 2.
Evolución clínica de los receptores de aloinjertos de piel humanaDurante el seguimiento de los receptores de aloinjertos de piel humana se documentó la evolución clínica de los receptores así como la evaluación física de los injertos. El 76.1% de los receptores de aloinjertos de piel humana (n=14) se mantuvieron vivos después de un mes de la colocación de aloinjertos de piel humana. El 23.9% (n=8) falleció durante el primer mes posterior a la colocación de los aloinjertos (tabla 3).
DiscusiónDesde su fundación en 2009, el BPyT-INR es el primero en proponer un programa de recuperación de tejidos con fines de trasplante. Este programa está basado en procesos de investigación aplicada para solventar las necesidades de salud. Hasta ahora, los estudios preliminares realizados en una muestra tomada al azar de cada lote de tejido han demostrado un rango de 75-85% de células vivas por cm2 de aloinjertos de piel humana, con certificación molecular negativa y con cultivos microbiológicos negativos, que son esenciales como procesos de calidad para garantizar la seguridad sanitaria. Se ha incrementado anualmente el volumen procesado de aloinjertos de piel humana y este ha mostrado una tendencia ascendente, con respecto al periodo comprendido del 2009-2014 (fig. 1). Esta tendencia de crecimiento puede ser resultado de 2 factores: 1) el incremento en el número de donaciones como resultado del impacto de la promoción y educación para fomentar la cultura de la donación de piel y otros tejidos inexistentes en nuestro país hasta el 2010 cuando el BPyT-INR lanzó la primera campaña de la donación de piel, dirigido al público abierto a través de los medios masivos de difusión como son: televisión, radio, prensa escrita e Internet; 2) el incremento en el número de hospitales generadores y procuradores de tejidos en los institutos nacionales de salud y de otros programas de donación de órganos y tejidos, además de la participación de otras instituciones, como son el Instituto Mexicano del Seguro Social (IMSS) y el Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE), así como la incorporación de otros hospitales estatales.
El impacto clínico de los aloinjertos humanos de piel con fines de trasplanteEl implante de aloinjertos de piel humana en el paciente quemado es el tratamiento de elección dentro de las primeras 48 horas posteriores al accidente8; sin embargo, otros grupos de investigadores han descrito respecto al uso exitoso en los pacientes con infecciones agregadas adicional a un esquema de antibióticos caracterizados para cada paciente.
De los 14,100 accidentes por quemaduras al año, el 10% se clasifican como grandes quemados, con quemaduras de tercer grado y superficie corporal afectada mayor al 30% de superficie corporal afectada. Los 2 grupos etarios más afectados se constituyen por menores de 10 años y por adultos mayores de 60 años con alguna discapacidad. Es interesante que nuestros datos hayan mostrado una moda de edad para los receptores de tejidos de 30 años, lo que implica la afección de un grupo económicamente activo. Por otro lado, el uso de aloinjertos de piel humana ha mostrado una tendencia ascendente que se incrementó de manera importante en 2013. Este dato tiene importancia debido a que el uso de aloinjertos humanos es una técnica relativamente nueva en México; históricamente se ha empleado piel de cerdo, amnios y piel irradiada para el tratamiento de los pacientes quemados9–11. Nuestros resultados demuestran que el empleo de aloinjertos de piel humana en pacientes quemados se inicia en 2011 y su pico máximo de uso es en 2013 con un 47.2%.
El principal consumidor de aloinjertos de piel humana es el Centro Nacional de Investigación y Atención a Quemados (CENIAQ) con un 97.1% de los 57,937.5cm2 de aloinjertos de piel humana, solicitados en el periodo de 2011-2014. Este incremento se explica por situaciones de contingencia nacional fortuitas ocurridas en 2013 y porque el principal consumidor de tejidos sea un centro nacional de referencia (CENIAQ). Sin embargo, la asignación de tejidos está limitada a las unidades de atención a quemados de los hospitales con un permiso vigente de donación o trasplante de órganos y/o tejidos autorizado por la COFEPRIS. Esta situación debe ser valorada en función de la legislación vigente en México, sin olvidar que el método de la recuperación biológica de tejidos conlleva el riesgo de transmisión de enfermedades infectocontagiosas, las cuales pueden ser identificadas con las pruebas moleculares de alta sensibilidad, como son la identificación de NATS12–14, con objeto de minimizar el riesgo de transmisión, la misma que ha sido implementada en nuestros procesos desde el inicio del programa7,15,16.
Los receptores más frecuentes de aloinjertos de piel humana son hombres en la tercera década de la vida y han recibido el implante quirúrgico de aloinjertos de piel humana, con una superficie corporal promedio de 59.2% de superficie corporal quemada (fig. 5). Estos datos son acordes a lo reportado en la bibliografía, y se reafirma que el uso aloinjertos de piel humana en pacientes grandes quemados es el tratamiento de elección.
La asignación de aloinjertos de piel humana con base en el grupo sanguíneoDe acuerdo con los reportes de la bibliografía no existe consenso alguno respecto a considerar el grupo sanguíneo (sistema ABO y factor Rh) para la asignación de aloinjertos de piel humana, debido a que estos son considerados como cubiertas temporales. En este reporte, el 68% de las solicitudes fueron acorde al grupo sanguíneo del receptor, el 29% fue con grupos compatibles; y solo en un caso se designó un grupo no compatible (fig. 4), en este último se usó otro grupo sanguíneo, debido a que el receptor fue de un grupo sanguíneo poco frecuente (A con factor RH-). La razón de tomar esta referencia como criterio de asignación se fundamenta en que los métodos de procesamiento tradicionales, como son la radiación gamma o la esterilización química; que se ha demostrado que son procedimientos seguros, pero que tienen el inconveniente de sacrificar la viabilidad celular. Considerando que el método empleado en nuestro banco es la recuperación biológica, este factor puede ser esencial para implementar un uso con fundamento científico de los aloinjertos de piel humana acorde al grupo sanguíneo de los receptores, con objeto de minimizar una respuesta incipiente de rechazo.
El 67% de los receptores de aloinjertos de piel humana se mantuvieron vivos después de su alta. El 32.3% de los receptores de aloinjertos de piel humana murió durante el transcurso de su atención médica. La superficie corporal quemada de los pacientes vivos tuvo un índice promedio menor (50.07% superficie corporal quemada) comparada con el grupo de los pacientes fallecidos (66.75% de superficie corporal quemada). Esto sugiere que los pacientes con mayor superficie corporal quemada presentan mayor riesgo de muerte; sin embargo, es necesario realizar un análisis más detallado de las condiciones de los receptores, la evolución clínica, el estado general en el momento de recibir el implante; así como de la presencia de infecciones sobre agregadas, ya que estos factores son esenciales y determinantes para el pronóstico.
ConclusionesDe acuerdo con nuestros resultados preliminares los aloinjertos de piel humana procesados en nuestro banco tienen una alta calidad biológica y seguridad sanitaria, lo que permite su uso seguro en pacientes grandes quemados. Considerando que el paciente gran quemado se mantiene inmunosuprimido y aun cuando no hay un consenso en el uso de aloinjertos de piel humana con fines de trasplante, se propone: tomar el grupo sanguíneo del receptor, como un criterio en la asignación del tejido fundamentado en la presencia de elementos vivos en los tejidos procesados por la recuperación biológica. Se requiere de un estudio más detallado de seguimiento a mediano y largo plazo para determinar el impacto que tiene el uso de aloinjertos de piel humana en pacientes grandes quemados con objeto de determinar su eficacia terapéutica y su repercusión económica para el sistema nacional de salud.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciamientoEste proyecto ha sido financiado por el Consejo Nacional de Ciencia y Tecnología de México CONACYT, a través de los Fondos Sectoriales de Investigación en Salud (FOSIS-2011-161624).
María Chacón Gómez, es becaria de Posgrado en el proyecto FOSIS-2011-161624.
María Simona Ustoa, Pablo Adrián Vizcaíno Dorado, Karina Guzmán Martínez, Araceli Barrera López, Christian Lomeli Rodríguez, Bruno Escobedo, miembros del equipo técnico y procurador del BPyT, por su colaboración en la identificación de donantes y procesamiento de tejidos.