Las características anatómicas e histológicas excepcionales de la arteria mamaria interna (AMI) la convierten en el hemoducto ideal para la cirugía de revascularización miocárdica. La técnica para su disección esqueletizada solo con clips y tijeras, permite la construcción de un injerto con más flujo y la conservación de una mayor circulación colateral residual al esternón, con la consiguiente mejor protección ante futuros eventos isquémicos o infecciosos.
Sin embargo, ese método de disección es el menos practicado por ser más lento y no estar exento de lesiones de ramas laterales de la arteria. En las últimas décadas se han introducido varios adelantos tecnológicos en el procedimiento de disección de la AMI, pero las técnicas actuales no aprovechan sus especiales características morfofisiológicas para potenciar la obtención de un hemoducto con más flujo y con menos riesgo de lesión vascular y sangrado.
En esta revisión se comentan las particularidades de la anatomía quirúrgica de la AMI, y se proponen modificaciones a la técnica clásica de disección esqueletizada con clips y tijeras para obtener un hemoducto de mayor calidad.
The exceptional anatomical and histological characteristics of the internal mammary artery make it the ideal graft for myocardial revascularization surgery. The technique for its skeletonized harvesting with only clips and scissors, allows the construction of a graft with more flow and the conservation of a greater residual collateral circulation to the sternum, with the consequent better protection against future ischemic or infectious events.
However, this harvesting method is the least practiced because it is slower and is not exempt from injuries to the lateral branches of the artery. In recent decades, several technological advances have been introduced in the internal mammary artery harvesting procedure, but current techniques do not take advantage of its special morphophysiological characteristics to enhance obtaining a hemoduct with more flow and with less risk of vascular injury and bleeding.
In this review, the peculiarities of the internal mammary artery surgical anatomy are discussed, and modifications of the classic skeletonized harvesting technique with only clips and scissors are proposed to obtain a higher quality graft.
La disposición anatómica y la histología especial de la arteria mamaria interna (AMI), que la hacen muy resistente a la trombosis y arteriosclerosis, la han convertido en el principal injerto utilizado en cirugía de revascularización miocárdica (CRM).
Probablemente los primigenios intentos de utilizar el flujo de la AMI para irrigar otros órganos humanos se remontan a mediados de la década de 19401. Poco después se describieron los primeros procedimientos para su disección en cirugía cardíaca, cuando se introdujo su implantación en el miocardio del ventrículo izquierdo, como revolucionaria técnica en el tratamiento de la insuficiencia arterial coronaria.
La práctica de diseccionar únicamente la AMI (primero un segmento y posteriormente todo el vaso) fue iniciada por Arthur Vineberg en 19502, pero las variantes del término «esqueletización» no comenzaron a ser acuñadas probablemente hasta mediados de la década de 19703. Durante esos años, algunas publicaciones mostraron breves descripciones del método de esqueletización mamaria, pero no fue hasta 1992 que James Cunningham detalló los principales fundamentos técnicos del procedimiento4 de la forma en que, esencialmente, aún se continúa ejecutando.
La preparación de la AMI solo con clips metálicos y tijeras es una variante de la disección esqueletizada en la que no se emplean dispositivos de cauterización térmica para la división y control del sangrado de las ramas laterales de la arteria, aunque probablemente sí se utilicen para la apertura de la fascia endotorácica y la identificación de las colaterales. Es una técnica que consume más tiempo, pero cuando se realiza con precisión disminuye considerablemente el riesgo de lesión del hemoducto y permite una mayor conservación de la anatomía de la pared torácica. Pocos grupos la practican, más aún después de la introducción del bisturí armónico en el procedimiento, pero debe considerarse una opción segura cuando no se dispone de esa tecnología, y la demora en la preparación del hemoducto no sea motivo de preocupación exagerada.
El adecuado conocimiento, no solo de las excepcionales características anatómicas e histológicas de la AMI, sino además de las principales variables fisiológicas que condicionan la dirección e intensidad de sus flujos, permite la introducción de sencillas modificaciones durante su disección esqueletizada, que facilitan la obtención de un hemoducto de mayor calidad.
Características anatómicas generales de la arteria mamaria internaLa AMI generalmente es única a cada lado, aunque un estudio5 encontró 2 troncos mamarios en el 1% de los casos estudiados. Parece ser bastante constante6, pero se ha reportado su ausencia o hipoplasia7. Tiene una disposición simétrica en su recorrido paralelo y bastante predecible, a una distancia variable de los bordes laterales del esternón8.
El diámetro de la AMI en adultos varía entre 1,5 y 2,4mm9. Existe consenso en cuanto a que la arteria correspondiente al hemicuerpo del brazo dominante tiene mayor calibre y flujo10,11. Se ha demostrado también una relación proporcional entre el índice de masa corporal y el calibre de la AMI12, pero esas circunstancias no parecen tener consecuencias clínicas importantes13 ni influir sobre la técnica de disección.
OrigenEn el 92-93% de la población, la AMI izquierda se origina en el aspecto anteroinferior de la primera porción (torácica) de la arteria subclavia, usualmente a 1-1,5cm del borde medial de la primera costilla, en una disposición opuesta al tronco tirocervical y medial al músculo escaleno anterior14. En el 7-8% de los casos su origen se sitúa en la segunda porción de la subclavia. La AMI derecha nace en el primer segmento de la subclavia en el 88-96% de la población, y en la segunda porción, en 4-11% de los casos. El origen de la AMI en el tercer segmento (cervical) de la subclavia se encuentra en el 1-1,4% de los casos. Ambas arterias nacen como un único vaso en una proporción semejante de casos (70-95%); sin embargo, en el 4-30% de la población, la AMI se origina como parte de un tronco común junto a otras ramas de la subclavia, como el tronco tirocervical y las arterias supraescapular y tiroidea inferior8. Autores5,7,14,15 han descrito diversas variantes anatómicas en el origen de la AMI, que en algunos casos lo sitúan incluso en el arco aórtico16.
RecorridoEn su recorrido inicial la AMI desciende sobre la cúpula pleural, para cruzar, después de un corto recorrido, el tercio esternal de la clavícula y el primer cartílago costal, antes de entrar en la cavidad torácica14. A nivel de la apertura torácica superior la AMI discurre en sentido inferomedial y posterior a la vena subclavia, y lateral al tronco venoso braquiocefálico. Allí el nervio frénico cruza el vaso en sentido lateral-medial17, a una distancia de 0,5-4,4cm de su nacimiento, para luego adosarse al pericardio y continuar su recorrido junto a la rama pericardiofrénica de la AMI18,19.
Probablemente, en este primer segmento de la AMI es donde se hace más compleja su disección esqueletizada. Además de las estrechas relaciones anatómicas que establece la arteria con otras estructuras, la interposición de un pulmón hiperinsuflado o enfisematoso en el campo visual del cirujano, dificulta el cómodo abordaje al hemoducto y obliga, muchas veces, a deprimir y traumatizar la víscera con instrumentos que no han sido diseñados a ese efecto. Nuestro grupo ha confeccionado un separador retráctil de pulmón, de sencilla fabricación, que facilita el acceso a la AMI en esa zona, y ayuda a prevenir la apertura indeseada de la cavidad pleural20–22.
Dentro del tórax, la arteria desciende casi verticalmente en una dirección lateral y a una distancia variable del margen externo del esternón; se ha situado en el rango 0,4-2,5cm50,14, pero nuestra práctica nos ha mostrado que la separación puede ser aún mayor. Un recorrido muy lateralizado de la AMI, no solo dificulta su disección, sino que propicia la apertura accidental del espacio pleural y obliga a una mayor elevación del hemiesternón. La AMI derecha discurre en un plano más cercano al esternón, y muchas veces se adosa a la pared torácica en un punto más distal de su recorrido, lo que puede causar su lesión accidental si se abre ampliamente la pleura, con electrocauterizador, por preferirse esa estrategia o para acceder a una arteria con un trayecto intrapleural.
La AMI cursa los aspectos posteriores de los primeros 6 cartílagos esternocostales y los correspondientes músculos intercostales internos antes de bifurcarse en sus ramas terminales, las arterias musculofrénica y epigástrica superior23, en un 90-96% de las veces. Menos frecuentemente, en un 4-10% de los casos, el vaso termina además en una tercera rama, llamada diafragmática por algunos autores6–8,14, al ser fuente de irrigación de dicho músculo24.
La longitud de la AMI se encuentra en el rango 13,2-26cm, con un promedio de 20,4±2,1cm (o menos según la literatura que se analice25). La izquierda es ligeramente más larga que la derecha, aunque en al menos un estudio24 sus mediciones fueron idénticas. Debe existir relación entre las longitudes del esternón y las arterias in situ26, pero una investigación27 no encontró correlaciones después de diseccionadas.
En general, en sentido caudo-cefálico, la AMI es acompañada por un par de venas homónimas, pero existen muchas variaciones en la disposición de los vasos mamarios5. En un estudio13 no se encontraron individuos sin venas mamarias, pero se evidenció la presencia de una sola hasta en el 19,5% y de 3 hasta en el 42% de los casos; otros hallazgos han motivado diversas clasificaciones de la distribución anatómica de dichos vasos12,28. Prácticamente en cualquier espacio intercostal (EIC), pero generalmente a nivel del tercero o cuarto, ambas venas confluyen en el aspecto medial de la arteria. Habitualmente en el tercer EIC la vena cruza la arteria y hace el resto de su recorrido en su aspecto lateral, hasta su desembocadura en el tronco venoso braquiocefálico14. Un estudio al menos ha descrito un recorrido retroesternal de una vena mamaria29.
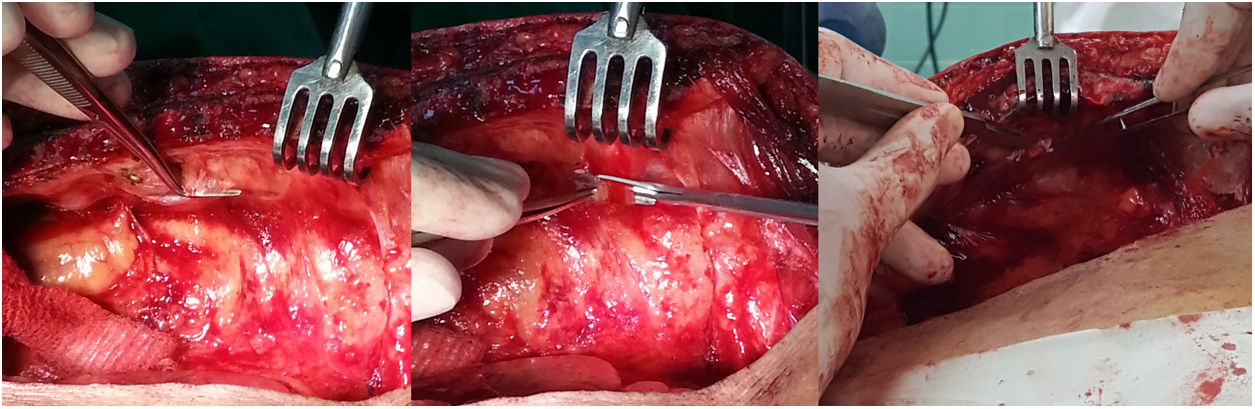
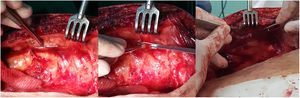
Hasta el tercer EIC la AMI está cubierta por fascia endotorácica y pleura parietal; su segmento distal discurre entre el músculo torácico transverso y los músculos intercostales5,13,14. En esa localización, esas estructuras son prácticamente avasculares y puede descubrirse la arteria sin necesidad de emplear el electrocauterizador. Cortes con bisturí o tijera de Potts, mientras se separan de la pared con una pinza de disección con su extremo modificado (en ángulo recto), agilizarán esta maniobra, sin riesgo de sangrado ni lesión del hemoducto30 (fig. 1). En los primeros EIC, la fascia endotorácica es más delgada y su leve tracción permitirá su apertura sin necesidad de emplear instrumentos de corte.
En el 60% de la población, en el caso de la izquierda, y en el 76,7% en la derecha, el sitio habitual de terminación de la AMI es en la sexta costilla o en su correspondiente EIC24,29. En una menor cantidad de individuos, el vaso puede culminar en el quinto o séptimo EIC31.
Ramas de la arteria mamaria internaUn estudio de 7 cadáveres encontró un promedio de 18,5 ramas de la AMI, pero esa cifra puede ser muy variable. En teoría, en la mayoría de los EIC pueden emerger hasta 4 ramas de la arteria, hacia el esternón, el mediastino, el músculo pectoral y el músculo intercostal25. A estas deben sumárseles otras arterias con sitios específicos de origen:
Rama accesoria o lateral (arteria torácica costal lateral)Cuando está presente (1,5-15% de los casos32,33), es una rama relativamente larga de la AMI, que nace a los 2,5cm de su origen. Hace su recorrido en la superficie interior de la pared torácica anterolateral (sobre la línea axilar media) y culmina a nivel del cuarto, quinto o sexto EIC. Su diámetro a veces es equivalente al del tronco principal de la AMI34. No se conoce su función; por su disposición se especula que puede estar relacionada con la irrigación de las mamas32. En su trayecto, sus ramas se comunican con las arterias intercostales anteriores y posteriores8.
Rama pericardiofrénicaEs la segunda rama de la AMI cuando está presente la arteria costal lateral35. En el 9,5% de los individuos se origina en una rama tímica y en el 0,5%, desde la arteria subclavia. Cuando se origina en la AMI (89%) lo hace de su segmento inicial, habitualmente en los 2 primeros EIC36. Acompaña al nervio frénico en su recorrido entre la pleura y el pericardio, hasta el diafragma, donde se anastomosa con las arterias musculofrénica37 y frénica superior (rama de la aorta torácica descendente38 o de la décima arteria intercostal, en el 58% de los casos en la rama derecha, y en el 49% en el caso de la izquierda39), así como con la rama medial de la arteria frénica inferior, que perfora el diafragma después de su nacimiento en la aorta abdominal o alguna de sus ramas (tronco celíaco, arterias renales, etc.38)8,14,40.
Rama tímicaEs una arteria delgada que se origina a nivel del primer EIC. Es más desarrollada en los primeros años de la vida14, o en individuos donde un timo patológico no degenera después de la infancia tardía. En la edad adulta irriga los remanentes de la glándula tímica8.
Ramas intercostales anterioresSe originan en los primeros 5 o 6 EIC8. Nacen de la cara lateral de la AMI; después de un recorrido inicial en el espesor de su músculo intercostal interno correspondiente, se ramifican para formar la arteria intercostal anterior y supracostal. Inicialmente ambas ramas corren entre la pleura y los músculos intercostales, más adelante discurren en el espacio subcostal y se anastomosan con las arterias intercostales posteriores14, ramas de la aorta torácica8. Las 2 últimas arterias intercostales anteriores son ramas de la arteria musculofrénica.
Ramas esternalesEstán distribuidas en cada EIC, y son la fuente principal de irrigación sanguínea del esternón. Generalmente forman un patrón de arcada, de los que se han reconocido cerca de 8 configuraciones14.
Ramas perforantesPueden originarse directamente desde el tronco de la AMI o desde las ramas esternales. Son más frecuentes entre el primer y tercer EIC5,41. Las de mayor calibre se encuentra en el segundo y primer EIC, en ese orden. Toman una ruta dorsolateral a través del EIC y perforan el aspecto medial del músculo pectoral mayor; superficialmente se diseminan en el tejido subcutáneo. Contribuyen a la irrigación sanguínea del esternón, los músculos pectorales, las mamas (60% de su nutrición41) y la piel. Se conectan al sistema vascular de la arteria torácica lateral14. Una rama perforante gruesa, que generalmente irriga la zona más extensa de piel, es un hallazgo constante en la porción superior del esternón, generalmente en el primer o segundo EIC41.
Algunos autores señalan la presencia de ramas perforantes arteriovenosas, que discurren en estrecha relación con ambos tipos de vasos42. De igual modo, a lo largo de estas ramas se disponen vasos linfáticos perforantes que drenan en la cadena torácica interna43. Es frecuente la lesión de esas estructuras vasculares durante la disección y división de las ramas que se originan en la cara lateral de la AMI. Durante la disección esqueletizada, un abordaje intencionado de las ramas, en 2 tiempos, facilita el control de las que se adentran en la musculatura del EIC, disminuye el sangrado y reduce la duración del procedimiento44.
Ramas mediastinalesPequeñas, irrigan el tejido graso retroesternal, los nódulos linfáticos mediastinales y músculos de la pared torácica14. Se ha descrito al menos un caso en el que una rama mediastinal muy desarrollada se empleó para revascularizar el territorio izquierdo en forma semejante a la configuración en Y45.
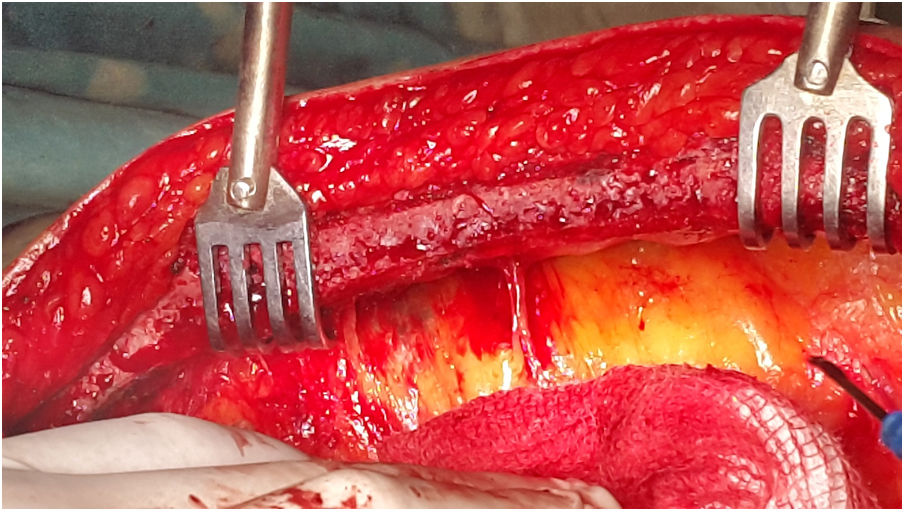
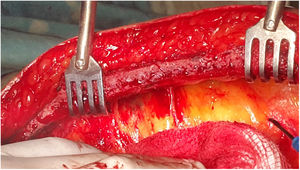
Ramas pericárdicasRamas de tamaño variable que irrigan el aspecto anterior del pericardio8. Son escasas, probablemente limitadas a una o 2 ramas, generalmente en el segmento medio de la arteria (fig. 2).
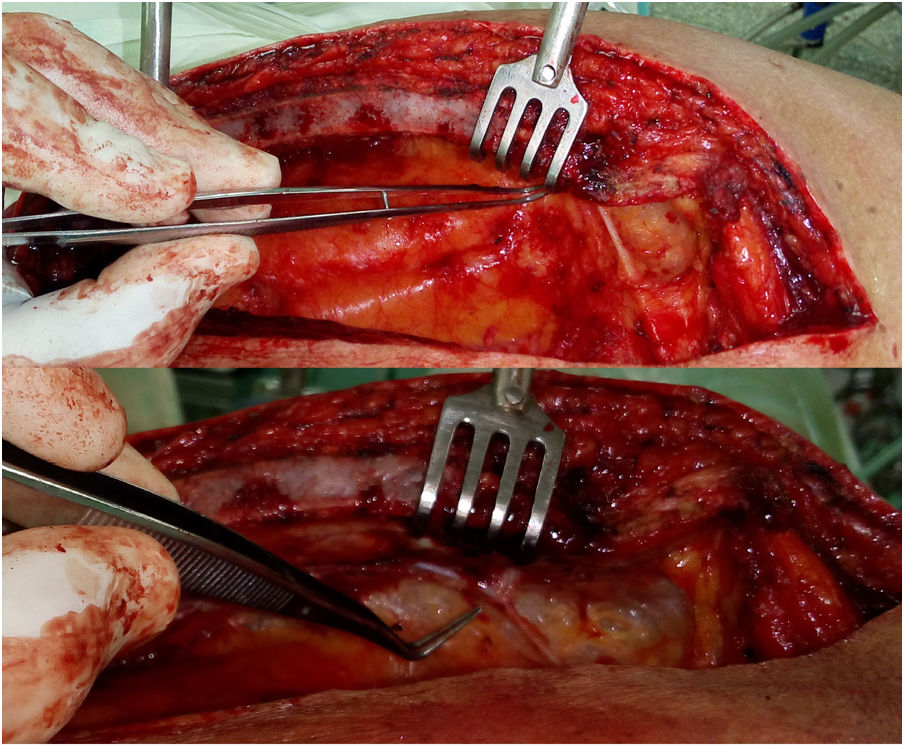
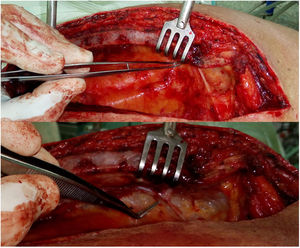
Rama xifoidea o diafragmáticaPequeña rama bilateral que en alrededor del 10% de los casos se origina directamente de la AMI, aunque algunos estudios en cadáveres señalan esta configuración en el 20-30% de los individuos40. Menos frecuentemente, esta rama se origina de la arteria epigástrica superior. Las arterias de ambos lados forman un arco anastomótico delante del proceso xifoideo del esternón14, que frecuentemente se lesiona durante la esternotomía, ocasionando un sangrado molesto. En nuestra práctica hemos observado ramas terminales largas de la AMI, que se separan de la pared torácica, atraviesan la grasa prepericárdica y se adentran en el diafragma. Probablemente se trate de una variante anatómica no descrita y, por su tamaño, posiblemente irrigue varios órganos (fig. 3).
Rama terminal de la AMI cuyo recorrido no se corresponde con la configuración anatómica habitual de las arterias musculofrénica, epigástrica superior o diafragmática. Probablemente se trate de una ramificación no descrita previamente. Se encontró aproximadamente en el 4% de los pacientes de nuestra serie.
Rama terminal lateral de la AMI. Inicialmente corre en el receso esternocostal; luego discurre en sentido inferolateral y posterior al séptimo-noveno cartílago costal, donde origina las arterias intercostales anteriores, antes de atravesar el diafragma cerca de la novena costilla. A ese nivel se ramifica y anastomosa con la rama medial de la arteria frénica inferior (que al igual que su contraparte lateral proviene de la aorta abdominal o alguna de sus ramas38)37, las 2 últimas arterias intercostales posteriores y la rama ascendente de la arteria ilíaca circunfleja profunda (rama lateral de la ilíaca externa46–48), para terminar cerca del último EIC.
Arteria epigástrica superiorRama terminal medial de la AMI. Corre a través del triángulo esternocostal (estructura fibrosa entre las porciones esternal y costal del diafragma, también llamado foramen de Morgagni38) y penetra la vaina del músculo recto abdominal sobre el séptimo cartílago costal. Culmina al anastomosarse con la rama epigástrica inferior de la arteria ilíaca externa, usualmente por debajo del nivel del ombligo.
Circulación colateral residual al esternón después de la disección de la arteria mamaria internaLa irrigación sanguínea del esternón humano adulto se deriva solamente de su plexo periosteal, alimentado por ramas de la AMI. No existe un sistema de nutrición intramedular, comparable al de los huesos largos. Un estudio de 198849 falló en evidenciar flujo colateral al esternón que pudiera sustituir inmediatamente al proveniente de la AMI, con un 90% de disminución en la perfusión ósea después de su movilización. Sin embargo, una investigación más reciente25 mostró que la irrigación del esternón se reduce en aproximadamente 13 y 25% cuando se diseccionan una y las 2 arterias mamarias, respectivamente.
Las principales ramas de la AMI que participan en la irrigación del esternón son las esternales y perforantes. El origen anatómico de estas puede estar, además, estrechamente relacionado con el de las ramas intercostales anteriores. Se han descrito 4 configuraciones de nacimiento y posterior ramificación de estas ramas14, de las cuales dependerá, en mayor o menor medida, la conservación de cierta irrigación colateral al hueso, después de la disección de la AMI.
Tipo ILas 3 ramas se originan de un mismo tronco25,50, después de un corto recorrido desde su nacimiento. Este patrón generalmente se observa a partir del cuarto EIC8. En este caso, si durante la disección esqueletizada de la AMI no se lesiona el punto de trifurcación, la irrigación esternal segmentaria es asumida por la aorta torácica, mediante la comunicación que se establece entre la arteria intercostal posterior y anterior, distribuida en el hueso por la rama esternal y perforante.
Tipo IILa rama esternal se origina como arteria independiente desde el aspecto medial de la AMI; un estudio24 las encontró en un número de 5-9 en el lado derecho y 4-9 en el lado izquierdo. Las ramas perforante e intercostal anterior se originan de un tronco común, semejante al tipo I. En este caso, la disección esqueletizada lesiona la rama esternal, pero si no se afecta el punto de bifurcación del tronco común, la irrigación sanguínea del esternón se conserva también mediante la circulación colateral proveniente de la aorta torácica, distribuida en el hueso por la rama perforante.
Tipo IIILas ramas esternal y perforante se originan de un tronco común. La rama intercostal anterior nace como un vaso independiente, por lo que no existe comunicación entre esta y las ramas perforantes-esternales. En este caso la irrigación del hueso estará más comprometida después de la disección, pero si se conserva el punto de bifurcación del tronco común, en teoría, en algunos pacientes el flujo sanguíneo puede alcanzar el hueso de forma retrógrada por medio de la comunicación de las ramas perforantes con las arterias acromiotorácica y torácica lateral, ambas ramas de la arteria axilar8,51.
Tipo IVLas 3 arterias nacen como ramas independientes. En este caso, solo las ramas perforantes podrían conservar la irrigación esternal si se establecen las conexiones señaladas en la anterior configuración. En ausencia de esas anastomosis, los patrones de disposición anatómica III y IV constituyen un factor de riesgo para complicaciones esternales, aun con disección esqueletizada de la AMI11.
Fisiología de la arteria mamaria interna: repercusión de la confluencia y competencia de flujosLa AMI es una arteria inusual, alrededor de la que se establecen múltiples conexiones anastomóticas que permiten la confluencia, en su luz, de flujos provenientes de varias ramas de la aorta: arteria subclavia, arterias intercostales posteriores, arterias frénicas y arteria ilíaca externa8. Lo que ocurre fisiológicamente en la AMI, es uno de los mejores exponentes, en el organismo humano, de la repercusión de la competencia sobre la intensidad y la dirección del flujo a través de una arteria. En esencia, al sustraer del análisis parámetros generalmente constantes como π y la viscosidad de la sangre, la ley de Poiseuille establece que, la cuantía del flujo está directamente condicionada por el radio elevado a la cuarta potencia y la diferencia de presión en ambos extremos del vaso; a su vez, la contrarresta la longitud del segmento vascular que recorre el fluido. El comportamiento de estos parámetros en la AMI de un ser humano, determina que su flujo nativo sea predominantemente sistólico52, anterógrado, proveniente esencialmente de la subclavia, lo que no impide que, en sentido retrógrado se le contrapongan otros de menos intensidad53, originados en diversos sistemas arteriales y que confluyen en las arterias musculofrénica y epigástrica superior.
En la competencia de flujos que se establece en la luz de la AMI, prevalece, en el tórax, el que se origina en la arteria subclavia. En ese punto, la presión supera a la del segmento distal de la arteria; además, el vaso tiene más calibre y su longitud hasta el sexto EIC solo sobrepasa ligeramente los 20cm, lo que ofrece menor resistencia. Más del 70% del flujo retrógrado de la AMI corresponde a la rama musculofrénica54 por sus múltiples conexiones con varios sistemas arteriales, pero está sometido a mayores resistencias por ser vasos de mayor longitud (originados en la aorta o en la arteria ilíaca externa)55 y en ocasiones, menor calibre. En el caso de la arteria epigástrica superior, la conexión con su homónima inferior, en cerca del 70% de los casos, se realiza a través de 2 o más vasos terminales de alta resistencia, cuyos diámetros han disminuido a la mitad durante su recorrido desde la distante región inguinal54.
Es difícil precisar con exactitud el valor del flujo fisiológico de la AMI; según la mencionada ley depende, al menos, del segmento de la arteria en que se mida. Sin embargo, 2 estudios56,57 hallaron que, independientemente de la técnica de disección empleada, de la administración o no de vasodilatadores y del sitio escogido para su cuantificación, la intensidad del flujo in situ disminuye considerablemente cuando se han ligado todas sus ramas laterales, pero permanecen permeables las terminales (tabla 1). El diseño de esas investigaciones permitió, además, descartar pequeñas variaciones en el diámetro de la arteria, como causa determinante de sus hallazgos por lo que, probablemente, deba asumirse que la diferencia en el gradiente de presión a lo largo del vaso, sea el principal factor causante de la disminución de su flujo durante la disección del hemoducto por las técnicas tradicionales.
Al menos 2 estudios han mostrado que el flujo in situ de la AMII disminuye después de la división de todas las ramas laterales, si las ramas terminales permanecen permeables
| Urso et al., 2008 (sin empleo de papaverina) | ||
|---|---|---|
| Medición del flujo | AMII esqueletizada conelectrocauterio bipolar | AMII esqueletizada conbisturí ultrasónico |
| Después de diseccionar los 3 primeros centímetros | 17,7±9,1 | 18,5±10,5 |
| Al final de la disección, antes de dividir la arteria | 3,9±7,9 | 3,4±7,2 |
| Satdhabudha et al., 2017 | ||
|---|---|---|
| Medición del flujo (en tercio medio de la arteria) | AMII pediculada | AMII semiesqueletizada |
| Al inicio de la disección | 11,1±5,2 | 12,3±5,6 |
| Al final de la disección, antes de dividir la arteria, después de 5min con papaverina tópica | 6,7±3,0 | 6,2±2,7 |
AMII: arteria mamaria interna izquierda.
En enfermedades oclusivas del eje aorto-ilíaco58,59 aumenta el diámetro y flujo a través de la AMI para suplir la deficiente irrigación de los miembros inferiores60,61. En cambio, en presencia de oclusión proximal de la arteria subclavia, el flujo de la AMI se invierte y participa en la circulación colateral del territorio del miembro superior distal a la estenosis62. El fundamento fisiopatológico de ambas respuestas es la disminución del gradiente de presión en la vía de Winslow63,64, lo que remarca la importancia de la competencia en la intensidad y dirección del flujo de la AMI. Cuando desaparece dicha competencia, su flujo retrógrado puede también ser utilizado para revascularizar coronarias enfermas65,66. Estudios recientes67,68 lo han cuantificado en el rango 70-105ml/min.
Modificación de la fisiología de la arteria mamaria interna para mejorar su flujo durante su disecciónEntre las principales metas de los cirujanos, durante la disección de la AMI, deben estar la obtención de un hemoducto con una longitud y diámetro máximos, así como un flujo suficiente para proveer adecuada perfusión al miocardio isquémico4. A comienzos de la década de 1970 se encontró que realizar un injerto con una AMI con poco flujo podía causar un «potencial desastre»69. Por tanto, su elevación fue la preocupación más temprana de los cirujanos cardíacos30 y el primer esfuerzo para lograrlo fue, probablemente, la administración de papaverina durante la disección del hemoducto, en 197170.
Desde entonces se han empleado diversos métodos para mejorar el flujo libre del hemoducto71. Los resultados no siempre han sido los esperados30 probablemente porque, de las variables que determinan su magnitud, solo se ha intentado modificar el diámetro de la arteria, durante su disección. Como ya se comentó, 2 estudios56,57 demostraron que, independientemente de la técnica de disección, empleo de bisturí armónico o administración de papaverina, el flujo de la AMI disminuye durante su preparación, si permanecen permeables sus ramas terminales. En teoría, la adición de un vasodilatador aumentaría el flujo de una arteria, pero en el caso particular de la AMI, más diámetro no siempre significa más flujo2, pues la resistencia que se le contrapone, en su posición nativa, parece ser un factor más determinante.
Según la ley de Poiseuille, el aumento del gradiente de presión a lo largo del vaso o la disminución de su longitud, provocarían un aumento de su flujo. Sin embargo, según nuestro conocimiento, nunca se han intentado modificar esos parámetros durante la disección de la AMI. Por una parte, al parecer todos los cirujanos consideran imprescindible la preparación de la arteria con su extremo distal permeable. Esa estrategia no parece tener ventaja hemodinámica alguna; al contrario, permite la persistencia de una competencia de flujos que disminuye el estrés parietal por cizallamiento (EPC), que es uno de los principales activadores fisiológicos de la enzima sintetasa de óxido nítrico (ON) a nivel endotelial72. Esta circunstancia es la que probablemente explica la disminución del flujo nativo de la AMI, cuando se ejecutan las técnicas clásicas de disección.
Por otra parte, el acortamiento intencional de la longitud de la arteria aparentemente está fuera de toda lógica, aunque probablemente conllevaría a un aumento importante de su flujo. En la era del máximo desarrollo de la revascularización arterial total, un precepto básico de la cirugía coronaria es la obtención de arterias mamarias con la mayor longitud permisible, por lo que, posiblemente, los cirujanos consideran imposible modificar esa variable en beneficio del flujo del hemoducto.
Sin embargo, debe tenerse en cuenta que, el término anatómico de la AMI ciertamente se sitúa en la vecindad del sexto EIC, pero el límite funcional de la vía de Winslow, en sentido céfalo-caudal, está localizado más distalmente. En 2 puntos, probablemente situados en la pared abdominal, los flujos que recorren la vía en sentido caudo-cefálico (incluyendo los que confluyen en la arteria musculofrénica, aunque no forme parte de la mencionada vía) son lo suficientemente intensos como para contrarrestar totalmente, el flujo que se origina en la subclavia, y viceversa. Allí se encuentran los límites funcionales de la importante vía de circulación colateral sistémica, en uno y otro sentido.
Por lo tanto, debido a sus características anatómicas únicas, el análisis del comportamiento del enunciado de Poiseuille en la AMI, no debe reducirse solamente al valor que toman sus parámetros entre el origen del vaso y el sexto EIC. Si se adapta esta ley de la física a lo que ocurre en un hemoducto vivo, sus preceptos deben aplicarse también a las ramas distales a su bifurcación final —aunque excedan su límite anatómico— mientras la dirección del flujo sanguíneo conserve el mismo sentido. Independientemente de que esos segmentos habitualmente tienen poca utilidad quirúrgica, ofrecen gran resistencia al flujo sistólico de la «porción torácica» de la arteria, ya sea por su longitud extra, su escaso diámetro o la confluencia de varios flujos retrógrados en sus lúmenes (menos gradiente de presión).
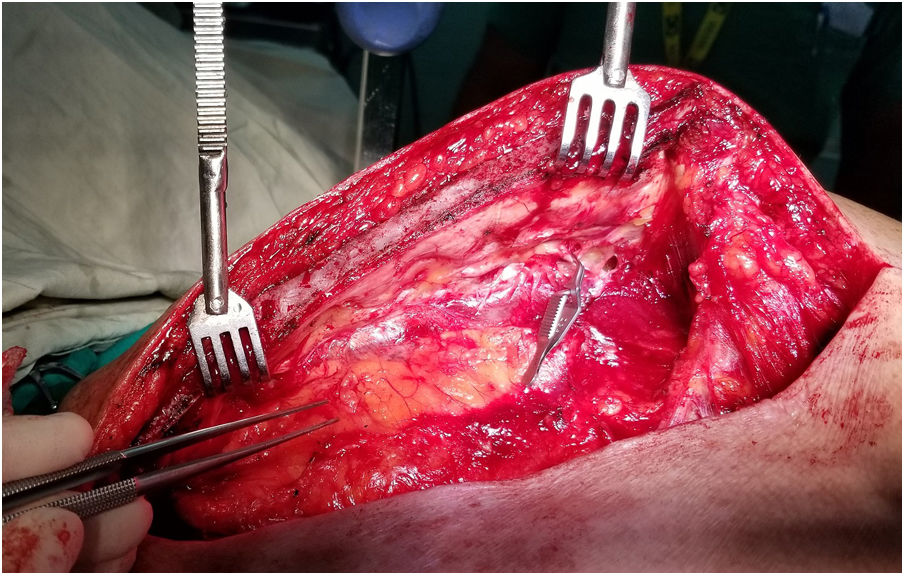
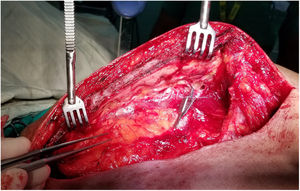
Una maniobra sencilla le permite al cirujano modificar, en su beneficio, los parámetros que determinan la magnitud del flujo de la AMI durante su disección: la oclusión distal de la arteria al inicio del procedimiento (fig. 4). La colocación de un clamp vascular o el clipado de la arteria antes de su bifurcación, sin necesidad de heparinizar al paciente73, altera las variables hemodinámicas del vaso y desencadena una serie de eventos muy ventajosos para la salud del hemoducto. Con esta estrategia, no solo se elimina casi por completo la competencia, en sentido caudo-cefálico, que ofrece la vía de Winslow —y la arteria musculofrénica— al flujo anterógrado de la AMI (aumento del gradiente de presión) sino que, además, disminuye la resistencia al mismo al acortarse en varios centímetros la longitud funcional del vaso, sin afectarse su longitud anatómica, necesaria para la revascularización.
Esta nueva situación anatómica permite, desde el inicio de la disección, un aumento de los flujos que convergen a ambos lados de la oclusión, aunque las condiciones hemodinámicas favorecen un mayor incremento del que se origina en la arteria subclavia. Un flujo más intenso aumenta el EPC en la luz de la AMI, lo que provoca un incremento continuo de la producción de ON durante un período de 2 h74. En este escenario, además, según lo establecido por la ley de la cuarta potencia75, un pequeño aumento en el diámetro de la arteria incrementará considerablemente su flujo con la consiguiente favorable repercusión en la calidad del injerto.
ConclusionesLa AMI es la única arteria periférica elástica en el organismo humano, lo que le permite comportarse como un hemoducto vivo en la CRM, adecuando su diámetro y flujo a las necesidades miocárdicas. Sus características histológicas excepcionales, que la hacen prácticamente inmune a la arteriosclerosis, y la elevada disponibilidad de ON, sulfato de heparina y factor tisular activador del plasminógeno en su luz, la convierten en el hemoducto ideal. En proporción a su tamaño, es probablemente la arteria que irriga la mayor cantidad de órganos, pero la gran colateralidad que la rodea permite su sacrificio sin temor de isquemia importante. Eso, además, condiciona especialmente las características de su torrente sanguíneo, pues al recibir irrigación de varios sistemas arteriales, la dirección y cantidad de ese flujo dependerá de la competencia que se establezca entre estos.
La modificación precoz de las variables que se oponen al flujo sistólico de la AMI, como método sencillo de obtención de un hemoducto de mayor calidad, es un terreno casi inexplorado en la CRM, lo que resulta curioso, pues solo precisa la oclusión distal de la arteria al inicio de su preparación. Un estudio aleatorizado controlado recientemente concluido por nuestro grupo (manuscrito en preparación) demostró que los cambios anatómicos y fisiológicos que se establecen a partir de esa sencilla maniobra, no solo provocan un mayor aumento del flujo y diámetro de la AMI, sino que probablemente facilitan la disección, disminuyen las lesiones de ramas laterales y el sangrado, reducen la incidencia de espasmo y favorecen una mayor irrigación y protección antibiótica y anti-isquémica del esternón y el miocardio (por circulación colateral coronaria de origen extra-cardíaco) mediante un desvío forzoso del flujo de la AMI durante su preparación.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.