La cirugía coronaria continúa siendo el tratamiento de elección para muchos pacientes con cardiopatía isquémica. A pesar de sus buenos resultados, no ha dejado de evolucionar desde su introducción en la práctica clínica. En esa línea innovadora, y siguiendo la deriva de la cirugía cardiaca en general, las técnicas actuales se centran en limitar la agresión al paciente manteniendo los buenos resultados clínicos, lo que se conoce como cirugía coronaria mínimamente invasiva.
De este modo, entendemos como cirugía coronaria mínimamente invasiva aquellas técnicas de revascularización coronaria que evitan la esternotomía media, el uso de circulación extracorpórea y la manipulación aórtica.
Dentro de sus principales indicaciones destaca, por encima de todas, la revascularización de la enfermedad de la arteria descendente anterior proximal aislada. También se presenta como una alternativa, en combinación con el intervencionismo percutáneo dentro de una estrategia híbrida, para el tratamiento de la enfermedad multivaso o la enfermedad combinada de la válvula aórtica y la arteria descendente anterior en pacientes con alto riesgo quirúrgico.
Desde el punto de vista técnico, la cirugía coronaria mínimamente invasiva se puede llevar a cabo con o sin empleo del robot. Mientras que la técnica convencional (sin robot) requiere en todos los casos de una pequeña toracotomía izquierda, el empleo del robot puede obviar dicha toracotomía utilizando únicamente puertos toracoscópicos, lo que limita todavía más la agresión.
Por último, a pesar de que no existen grandes estudios comparativos, la cirugía coronaria mínimamente invasiva se muestra como una técnica segura, con una baja incidencia de reconversión y de complicaciones. Sus principales ventajas residen en la reducción del dolor postoperatorio, las infecciones, las transfusiones y la estancia hospitalaria, lo que además se traduce en una reducción de los costes hospitalarios.
Coronary artery bypass grafting remains the treatment of choice for many patients with ischemic heart disease. Despite its good results, it has not stopped evolving since its introduction into clinical practice. In this innovative line and following the trend of cardiac surgery in general, current techniques focus on limiting aggression to the patient while maintaining good clinical results, which is known as minimally invasive coronary artery bypass grafting.
Thus, minimally invasive coronary surgery refers to those coronary revascularization techniques that avoid median sternotomy, the use of cardiopulmonary bypass, and aortic manipulation.
Among its main indications, the revascularization of isolated proximal left anterior descending artery disease stands out above all others. It also serves as an alternative, in combination with percutaneous intervention within a hybrid strategy, for the treatment of multivessel disease or combined disease of the aortic valve and left anterior descending artery in patients at high surgical risk.
From a technical standpoint, minimally invasive coronary surgery can be performed with or without the use of robotic assistance. While the conventional (non-robotic) approach always requires a small left thoracotomy, robotic techniques can eliminate the need for thoracotomy altogether by using only thoracoscopic ports, further reducing invasiveness.
Finally, although large comparative studies are lacking, minimally invasive coronary surgery appears to be a safe technique, with a low incidence of reconversion and complications. Its main advantages include reduced postoperative pain, infections, transfusions, and hospital stay, which also translates into lower healthcare costs.
Desde sus inicios en la década de los 60, la cirugía coronaria no ha dejado de crecer y desarrollarse. Pioneros como Kolesov, con la revascularización con arteria mamaria interna (AMI) de la descendente anterior (ADA)1, y Favaloro con la revascularización con vena safena (VS)2,3 iniciaron una terapia que ha demostrado ser una excelente opción en el tratamiento de la cardiopatía isquémica.
Establecida su eficacia, se han ido sucediendo avances en busca de una menor agresión al paciente. Destaca en este sentido el inicio de la cirugía de revascularización coronaria sin circulación extracorpórea (OPCABG), a finales de la década de los 804, y su posterior desarrollo y expansión en los 905,6.
En esta línea de buscar una menor agresión, y siguiendo la deriva de la cirugía cardiaca en general, el siguiente paso ha sido evitar la esternotomía media y así ahorrar al paciente la morbilidad a ella asociada. De este modo se han introducido técnicas de revascularización mediante minitoracotomía anterior izquierda, ya sea como un procedimiento de revascularización único o como parte de una estrategia híbrida. Por último, y de forma más reciente, se han sumado las técnicas de revascularización robóticas, si bien de una forma menos generalizada y más restringida a determinados centros de excelencia. En conjunto conforman lo que se conoce como técnicas de cirugía coronaria mínimamente invasivas o MIDCAB, que las definiremos como aquellas en las que se realiza una revascularización coronaria quirúrgica sin llevar a cabo una esternotomía media, sin el empleo de circulación extracorpórea y sin manipulación de la arteria aorta ascendente, y serán las que tratemos en la actual revisión.
Si bien el término MIDCAB se suele usar para referirse de forma genérica a todas estas técnicas de revascularización mínimamente invasivas (y así se ha hecho en esta revisión), conviene aclarar que existen acrónimos que se refieren de forma particular a variantes técnicas concretas. Entre estos acrónimos cabe destacar:
- -
MICS-CABG: cirugía de revascularización mínimamente invasiva o MIDCAB multivaso.
- -
ENDOACAB: MIDCAB con disección toracoscópica de la AMI.
- -
RACAB: MIDCAB con disección toracoscópica de la AMI mediante robot.
- -
TECAB: MIDCAB completamente toracoscópico.
Tanto la cirugía como el tratamiento percutáneo son técnicas consolidadas a la hora de tratar la cardiopatía isquémica. El desarrollo y empuje de ambas técnicas las ha llevado a una constante mejora en un intento de mantener o potenciar sus principales ventajas y limitar sus puntos débiles. Por este motivo se hace necesaria una constante actualización en las recomendaciones de las guías de práctica clínica lo cual, en algunos escenarios, no ha estado exento de polémica7.
En el caso de la cirugía sus principales puntos fuertes residen en la posibilidad de una revascularización más extensa y en la mayor durabilidad de la misma, lo cual se traduce en una menor necesidad de nueva revascularización en el seguimiento, con las implicaciones que ello tiene en el devenir de los pacientes8,9. Por el contrario, asocia una mayor morbilidad al tratarse de una terapia más invasiva, con la consecuente penalización en los resultados globales a corto plazo. Esto último es especialmente relevante en aquellos subgrupos de pacientes con mayores comorbilidades y, por tanto, una menor expectativa de vida. Es en estos pacientes donde el MIDCAB puede suponer una alternativa a la cirugía convencional, evitando los problemas asociados a la esternotomía media y al uso de circulación extracorpórea.
A la hora de considerar un paciente para revascularización mediante MIDCAB, en primer lugar debemos descartar la existencia de contraindicaciones. Algunas de estas contraindicaciones son relativas, por lo que será deseable evitarlas en la fase inicial de la curva de aprendizaje y, a medida que se avance en dicha curva, podrán ser obviadas para de esta manera expandir la técnica a un mayor número de pacientes.
La necesidad de revascularización emergente se considera una contraindicación, así como anatomías torácicas complejas tipo pectus excavatum o escoliosis muy marcadas. En este sentido, la obesidad es una condición idealmente evitable, especialmente cuando el índice de masa corporal (IMC) sea mayor de 35. Algo similar ocurre con la enfermedad pulmonar, especialmente cuando se trate de una EPOC severa que pueda afectar a la tolerancia de la ventilación unipulmonar. No obstante, tal y como ocurre en otros ámbitos de la cirugía mínimamente invasiva, son estos pacientes los que más se pueden beneficiar de evitarles una esternotomía media. Una esternotomía o toracototomía previas no suponen una contraindicación per se, si bien pueden dificultar el abordaje y suponer un mayor reto técnico.
En cambio, sí que resulta crucial una adecuada valoración de la ADA. En primer lugar, deberemos descartar la existencia de una ADA intramiocárdica. Un trayecto recto, con ausencia de acortamiento con la contracción y/o la presencia de compresión sistólica de la arteria nos deberán hacer sospechar de este hecho10. A ello deberemos sumar una adecuada zona a nivel medio-distal para poder realizar el bypass, refiriéndonos con adecuada a una ADA a ese nivel con un calibre apropiado y con ausencia o mínima calcificación11. La ausencia de una ADA favorable sí se considera una contraindicación absoluta para el MIDCAB.
Teniendo lo anterior muy presente, podríamos definir como paciente prototipo ideal para MIDCAB aquel con enfermedad de vasos de la cara anterior (ADA±ramos diagonales), no obeso y sin deformidades o cirugías torácicas, con buena función ventricular y vasos no calcificados ni intramiocárdicos. Como suele ocurrir en la práctica clínica, es difícil encontrar ese paciente ideal. Siendo menos estrictos podemos ampliar el grupo de pacientes que se pueden beneficiar de esta técnica, estableciendo así como principales indicaciones del MIDCAB las siguientes:
- •
Enfermedad multivaso en pacientes con alto riesgo quirúrgico/alto riesgo de complicaciones de la herida de esternotomía media (tratamiento híbrido) o con malos lechos distales en los territorios de la circunfleja y la coronaria derecha.
- •
Enfermedad aislada de la ADA proximal.
- •
Enfermedad de la ADA combinada con:
- ∘
Estenosis aórtica severa: MIDCAB+TAVI.
- ∘
Insuficiencia mitral: MIDCAB+TOP-MINI.
- ∘
Fibrilación auricular: MIDCAB+TT-Maze.
- ∘
A continuación, analizamos los escenarios de mayor aplicación de la revascularización mínimamente invasiva.
Enfermedad multivasoLa cirugía de revascularización coronaria continúa siendo la técnica de elección para la enfermedad multivaso, especialmente en pacientes diabéticos y/o con disfunción ventricular12. Si bien es factible llevar a cabo una revascularización completa de una enfermedad multivaso mediante MIDCAB, lo que se conoce como MICS-CABG, es técnicamente demandante. En este escenario la revascularización quirúrgica mediante esternotomía media continúa siendo la técnica más empleada. Sin embargo, en aquellos pacientes de alto riesgo quirúrgico la opción de una terapia híbrida se presenta como una alternativa muy atractiva. Dicha opción pretende aunar los puntos fuertes de cada una de las opciones de revascularización: por un lado, la revascularización de la ADA con un injerto de AMI mediante una pequeña toracotomía anterior izquierda y, por otro, la menor agresión que ofrece el tratamiento percutáneo del resto de lesiones. A pesar estas ventajas es una opción de revascularización poco extendida, representando un 0,2% del total de procedimientos de revascularización en enfermedad multivaso en EE. UU.13.
Las guías de práctica clínica no ofrecen una recomendación específica en lo que a las técnicas híbridas se refiere en la enfermedad multivaso12,14, dejando en manos del Heart Team la decisión en cuanto a la mejor estrategia de revascularización. Dichas guías sí que enfatizan la importancia de alcanzar una revascularización lo más completa posible, equiparando en pacientes no diabéticos el tratamiento percutáneo a la cirugía con un grado de recomendación i y nivel de evidencia A solo en el caso de que el tratamiento percutáneo pueda alcanzar una revascularización completa12. Por extensión, este mismo principio concierne a la revascularización híbrida, no debiendo sacrificar una revascularización lo más completa posible en aras de una menor invasión.
Enfermedad de la arteria descendiente anterior proximalEn el caso de la enfermedad de 1-2 vasos con afectación de la ADA proximal, las guías recomiendan tanto el tratamiento percutáneo como la cirugía (grado de recomendación i y nivel de evidencia A), dejando en manos del Heart Team la decisión entre una u otra modalidad12. Apuntan que, si bien no hay diferencias en términos de mortalidad, infarto y/o ictus, el tratamiento percutáneo se asocia con tasas más altas de necesidad de nueva revascularización, especialmente en el caso de enfermedad compleja de la ADA. Por el contrario, la cirugía asocia una mayor morbilidad perioperatoria y una mayor estancia hospitalaria. Es en este escenario donde el MIDCAB se muestra como una opción especialmente atractiva, siendo este el ámbito donde es más frecuentemente llevado a cabo. Conserva el punto fuerte de la cirugía (la durabilidad de la revascularización mediante el injerto de AMI), pero limita en gran medida la agresión al paciente, lo cual tiene una traducción directa en términos de complicaciones, recuperación y satisfacción del paciente.
Cirugía concomitante de estenosis aórtica y revascularización miocárdicaLa coexistencia de cardiopatía isquémica y estenosis aórtica severa no es infrecuente, estimándose que entre un 40% y un 75% de pacientes con estenosis aórtica severa presentan enfermedad coronaria asociada15. La cirugía continúa siendo la técnica de elección en estos pacientes16. No obstante, el aumento de la edad y del perfil de riesgo de los pacientes con estenosis aórtica severa hacen que la cirugía combinada pueda resultar, en ciertos casos, demasiado agresiva. Esto, unido al desarrollo de las prótesis aórticas transcatéter (TAVI), hace que en la actualidad existan otras alternativas para pacientes de alto riesgo quirúrgico: tratamiento completamente percutáneo, tratamiento quirúrgico mínimamente invasivo o tratamiento híbrido.
La opción mínimamente invasiva y la híbrida resultan más atractivas en aquellos casos en los que la enfermedad coronaria implica la ADA de forma aislada. Si bien en estos pacientes la terapia enteramente percutánea resulta de elección, puede no ser la más adecuada cuando la enfermedad de la ADA es compleja y, por tanto, de alto riesgo para la revascularización percutánea. Del mismo modo, pacientes con enfermedad arterial periférica y malos accesos vasculares pueden no ser candidatos a una TAVI por vía transfemoral. Estos pacientes se pueden beneficiar de un procedimiento híbrido, con revascularización mediante MIDCAB y posterior implante de TAVI transfemoral, o de un tratamiento enteramente quirúrgico mínimamente invasivo mediante revascularización por MIDCAB y tratamiento de la estenosis aórtica mediante TAVI transapical17–19. A pesar de que no existen recomendaciones específicas en las guías y de que la literatura al respecto se compone de series de pocos casos, es una opción válida que debemos tener presente.
Cirugía concomitante de insuficiencia mitral y revascularización miocárdicaLas principales causas de insuficiencia mitral son la enfermedad degenerativa y la cardiopatía isquémica, por lo que la coexistencia de insuficiencia mitral y enfermedad coronaria no es infrecuente20. El escenario más común suele ser la enfermedad coronaria multivaso, que asocia deterioro de la función ventricular e insuficiencia mitral de tipo funcional. No obstante, también podemos encontrar casos de enfermedad degenerativa de la válvula mitral que asocien algún grado de enfermedad coronaria silente objetivada en el estudio preoperatorio.
El tratamiento de elección de la insuficiencia mitral degenerativa, cuando está indicado intervenir sobre ella, es la cirugía16. Junto a las técnicas convencionales de reparación valvular, y de forma análoga a otros campos de la cirugía cardiaca, han surgido técnicas mínimamente invasivas. En este campo, y de especial interés para el abordaje conjunto de la enfermedad coronaria y de la válvula mitral, destaca la reparación mitral mediante implante de neocuerdas por vía transapical o TOP-MINI21. Se trata de una técnica que requiere de una elevada especialización, así como de una cuidadosa selección de los pacientes22. No obstante, en casos anatómicamente favorables (principalmente prolapsos de P2) puede ser una excelente alternativa para, mediante una pequeña toracototomía izquierda, reparar la válvula mitral y revascularizar la ADA. La revascularización puede completarse de forma percutánea en caso de ser preciso.
Aspectos técnicosAunque es posible una revascularización de todos los territorios coronarios mediante MIDCAB, en esta revisión nos centraremos principalmente en los aspectos técnicos referentes a la revascularización de la cara anterior (ADA y ramos diagonales), puesto que es lo más extendido en la práctica clínica. Al final también se hará una breve descripción de los aspectos más relevantes de la revascularización mínimamente invasiva de la enfermedad multivaso (MICS-CABG y tratamiento híbrido).
Para analizar los aspectos técnicos más en detalle en lo que al MIDCAB monovaso se refiere, consideraremos por un lado el MIDCAB convencional y, por otro, el MIDCAB con robot.
Cirugía coronaria mínimamente invasiva convencional por minitoracotomía anterior izquierdaLa preparación y colocación del paciente van a ser muy similares para ambas técnicas. Este se dispone en decúbito supino, con un apoyo colocado debajo de la escápula izquierda para ayudar en la exposición del hemitórax izquierdo a la hora de disecar la AMI. El procedimiento se lleva cabo bajo anestesia general. En cuanto a la intubación, esta se suele llevar a cabo mediante tubo de doble luz, si bien no es estrictamente necesario y el procedimiento se puede realizar con intubación orotraqueal estándar. Como parte de la estrategia anestésica para el control del dolor postoperatorio, algunos grupos emplean catéteres paravertebrales, que son implantados durante esta fase anestésica. Otros grupos emplean, en su lugar, catéteres incisionales y técnicas locales de bloqueo intercostal al final de la intervención. Ambas opciones son válidas, pudiendo además asociarse técnicas de crioablación intercostal previo al cierre de la toracotomía, cada vez más habituales en procedimientos torácicos23. Debido al acceso limitado del que se dispondrá al corazón, es habitual colocar palas de desfibrilación externas.
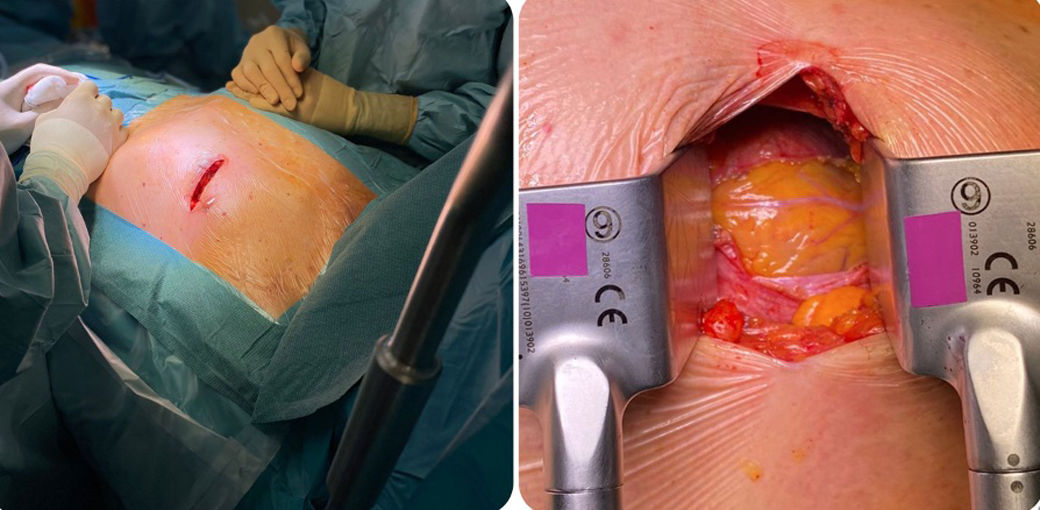
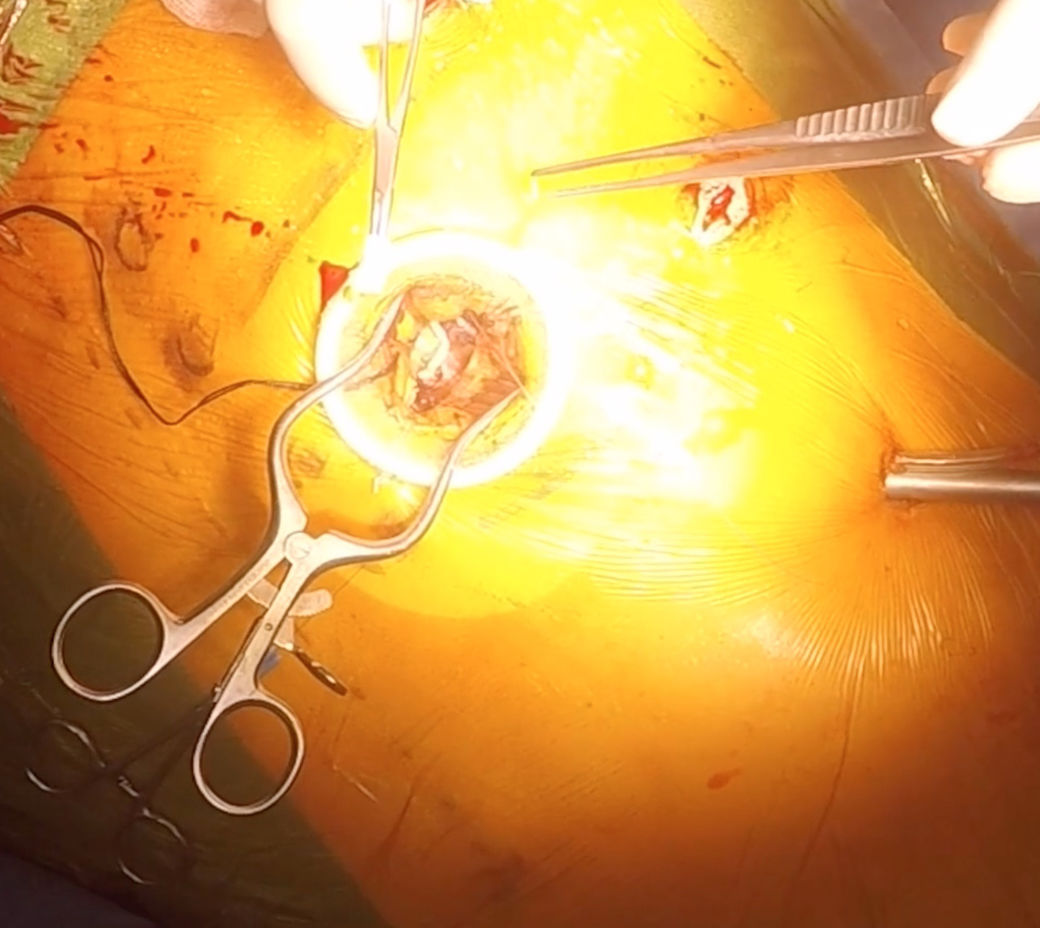
El abordaje consiste en una incisión de unos 5-8cm, extendiéndose desde unos 2cm del borde izquierdo esternal hasta sobrepasar mínimamente la mamila izquierda (fig. 1a). A continuación, se accede al tórax por el 4.° espacio intercostal (EIC) para, acto seguido y previo a la disección de la AMI, abrir el pericardio y exponer la ADA para confirmar que es pontable mediante este acceso (fig. 1b). A pesar de que con estas referencias anatómicas la visualización de la ADA debería ser buena en la mayoría de casos, resulta de gran utilidad realizar un ecocardiograma previo a la incisión para localizar con exactitud el ápex. Ello nos permitirá ajustar el abordaje a la anatomía del paciente en aras de conseguir la mejor exposición posible de la ADA.
Confirmada la pontabilidad de la ADA, a continuación disecaremos el injerto de AMI. Para ayudarnos, en caso de intubación con tubo de doble luz iniciamos la ventilación unipulmonar en este momento, comprobando la tolerancia respiratoria y hemodinámica. Para la exposición existen diversos sistemas de tracción que van a elevar el hemitórax izquierdo, debiendo aplicar la tracción de forma progresiva para evitar fracturas costales. Generalmente, se lleva a cabo una disección esqueletonizada de la AMI, maximizando de este modo la longitud del injerto. Una vez disecada la AMI por completo, y tras heparinizar al paciente, la seccionaremos distalmente para comprobar que el flujo y la longitud son correctos (fig. 2).
Una vez obtenido el injerto de AMI, nos centraremos en la colocación del corazón. Para ello, traccionaremos del pericardio para centrar en la incisión la zona donde llevaremos a cabo la anastomosis. Además, esta tracción del pericardio también nos puede servir para impedir que el pulmón interfiera en el campo, lo que nos permitirá una ventilación bipulmonar que favorecerá la tolerancia hemodinámica, eso sí, con baja PEEP y bajos volúmenes minuto.
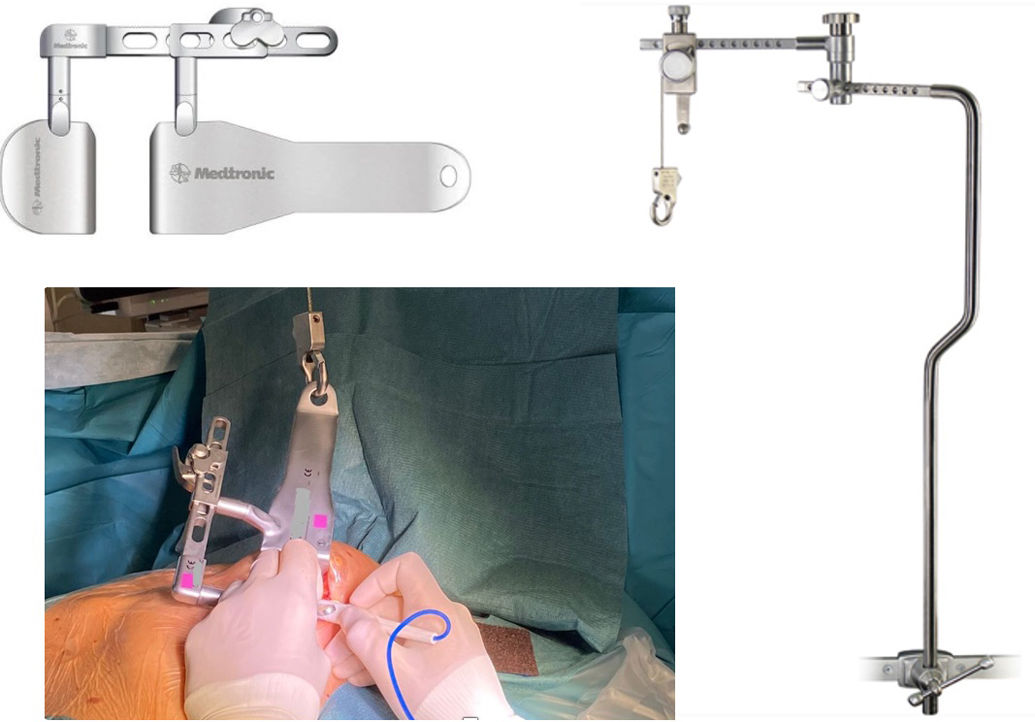
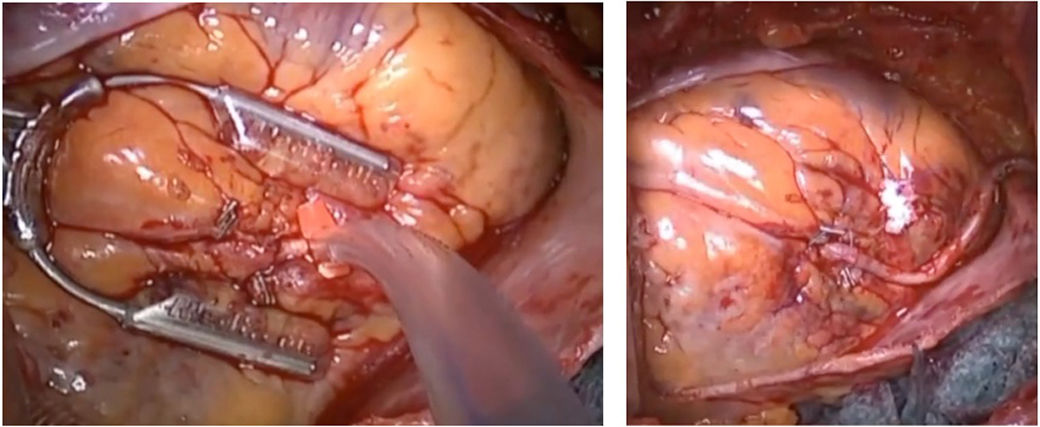
Una vez expuesta la ADA procederemos a realizar la anastomosis término-lateral entre AMI-ADA, colocando un estabilizador a través de la propia toracotomía o, idealmente, empleando un estabilizador especialmente diseñado para MIDCAB como es el Octopus Nuvo® (Medtronic, Minneapolis, MN, EE. UU.)11. Por lo demás, la técnica no difiere de una anastomosis AMI-ADA mediante OPCABG por esternotomía (fig. 3).
Anastomosis AMI-ADA21.
En el caso de realizar más anastomosis, el orden variará en función de la estrategia. Para revascularizar una rama diagonal, podremos realizar una anastomosis secuencial con la AMI, en cuyo caso y de forma análoga a la OPCABG realizaremos primero la anastomosis de la diagonal y, seguidamente, la de la ADA. Por otro lado, podemos emplear otro injerto (vena safena y arteria radial) para ese segundo vaso. En este caso, realizaremos primero la anastomosis del segundo injerto a la AMI para, a continuación, revascularizar la ADA y, finalmente, revascularizar ese segundo vaso (ramo diagonal, ramo bisectriz y ramo marginal)24.
Por último, aproximaremos el pericardio y ventilaremos hasta comprobar la correcta expansión pulmonar, confirmando la ausencia de tensión y/o distorsión de la AMI. Tras ello, aproximaremos las costillas para evitar la herniación pulmonar y cerramos la incisión de forma estándar, dejando un tubo de drenaje torácico.
Cirugía coronaria mínimamente invasiva mediante robotComo ya se mencionó con anterioridad, el MIDCAB mediante robot es una técnica menos extendida, principalmente debido a una mayor complejidad y, por ende, a una mayor curva de aprendizaje. A pesar de que se trata de una técnica que no está disponible en nuestro país en la actualidad, cada vez son más los centros en Europa que incorporan esta técnica en su cartera de servicios, de tal modo que en la actualidad la cirugía coronaria representa casi el 50% del total de cirugías cardiacas realizadas con robot en nuestro continente25.
Desde un punto de vista técnico, el set-up es similar al MIDCAB convencional. El paciente se coloca en decúbito supino, si bien en este caso se intenta elevar más el hemitórax izquierdo y dejar más bajos el hombro y brazo izquierdos para poder maniobrar mejor con los brazos del robot. La monitorización y la técnica anestésica son análogas a las descritas para el MIDCAB convencional, si bien en este caso la intubación con tubo de doble luz es indispensable.
En cuanto a la localización de los puertos, estos se van a disponer de forma análoga a como se hace en la disección toracoscópica de la AMI (ENDOACAB). La cámara se introduce por el 4.° EIC, mientras que los puertos para los instrumentos se introducen por el 2.° y el 6.° EIC. Para la introducción de dichos puertos vamos a tomar como referencia la línea axilar anterior, manteniendo el puerto de la cámara discretamente más lateral que los puertos de los instrumentos, de tal forma que conformen una especie de triángulo. En la figura 4 se puede observar la disposición de estos puertos en un caso de ENDOACAB.
Tras la introducción de los puertos y la inducción del neumotórax, procederemos con la disección de la AMI, para lo que introduciremos una pala con coagulación monopolar a través del puerto del 2.° EIC y una micropinza con coagulación bipolar por el puerto del 6.° EIC. De forma análoga al MIDCAB convencional, la AMI se diseca de forma esqueletonizada para maximizar su longitud, coagulando sus ramas con la micropinza bipolar (se puede añadir un clip en las de mayor tamaño). Dada la mejor visualización de la AMI en todo su trayecto, especialmente en sus extremos proximal y distal, el robot permite una mayor disección de la misma, lo que se traduce en una longitud mayor.
Finalizada la disección de la AMI, se procede a la apertura del pericardio e identificación de la ADA. Tras ello, se administra heparina y se clipa y secciona distalmente la AMI, fijándola al pericardio para tenerla localizada en todo momento.
A partir de este punto existen 2 opciones: continuar con el procedimiento de forma toracoscópica, lo que se conoce como cirugía de revascularización totalmente endoscópica o TECAB, por sus siglas en inglés, o realizar una pequeña toracotomía para llevar a cabo la/s anastomosis distal/es. El TECAB supone un grado mayor de especialización y complejidad. A pesar de su constante desarrollo y crecimiento, y de unos resultados que no han dejado de mejorar desde su instauración a principios de siglo, sigue estando relegado a muy pocos centros en el mundo26. Por este motivo nos centraremos en la segunda opción (pequeña toracotomía adicional).
A la hora de hacer la toracotomía lo primero será liberar lentamente el neumotórax para que las estructuras torácicas, el corazón incluido, vuelvan a su posición natural y de este modo podamos seleccionar con mayor precisión el lugar más apropiado para dicha toracotomía. A diferencia del MIDCAB convencional, y como principal ventaja frente al mismo, dicha toracotomía será más pequeña y no se requerirá en muchos casos el empleo de un separador costal. Por lo demás, la técnica es análoga a la anteriormente descrita27. Dado el pequeño tamaño de la toracotomía será imprescindible emplear un estabilizador específico como el Octopus Nuvo® (Medtronic, Minneapolis, MN, EE.UU.), que se introducirá por el orificio del puerto del 6.° EIC (fig. 5).
Anastomosis AMI-ADA tras disección de AMI con robot24.
Finalizada la anastomosis y comprobada mediante el flujómetro, procederemos a la reexpansión paulatina del pulmón izquierdo para comprobar la posición y la tensión de la AMI. Tras colocar el drenaje y aproximar el pericardio cerraremos la toracotomía, no siendo necesario en este caso puntos de aproximación costales.
Revascularización mínimamente invasiva multivasoLa revascularización multivaso supone un paso más en la complejidad de la cirugía coronaria mínimamente invasiva. La colocación, monitorización y la técnica anestésica no van a diferir de lo descrito previamente para la revascularización aislada de la ADA.
El abordaje también va a ser el mismo, consistiendo en una pequeña toracotomía izquierda de unos 5-8cm al nivel del 4.° EIC. Del mismo modo que para el MIDCAB monovaso, la realización de un ecocardiograma para ajustar la incisión puede resultar de gran ayuda. Tras la apertura del pericardio se inspeccionarán los vasos para confirmar que el procedimiento es factible mediante este abordaje.
Acto seguido se procederá a la extracción de los injertos. La técnica de extracción de la AMI izquierda no difiere de la ya comentada en el apartado anterior. Para el resto de anastomosis podremos emplear injertos de AMI derecha, vena safena y/o arteria radial. En el caso de la vena safena y la arteria radial se podrán emplear técnicas abiertas o endoscópicas. No es objetivo de la presente revisión analizar las técnicas endoscópicas de extracción de injertos, pero la lógica dice que serán de elección en un procedimiento de mínima invasión.
Deteniéndonos un poco más en la extracción de la AMI derecha, de igual modo que para la AMI izquierda, puede realizarse de forma directa a través de la toracotomía, de forma videoasistida (ENDOACAB) o mediante el empleo del robot (RACAB.y TECAB). En cualquier caso se extraerá antes que la AMI izquierda, para evitar lesionar esta última durante la extracción28. Debido a la mayor lejanía, su extracción bajo visión directa resulta compleja, siendo habitual la asistencia con la cámara para una mejor visualización. De igual modo que para la cirugía coronaria convencional, se puede emplear como injerto in situ o como injerto libre anastomosado a la AMI izquierda.
Una vez extraídos los injertos el siguiente paso es realizar las anastomosis proximales de los injertos libres. Existen 2 opciones: realizar estas anastomosis proximales en la aorta ascendente o realizarlas a la AMI izquierda. En el caso de realizarlas en la aorta ascendente, para su exposición y acceso llevaremos a cabo las siguientes maniobras: mantendremos el mismo separador que para la extracción de la AMI, atraeremos la aorta ascendente hacia la toracotomía mediante tracción con puntos de pericardio y la colocación de una gasa entre la vena cava superior y la aorta y comprimiremos discretamente el tracto de salida del ventrículo derecho con el estabilizador coronario29. Posteriormente aplicaremos un clamp exclusor y realizaremos las anastomosis proximales.
No obstante, puesto que una de las premisas de la cirugía coronaria mínimamente invasiva consiste en no tocar la aorta ascendente, será de elección realizar las anastomosis proximales a la AMI izquierda. Es habitual realizar una única anastomosis y emplear injertos secuenciales en aras de simplificar esta parte del procedimiento. Dicha anastomosis deberá realizarse lo suficientemente proximal en la AMI izquierda, aislando la AMI del corazón para que no se mueva con el latido cardiaco, pudiendo ayudarnos para ello del estabilizador coronario.
Seguidamente procederemos con las anastomosis distales. Preferiblemente dejaremos para el final la anastomosis AMI-ADA para reducir el riesgo de dañarla con las manipulaciones para exponer las caras lateral e inferior. Para dicha exposición nos ayudaremos del posicionador apical Starfish® (Medtronic, Minneapolis, MN, EE.UU.), introducido a través de la toracotomía. Para la exposición de la cara inferior lo aplicaremos en el ápex y traccionaremos de él hacia el hombro izquierdo del paciente, mientras que para exponer los vasos marginales traccionaremos del ápex hacia la cadera derecha, pudiendo colocar dicho posicionador sobre el borde agudo del corazón para realizar dicha tracción y obtener así una mejor exposición29,30. Dicha exposición se completa con la estabilización con el Octopus Nuvo® (Medtronic, Minneapolis, MN, EE.UU.). Por lo demás, la técnica no difiere de lo mencionado para el MIDCAB monovaso.
ResultadosA la hora de analizar los resultados del MIDCAB, fundamentalmente nos encontramos con estudios observacionales, en muchos casos retrospectivos y unicéntricos en los que cada centro analiza su experiencia con la técnica, siendo escasos los estudios multicéntricos de gran tamaño que lo enfrenten con la cirugía de revascularización estándar o con el tratamiento percutáneo. Por lo tanto, la calidad de la evidencia es baja, lo que se traduce en la ausencia de recomendaciones fuertes en las guías de práctica clínica12,14.
Existen diferentes series publicadas por los grupos con mayor experiencia en MIDCAB que han demostrado la seguridad y efectividad de dicha técnica. Dichas series presentan mortalidades postoperatorias consistentemente por debajo del 1%, con bajas tasas de reconversión a esternotomía media (en torno al 2% en el caso de MIDCAB monovaso y en torno al 5-6% en el caso del MICS-CABG), una incidencia menor del 2% de reintervención por sangrado, una incidencia por debajo del 1% de ictus y menos de un 5% de infarto o necesidad de nueva revascularización a medio-largo plazo31,32.
Desde un punto de vista didáctico, dividiremos el análisis de los resultados en 4 apartados: MIDCAB vs. cirugía convencional, MIDCAB vs. tratamiento percutáneo, MIDCAB convencional vs. MIDCAB con robot y, por último, revisaremos el tratamiento híbrido.
Cirugía coronaria mínimamente invasiva vs. cirugía convencionalExisten diversos estudios que han analizado las potenciales ventajas que puede ofrecer el MIDCAB con respecto a la cirugía convencional a corto plazo, comparándola fundamentalmente frente al OPCABG. En estos estudios el MIDCAB se presenta de forma consistente como una técnica segura, con una baja mortalidad quirúrgica, una baja incidencia de conversión a esternotomía media y una baja incidencia de complicaciones de forma global11.
El principal punto fuerte de la técnica con respecto a la cirugía convencional reside en su menor agresión. Este hecho se traduce a corto plazo en unos mejores resultados en lo referente al dolor postoperatorio, una menor incidencia de infección de la herida quirúrgica, menor requerimiento transfusional y una menor estancia hospitalaria (de media entre uno y 2 días menos en las diferentes series)32,33. A ello se le suma el evidente beneficio estético. Estos beneficios a corto plazo son bastante consistentes en la literatura, si bien existe algún estudio que ha cuestionado estos mejores resultados en lo que al dolor y la infección respecta11.
A los beneficios clínicos anteriormente mencionados se le suman las ventajas en términos de utilización de recursos. De forma análoga a otros procedimientos mínimamente invasivos, los estudios de coste-efectividad también demuestran una superioridad de la mínima invasión frente a la cirugía convencional en el campo de la cirugía coronaria34.
En el seguimiento a medio-largo plazo, que es el punto fuerte de la cirugía convencional, el MIDCAB también se presenta como una opción sólida. En el caso de la enfermedad aislada de la ADA, el MIDCAB presenta resultados excelentes11, con tasas de permeabilidad del injerto de AMI-ADA análogos a la cirugía abierta. Tampoco se observan diferencias significativas entre ambas técnicas en términos de supervivencia (95% y 76% a 5 y 10 años respectivamente) y eventos mayores cardiovasculares (MACE) a 10 años35, estableciéndose por lo tanto como técnicas equivalentes en este sentido. En lo que respecta a la revascularización híbrida, la evidencia es más confusa, con estudios que apuntan en una y otra dirección. De forma global, se presenta como una técnica no inferior en términos de supervivencia, pero con una mayor incidencia de MACE, fundamentalmente a expensas de mayores tasas de nueva revascularización36.
Cirugía coronaria mínimamente invasiva vs. tratamiento percutáneoExisten pocos estudios que comparen el MIDCAB con la revascularización percutánea, centrándose los pocos que hay en pacientes con enfermedad aislada de la ADA proximal y presentado la mayor parte de ellos cortos periodos de seguimiento (la mayoría inferiores a los 5 años).
En relación con los resultados a corto plazo, ambas técnicas han demostrado ser eficaces y seguras en el tratamiento de la enfermedad de la ADA proximal. Los estudios llevados a cabo no han demostrado diferencias en términos de mortalidad, IAM periprocedimiento o ictus11,31,37. Como era de esperar, el MIDCAB sí que se asoció con tiempos de ingreso más prolongados38.
En cuanto al seguimiento, los estudios con seguimiento inferior a 5 años no encuentran diferencias entre ambos procedimientos en lo que a mortalidad se refiere. En cambio, el tratamiento percutáneo asocia más MACE, principalmente a expensas de mayores tasas de nueva revascularización y de revascularización de vaso diana37. A ello se suma una mayor incidencia de angina en el seguimiento, no así de IAM31. Por lo tanto, el MIDCAB parece ofrecer una solución más definitiva a la enfermedad de la ADA. Es posible que, extendiendo el seguimiento, esa solución más definitiva o duradera que ofrece el MIDCAB pudiese tener una traducción en términos de supervivencia, como sugiere el estudio de Benedetto el al.38, sin dejar de tener presente que se trata de un estudio observacional y unicéntrico, que ofrece un seguimiento a 10 años, encontrando diferencias en la supervivencia en favor del MIDCAB, además de la ya mencionada menor necesidad de nueva revascularización con el mismo.
Cirugía coronaria mínimamente invasiva convencional vs. con robotYa se ha mencionado con anterioridad que la cirugía robótica de revascularización coronaria es una técnica que se lleva a cabo en unos pocos centros en todo el mundo por unos pocos cirujanos especializados. Este hecho hace que la literatura al respecto consista principalmente en series unicéntricas que comparan sus propios resultados en MIDCAB antes y después de la adopción del robot.
En lo que al riesgo quirúrgico se refiere, ambas técnicas presentan resultados comparables en cuanto a mortalidad y morbilidad posquirúrgicas39. A pesar de tiempos quirúrgicos algo más prolongados, el MIDCAB con robot se asocia en algunas publicaciones con menores pérdidas sanguíneas, menor dolor postoperatorio y estancias hospitalarias discretamente menores40. Esto puede explicarse por el menor tamaño de la toracotomía y, sobre todo, por el menor traumatismo torácico asociado a la exposición. Por el contrario, el MIDCAB con robot se asocia con costes más elevados en comparación con el MIDCAB convencional. Es remarcable que en ningún estudio publicado se observan diferencias entre ambas técnicas en lo que a necesidad de reconversión se refiere.
En lo que respecta al seguimiento, los pocos estudios publicados alcanzan seguimientos medios que en su mayoría no llegan a los 5 años, especialmente para el grupo de pacientes revascularizados con robot. Ninguno de estos estudios encuentra diferencias entre ambas técnicas en supervivencia o MACE40,41. Tampoco observan diferencias en la incidencia de angina o IAM, así como en la permeabilidad del injerto/s a un año40. El único estudio publicado hasta la fecha con seguimiento a 10 años tampoco encuentra diferencias en términos de supervivencia entre ambas técnicas39.
Revascularización híbrida: cirugía coronaria mínimamente invasiva+tratamiento percutáneo de los territorios no descendente anteriorYa se ha mencionado con anterioridad en esta revisión que una de las opciones de revascularización de la enfermedad multivaso puede consistir en ofrecer un puente de AMI a DA mediante MIDCAB y revascularizar el resto de territorios coronarios mediante tratamiento percutáneo, que es lo que denominamos tratamiento o revascularización híbrida. Dicha estrategia pretende, por un lado, conservar los beneficios de revascularizar el territorio de la ADA con una AMI evitando la morbilidad asociada a la esternotomía media y, por otro, conseguir una revascularización completa tal y como recomiendan las guías de práctica clínica14.
Teniendo esto presente, aquellos pacientes con importante morbilidad asociada y lesiones complejas de la ADA, junto con lesiones favorables para la revascularización percutánea en el resto de territorios, van a ser los candidatos ideales para este tipo de procedimientos42.
Una de las cuestiones aún no del todo resueltas reside en el orden de los procedimientos. Por un lado existe la posibilidad de realizar ambos tratamientos en el mismo procedimiento, algo que se ha visto favorecido por el desarrollo de los quirófanos híbridos. Presenta la ventaja de someter al paciente a un único procedimiento y de asociar tiempos de estancia menores. Por el contrario, la necesidad de doble antiagregación previo al implante de los stents aumenta el riesgo de sangrado postoperatorio y se aumenta notablemente la duración del procedimiento, lo cual puede tener sus implicaciones en la evolución en el postoperatorio inmediato43.
Por otro lado, está la opción de separar ambos procedimientos en el tiempo, lo cual arroja 2 nuevas cuestiones: cuál llevar a cabo primero y cuánto tiempo esperar entre uno y otro. La opción de realizar primero la revascularización percutánea tiene la ventaja de, en caso de un mal resultado o una complicación de esta, poder darle solución durante la intervención quirúrgica, pudiendo cambiar incluso una cirugía clásica por esternotomía media en caso de ser necesario. A pesar de ello, lo más frecuente es realizar primero el MIDCAB debido principalmente a 3 motivos: se disminuye el riesgo de sangrado al no tener que operar con doble antiagregación, la revascularización percutánea posterior asocia menos riesgo al estar ya revascularizada la ADA y, por último, se puede comprobar la permeabilidad del injerto de AMI a ADA42.
Nuevamente, la evidencia científica al respecto se basa en su mayor parte en series unicéntricas retrospectivas, por lo que su calidad es baja. A pesar de ello, la estrategia híbrida asocia muy buenos resultados a corto plazo, con una mortalidad hospitalaria inferior al 2%, estancias postoperatorias cortas y recuperación funcional más rápida tras el alta hospitalaria42.
Si comparamos la estrategia híbrida con la cirugía de revascularización convencional encontramos que la primera se asocia con menos transfusiones, menos tiempo de ventilación mecánica y menos estancia hospitalaria (de media en torno a 1,5 días menos)44. No obstante, estos beneficios son más notorios en pacientes con anatomías coronarias menos complejas y con menos comorbilidades asociadas45.
En relación con la revascularización percutánea, no hay estudios que hayan demostrado diferencias en términos de mortalidad entre ambas estrategias, ya sea hospitalaria o a medio plazo. Por el contrario, la estrategia híbrida sí que se ha asociado con menos angina y menos necesidad de re-revascularización del territorio de la ADA en el seguimiento46. Estos beneficios se han mostrado más consistentes en aquellos pacientes de bajo-medio riesgo quirúrgico con anatomías coronarias más complejas determinadas mediante SYNTAX score47.
ConclusiónLa cirugía mínimamente invasiva es una realidad en el ámbito de la cirugía cardiaca. El empuje de la cardiología intervencionista ha llevado al desarrollo de técnicas que, manteniendo la eficacia de la cirugía convencional, intentan reducir la agresión para minimizar las complicaciones y favorecer una recuperación más precoz de los pacientes. La cirugía coronaria no ha sido una excepción a este hecho, primero eliminando el uso de circulación extracorpórea y, después, evitando la esternotomía media.
Hoy en día la revascularización de la ADA con la AMI mediante minitoracotomía anterior izquierda resulta una práctica extendida y con resultados contrastados. Las tasas de permeabilidad del injerto de AMI a largo plazo con esta técnica son análogas al abordaje clásico, con ventajas demostradas en cuanto a transfusiones, infecciones y estancia hospitalaria. Más complejo resulta la revascularización mediante este acceso de otros territorios coronarios (cara lateral e inferior), estando esta práctica menos generalizada y, por ende, ofreciendo resultados menos consistentes.
Un paso más en la limitación de la agresión ha supuesto el empleo del robot, aunque su uso sigue concentrándose en unos pocos centros en todo el mundo. Su principal ventaja reside en una mejor exposición de la AMI para su disección con un menor traumatismo torácico asociado. Algunos estudios han asociado este menor traumatismo con una recuperación más precoz, aunque estos resultados deber ser tomados con precaución. En su mayor parte se trata de estudios en los que los procedimientos fueron llevados a cabo por un único cirujano muy especializado en la técnica, con pocos pacientes y, en general, muy seleccionados. Más limitada es la experiencia con el TECAB.
La principal limitación de estas técnicas reside en la posibilidad de conseguir revascularizaciones completas cuando existen otros territorios coronarios enfermos, aparte de la cara anterior. En este sentido, los procedimientos híbridos se presentan como una estrategia muy interesante, aunando los puntos fuertes de cada técnica. Son necesarios más estudios para evaluar sus resultados a medio-largo plazo y comparar su eficacia con las técnicas clásicas de revascularización coronaria.
Consideraciones éticasNo fue necesaria la obtención de consentimiento informado de ningún paciente para la realización y publicación del presente artículo de revisión.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.