Castor™ (MicroPort®) es una endoprótesis mono-ramificada para sellado parcial en arco. Aunque las instrucciones de uso de Castor™ son para disecciones tipo B, en la práctica real se ha expandido a otras entidades.
El objetivo es analizar la prótesis Castor™ a partir de nuestra experiencia inicial.
MétodosDescripción de prótesis Castor™ y método de implante.
Descripción de 2 casos clínicos.
ResultadosHay varias consideraciones para el adecuado implante de Castor™: introductor 8F Flexor®(Cook) × 110cm para tutorizar la guía de la rama, proyección de trabajo de ostium de subclavia izquierda, maniobras para guías entrelazadas y alineamiento de la rama, control presión arterial para liberación endoprótesis con endoclampaje de cava inferior o estimulación ventricular rápida.
El caso 1 es un varón de 54 años con un seudoaneurisma crónico postraumático (zona 3). El caso 2 es otro varón de 59 años con una disección tipo B subaguda (Tb,E3,M3-) con factores de riesgo (radiológicos/clínicos). En ambos, el implante fue en zona 2 y transfemoral derecho percutáneo.
El postoperatorio inmediato en ambos casos cursó sin complicaciones mayores y la tomografía de control fue satisfactoria.
El seguimiento cursó con buena evolución clínica tanto en caso 1 (3,5 meses) como en caso 2 (un mes).
ConclusionesEn nuestra corta experiencia, y coincidiendo con la literatura, Castor™ es un dispositivo con rama seguro para el sellado parcial del arco, aunque son necesarios más estudios para reforzar los resultados a largo plazo.
Este dispositivo tiene varios pasos que deben ser respetados para un adecuado implante.
Castor™ (MicroPort®) is a single-branched thoracic endograft platform for a partial arch sealing. Even Castor™ instructions for use are for type B aortic dissections, its use in real-world is spreading along other aortic diseases.
The objective is to analize the endograft Castor™ from our initial experience.
MethodsDescription of endograft Castor™ and its implantation.
Description of 2 clinical cases.
ResultsThere are several tips and tricks for an adequate Castor™ implantation: 8F Flexor® (Cook) sheath × 110cm for guiding the traction wire, working projection of the left subclavian artery ostium for delivery, maneuvers for twisted wires and branch alignment, blood pressure control for aortic graft opening with inferior vena cava endoclamping or rapid ventricular pacing.
Case 1 is a 54-year-old male with a chronic post-traumatic pseudoaneurysm at zone 3. Case 2 is a 59-year-old male with a subacute type B aortic dissection (Tb,E3,M3-) with high-risk factors (radiological and clinical). Both Castor™ devices were implanted at zone 2 via right common femoral artery (percutaneously).
Postoperative course was uneventful for major complications and tomography control was satisfactory for both cases.
At follow-up (case 1 with 3,5 months; case 2 with 1 month), the clinical status was fine.
ConclusionsIn our short initial experience, as well as literature experience, Castor™ is a safe single-branched device for arch sealing, even further studies are needed for long-term outcomes.
This device has several steps that should be followed for a succesful implantation.
Castor™ (MicroPort Endovascular, Shanghai, China) es una endoprótesis torácica mono-ramificada cuya rama está integrada en el injerto aórtico permitiendo así aumentar la zona de sellado en arco (zona 2) y la revascularización concomitante de la arteria subclavia izquierda (ASI). Esta opción de rama integrada, prácticamente única en el mercado, evita el riesgo de endoleak tipo III (respecto a las ramas internas o fenestraciones). Aunque las instrucciones de uso de Castor™ son para disecciones tipo B y sellados en zona 2, en la práctica real se ha expandido a otras afecciones (aneurismas, traumatismos), así como se han realizado sellados en zona 0 o 11,2.
La tendencia en general, apoyado por las guías actuales de práctica clínica3, es la revascularización de la ASI cuando se realiza thoracic endovascular aneurysm repair (TEVAR) en zona 2, ya que la incidencia de ictus, daño medular e isquemia del brazo es menor. Hay situaciones que es más forzosa dicha revascularización como en ausencia/oclusión de arteria vertebral derecha, arteria vertebral izquierda (AVI) terminal en arteria cerebelosa posteroinferior, la existencia de bypass coronario permeable con mamaria izquierda o de una fístula arteriovenosa ipsilateral funcionante para diálisis4. En otras circunstancias es más permisiva la no revascularización de la ASI, como en emergencias o inestabilidad hemodinámica por la enfermedad a tratar. La detección de variantes anatómicas de los troncos supraaórticos, y más específicamente de las arterias subclavias y vertebrales es esencial en la planificación correcta de estos procedimientos5.
Existen múltiples formas de revascularización de la ASI. La más clásica es el bypass carótido/subclavio izquierdo con excelentes resultados de permeabilidad6,7 a un año (97-99,5%) y 5 años (98%), aunque con riesgos aproximadamente del 6% para parálisis frénica izquierda, oclusión de AVI, y fuga de quilo (lesión conducto torácico). La transposición subclavio/carotídea, el bypass carótido/axilar izquierdo y el áxilo/axilar cruzado son alternativas de revascularización con cirugía abierta. Alternativamente, disponemos de opciones de revascularización endovascular de ASI, más recientes, y cada una de ellas con sus pros y contras: prótesis fenestrada (customizada o in vitro), fenestración in situ (láser o aguja), prótesis con rama interna (retrógrada) o injerto paralelo (chimenea). Un artículo reciente8 con 2.489 pacientes presenta un menor stroke postoperatorio (2,6 vs. 4,8%) y complicaciones intrahospitalarias (20 vs. 27%) a favor de la revascularización endovascular en TEVAR zona 2.
El objetivo de este trabajo es analizar la prótesis Castor™ a partir de nuestra experiencia inicial.
MétodosSe realiza una descripción de las características de la prótesis Castor™, así como de su método de implante paso a paso con consejos y trucos prácticos. Se describen nuestra experiencia inicial en 2 casos clínicos.
ResultadosCaracterísticas Castor™Anatomía del sistema de liberación y la endoprótesis- 1.
Introductor externo(outer sheath). Tiene cubierta hidrofílica y un perfil de 24F (diámetro externo) (fig. 1a).
Figura 1.a) Sistema de liberación de prótesis Castor™. Porciones: A: introductor externo, B: mango controlador de camisa interna, C: mango controlador de cánula interna, D: cánula interna, E: control del trigger wire. Seguros de control entre las porciones (para solidarizar o independizar movimientos de las porciones): 1, 2 y 3.
b) Componentes de la endoprótesis Castor™. A: rama integrada arteria subclavia izquierda, B: porción proximal aórtica, C: porción distal aórtica, D: hilo con bucles para crimpaje de cada stent, liberación de cada stent controlada por la trigger wire no representada.
c) Porción proximal de endoprótesis y sistema liberación tras retirada de camisa interna. 1: capuchón de rama arteria subclavia izquierda (ASI), 2: nariz del sistema liberación. Flechas largas (trigger wire), flecha corta (sujeción de capuchón rama ASI en trigger wire).
d) Rama ASI. 1: capuchón de rama ASI. Flechas cortas (sujeción de capuchón rama ASI en trigger wire tras retirada de la misma).
- 2.
Camisa interna(inner sheath). Cubre la rama ASI y el injerto aórtico, es un polyester blando para cruzar arco con mayor seguridad y menor perfil.
- A.
Endoprótesis tiene una porción aórtica y una rama ASI integrada, a modo de 2 cabezas «independientes» a nivel proximal. Está formada por Z-stent autoexpandibles (nitinol) con cobertura de woven polyester. Los stent aórticos más proximales son de menor longitud (mayor adaptabilidad). Hay un stent circular de acero1 en la base de la rama ASI, por contra, los 5mm distales de la rama el stent es descubierto (fig. 1b).
- B.
Trigger wire o guía de liberación de níquel-titanio sobre hilo con bucles que atrapan y crimpan la endoprótesis hasta que es retirada, en dicho momento el injerto aórtico se libera de la cánula interna (la cual lleva incorporada la nariz del sistema) (fig. 1c).
- 3.
Un capuchón de polyester envuelve y mantiene crimpada la rama ASI, el cual lleva acoplado a su extremo distal una guía de tracción que permite tensar desde el brazo izquierdo, así como 2 bucles de hilo en su parte proximal que quedan atrapados por el trigger wire aórtico. Por tanto, no se puede liberar la rama ASI hasta que no se haya retirado el trigger wire aórtico. La rama viene plegada con su extremo distal apuesto al extremo proximal aórtico y cubierto por la camisa interna, permitiendo en el momento oportuno encarar el ostium de ASI desde su cara posterior (fig. 1d).
- 4.
Existen varios «seguros» que nos permiten solidarizar los diferentes componentes (fig. 1a).
Radiomarcadores (en forma de 8 y circular) (fig. 2). Su posición respecto a horas reloj, si consideramos las 12h el centro de la rama ASI, serían:
- –
Injerto aórtico proximal: un 8 a las 6h, 2 círculos laterales a las 3 y 9h.
- –
Injerto aórtico distal: un 8 a las 6h y un círculo a las 12h.
- –
Rama ASI: 4 círculos en proximidad al stent de su base en los 4 puntos cardinales, y 2 círculos enfrentados en la zona de stent cubierto distal.
- –
Además, hay un 8 en la camisa interna a las 6h. Solo útil en la orientación más inicial de la prótesis en aorta torácica descendente (ATD), una vez que ya sale la nariz del outer sheath y se vuelve a reintroducir, pierde dicho valor. Cuando se realiza el pull-back de la camisa interna se visualiza como dicho 8 se moviliza caudalmente.
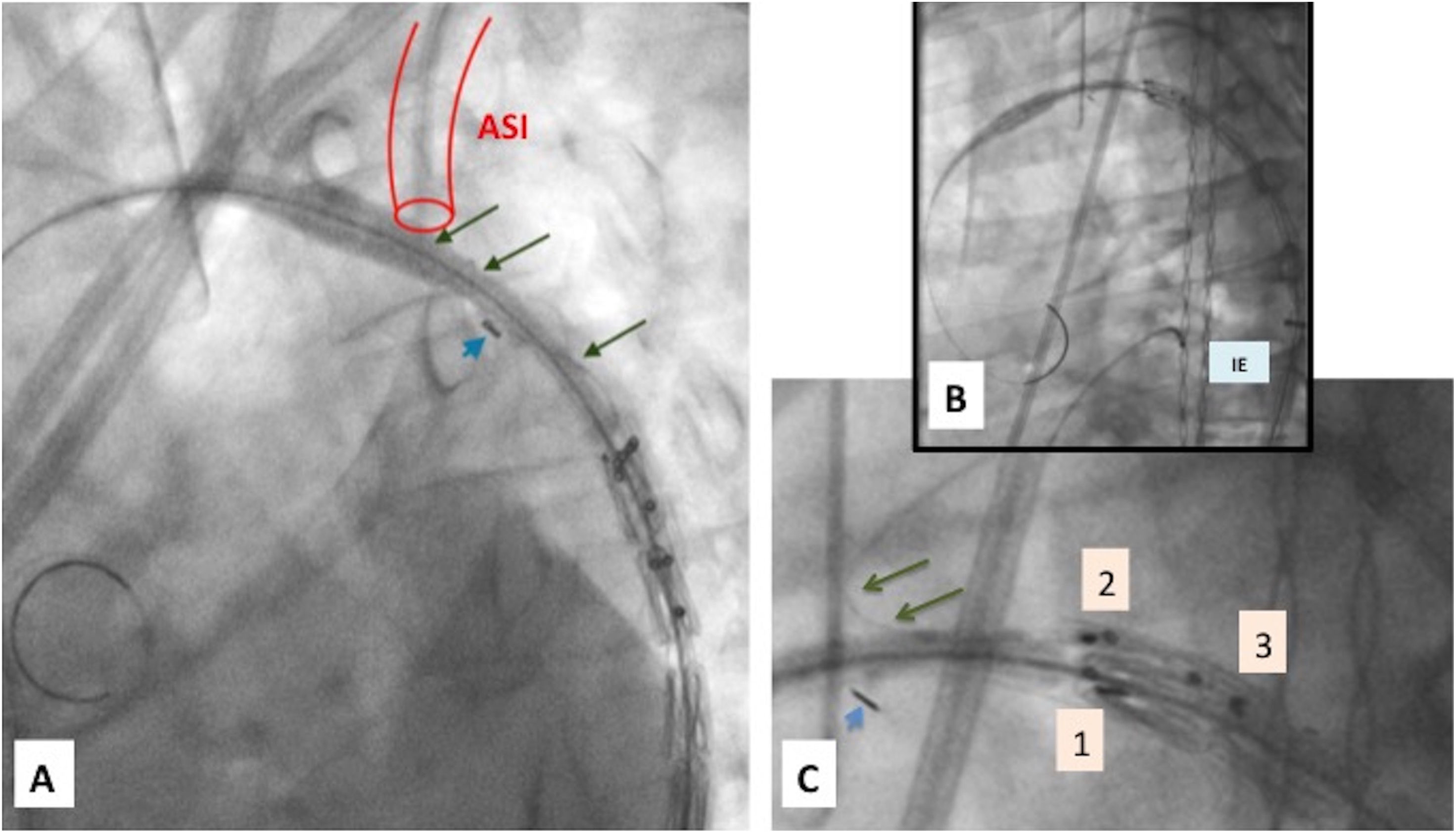
Implante paso a paso (I): A) Guías entrelazadas (2 vueltas) con flechas largas. Radiomarcador de 8 de camisa interna normoposicionado en curvatura menor con flechas cortas. B) Guías no entrelazadas, normoposición radiomarcadores de base de rama. C) Detalle ampliado de imagen B. Guías no entrelazadas con flechas largas. Radiomarcador de 8 de camisa interna normoposicionado en curvatura menor con flechas cortas. 1: radiomarcadores proximales aórticos, 2: radiomarcadores distales de rama de ASI, 3: radiomarcadores basales de rama de ASI.
ASI: arteria subclavia izquierda; IE: introductor externo.
Se describe cómo se nomina la prótesis (Ej. C322610-2003010 sería CD1D2D3-L1L2L3):
- •
C: Castor™.
- •
D1: Diámetro proximal aórtico (mm).
- •
D2: Diámetro distal aórtico (mm).
- •
D3: Diámetro rama ASI (mm). La porción más proximal de la rama mide 2mm más.
- •
L1: Longitud injerto aórtico.
- •
L2: Longitud rama ASI (incluyendo la porción descubierta).
- •
L3: Distancia desde extremo proximal aórtico a cara anterior rama ASI.
Existen múltiples opciones de medidas para adaptación a las diferentes anatomías.
Implante paso a paso: consejos y trucos- 1.
Accesos ecoguiados. Arteria femoral para la endoprótesis (abierta o percutánea); arteria humeral izquierda (abierta o percutánea) para through-and-through (T&T); arteria radial/humeral derecha o femoral contralateral para pigtail; vena femoral.
- 2.
Colocación guías. Aorta ascendente/femoral y T&T húmeral izquierda/femoral. Es crucial en disecciones verificar la posición en verdadera luz en todo el trayecto (intravascular ultrasound [IVUS] vs. angiografías), además de comprobar la no progresión de la disección tras la última tomografía axial computarizada (TAC). Material útil: guía Lunderquist ® 300mm (COOK, Bloomington, IN, EE. UU.), guía Glidewire® blanda 400mm (Terumo Medical Corp., Somerset, New Jersey, EE. UU.), introductor 18-22F × 28-33cm, lazo.
- 3.
Sistema de control de presión arterial. Se utiliza en el momento del despliegue (retirada trigger wire), para asegurar la posición precisa y disminuir el riesgo de pico de pájaro. Las más utilizadas son el rapid ventricular pacing (implica colocar un marcapasos temporal por vena femoral o yugular) o la oclusión de cava inferior con acceso venoso 12-14F y endoclamp con Coda® 46mm (COOK Incorporated, Bloomington, IN, EE.UU.), o Reliant® (Medtronic, Santa Rosa, CA, EE. UU.). Es el momento de hacer un test de normofuncionamiento.
- 4.
Subir Castor™.
- a.
Introducir dispositivo sobre Lunderquist con la rama ASI a las 6h9,10, usando como referencia la guía tracción que cruza a través del introductor 8F Flexor® (COOK Incorporated, Bloomington, IN, EE. UU.) × 110cm con su dilatador que viene desde humeral izquierda. Evitando que se entrecruce y traccionando de la guía ASI (realmente desde un mosquito que se coloca en la guía a ras del dilatador del introductor) según se avanza la CastorTM bajo control escópico. El Flexor® 8F × 90cm desde humeral puede ser útil, pero se suele quedar a nivel de ilíaca externa (menor comodidad). Un operador está dedicado al control de la guía de tracción.
- b.
En proyección de trabajo de ASI, se va progresando el dispositivo hasta 5-10cm distal a la ASI.
- c.
Se verifica que radiomarcador 8 de la camisa interna se ve como una línea en la zona medial de la ATD.
- a.
- 5.
Angiografía. Se puede ajustar la fusión si se dispone de ella. La proyección de trabajo de ASI ya se mantendrá todo el procedimiento.
- 6.
Avanzar dispositivo con camisa interna (fig. 2).
- a.
Tras abrir el seguro 1.°, avanzar el dispositivo solo con la camisa interna11.
- b.
Verificar que la guía de ASI no está entrelazada en el dispositivo (a nivel de cara posterior ASI). Si estuviera entrelazada, recuperar el dispositivo hasta el introductor externo (es ligeramente costoso reintroducirlo), cerrar el seguro 1.°, y girar 360° todo el sistema a favor o en contra de agujas del reloj (tutorizando el giro con la escopia y el movimiento del puerto lateral), abrir seguro 1.° y avanzar con la camisa interna de nuevo. Si a pesar de ello sigue entrelazada, hacer 2 giros de 360° contraria a la dirección que tomamos antes. Si ya no entrelazada, pasar a siguiente paso.
- c.
Verificar en cara posterior ASI normoposición de los radiomarcadores de la base de la rama ASI. Si todos están por encima de la Lunderquist® se puede aceptar, no obstante, si todos los marcadores estuvieran en la misma línea sería la situación de máxima alineación. Si no es así, hacemos la misma maniobra del punto anterior en ATD, pero con pequeños giros de 30-90° para buscar la posición correcta.
- a.
- 7.
Retirar todo el introductor externo.
- 8.
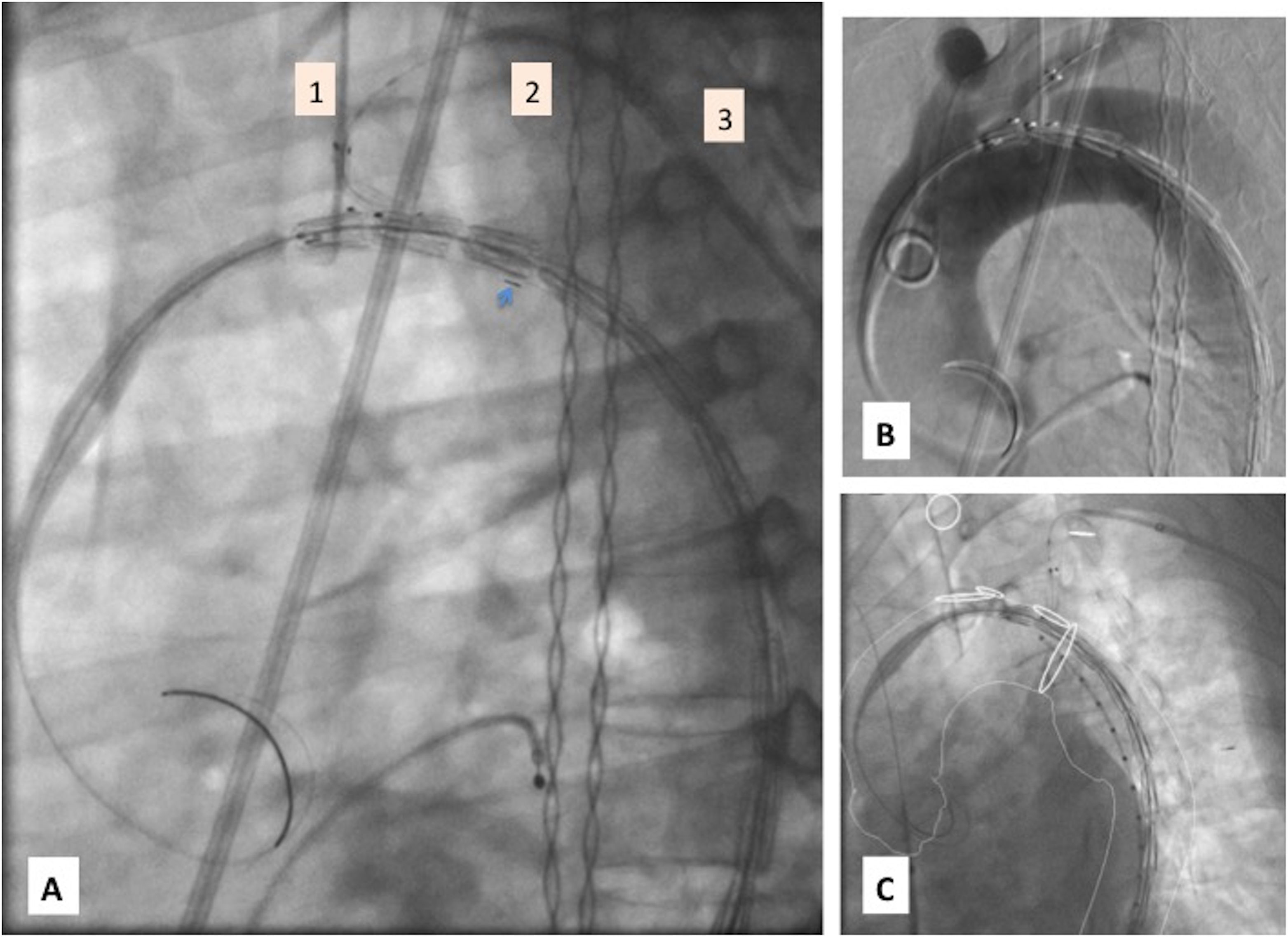
Pull & Through (fig. 3). Tras abrir seguro 2.°, primero se inicia retirada (PULL) de unos 2-4cm de la camisa interna, en dicho momento simultáneamente se sigue con esta maniobra hasta el final mientras se avanza de forma concomitante la prótesis/cánula interna (Through) de forma que la rama va entrando en la ASI y la cabeza aórtica avanza hacia su landing proximal.
Figura 3.Implante paso a paso (II): A) Durante maniobra de pull & through: entrada de rama en la subclavia izquierda y retirada progresiva de camisa interna (radiomarcador de 8 con flecha corta). 1: capuchón de rama de subclavia izquierda, 2: dilatador del Flexor® 8F, 3: introductor Flexor® 8F. B) Marcaje preciso de arteria subclavia izquierda previo a liberación protésica con angiografía. C) Marcaje preciso de arteria subclavia izquierda previo a liberación protésica con fusión.
- 9.
Angiografía ASI por pigtail (fig. 3). Se verifica que la posición del radiomarcador anterior de la base de la rama coincide con la cara anterior de la ASI.
- 10.
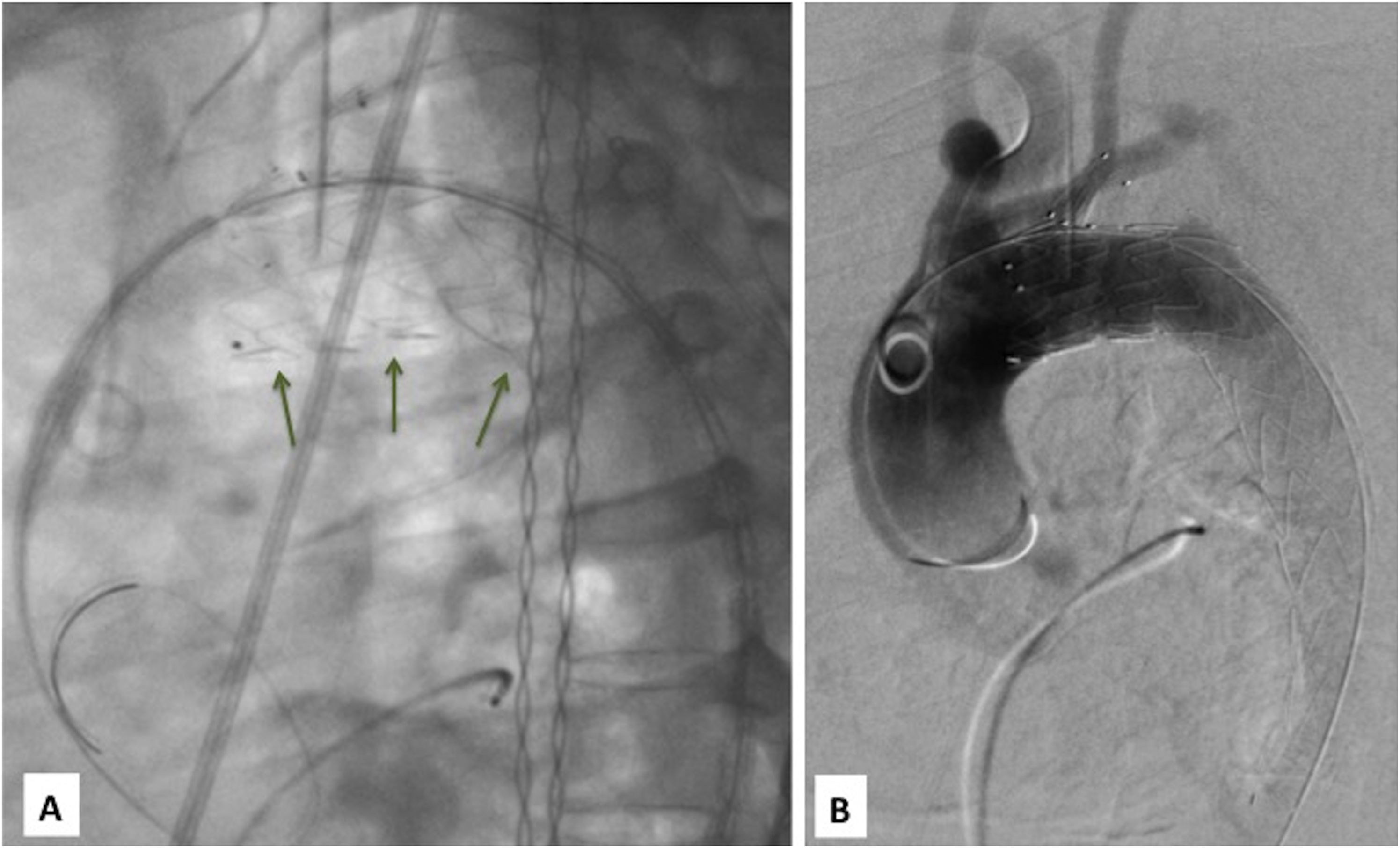
Retirada trigger wire. Bajo hipotensión extrema mediante los sistemas de control antes mencionados, se retira el trigger wire de forma continua y con ello se empieza a expandir toda la porción aórtica de la endoprótesis. Durante este paso se recomienda una ligera tracción de guía de ASI, simultáneamente la Lunderquist® debe estar bien apoyada en curvatura externa (en las disecciones el apoyo en la lamella suele dar una falsa imagen de no apoyo en curvatura externa) (fig. 4).
- 11.
Apertura rama ASI. Se tracciona de la guía para extraer el capuchón. Si se retira el dilatador del Flexor®, saldrá el capuchón por el introductor 8F, manteniendo así el acceso. Existen varias maniobras de bail-out, en caso de dificultad de extraer el capuchón de la rama.
- 12.
Retirada de nariz-cánula interna. Se retira hacia introductor externo, se bloquean seguros y se extrae todo el sistema. Se coloca el introductor de 18-22F que previamente se utilizó.
- 13.
Angiografía control. Verificando correcta expansión rama ASI (por si conviene baloneo o extensión con stent descubierto o cubierto), así como normoposición Castor™ y endofugas (fig. 4).
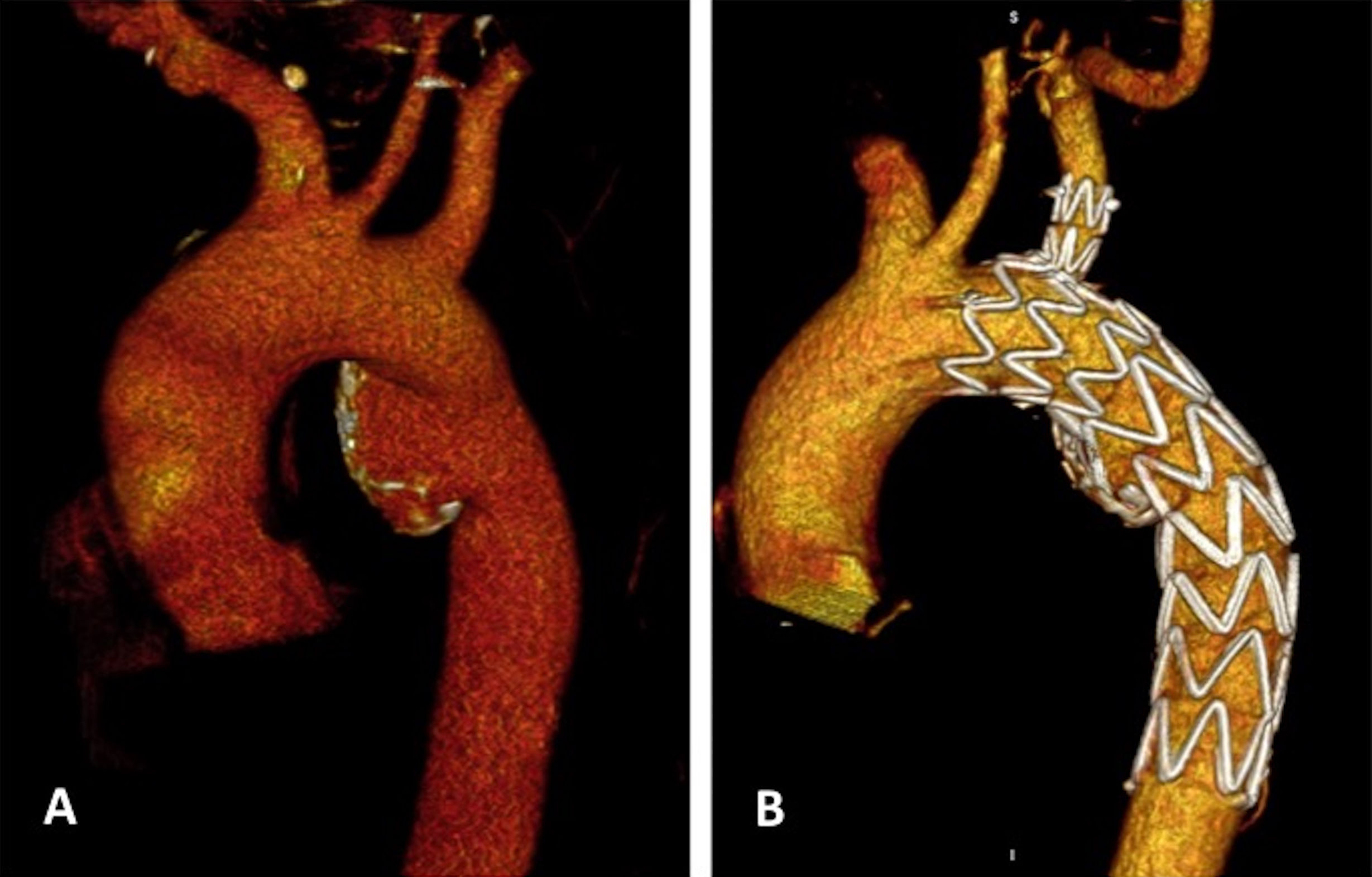
Es un varón de 54 años con un seudoaneurisma crónico postraumático en zona 3, de 32mm de base y 17mm de profundidad (tablas 1 y 2, y fig. 5). Se implantó una Castor™ (C342812-1502510) sin incidencias. Se utilizó un lazo Amplatz GooseNeck® 20mm (ev3) desde la arteria femoral a nivel de la aorta infrarrenal para el T&T. Se realizaron 2 maniobras de recolocación del dispositivo por guías entrelazadas. El postoperatorio inmediato clínico y radiológico (TAC) fue favorable. Seguimiento clínico a 3,5 meses sin incidencias.
Casos clínicos: características clínicas y anatómicas vasculares
| Caso 1 | Caso 2 | |
|---|---|---|
| Edad | 54 años | 59 años |
| Sexo | Varón | Varón |
| Antecedentes interés | No | Cocaína, hipertensión, obesidad |
| Enfermedad aórtica | Seudoaneurisma crónico z3 (trauma) | Disección tipo B subaguda (Tb, E3, M3-) |
| Indicación | Factores alto riesgo (sacular) | Factores alto riesgo (radiológicos/clínicos) |
| Medidas aorta | Base 32mm, profundidad 17mm, diámetro total aórtico 39mm | Puerta entrada proximal >1cm, diámetro total 36mm |
| Arco | Tipo 1. Bovino | Tipo 2. Bovino |
| Arterias vertebrales | Codominancia, origen normal | Codominancia, origen normal |
| Otras consideraciones | No | Suboclusión hipogástrica izquierdaHipoperfusión renal derecha (dinámica) |
z3: zona 3.
Casos clínicos: estrategia de implante
| Caso 1 | Caso 2 | |
|---|---|---|
| Anestesia | General | General |
| Drenaje LCR | No | Sí |
| PESS/PEM monitor | No | Sí |
| Acceso arterial ppal | AFC dcha pc | AFC dcha pc |
| Acceso arterial adicional | AFC izqda pc/humeral izqda pc | AFC izquierda pc/humeral izqda pc/axilar dcha pc |
| Acceso venoso adicional | VFC dcha pc | VFC izqda pc |
| Control presión arterial | Endoclamp VCI (Coda® 4mm) | Rapid ventricular pacing |
| Proximal landing zone | Zona 2 | Zona 2 |
| Proyección trabajo ASI | OAI 53 CAU 10 | OAI 56 CAU 3 |
| Endoprótesis adicionales | No | Distalmente ZTA-P-30-155 (Cook®) |
| Distal landing zone | 120mm por encima TC | 30mm por encima TC |
| IVUS | No | Sí |
| FUSION | Sí | Sí |
AFC: arteria femoral común; ASI: arteria subclavia izquierda; CAU: caudal; dcha: derecha; IVUS: intravascular ultrasound; izqda.: izquierda; LCR: líquido cefalorraquídeo; OAI: oblicua anterior izquierda; pc: percutáneo; PESS/PEM: potenciales evocados somatosensoriales/potenciales evocados motores; ppal: principal; TC: tronco celíaco; VCI: vena cava inferior; VFC: vena femoral común.
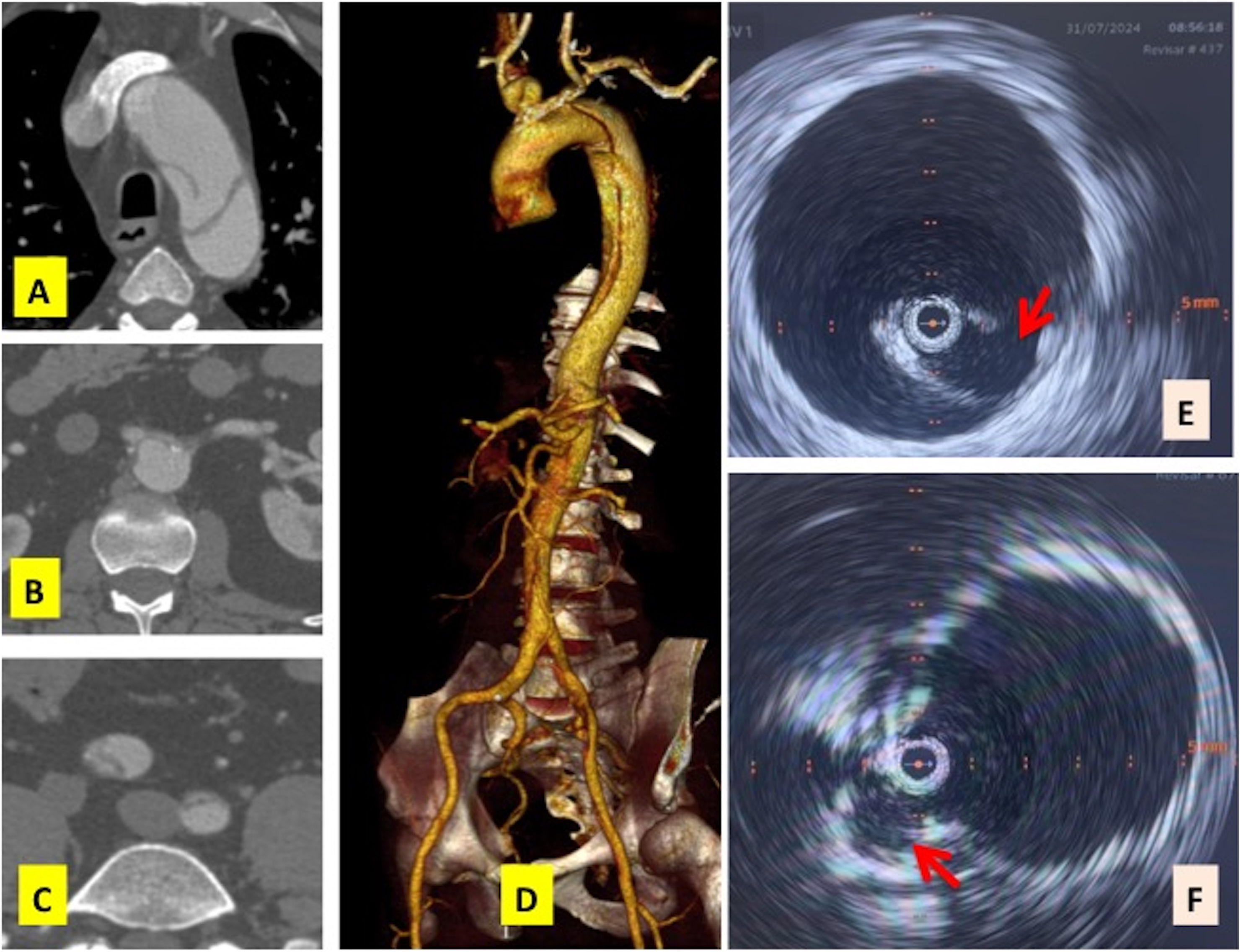
Es un varón de 59 años con una disección tipo B subaguda3 (Tb,E3,M3-) con factores de riesgo radiológicos (puerta de entrada proximal y> 10mm) y clínicos (hipertensión arterial tratada con 5 fármacos) (tablas 1 y 2, y fig. 6). Se implantó una Castor™ (C363010-2002510) sin incidencias. Se utilizó un lazo Indy® (COOK Incorporated, Bloomington, IN, EE. UU.) desde la humeral izquierda a nivel de la aorta ascendente para el T&T. Las guías no se entrelazaron, aunque sí que hubo que movilizar el dispositivo para ajustar la posición de la rama. Hubo una mejoría significativa de la verdadera luz a nivel yuxtarrenal tras el procedimiento. El postoperatorio inmediato radiológico (TAC) fue favorable y a nivel clínico presentó cefalea (posdrenaje espinal) y una fístula arteriovenosa humeral izquierda pospunción asintomática (manejo conservador). En el seguimiento a un mes, el paciente estaba asintomático.
Caso clínico 2. Tomografía axial computarizada preoperatoria: A) zona 3, B) zona 8, colapso de verdadera luz, C) zona 10, disección de ambas arterias ilíacas comunes), D) volume rendering 3D. IVUS: intravascular ultrasound, E) puerta de entrada en zona 3, previo a implante Castor™, F) rama de arteria subclavia izquierda postimplante Castor™.
La experiencia en nuestro centro con Castor™, aunque pequeña y reciente, y por las bondades de la prótesis, nos hace prever un salto cualitativo hacia este tipo de dispositivo para el TEVAR en zona 2, es decir, hacia un cambio de paradigma que puede ir dejando atrás progresivamente la revascularización extraanatómica con bypass/transposición carótido/subclavia. La gran experiencia en China alienta a resultados muy prometedores a largo plazo, si bien la disponibilidad no inmediata (custom-made) y el coste de la endoprótesis (que puede ser 3-4 veces superior a un módulo convencional) en nuestro medio actualmente genera cierta dificultad.
Respecto a las complicaciones menores observadas en los casos presentados, cabe destacar que la fístula arteriovenosa humeral podría quizás haberse evitado con una punción longitudinal ecoguiada de la arteria humeral, en lugar de transversal, o alternativamente, con un acceso abierto. Por otro lado, la cefalea pospunción se hubiera eliminado con una estrategia de drenaje espinal terapéutico. Aunque controvertido todavía, la tendencia actual se va alejando del drenaje espinal profiláctico, si bien conviene adecuar la decisión a las condiciones de cada centro y cada paciente (riesgo de isquemia medular)12.
Respecto a la imagen preoperatoria, además de los parámetros habituales en TEVAR (longitud/diámetro/calcio-trombo en landing proximal/distal, tortuosidad aórtica, accesos) es primordial la ASI (diámetro, distancia ostium ASI-AVI, angulación). Los datos radiológicos objetivo en la TAC de control inicial son la ausencia de endofugas (en las disecciones sería permisible la endofuga retrógrada) y la permeabilidad de la rama, así como la ausencia de efecto pico de pájaro significativo en el sellado proximal, todos presentes en ambos casos.
La puerta entrada en la disección tipo B se ubica en zona 3 en el 71% de los casos, el 18,9% tienen un arco tipo III, la posición horaria media de ASI es 12,15h (rango intercuartílico: 11,16-1,16) y la posición media de ASI respecto a carótida izquierda es de −10min10.
El uso de Castor™ en disección aórtica tipo B (aguda/subaguda), según un reciente consenso de expertos9 de China, lugar de mayor experiencia en Castor™, se recomienda especialmente cuando la distancia del ostium ASI a la puerta de entrada es <15mm o si hay existencia de disección retrógrada hacia la ASI. La sobredimensión proximal recomendada es 0-5%9, ya que la rama ASI es un anclaje añadido, de hecho, la capacidad de fijación de Castor™ respecto a TEVAR recto parece ser 3 veces mayor10.
En la literatura para Castor™ se aprecia dificultad de análisis por heterogeneidad de criterios, fundamentalmente en patologías y su temporalidad como en concepto de sellado proximal. No obstante, el metaanálisis de Yao et al. (2022) con 415 casos4 en disección tipo B, con distancia de puerta de entrada a ASI<15mm, puede facilitar una visión global. Los resultados a 30 días son: éxito técnico 97,5%, permeabilidad intraoperatoria ASI 99,5%, endofuga tipo I precoz 1,6%, mortalidad 0,96%, reintervención precoz 0,9%, stroke perioperatorio 0%. La supervivencia a un año es del 99,7% y la permeabilidad de ASI a 2 años es del 95,2%. Cabe destacar que en el estudio multicéntrico de Zaiping et al.11 con 73 casos (71% en fase aguda), se añadieron stent en ASI durante el procedimiento en 6 pacientes, así como el 7,3% de las ramas ASI se ocluyeron a 61 meses de seguimiento. Por otro lado, hay experiencias en disección tipo B aguda/subaguda7 y seguimiento medio de 69 meses con permeabilidad de la ASI de 100%, así como de trombosis completa de falsa luz (al menos en la parte más proximal de la ATD).
Hay algunos aspectos a reseñar de especial importancia durante el implante Castor™.
El perfil externo de 24F es un límite para ciertos pacientes por diámetros, aunque además hay que valorar calcificaciones y tortuosidades ilíacas o aórticas para determinar el grado de complejidad del acceso para su navegación. En esta prótesis es necesario una orientación precisa, ello hace, que en los accesos complejos, es posible no llegar a conseguir que obedezca el dispositivo en la ATD a las modificaciones de posición que se ordenan desde el lugar de acceso.
Si no se consigue deshacer las guías entrelazadas o alinear adecuadamente la rama, quizás la mejor opción es retirar la prótesis y decidir si se vuelve a intentar su introducción o se aborta el procedimiento. Una malposición protésica puede generar endofuga tipo I o problemas en la perfusión ASI, con soluciones más o menos complejas endovasculares y/o abiertas.
En angulación severa de la ASI proximal, se podría avanzar más proximal la prótesis, retirar la camisa interna superando la rama ASI y buscar una entrada de esta desde aorta ascendente/arco en vez desde ATD.
Para optimizar al máximo la precisión del implante, es útil un control rápido de gasto cardíaco y tensión arterial, por ello el uso del clampaje de vena cava inferior o del rapid ventricular pacing para obtener tensiones arteriales sistólicas de 30-60mmHg con inducción y reversión rápidas. No obstante, en el caso 2, no funcionó la oclusión de cava, generando desaturación fundamentalmente; se cambió a rapid ventricular pacing que funcionó adecuadamente. La colocación de marcapasos temporales obliga a la realización de una ecocardiografía posteriormente, ya que ocasionalmente se producen perforaciones del ventrículo derecho y taponamientos que requieren pericardiocentesis o incluso abordaje quirúrgico. De forma alternativa, se han descrito otras técnicas de control rápido como Munich Valsalva Implantation Technique (MuVIT)13 o el uso de adenosina. Algunos grupos de alta experiencia también realizan simple control farmacológico antihipertensivo2 con objetivo de presión sistólica <90mmHg, aunque quizás no recomendable como experiencia inicial.
El 2,5-8,5% de la población tiene un nacimiento anómalo de la AVI en el arco, entre carótida izquierda y ASI5. Su oclusión terapéutica con TEVAR zona 2, puede tener consecuencias nefastas (infarto fosa posterior o daño medular) en ciertas circunstancias, por eso, su preservación selectiva o sistemática las previene. Luo et al.14 describen 25 pacientes tratados con Castor™ con fenestración in vitro (physician modified) proximal a la rama con permeabilidades del 100% en seguimiento medio a 28,5 meses. La tendencia en la evolución de su experiencia ha ido hacia reforzar la fenestración con anillo metálico, así como a evitar el stent de inicio a través de la fenestración. Tuvieron 2 casos de endofuga por la fenestración y se resolvió mediante implante de stent o de forma espontánea. Los resultados parecen prometedores, pero se precisa seguimiento a largo plazo y mayor casuística.
Aunque se sale del objetivo del trabajo, cabe mencionar que hay grupos con experiencias iniciales de sellados en zona 0 y 11,2 con Castor™, en combinación con revascularizaciones extraanatómicas de troncos supraaórticos y/o fenestraciones de la endoprótesis ya bien sean in situ o in vitro (physician modified), ampliando así el abanico de posibilidades terapéuticas.
En 2021, más de 7000 Castor™ habían sido implantadas en el mundo4, aunque posiblemente esta cifra haya sido ya triplicada en 2024. No obstante, hay otros dispositivos de una rama para TEVAR en zona 215. Valiant Mona left subclavian artery (Medtronic Inc, Santa Rosa, CA, EE. UU.) y Gore TAG Thoracic Branch Endoprosthesis (TBE, WL Gore, Flagstaff, AZ, EE. UU.) son dispositivos con una rama interna retrógrada que viene precargada con guía. Precisan una rama puente para conectar la rama interna con ASI. Ambos son off-the-shelf, ventaja significativa de cara a disponibilidad, aunque solo disponible el último en España recientemente. En una línea similar, Terumo y Cook tiene la opción de ramas retrógradas como productos Custom Made Device. Todos estos dispositivos de ramas internas pueden tener riesgo de endofuga IIIc, no posible en Castor™.
Actualmente la opción quirúrgica abierta pasa a un segundo plano en el tratamiento de la aorta torácica descendente puesto que el tratamiento endovascular es la primera elección3, excepto en circunstancias seleccionadas (conectivopatías, infecciones, anatomía desfavorable).
ConclusionesEn nuestra corta experiencia, y coincidiendo con la literatura, Castor™ es un dispositivo con rama seguro para el sellado parcial del arco, aunque más estudios siguen siendo necesarios para reforzar los resultados a largo plazo.
Este dispositivo tiene varios pasos que deben ser respetados para un adecuado implante y evitar catástrofes con soluciones potencialmente complejas o con necesidad de conversión a cirugía abierta.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Consideraciones éticasSe obtuvo el consentimiento informado de los pacientes por escrito para la publicación del artículo.
A todo el equipo de enfermería (quirófano, reanimación, sala de hospitalización), de perfusión, de anestesia, de neurofisiología y de cirugía cardiovascular de nuestro centro, por la dedicación y el esfuerzo que realizan a diario en la atención de la patología aórtica compleja.