El síndrome aórtico agudo es una entidad poco frecuente con una elevada morbimortalidad en la que el diagnóstico y tratamiento precoces son fundamentales para mejorar el pronóstico. Dentro de este síndrome se encuadran la úlcera penetrante, el hematoma intramural y la disección aórtica. De todas estas, la más frecuente es la disección aórtica. La clínica típica de este síndrome es el dolor torácico de carácter lacerante, pudiendo presentar otros muchos síntomas. Se diagnostica mediante diversas pruebas de imagen como ecocardiograma (transtorácico o transesofágico), tomografía axial computarizada y resonancia magnética. Se trata de una urgencia médica que en la mayoría de los casos va a precisar tratamiento quirúrgico.
Acute aortic syndrome is a rare condition with a high morbidity and mortality rate, in which an early diagnosis and treatment are essential in order to improve its prognosis. Within the features of this syndrome can be found, the penetrating ulcer, intramural hematoma, and with aortic dissection being one of the most common features. The typical clinical manifestation of this syndrome is the stabbing chest pain, with the possibility of more symptoms being present. It is diagnosed using diagnostic imaging techniques, such as echocardiogram (transthoracic and/or transesophageal), computerized axial tomography and magnetic resonance. It is treated as a medical emergency, which in the majority of cases might require surgical treatment.
El síndrome aórtico agudo (SAA) como su propio nombre indica es un cuadro sindrómico. Dicho síndrome engloba 3 enfermedades que representan a un grupo heterogéneo de pacientes con un perfil clínico similar. Entre ellos se encuentra la úlcera penetrante (UP), el hematoma intramural (HI) y la disección aórtica. Recientemente se ha hablado de una cuarta entidad que sería la disección aórtica (DA) incompleta. Esta última implica la laceración de la pared aórtica sin afectación de la capa media.
Una característica básica del SAA es su carácter dinámico, es decir, entre ellas pueden evolucionar hacia una forma u otra, pudiendo provocar la rotura de la pared aórtica que puede a su vez estar contenida o no1.
El SAA es la enfermedad más grave que pueden presentar los pacientes que comienzan con dolor torácico. Por este motivo el reconocimiento y tratamiento precoces son de vital importancia. Está demostrado que la demora en el diagnóstico y tratamiento condiciona el pronóstico2,3.
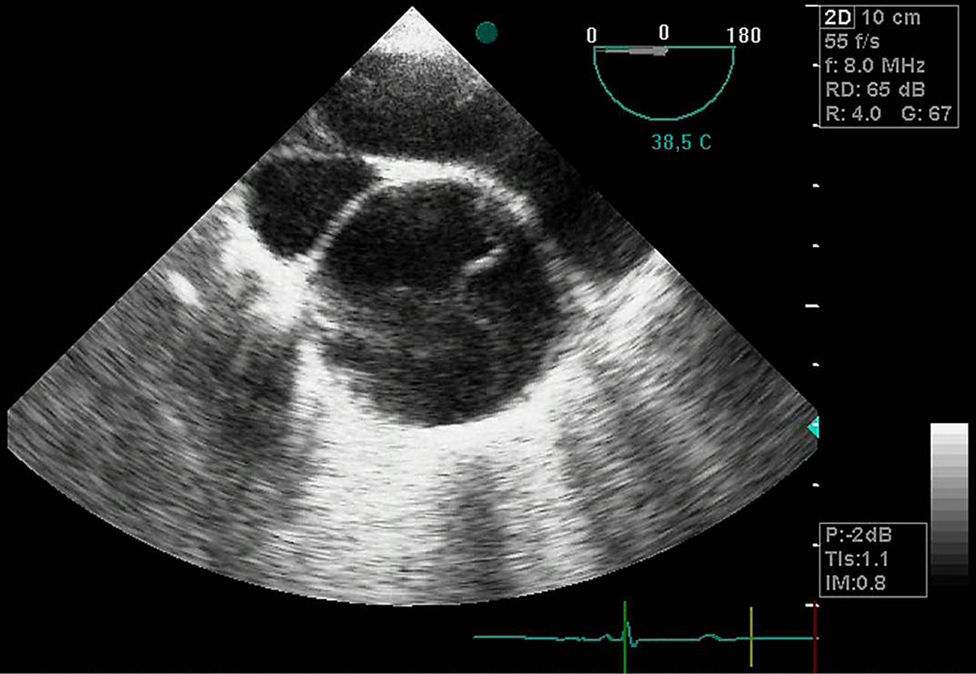
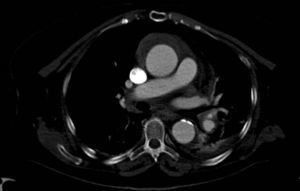
Cuadros clínicosHematoma intramuralSe trata de un hematoma que afecta a la pared arterial (fig. 1). También se conoce como disección aórtica sin desgarro intimal. La luz falsa generalmente se origina por la rotura de un vasa vasorum de la capa media de la pared aórtica. En este caso, 2 mecanismos han sido descritos como responsables: el primero, la rotura espontánea y el segundo, la rotura inducida por una UP aterosclerótica (UPA)3. La presencia de úlcera o no en las pruebas de imagen tiene importantes implicaciones pronósticas con elevada probabilidad de progresión si se realiza solo tratamiento médico3,4.
A efectos prácticos, el HI es considerado el precursor de la DA3. En diferentes series de pacientes con HI estudiados, estos representaron el 5-20% de los pacientes con síntomas coincidentes con DA5–7.
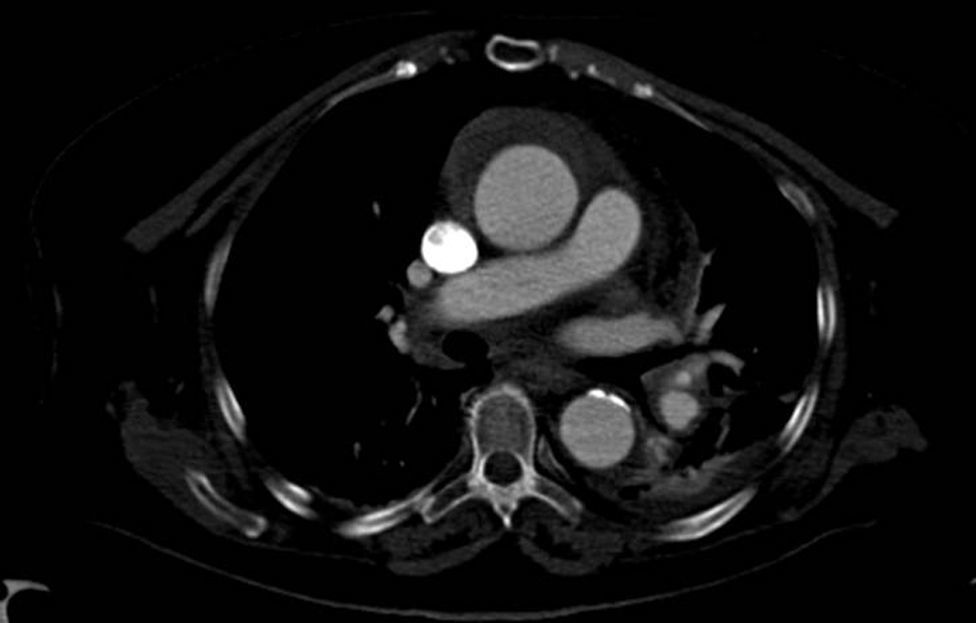
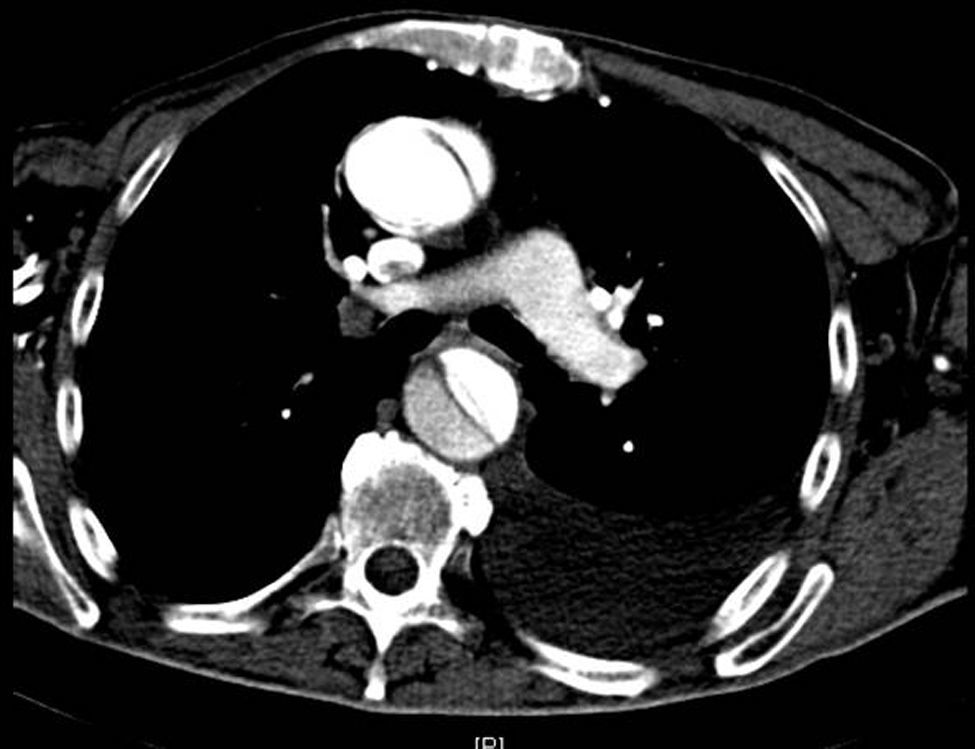
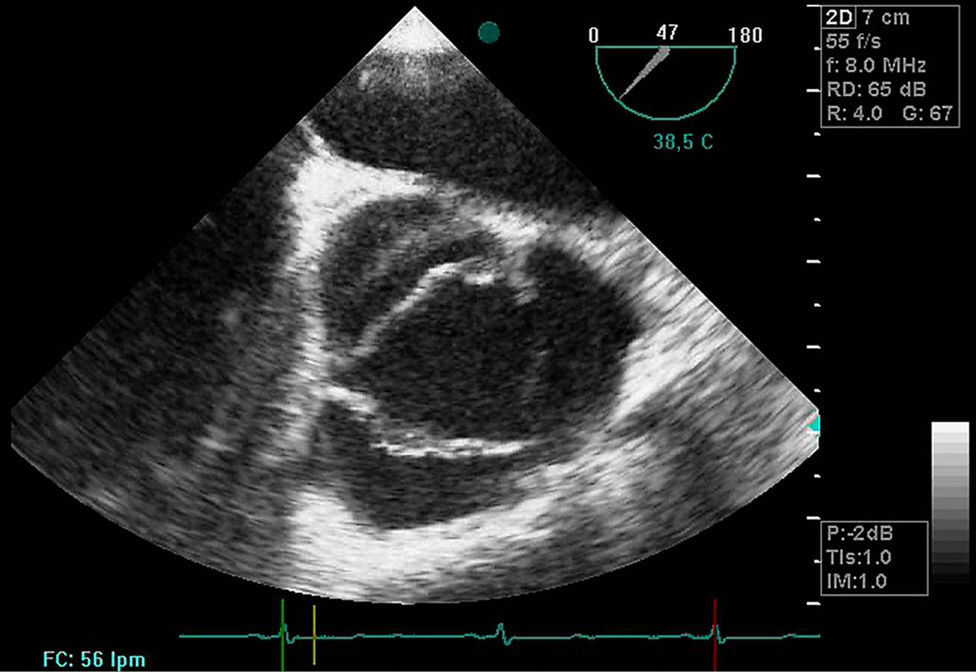
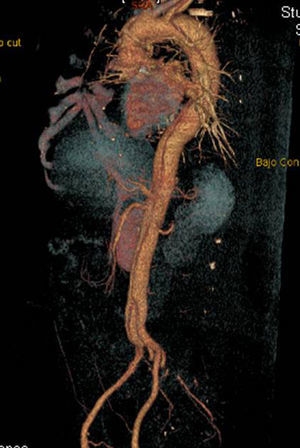
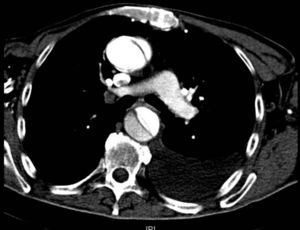
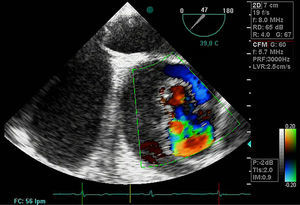
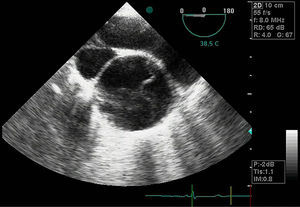
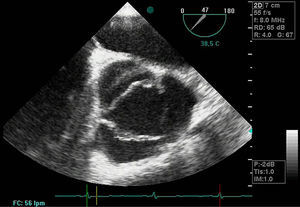
Disección aórticaEs la disrupción de la capa media de la pared aórtica con sangrado hacia dentro y a lo largo de la pared (fig. 2). Esto genera, como consecuencia, la separación de las capas parietales (fig. 3). Quedan así 2 luces, una falsa y una verdadera, separadas por un «flap» intimal (figs. 4 y 5). Debido a la presión arterial se puede romper la íntima distalmente, reconduciendo el flujo a la luz verdadera, o romper la adventicia, provocando hemorragia o hematoma periaórtico. Otro fenómeno evolutivo es la trombosis de la luz falsa a medida que pasa el tiempo en función de las circunstancias, como es en el caso de la corrección de la puerta de entrada en el procedimiento quirúrgico o el correcto control del doble producto. De dicha rotura se derivan diferentes complicaciones causadas por problemas fundamentalmente obstructivos, por el flap, o de déficit de perfusión. En la mayoría de los casos (60-90%) esta rotura (puerta de entrada) es visible y se puede diagnosticar mediante las pruebas de imagen, como veremos más adelante (fig. 4).
De todas las lesiones englobadas dentro del SAA es con diferencia la menos frecuente (5-10% de los casos según las series). Se trata de una lesión arteriosclerosa con ulceración que penetra en la lámina elástica interna y puede provocar la formación de hematomas en la capa media de la pared. Puede, así mismo, evolucionar hacia cualquiera de las otras formas de SAA. Guarda una importante relación con los factores de riesgo cardiovascular, más marcada que en las otras 2 entidades clínicas; es más frecuente en varones, personas mayores de 65 años y en aquellos que presentan arteriosclerosis difusa. La localización más frecuente es la aorta descendente (90%) y en ello influyen como determinantes los factores de riesgo cardiovascular.
En su proceso evolutivo, con frecuencia da lugar al desarrollo de aneurismas saculares o fusiformes. La aparición de seudoaneurisma aórtico llega a estar presente hasta en el 25% de los casos, y un 8% va a presentar rotura aórtica8.
ClasificaciónExisten diferentes clasificaciones que atienden a diversos criterios.
1) Según el tiempo de evolución desde la aparición de los síntomas se clasifica en:
Aguda: menos de 2 semanas del inicio del dolor
Subaguda: entre 2 y 6 semanas desde el inicio del dolor
Crónica: más de 6 semanas
2) Según la localización de la afectación tendremos las clasificaciones anatómicas.
Se utilizan 2 clasificaciones y tiene una gran importancia porque a partir de ellas se determina el tratamiento y la estrategia quirúrgica a seguir.
Clasificación de DeBakey
Tipo I: Se origina en aorta ascendente y se propaga distalmente, al menos hasta el arco, y típicamente a la aorta descendente (distal a la subclavia izquierda). El tratamiento recomendado es el quirúrgico.
Tipo II: Se origina en aorta ascendente y se limita a esta. El tratamiento recomendado también es el quirúrgico.
Tipo III: Se origina en aorta descendente y se propaga habitualmente de forma distal. Pero puede también progresar de forma proximal hacia aorta ascendente (disección retrógrada). Tratamiento quirúrgico usualmente no recomendado.
Tipo IIIa: Limitada a aorta descendente torácica
Tipo IIIb: Extendida a aorta abdominal
Clasificación de Standford
Esta clasificación divide la disección aórtica en aquellas que afectan a la aorta ascendente con independencia de la localización de la puerta de entrada (tipo A, con indicación de cirugía urgente) y las que no afectan a la aorta ascendente (tipo B, tratamiento inicial no quirúrgico). La disección del arco sin afectación de la aorta ascendente se clasifica como tipo B.
EpidemiologíaEn España, basándonos en los datos del Registro Español del Síndrome Aórtico Agudo (RESA), se estima que el SAA tiene una incidencia de 20-40 casos/millón de habitantes/año, siendo más prevalente en varones (70%)9. Dentro de la distribución según enfermedades vemos que lo más frecuente es la DA (80%), seguido del HI (15%) y finalmente la UPA que es poco frecuente (5%). Respecto a la localización, el 68% de las lesiones afectan a la aorta ascendente (tipo A) y el 32% a la aorta descendente (tipo B).
Si analizamos la información de otras bases de datos como la del Registro Internacional de Disección Aórtica (IRAD) de 1.010 pacientes estudiados con SAA, el 5,7% presentaron un HI. Además, entre los 51 pacientes con solo HI en el momento del diagnóstico solo en 8 (16%) este progresó a disección, valorado mediante estudios de imagen10,11.
En relación con los factores de riesgo cardiovascular, se ha visto que el HI se asoció con hipertensión de larga evolución. En un metaanálisis de 143 casos reportados, aproximadamente la mitad presentaban hipertensión arterial7,10,11.
ClínicaDesde el punto de vista clínico existen muchas similitudes entre estas 3 entidades clínicas; si bien es cierto que hay algunos datos identificadores o característicos en cada una de ellas. En el caso de la DA, la clínica predominante es de dolor torácico agudo descrito por el paciente como «desgarrador», irradiado a espalda si la disección se origina por debajo de la subclavia izquierda (tipo B) y retroesternal en el caso de que esté en la aorta ascendente o cayado (tipo A)12,13.
Los pacientes con HI tienen con más frecuencia lesiones de tipo B que los pacientes con DA, así en el registro IRAD el 60 frente al 35% en el examen IRAD10.
El hecho de que el dolor sea migratorio es una característica variable que puede llegar al 50% de los casos. También es una característica variable que el dolor puede ceder para reaparecer con mayor intensidad. Estos 2 aspectos añaden complejidad en el momento del diagnóstico. La ausencia de dolor en el SAA es un hecho muy infrecuente. Así, según datos del registro IRAD este no estuvo presente solo en el 6,4% de los casos14. Al margen del dolor, existen otras manifestaciones clínicas menos frecuentes.
A) La clínica neurológica es relativamente frecuente y añade severidad al cuadro. Las causas de estas son variadas y entre ellas están: 1) alteraciones vasculares (flujo cerebral reducido y activación de barorreceptores aórticos), 2) neurológicas propiamente (respuesta vasovagal al dolor) y 3) hipovolemia que genera hipotensión (sangrado periaórtico). En las lesiones tipo A, en torno al 15% de los pacientes presentan síntomas neurológicos mientras que en el contexto del B es mucho menos frecuente (6%) según datos del RESA9.
Otra de las manifestaciones neurológicas es el síncope, que igualmente es más frecuente en los pacientes con SAA que presentan lesiones tipo A. La hipertensión arterial, como enfermedad concomitante o como consecuencia del dolor, es más frecuente en las lesiones tipo B (31,3 frente al 63%; p<0,001). Por el contrario, la hipotensión/shock y la insuficiencia cardiaca congestiva lo son en los SAA de tipo A.
B) Clínica cardiológica. La insuficiencia aórtica (IAo) aguda es la complicación cardiaca más frecuente en las lesiones tipo A; está presente en el 40-75% de los casos. Los mecanismos que explican su aparición son 1) el prolapso del flap intimal hacia el plano valvular en la diástole, 2) la dilatación aguda de la raíz aórtica como consecuencia de la progresión de la luz falsa y 3) la disección de la raíz que condiciona la desinserción de los velos valvulares15.
Otra de las manifestaciones cardiológicas son los fenómenos isquémicos por afectación directa de las arterias coronarias dentro del proceso de la disección aórtica o en el contexto de fenómenos dinámicos por obstrucción de la luz por el flap. Esto va a generar alteraciones electrocardiográficas que se presentarán en forma de isquemia (15-20% de los casos) o infarto (7%). Este hecho también puede complicar el diagnóstico diferencial en los pacientes con dolor torácico, así como su manejo.
El derrame pericárdico y taponamiento cardiaco son consecuencia del sangrado o la rotura de la pared al saco pericárdico. También en los pacientes con sangrado se puede observar la presencia de hemotórax. Todas estas manifestaciones pueden condicionar el desarrollo de insuficiencia cardiaca y shock hasta en un 5% de los pacientes.
C) Déficits de perfusión e isquemia de órganos. Dentro de ellos se engloban un gran número de manifestaciones cuya interpretación es de fácil razonamiento. Bien sea como consecuencia de una obstrucción dinámica por el flap intimal o bien por oclusión estática debida a la propia disección o el hematoma. En cualquiera de los casos se va a generar una disminución en el flujo sanguíneo de distintos órganos y tejidos. Como consecuencia, ello dará lugar a disfunción de los mismos. Dentro de las pruebas diagnósticas hay que tener en consideración que muchas no se alterarán hasta pasadas unas horas, como por ejemplo los marcadores bioquímicos en el caso de la isquemia mesentérica o renal. De todas estas manifestaciones posibles las más comunes son entre otras:
Gastrointestinales. La isquemia mesentérica es la más frecuente de las complicaciones gastrointestinales y la causa de muerte más frecuente en la disección aórtica tipo B. La clínica que produce es poco específica y se caracteriza por un dolor abdominal intenso, sin hallazgos en las pruebas diagnósticas. Los marcadores bioquímicos de isquemia, como señalábamos, se elevan tardíamente por lo que es importante la sospecha diagnóstica para poder descartar este cuadro clínico. Otras manifestaciones digestivas, como puede ser la hemorragia, son excepcionales y se acompañan de una elevada morbimortalidad; son causadas por fístulas aortoesofágicas o aortoentéricas a nivel del intestino delgado proximal.
Isquemia periférica. Déficits isquémicos agudos en extremidades, fundamentalmente en los miembros inferiores. Esta complicación es típica de la DA. Se acompaña de disminución o ausencia de pulsos periféricos, dolor y déficits neurológicos. En el caso de los pacientes con SAA tipo A este se ha cifrado en 19-30% y en el tipo B en 9-21%15–17.
En el caso de los SAA con afectación de troncos braquiocefálicos son típicas las diferencias de presión entre extremidades superiores y, en el caso de sospecha de SAA, es obligado su registro. Así, en estos casos es frecuente observar diferencias de presión mayores a 20mmHg (fig. 6).
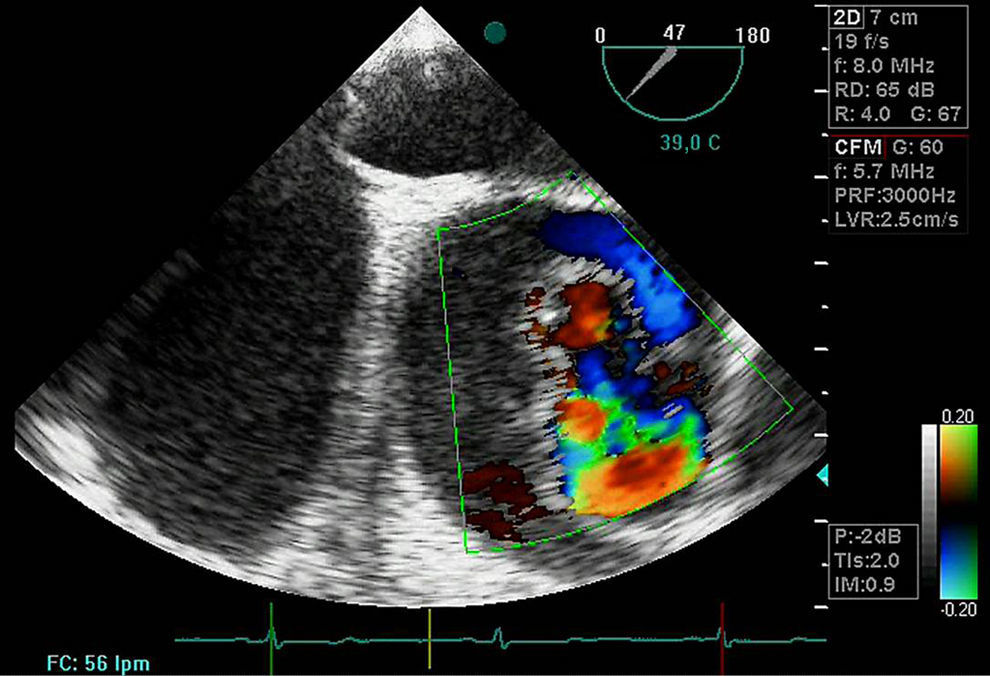
DiagnósticoPruebas diagnósticasEcocardiograma transesofágico. Son numerosos los grupos de trabajo que consideran la ecografía como la primera de las pruebas diagnósticas a realizar por su disponibilidad, baja agresividad y coste. La ecocardiografía transesofágica (ETE) nos aporta una gran cantidad de información como es la localización del desgarro intimal y, por lo tanto, su clasificación: la presencia de hematoma asociado, la coexistencia de alteraciones valvulares aórticas, la presencia de derrame pericárdico sugestivo de complicación por sangrado y la afectación de troncos supraórticos entre otros (figs. 4–6). Es una prueba especialmente útil en pacientes inestables18. Obviamente, esta exploración debe ser realizada por ecocardiografistas expertos, por la complejidad de la exploración y sus implicaciones en el manejo terapéutico.
El doppler color ofrece una elevada sensibilidad y especificidad para la detección de IAo. La IAo llega a estar presente en el 52% de los pacientes con disección tipo I y en el 64% de los pacientes con disección tipo II19. El mecanismo que genera la IAo puede ser funcional, no solo por la dilatación anular asociada en los casos de enfermedad aneurismática de la aorta ascendente sino por prolapso de la íntima de la aorta hacia la cavidad ventricular.
La sensibilidad y especificidad así como la capacidad predictiva diagnóstica de la ETE han sido ampliamente analizadas en el contexto de la DA torácica. En las principales series publicadas, la sensibilidad de la ETE se estima en el 97 a 99% mientras que la especificidad es mucho más baja, con cifras de 77-85%. Esto se debe fundamentalmente a falsos positivos en los hallazgos en aorta ascendente. Si se analizan estos hallazgos en modo M la especificidad se acerca al 100%18,20.
Tomografía axial computarizada (TAC). La TAC es la técnica de imagen diagnóstica más frecuentemente empleada en nuestro medio en los pacientes en los que se sospecha DA según los datos del registro RESA (figs. 1–3). Gracias a la TAC multicorte y a la capacidad de reconstrucción de las imágenes, la sensibilidad de esta prueba diagnóstica se aproxima al 90% con una especificidad del 85%21,22.
La principal limitación que presenta es que no puede aportar información dinámica como es la función sistólica del ventrículo izquierdo o el comportamiento de la válvula aórtica. En aquellos pacientes en los que se realiza la TAC es conveniente obtener primero las imágenes sin contraste con la finalidad de detectar la presencia de sangrado activo y realizar el diagnóstico diferencial con el HI. Posteriormente se aconseja realizar la exploración con contraste. De esta forma vamos a valorar mejor la morfología de la luz verdadera y la localización del paso de sangre a la luz falsa en el caso de que el hematoma coexistente no esté trombosado.
Resonancia magnética nuclear (RMN). La RMN presenta la ventaja, al igual que la ecografía, de ser una técnica no invasiva. Este aspecto la hace sumamente útil en el seguimiento de pacientes, bien sea con dilatación de aorta ascendente bien en los casos de disecciones crónicas, con objeto de disminuir la radiación que recibe el paciente a lo largo del seguimiento23. En el contexto del SAA aporta prácticamente la misma información que la TAC pero además es capaz de valorar aspectos dinámicos como volúmenes ventriculares, presencia de alteraciones funcionales valvulares y comportamiento dinámico de la pared aórtica. Su sensibilidad y especificidad se aproximan al 100%. La principal desventaja que presenta esta técnica es que, con independencia de que es menos disponible que la TAC, requiere unas condiciones de estabilidad en el enfermo para poder ser llevada a cabo.
La TAC, la RMN y la ETE tienen una capacidad diagnóstica parecida con algunas peculiaridades en la definición de la lesión entre unas y otras21. La elección de la técnica de imagen inicial más adecuada para el diagnóstico ha sido ampliamente debatida3–5. El consenso tiende a indicar como idónea para el diagnóstico aquella prueba en la que en el centro exista mayor experiencia y disponibilidad. Algunos grupos consideran que la ETE es la técnica más indicada15,24-26. Así por ejemplo, de forma comparativa, en el registro español la TAC fue utilizada como primera prueba de imagen diagnóstica en el 77% de los casos frente al 61% de los casos en el registro IRAD25,27,28.
Respecto a otras pruebas como las analíticas, y dentro de estas el dímero D, no ha demostrado ninguna utilidad práctica diagnóstica. Si bien es cierto que valores normales (cifras menores a 500ng/ml) tienen un valor altamente predictivo para poder excluir la presencia de SAA, estimándose una sensibilidad del 97% con una especificidad del 56% y un valor predictivo negativo del 96%29–32.
Otros test diagnósticos de laboratorio, como la concentración de lactato que puede estar elevado por la hemólisis que se genera por el flujo en la luz falsa, no tienen especificidad. Las pruebas de inmunoanálisis como la detección de cadenas pesadas de miosina han sido testadas en este grupo de pacientes y su sensibilidad y especificidad se aproximan a las de las pruebas de imagen rutinariamente utilizadas (ETE, TAC y RMN); no obstante la utilidad de este test diagnóstico está pendiente de validación33,34.
La radiografía de tórax es una prueba muy inespecífica en la que en el 15% de los casos podremos observar alguna alteración, de las cuales, la más frecuente es el ensanchamiento mediastínico (en torno al 50% de los casos) seguida de alteraciones en el contorno de la aorta (20%)15,35. Otras alteraciones como el derrame pleural son infrecuentes y están en relación con el sangrado.
Respecto al ECG se pueden observar alteraciones por obstrucción o afectación del ostium de las coronarias y progresión de la lesión, con signos de isquemia36,37.
Mediante el estudio con las pruebas de imagen es poco frecuente pero puede que existan casos de falsos negativos. En dicho caso, si la sospecha de SAA es alta, es recomendable la realización de una segunda prueba de imagen que complemente la información aportada por la que ya se realizó previamente.
Diagnóstico diferencial entre las 3 entidadesExisten una serie de características dentro de cada una de las entidades que conforman el SAA desde el punto de vista clínico y de las pruebas de imagen que pueden y deben orientarnos en el diagnóstico.
El HI se caracteriza por presentar múltiples capas que se corresponden con la pared aórtica que se separa por la hemorragia que infiltra y da lugar a un engrosamiento mayor de 0,5cm y a un incremento de la distancia de la luz al esófago y zona periaórtica sin eco como signo de extravasación6. La calcificación de la íntima es de gran utilidad en el diagnóstico diferencial del hematoma con el trombo mural. Hay que recordar que dentro de la evolución del hematoma este tiene un carácter dinámico y entre el 30 y el 50% llegan a provocar una disección, el 20-47% pueden provocar rotura aórtica y en el resto tiende a estabilizarse y cronificarse e incluso reabsorberse, en torno al 10%19.
Siguiendo con el hematoma, los datos ecocardiográficos característicos son el engrosamiento semicircular o circular de la pared aórtica mayor o igual a 5-7mm de una densidad parecida a la del trombo, sin evidencia de flujo doppler en su interior y sin evidencia de desgarro intimal. Este engrosamiento va a generar un desplazamiento de la íntima a la vez que disminuye el diámetro de la luz aórtica. En una proporción no despreciable se pueden observar zonas ecolucentes que traducen el contenido líquido, pero sin que exista flujo en su interior. Si estas se presentan por debajo de la íntima, puede dar lugar a imágenes de colgajo que deben no ser móviles, a diferencia de lo que ocurre en la DA. No obstante, en numerosas ocasiones es difícil diferenciar entre esto y la DA no comunicante.
Dentro de la úlcera, el contexto clínico, como señalábamos, es sumamente útil para orientar el diagnóstico: es el de pacientes añosos e hipertensos con arteriosclerosis difusa. La erosión que provoca la úlcera en ocasiones afecta a la media y genera sangrado. Es por este motivo por el que no es infrecuente la coexistencia de ambas entidades, si bien es cierto que este suele ser mucho más delimitado desde el punto de vista de la extensión longitudinal por los fenómenos de fibrosis presentes en la arteriosclerosis que ayudan a contener el sangrado38. Al igual que el hematoma, es un proceso dinámico pero con una evolución más lenta que en raras ocasiones genera DA. Es más frecuente la cronificación y desarrollo de zonas aneurismáticas. La morfología de la lesión es sumamente característica: ecocardiográficamente se aprecia una zona excavada en la pared arterial con bordes irregulares. Esta lesión suele presentar flujo en su interior y en los márgenes. Estos datos ayudan en el diagnóstico diferencial con el hematoma39,40. La estabilización de la placa suele acompañarse de la desaparición de aquel.
TratamientoDentro del tratamiento del SAA podemos diferenciar un tratamiento inicial o sindrómico y un tratamiento definitivo en función de la lesión, de su localización y del estado del paciente.
Tratamiento sindrómicoEn relación con el tratamiento inicial del SAA son fundamentales algunos aspectos:
Control del dolor. El dolor genera la activación del sistema simpático y con ello la regulación neurohormonal de que se acompaña, que se traduce en un aumento de la vasoconstricción periférica, tendencia a la HTA y a la taquicardia. Todos estos efectos van a generar un aumento en la tensión parietal que contribuye a favorecer la progresión del SAA. Por ello, es fundamental el control del dolor no solo por el bienestar del paciente sino por las implicaciones que en la evolución de esta enfermedad tiene. En el tratamiento del dolor se emplean opiáceos administrados intravenosamente (iv).
Control de la ansiedad. Íntimamente relacionado con el dolor. El objetivo en el tratamiento es superponible al del dolor.
Control del doble producto. El control de la presión arterial así como de la frecuencia cardiaca tienen un doble sentido: por una parte, disminuir el estrés parietal y la progresión de las lesiones y, por otro, el mantenimiento hemodinámico del paciente en las mejores condiciones posibles hasta llegar al tratamiento definitivo, consiguiendo de esta forma mejorar los resultados.
El estrés de la pared aórtica depende de la velocidad de la contracción ventricular (dp/dt), la frecuencia de la contracción ventricular y la presión arterial. Los betabloqueantes reducen estas 3 variables. El objetivo a alcanzar en este grupo de pacientes es una presión arterial sistólica con rangos entre 100mmHg y 120mmHg y una frecuencia cardiaca de en torno a 60 latidos por minuto. Los fármacos más frecuentemente empleados son labetalol, esmolol y menos frecuentemente propranolol y metoprolol. Todos ellos administrados de forma iv. Si existiera contraindicación para su administración se puede utilizar el esmolol, dado que su vida media es muy corta. En cualquier caso, si no se pudieran utilizar, está indicada la administración de calcio antagonistas no dihidropiridínicos vía iv (verapamil o diltiazem). En aquellos pacientes en los que coexista IAo se deban evitar los betabloqueantes debido a la taquicardia refleja que pueden provocar.
Es poco frecuente que la tensión arterial permanezca elevada tras la administración de analgésicos, ansiolíticos y betabloqueantes o calcio antagonistas; no obstante si esto fuera así se aconseja asociar algún vasodilatador; generalmente se utiliza el nitropusiato.
Existe una situación opuesta y es aquella en la que los pacientes presentan hipotensión por cualquiera de las causas previamente mencionadas en la clínica cardiológica. En primer lugar, se intentará realizar un tratamiento etiológico. En segundo lugar, se utilizan expansores de volumen y, finalmente, vasopresores que obviamente van a favorecer la progresión del cuadro clínico. Las principales causas de hipotensión en el SAA como señalábamos son el taponamiento cardiaco, la aparición de IAo aguda, el sangrado y el desarrollo de infarto de miocardio. En el tratamiento del taponamiento cardiaco es importante tratar de no realizar pericardiocentesis dado que va a favorecer el resangrado. Se trataría de extraer la mínima cantidad de sangre posible, teniendo en consideración el estado hemodinámico del paciente.
Tratamiento definitivo, consideraciones en el hematoma intramural y la úlcera penetranteLas UPA, también denominadas defectos intimales sin hematoma, se caracterizan por ser lesiones focales que afectan a una porción limitada de la aorta. De los 3 tipos de procesos clínicos que se engloban dentro del SAA son los más favorables por su pronóstico. El tratamiento está en gran medida condicionado por su localización; en aorta torácica o abdominal son muy favorables para tratamiento endovascular. La afectación de la aorta ascendente hace que se recomiende la cirugía urgente/emergente dado que la probabilidad de evolución hacia DA es importante41.
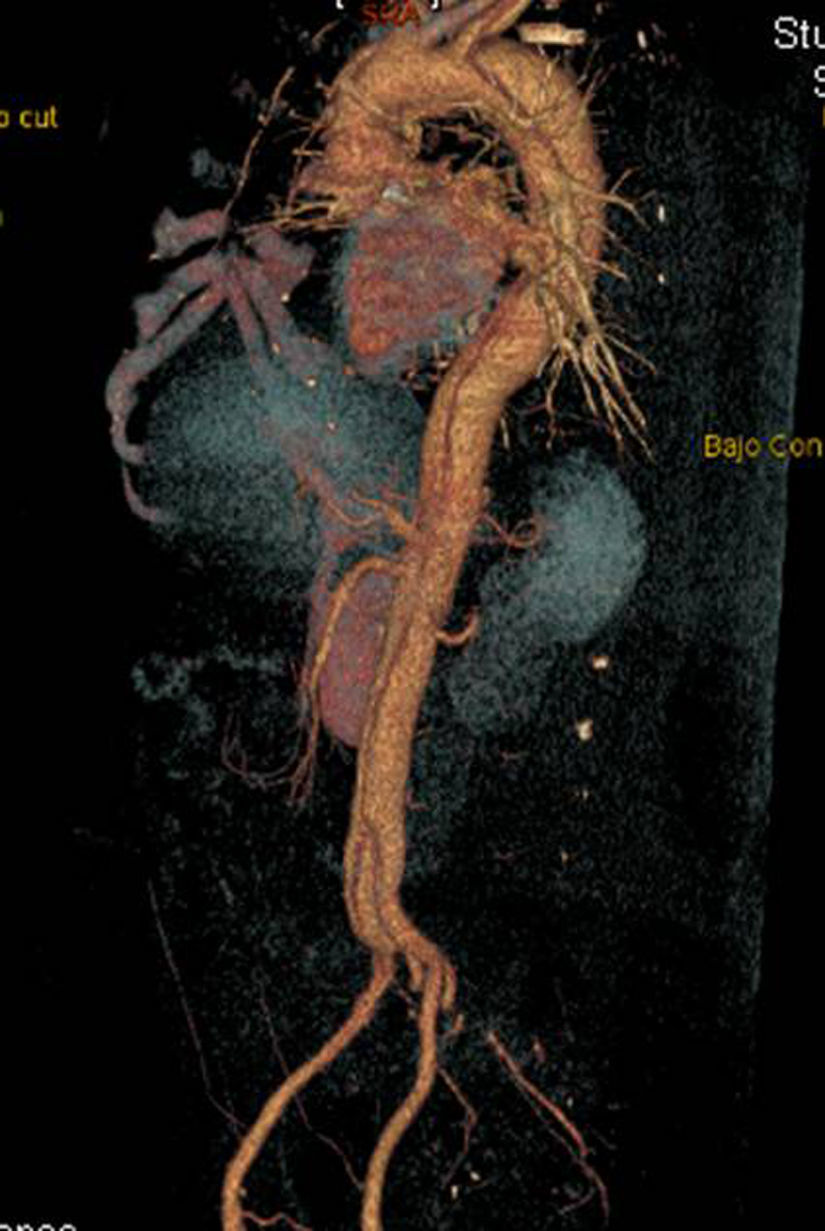
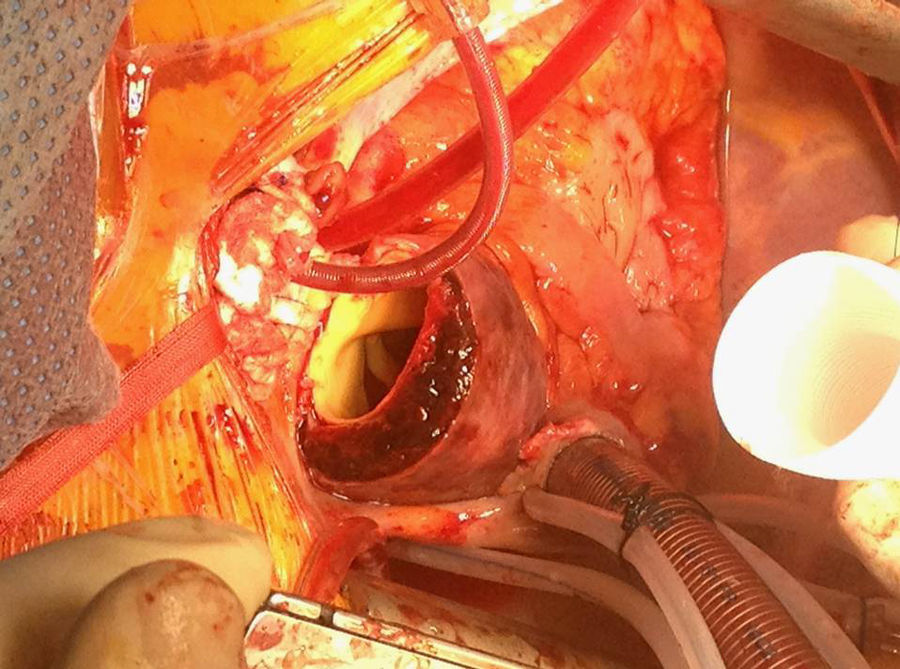
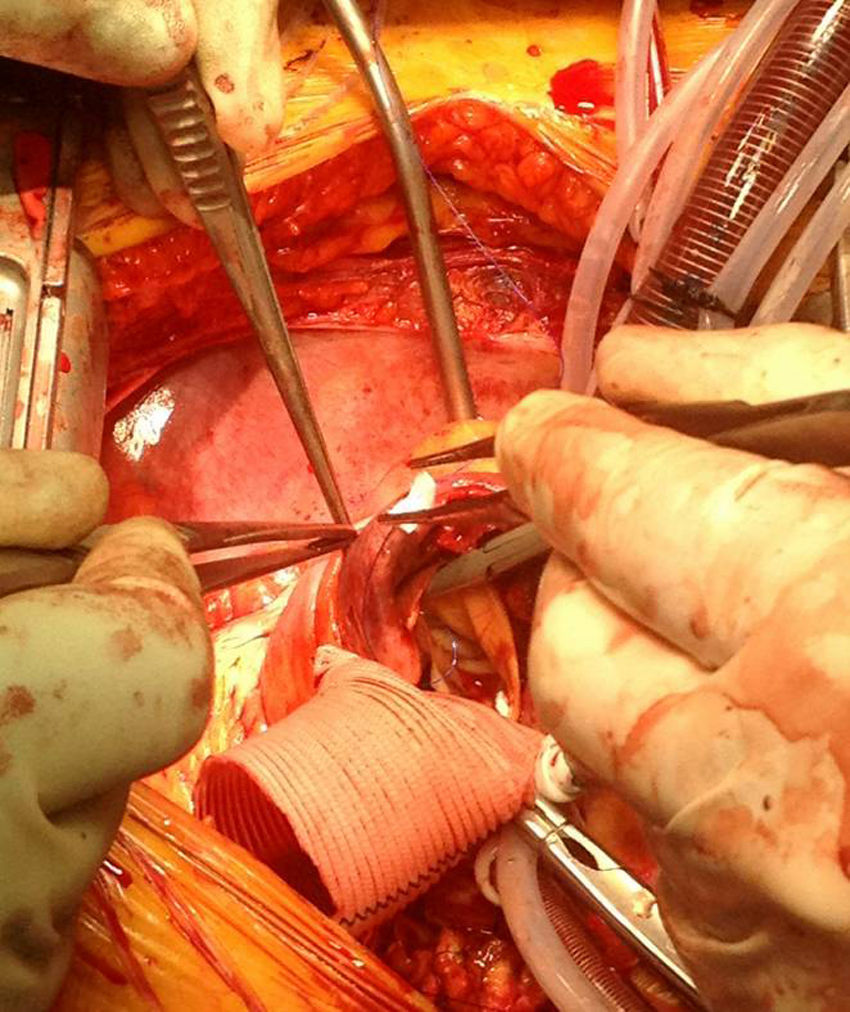
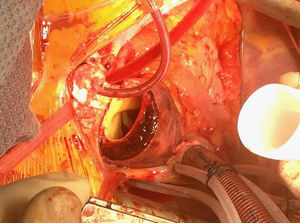
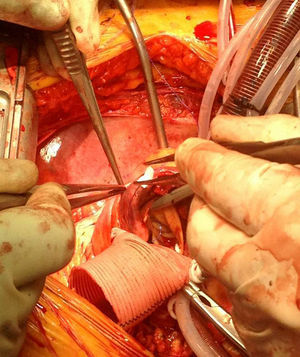
En el caso de los HI se considera que su tratamiento es superponible al de la disección dado que es un estadio precursor del desarrollo de DA y rotura aórtica (figs. 7 y 8). Si el hematoma se localiza en aorta descendente, el manejo terapéutico es superponible al de la DA tipo B. En aquellos pacientes que quedan asintomáticos tras el tratamiento médico es posible retrasar la cirugía o el tratamiento endovascular hasta que el hematoma se haya reabsorbido y organizado; esto mejora los resultados. Incluso algunos autores no recomiendan ningún tratamiento quirúrgico o endovascular si el HIM se ha reabsorbido completamente. En casos de persistencia del dolor, evidencia de expansión o de rotura o signos de mala perfusión, se indicará la intervención urgente mediante abordaje quirúrgico o tratamiento endovascular en los de aorta descendente17,42,43.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.