El tratamiento percutáneo de la estenosis aórtica severa es una opción terapéutica para paciente inoperables y para aquellos de moderado o elevado riesgo quirúrgico.
Presentamos el caso de un paciente joven inicialmente considerado inoperable, sometido a una implantación transcatéter de válvula aórtica, que comenzó a mostrar signos de degeneración tras seis años, que evolucionaron hasta requerir tratamiento quirúrgico a los ocho años del implante. Durante este tiempo, su estado de salud mejoró, por lo que fue presentado en sesión médico quirúrgica para la resección de la válvula previamente implantada y sustitución por otra bioprótesis. El procedimiento transcurrió sin complicaciones.
No obstante, la resección de estas válvulas no es un procedimiento exento de riesgo, por las densas adherencias del marco a la raíz aórtica.
Por este motivo, la expansión de esta tecnología a pacientes jóvenes y de bajo riesgo, no estaría justificada.
Percutaneous treatment of severe aortic stenosis is an alternative option for patients that are not candidates for cardiac surgery and for those with high or moderate surgical risk.
We have recently treated a young man rejected initially for cardiac surgery because of high risk some years ago, who went through a transcatether aortic valve implantation and presented signs of degeneration after 6 years, that worsened until the patient needed surgical treatment 8 years after the implant. Meanwhile, his health status improved, the case was discussed by the heart team and accepted for resection of the percutaneous valve and implantation of a new bioprosthesis. The procedure went smoothly.
Nevertheless, the resection of these valves is not a procedure free of risk due to the dense adherences of the frame of the valve with the aortic root.
For these reason, the expansion of this technology to young low risk patients is not justified.
El tratamiento percutáneo de la estenosis aórtica severa, reservado inicialmente para los pacientes inoperables o de alto riesgo quirúrgico, se ha extendido recientemente a los de riesgo moderado. Las técnicas para la resección tanto precoz como tardía ya han sido descritas en el pasado1–3. La posible expansión de esta tecnología hacia grupos de población más jóvenes a raíz del ensayo PARTNER 3 obliga al cirujano cardiaco a estar familiarizado con la explantación de válvulas transcatéter4.
Describimos aquí nuestra experiencia con la extracción tardía de una CoreValve® (Medtronic Inc. Minneapolis, EE. UU.).
Caso clínicoPresentamos el caso de un varón de 61 años actualmente sometido a implantación de válvula aórtica transcatéter en 2012, por estenosis aórtica severa (gradiente máximo 94 mmHg, medio de 50 mmHg y área de 0,7 cm2) asintomática, que era candidato a inclusión en lista de espera para trasplante hepático por cirrosis hepática secundaria a virus de la hepatitis C con respuesta virológica sostenida (estadio Child Pugh B7, MELD 22, MELD-Na+ 24) y retrasplante renal por rechazo crónico del injerto previo que condicionaba una insuficiencia renal terminal en el programa regular de diálisis. Se consideró al paciente de alto riesgo a pesar de Euroscore II 0,95% por comorbilidad no contemplada en el score, y en sesión médico quirúrgica se decidió tratamiento percutáneo de la valvulopatía aórtica.
En septiembre del 2012 se realizó una implantación de válvula aórtica transcatéter CoreValve® de 29 mm por vía transfemoral, con aceptable resultado angiográfico inicial (fuga paravalvular ligera), pero objetivándose en el ecocardiograma posterior una fuga paravalvular que condicionaba una insuficiencia aórtica moderada-severa (tiempo de hemipresión de 258 ms, sin inversión del flujo diastólico en aorta torácica) y gradientes valvulares aumentados (gradiente medio 23 mmHg).
Recibió tratamiento con rituximab y bortezomid además de inmunoadsorción por presentar anticuerpo anti human leukocyte antigen (anti HLA) de clase I y II, y en febrero del 2014 fue sometido a trasplante hepatorrenal, evolucionando de forma favorable. Desde entonces, estuvo en seguimiento en consulta de Cardiología, permaneciendo asintomático desde el punto de vista cardiovascular, hasta que en diciembre del 2019 acudió a revisión, refiriendo disnea de moderados-mínimos esfuerzos. En el ecocardiograma se constató una prótesis aórtica biológica disfuncionante con estenosis severa (gradiente medio 43 mmHg, máximo 80,3 mmHg, velocidad máxima 4,43 m/s, effective orifice area [EAO] protésico 0,62 cm2) e insuficiencia moderada. Se realizó una coronariografía que descartó la existencia de lesiones angiográficamente significativas. En enero del 2020 se realizó una valvuloplastia percutánea con balón por no ser el paciente candidato a implantación de válvula percutánea sobre válvula percutánea (TAVI in TAVI), por la distancia entre el anillo y los ostia coronarios y el reducido diámetro de la aorta a nivel de los senos de Valsalva. En el ecocardiograma de control, tras el procedimiento, se objetivaron unos gradientes elevados (gradiente medio 60,7 mmHg, gradiente máximo 110,5 mmHg, velocidad máxima 5,26 m/s) y una insuficiencia moderada-severa de válvula aórtica, con regurgitación periprotésica e intraprotésica. Tras el alta, el paciente continuó sintomático a pesar de optimización del tratamiento médico. Por este motivo, fue presentado en sesión médico quirúrgica decidiéndose por el tratamiento quirúrgico de la valvulopatía.
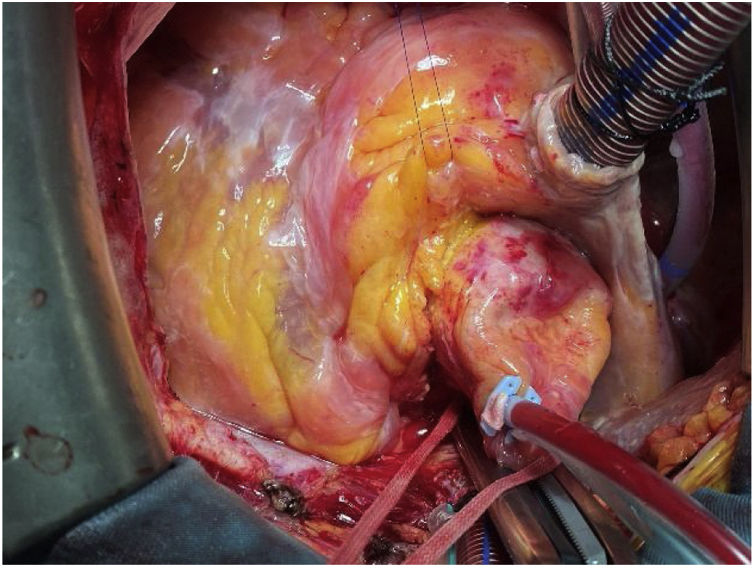
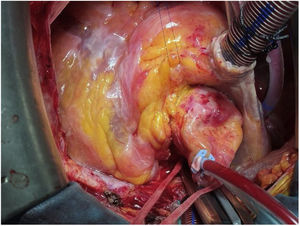
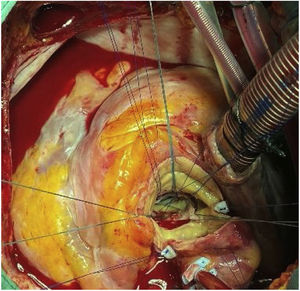
TécnicaLa intervención se realizó con anestesia general, a través de esternotomía media y con circulación extracorpórea. La cánula arterial se insertó en la aorta ascendente. Previamente al pinzamiento aórtico, se palpó la parte superior del marco de nitinol para comprobar su posición, y de este modo, llevar la pinza aórtica lo más distalmente posible. No nos planteamos un acceso arterial periférico porque había suficiente espacio en la aorta ascendente para la cánula. La cardioplejia hemática se administró por vía anterógrada inicialmente y por retroplejia el resto (fig. 1).
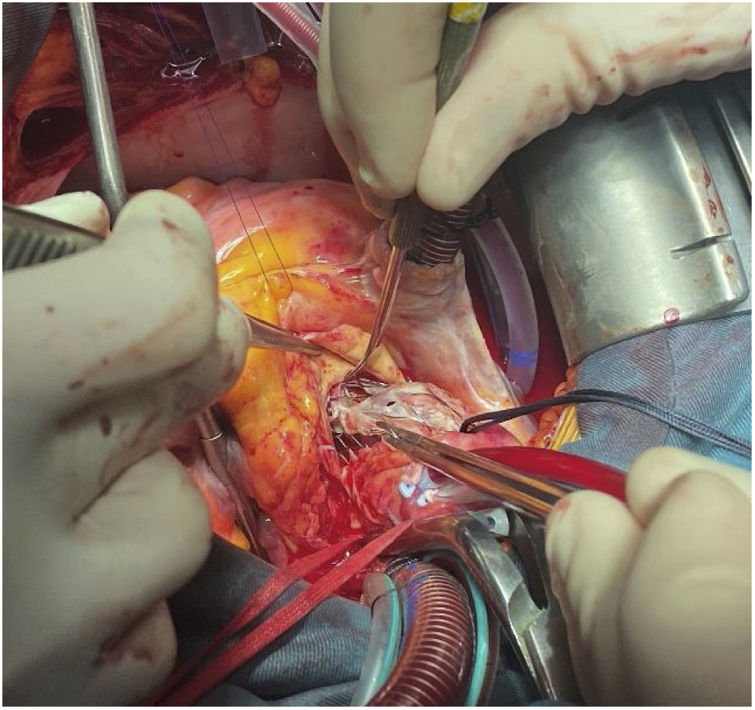
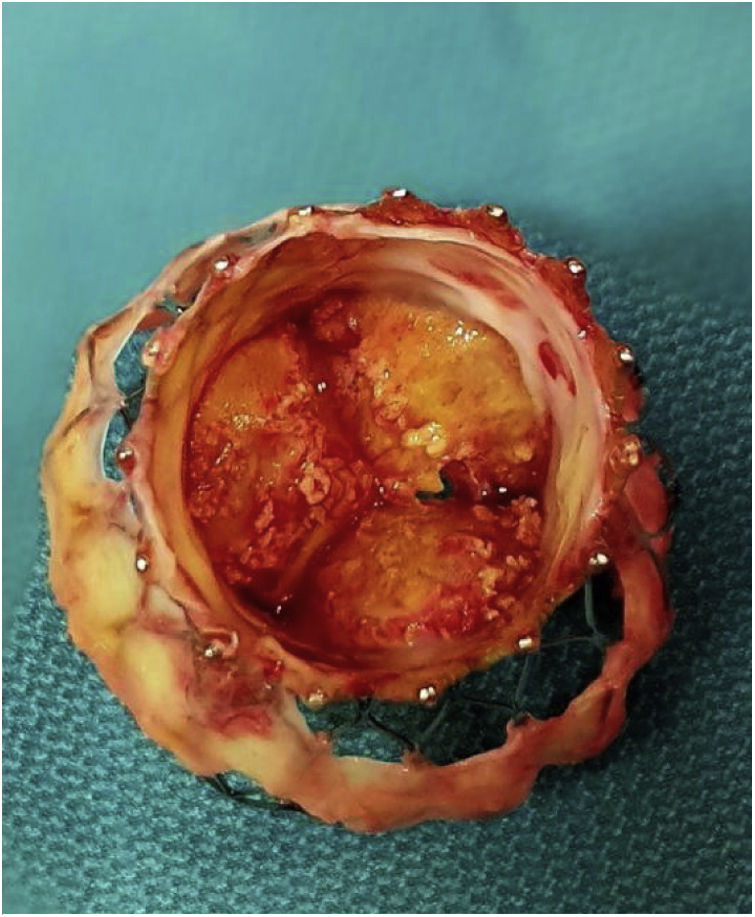
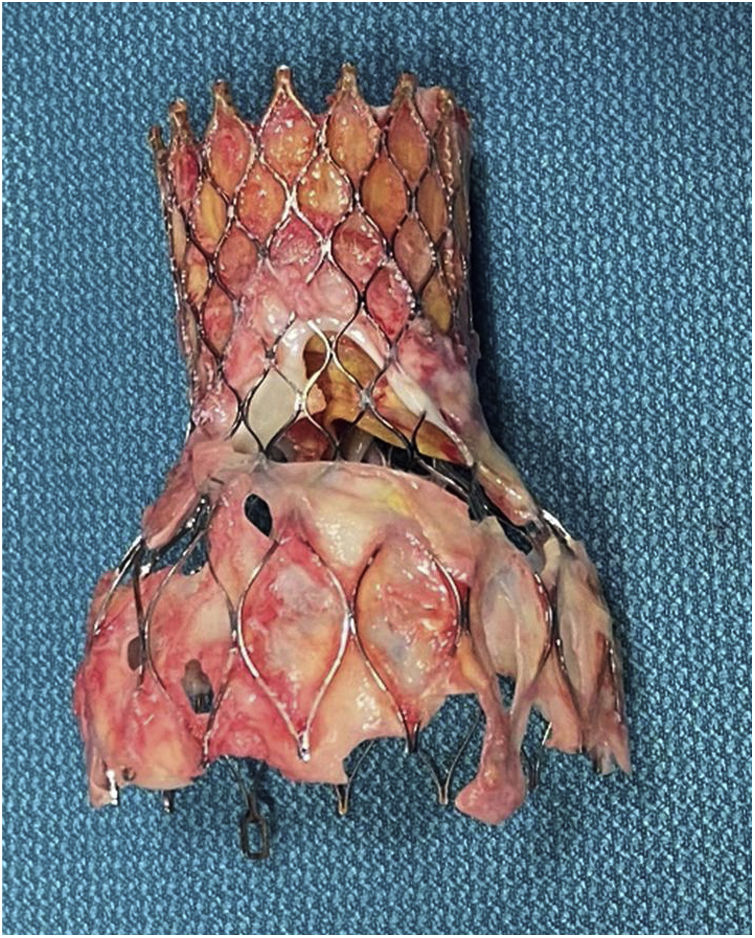
Tras la administración de cardioplejia, se localizó de nuevo el límite de la prótesis y se inició la aortotomía sobre el marco, aproximadamente a un centímetro del extremo de la misma. A este nivel, nos encontramos las celdillas completamente endotelizadas e incluidas en la pared aórtica. Con una espátula de endarterectomía y realizando tracción con pinzas de resano, se procedió a liberar el marco de nitinol de la aorta, avanzando distalmente, a la vez que se ampliaba la aortotomía gradualmente. El plano de disección se localizó haciendo presión sobre el nitinol, produciéndose pequeños desgarros en el endotelio aórtico al buscar el plano en la pared aórtica. En nuestro caso, las celdillas más distales no estaban endotelizadas, por lo que la disección a ese nivel fue mucho más sencilla (fig. 2).
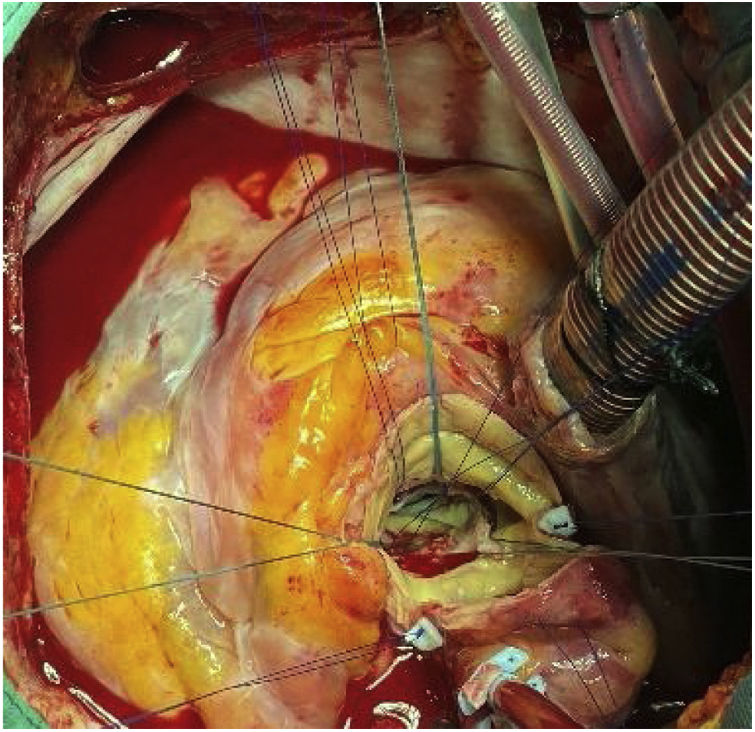
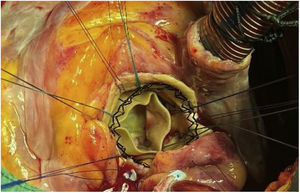
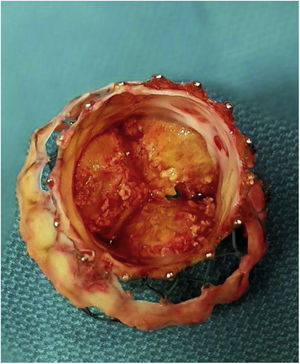
Tras liberar el marco de la prótesis distalmente, se procedió a colapsar las celdillas, aproximándolas con dos sedas anudadas perpendicularmente. Con esta maniobra se facilitó la exposición y la disección mediante tracción y movilización. En nuestro caso, al haber adherencias tan firmes, la administración de suero frío no tuvo ningún efecto sobre la colapsabilidad. Se avanzó en la disección proximalmente, encontrándose adherencias hasta a nivel de la unión sinotubular, estando los senos de Valsalva libres. A nivel del anillo, la prótesis estaba completamente endotelizada y rodeada por tejido calcificado correspondiente a los velos nativos, apuestos entre la pared aórtica y la endoprótesis. Los velos nativos se dejaron in situ hasta completar la extracción de la válvula. Se procedió a la liberación de la porción intraventricular que estaba adherida a la cortina mitroaórtica. Tras retirar la prótesis, se resecaron los velos nativos (fig. 3).
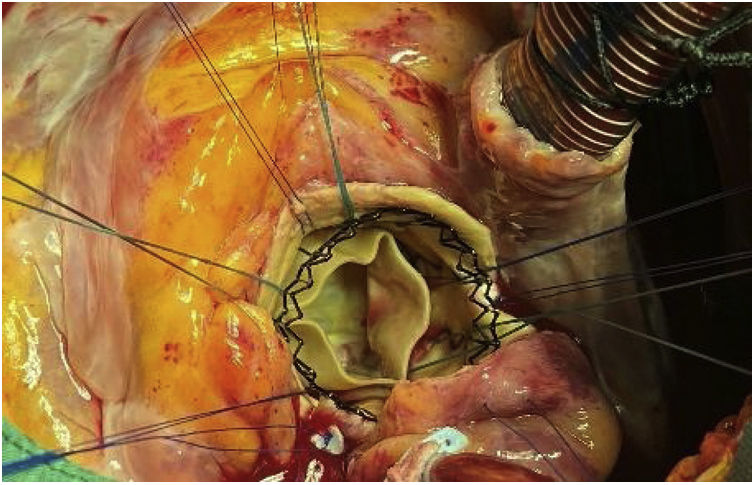
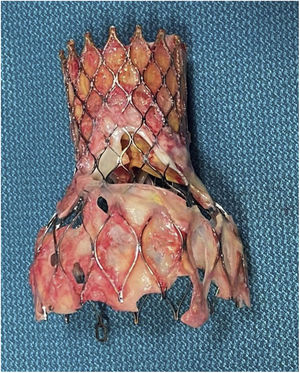
Está descrito que tras retirar la bioprótesis, los velos pueden caer a su posición nativa5, pero en nuestro caso estaban firmemente calcificados, fijos y apuestos a la pared aórtica. Se resecaron según la técnica habitual, y tras limpiar el anillo se implantó una válvula Perceval® Plus (Livanova, Milan, Italy) tamaño L (fig. 4).
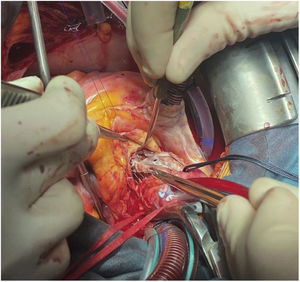
No se apreció daño significativo en la pared aórtica que requiriera actuación, por lo que se procedió a suturar la aortotomía, se realizaron maniobras de purgado, salida de bomba y cierre según la técnica habitual.
El tiempo de isquemia fue de 93 minutos y el de circulación extracorpórea de 116 (figs. 5 y 6).
El paciente fue trasladado a la Unidad de Cuidados Intensivos (UCI) y en el primer día postoperatorio a la planta de Cirugía Cardiaca, siendo dado de alta en el sexto día postoperatorio, con función hepática y renal similares a las basales. El ecocardiograma postoperatorio describió una válvula biológica normofuncionante (gradiente máximo 16 mmHg, medio 8 mmHg), sin insuficiencia valvular.
DiscusiónLa primera implantación con éxito de una válvula transcatéter para tratar la estenosis aórtica severa fue realizada en el 20026. Desde entonces, esta técnica ha desplazado a la cirugía convencional por su carácter menos invasivo y por evitar la circulación extracorpórea, inicialmente en pacientes de alto riesgo y posteriormente en los de riesgo intermedio. Cabe la posibilidad de que esta expansión acabe afectando también a los pacientes de bajo riesgo en el futuro4. Los cirujanos cardiacos deben no solo aprender a realizar estos procedimientos, sino también a resolver las potenciales complicaciones asociadas, en pacientes considerados inicialmente de riesgo extremo, alto o intermedio, y que solo son susceptibles de tratamiento quirúrgico1,5,7,8.
La extracción tardía de una válvula transcatéter es una operación claramente diferente de la precoz por la existencia de adherencias. También existen consideraciones técnicas según el tipo de válvula. El menor perfil de la Sapien® (Edwards Lifesciencs, Irvine, California) no plantea problemas para la inserción de la cánula aórtica. Sin embargo, aunque no es lo habitual, y dependiendo de la longitud de la aorta y de la altura de implantación de la CoreValve®, puede ser necesario canular el arco u otros accesos, dejando espacio para la pinza aórtica. El drenaje venoso cavoatrial es de elección, salvo que se sospeche interacción del marco de la bioprótesis con la válvula mitral, en cuyo caso habría que considerar emplear cánulas venosas en ambas cavas. La cardioplejia se puede administrar de forma anterógrada o retrógrada, pero no a través de los ostia hasta que la prótesis se haya extraído, ya que el marco de la misma y la ocupación parcial de los senos por los velos nativos harían el acceso sumamente complicado. La válvula Sapien® suele quedar a la altura de la unión sinotubular, por lo que la posición de la aortotomía no ha de ser modificada. En el caso de la CoreValve®, la aortotomía se puede iniciar sobre el marco de nitinol como en nuestro caso, o más distalmente. Con ambas válvulas se avanza, creando un plano de disección entre el vaso y la próstesis. La retirada de una Sapien® es un reto debido al grado de endotelización, pero su localización anatómica intranular hace que el área a liberar sea relativamente menor. Debido al diseño de la CoreValve®, las adherencias más firmes se encuentran en la unión sinotubular y el anillo aórtico, pero son prácticamente inexistentes a nivel de los senos de Valsalva, ya que el marco de nitinol queda lejos del endotelio en esta zona, simplificando el procedimiento al eliminar la necesidad de disección cerca de los ostia. La aplicación de suero salino frío con hielo facilita el colapso de la CoreValve®. Sin embargo, en el caso de la Sapien® es necesario emplear unas pinzas de kocher para aplastar el marco y permitir la extracción. Finalmente, en casos de implantación baja, hay que ser muy cuidadosos con la disección a nivel de la cortina mitroaórtica1,5.
En 2020, Fukuhara et al. publicaron una serie de 1.442 pacientes consecutivos sometidos a implante percutáneo de válvula aórtica, de los cuales 15 requirieron cirugía de recambio valvular. Las indicaciones de intervención quirúrgica fueron las siguientes: fuga perivalvular aórtica (41,2%), deterioro estructural (23,5%), complicaciones derivadas del procedimiento (23,5%), endocarditis (5,9%) y puente a la cirugía definitiva (5,9%). En los cinco pacientes con prótesis de más de un año de antigüedad hubo que realizar endartarectomía exhaustiva y dos (40%) de ellos necesitaron reparación aórtica. La mortalidad hospitalaria global de la serie fue de dos pacientes (11,8%). Con estos datos concluyen que explantar una prótesis crónicamente implantada no es un procedimiento que deba tomarse a la ligera, desaconsejando la expansión de la indicación de tratamiento percutáneo de la estenosis aórtica a pacientes jóvenes y de bajo riesgo9.
La bibliografía, no obstante, refleja una mortalidad del 11,8% para este tipo de procedimientos en pacientes con prótesis crónicamente implantadas, vs. menos del 3% (2,23% para un varón de 70 años en clase funcional II /IV de la New York Heart Association (NYHA) sin comorbilidad asociada y 2,77% para una mujer de las mismas características) de mortalidad predicha según Euroscore II de una reoperación cardiaca de reemplazo de prótesis aórtica.
En cuanto a la posibilidad de implantar una TAVI in TAVI previamente degenerada, no hay evidencia suficiente sobre la durabilidad y factibilidad de este procedimiento.
Teniendo en cuenta estos datos, y que la mortalidad operatoria predicha por el Euroscore II para una sustitución valvular aórtica en un paciente de bajo riesgo es inferior al 1% (0,74% para un varón de 70 años en clase funcional II /IV NYHA sin comorbilidad asociada y 0,92% para una mujer de las mismas características), consideramos que la expansión del tratamiento percutáneo de la estenosis aórtica severa a pacientes jóvenes y de bajo riesgo no estaría justificada.
ConclusionesEn el presente caso, confirmamos la neoendotelización e incorporación de la jaula de nitinol en la pared aórtica, aunque de forma incompleta, tras casi ocho años desde la implantación. El explante con espátula de endarterectomía y tracción cuidadosa puede ser realizada sin necesidad de reemplazo de la raíz aórtica.
Tomando en cuenta el bajo riesgo quirúrgico de un recambio valvular aórtico en un paciente joven sin comorbilidades, consideramos que la expansión del tratamiento percutáneo de la estenosis aórtica severa a este grupo de pacientes no está justificado.
En nuestra opinión, el uso de válvulas sin suturas puede ser una ventaja añadida en estos casos, permitiendo reducir el tiempo de isquemia.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.