A pesar de los avances de la cirugía vascular, la mortalidad de reparación abierta de una rotura de un aneurisma de aorta abdominal (AAAR) es cercana al 50%. El objetivo de nuestro trabajo es la descripción de nuestra técnica y el análisis de los resultados.
Material y métodosEntre 1999–2009, hemos intervenido a 92 pacientes con AAAR. Edad media 72± 8 años, 87 varones. Veintiún casos (23%) presentaban dolor abdominal, 46 (50%) dolor y signos de shock y 25 (27%) shock hemorrágico. Todos fueron diagnosticados mediante angiotomografía axial (angio-TC) abdominal e intervenidos de urgencia. El tamaño medio del aneurisma era 8±3cm. La técnica utilizada fue oclusión aórtica intraluminal con balón en 75 (81%), y se utilizó un módulo de circulación extracorpórea para recuperar la sangre y reinfundirla, para mantener la estabilidad hemodinámica del paciente. El volumen medio de sangre reinfundida fue 6.852ml. A 57 (62%) se les implantó un injerto aortoaórtico, y a 35 (38%), aortobifemoral.
ResultadosLa mortalidad hospitalaria ha sido de 34 casos (37%), ocho en quirófano y 26 en el postoperatorio. Entre las causas de muerte podemos destacar: intraoperatorias, parada cardio-rrespiratoria en cinco y hemorragia en tres. Postoperatorias, fracaso multiorgánico 15, hemorragia cuatro y otras siete.
ConclusionesLa oclusión intraaórtica con balón permite control rápido y seguro del cuello del aneurisma. La utilización de la circulación extracorpórea ayuda al restablecimiento rápido de la volemia, de la hemodinámica del paciente y a mantener un campo operatorio sin sangre evitando disecciones innecesarias. Consideramos una notable mejoría de la mortalidad.
Despite major advances in vascular surgery, mortality for open repair of ruptured abdominal aneurysms (RAAA) remains around 50%. This prompted us to improve the surgical approach. Our operative technique and results are described.
Material and methodFrom 1999–2009, 92 patients with a RAAA, mean age 72±8 years, 87 men were operated at our hospital. Twenty one cases (23%) presented with abdominal pain, 46 (50%) pain and shock and 25 (27%) hemorrhagic shock. All patients underwent contrast-enhanced preoperative computed tomography for diagnosis. Mean aneurysm size was 8±3cm. The technique used was intraluminal balloon clamp with a Pruitt 75ml catheter (81%). An extracorporeal circulation pump head was used to recover the blood from the field; this is filtered and reinfused directly into a large jugular catheter to maintain hemodynamic stability. Mean reinfused volume was 6,852cc. 57 cases (62%) received a straight graft and 35 (38%) a bifurcation graft.
ResultsHospital mortality was 34 cases (37%), 8 deaths intraoperative and 26 in the postoperative period. Causes of death were: intraoperative, massive bleeding in three cases, cardiorespiratory failure five. Postoperatively, 15 multiorgan failure, bleeding four.
ConclusionsIntraluminal clamping allows a rapid and safe control of the aneurysmal neck. The use of extracorporeal circulation pump helps to reestablish volume, maintain hemodynamic stability providing a dry field without the need for extensive dissection. We consider that mortality rates have been improved with this approach.
La AAAR constituye uno de los grandes desafíos de la cirugía vascular, se asocia a una alta mortalidad y no ha podido ser mejorada en los últimos 30 años. Es la complicación vascular más letal vista en un quirófano de urgencia. Mientras el desarrollo de las técnicas quirúrgicas y anestésicas han conseguido una notable mejoría en la mortalidad operatoria de los aneurismas de aorta abdominal (AAA) intervenidos de forma electiva (4%), la mortalidad de la AAAR es de un 50%1 y puede alcanzar el 90% si se tienen en cuenta aquellos pacientes que mueren antes de llegar al hospital2. Ya en 1980, Thompson3 afirmaba que ninguna mejoría de la mortalidad podía ser esperada hasta no asegurarse de que el aneurisma se operaría antes de romperse.
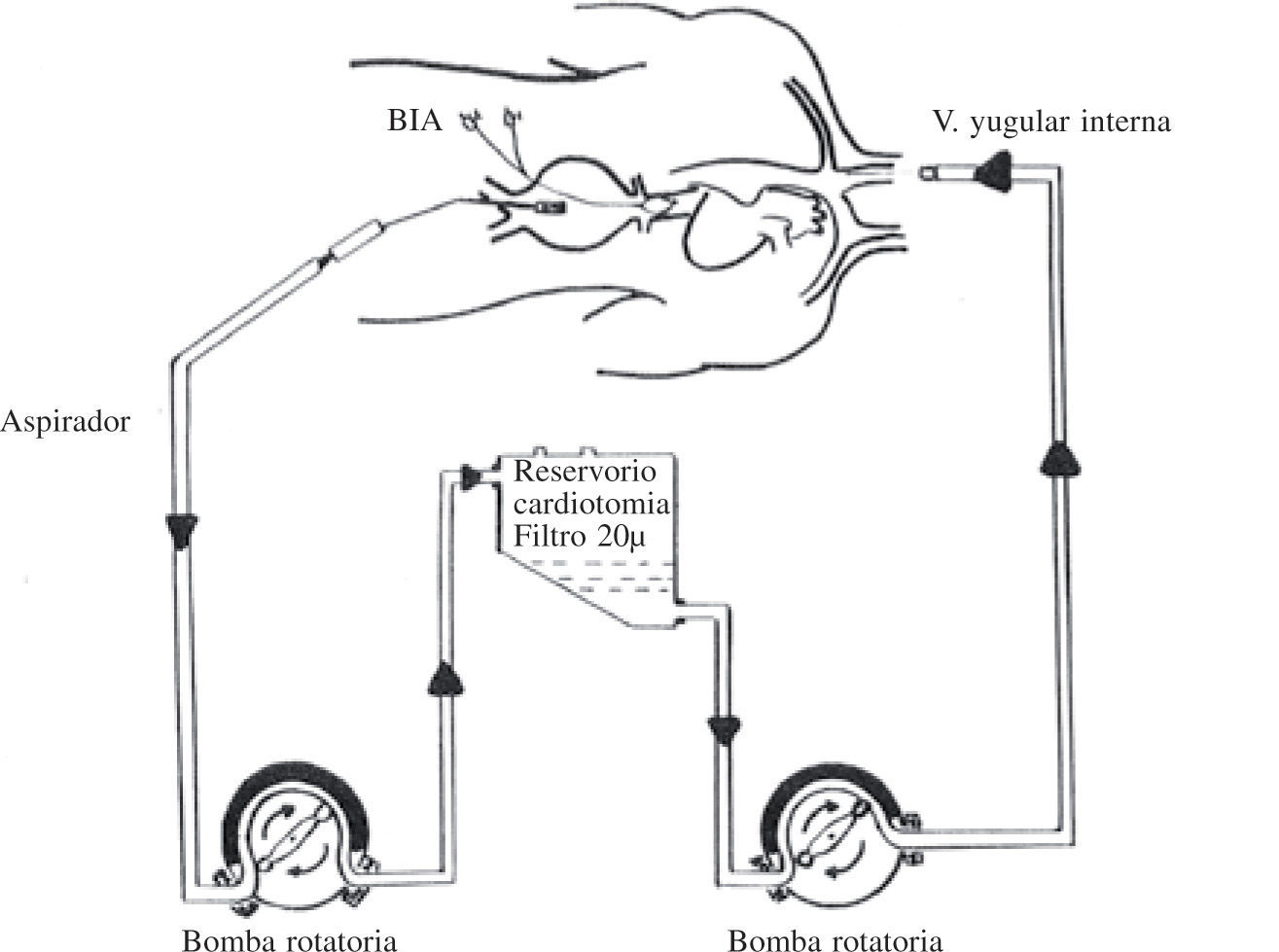
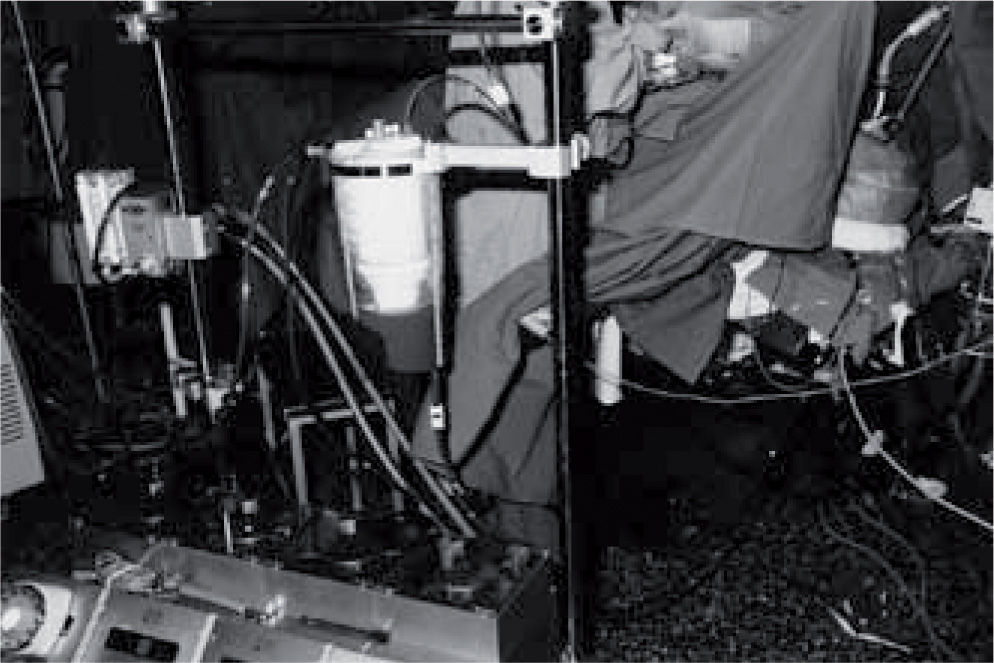
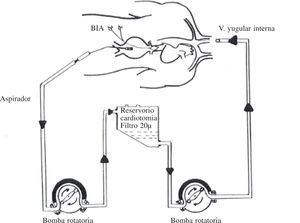
Material y métodosDesde 1990–2009 hemos intervenido a 92 pacientes con AAAR, mediante oclusión intraaórtica con balón de oclusión de Robicsek-Pruitt4 (Fig. 1) y utilizando el circuito de circulación extracorpórea (CEC) (Fig. 2) para la recuperación de sangre del campo operatorio.
Cateter de oclusión aortico4.
El balón de oclusión consiste en un catéter balón de doble luz, una de las cuales permite mediante su inflado la oclusión intraluminal de la aorta con 50cc de suero salino, y la otra la administración de volumen o la medición de la presión arterial. El balón ofrece dos posibilidades: una para ser implantado percutáneo vía femoral a través de un introductor, y otra directamente a través del aneurisma.
Circuito de CEC (Fig. 3). Diseñamos un equipo compuesto por un reservorio de cardiotomía de 4.000cc con un filtro de 20μ, un circuito adaptado con 20cm de tubo de 3/8 × 3/32 reducido a un tubo de 1/4 × 1/16 de 2,80m de longitud, terminado en una conexión luer-lock macho. Desde hace unos años vimos el beneficio de intercalar un filtro de sangre de 40μ, que entre otros usos nos ha servido como puerto de acceso para hemofiltración y completando el circuito con dos líneas de aspiración. Todo esto además de tres rodillos de la bomba de CEC. Se anticoagula con heparina 2mg/kg hasta alcanzar un tiempo de coagulación activado (TCA) superior a 350s. Se ceba el circuito con 500cc de solución salina 0,9%, añadiendo 50mg de heparina sódica. Se efectúan controles periódicos de hematocrito y posible acidosis metabólica que se puede producir por la isquemia prolongada de los miembros inferiores. Se controla la diuresis administrando manitol al 20% antes de la oclusión, teniendo en cuenta el nivel de éste (infra o suprarrenal).
Técnica quirúrgicaDurante la preparación anestésica, se canula una vía venosa central con un catéter 9F o una vía periférica con un catéter 14G para la reinfusión. Todos los pacientes fueron intervenidos a través de laparotomía media xifopúbica. Se realiza una abertura de 1cm en el retroperitoneo hasta alcanzar la pared del aneurisma. Se hepariniza al paciente con 2mg/kg, consiguiendo un TCA de 350s, se introduce previa apertura mínima del aneurisma el balón de Robicseck-Pruitt hasta alcanzar el cuello del aneurisma; una vez situado el balón se infla con 50cc de suero fisiológico ocluyéndose el aneurisma, la mayoría de las veces a nivel suprarrenal. Se abre al aneurisma, se extrae el trombo intramural y se evalúa la oclusión. No se disecan las arterias ilíacas para evitar complicaciones vasculares innecesarias y la sangre del campo procedente de las arterias lumbares y vasos ilíacos se aspira con el aspirador de CEC y se reinfunde a través de la vía venosa; se consigue mantener la estabilidad hemodinámica con presión arterial sistólica 90–mmHg. Con el campo exangüe, se procede a implantar una prótesis de dacrón recubierta de colágeno previa medición del cuello del aneurisma, en posición aortoaórtico o bifemoral. Posteriormente se revierte la heparina con protamina (1/1,5), se revisa la hemostasia y se cierra el abdomen.
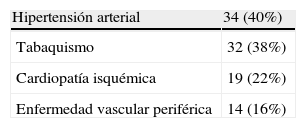
ResultadosLa edad media fue de 72±8 años; 87 (95%) eran hombres y cinco mujeres. Los antecedentes personales se expresan en la tabla I. Veintiún pacientes (23%) presentaban dolor abdominal, 46 (50%) dolor abdominal e hipotensión, y 25 casos (27%) signos de shock hemorrágico. El tamaño medio del aneurisma fue de 8±3cm.
La oclusión intraluminal se utilizó en 75 pacientes (81%) y la oclusión convencional infrarrenal en 17 (19%). En ningún caso se utilizó oclusión supracelíaca. El tiempo medio de oclusión fue de 61min y el volumen medio de reinfusión 6.852ml. A 57 pacientes (62%) se les implantó una prótesis aortoaórtica, y a los 35 restantes una prótesis aortobifemoral.
La mortalidad hospitalaria global ha sido de 34 casos (37%); ocho fallecieron durante la intervención y 26 durante el primer mes tras la intervención. Entre las causas de mortalidad intraoperatoria destaca parada cardíaca irrecuperable en cinco casos, hemorragia masiva incontrolable en tres. Otras causas postoperatorias fueron: sepsis, fracaso renal, y fracaso respiratorio en siete pacientes. No hemos identificado clínicamente complicaciones sistémicas ni pulmonares en relación con la reinfusión de sangre del campo operatorio simplemente filtrada y sin procesar.
DiscusiónDesde la descripción original de Dubost en 1951 sobre los AAA5, la técnica quirúrgica ha mejorado notablemente; sin embargo, mientras la reparación electiva tiene una tasa de mortalidad inferior al 5%, la mortalidad de los AAAR está inamovible desde hace décadas. Así, Hyde comentaba, en 1982: “Surgical progress has had little effect on the mortality of those patients with ruptured abdominal aortic aneurysms“6. En la actualidad sabemos que el 90% de los pacientes con un AAAR mueren antes de llegar al hospital, y del 10% restante el 50% mueren tras la operación; bien merece un esfuerzo mejorar los resultados operatorios como el acceso urgente al hospital y, sobre todo, el diagnóstico precoz y la corrección electiva.
Las manifestaciones clínicas típicas de AAAR son dolor abdominal irradiado a región lumbar seguido de hipotensión, que es inicialmente controlado y que permite al paciente, aunque maltrecho, llegar al hospital; este periodo de tiempo debe ser lo más corto posible, puesto que a partir de este momento la rotura definitiva con la exanguinación es lo más probable.
Las dificultades en la técnica para controlar un AAAR son fáciles de entender. El objetivo fundamental es el control proximal (oclusión del cuello del aneurisma). La técnica clásica inicial es la oclusión proximal del cuello, no exenta de riesgo de accidente, ya que el extenso hematoma retroperitoneal dificulta la identificación de algunas estructuras que pueden ser dañadas inadvertidamente (venas cava inferior, renal izquierda, ilíacas). Otra opción es la oclusión de la aorta abdominal por vía retrógrada a través de la arteria humeral con sonda de Fogarty; esta técnica ha sido utilizada en nuestro servicio y, aunque aparentemente parece factible, el balón blando de la sonda de Fogarty se rompía con cierta frecuencia. La técnica más extendida es la oclusión supracelíaca, la más segura de todas, aunque depende de la anatomía del paciente y la habilidad del cirujano, sin olvidar la posibilidad de isquemia intestinal.
En nuestro grupo, tras años de experiencia con la técnica de oclusión percutánea, adoptamos el uso de oclusión aórtica intraluminal a través del aneurisma con balón de Robicsek-Pruitt; la implantación directa del balón a través del aneurisma, aunque aparentemente sencilla, requiere cierto grado de destreza y experiencia que se va ganando con su uso. Es preciso conocer bien la forma y dirección del cuello mediante un examen minucioso de la angiotomografía.
En el AAAR, el sistema cardiovascular de los pacientes suele funcionar con normalidad, lo que nos ha permitido utilizar la CEC de forma parcial, desarrollando un circuito para la reinfusión venosa. Este sistema exige anticoagulación moderada, lo que puede ser un inconveniente frente a los sistema de autotransfusión, pero tiene la enorme ventaja de que permite en un momento determinado de la intervención una reinfusión rápida, inconveniente de los recuperadores celulares, los cuales necesitan unos minutos para procesar la sangre aspirada del campo operatorio. Las complicaciones de la técnica son escasas y en menor grado que las propias de la CEC. El recuperador celular ha sido utilizado junto con la reinfusión de forma irregular para procesar la sangre, obtener concentrados de hematíes y posteriormente ser transfundido en el postoperatorio inmediato.
El primer AAAR fue intervenido con éxito por De-Bakey en 19547. El análisis de las grandes series de la literatura hasta la década de 1990, en que se utilizó por primera vez la reparación endovascular (REVA) en un AAAR, muestra una mortalidad operatoria que oscila entre el 23–69%, con una media del 49%8. Presentamos una mortalidad operatoria del 37%, por debajo de la cifra media de la literatura, que asociamos a la experiencia de los cirujanos, a la oclusión intraluminal y a la utilización de la CEC modificada. Además, hemos de mencionar el traslado rápido de los pacientes, las mejoras en el diagnóstico con la utilización de las técnicas de imagen (angio-TC) y el desarrollo actual de las técnicas de anestesia y cuidados intensivos.
Se ha realizado multitud de estudios para identificar aquellos factores preoperatorios que puedan predecir con exactitud la mortalidad operatoria de los pacientes con AAAR, llegándose a la conclusión de que la mortalidad en estos pacientes es multifactorial. Halpert, et al.9 identificaron, por análisis multivariable, tres factores pre-dictivos de mortalidad, que eran: hemoglobina al ingreso menor de 10g/l y la pérdida de conciencia y creatinina mayor de 1,5mg/dl. De hecho, la asociación de estos tres factores se asociaba a una mortalidad operatoria del 100%.
El primer AAAR tratado con REVA fue publicado en 1994 por Yusuf, et al.10. Numerosos autores han demostrado una clara correlación entre el uso de REVA para los AAAR y la mejora de la mortalidad precoz respecto a la reparación abierta11,12. La mayor parte de estos autores han llegado a la conclusión de que la REVA es un tratamiento viable en pacientes con una anatomía apropiada. En 2005, Alsac, et al.11 describieron una revisión de la literatura sobre la REVA de los AAAR, que indicaba que estas intervenciones ofrecían una disminución de los tiempos operatorios, pérdidas hemáticas y duración de la hospitalización, incluyendo la del ingreso en la unidad de cuidados intensivos, con una tasa de mortalidad operatoria media del 24%.
De todo esto se deduce que la REVA debería utilizarse en un grupo de pacientes con anatomía adecuada (Tabla II)13, y que en ese grupo ofrece mejores resultados que la reparación abierta. La REVA puede ser utilizada en el 40% de los AAAR13, pero la pregunta no se debe plantear como si es mejor la REVA que la reparación abierta, sino si podemos mejorar los resultados de los AAAR incorporando la REVA a nuestro protocolo, reconociendo, por lo tanto, el sesgo de selección intrínseco y la imposibilidad de tratar a todos los pacientes con REVA.
No debemos dejar pasar esta ocasión sin recordar los programas ambulatorios de detección precoz de AAA mediante ecografía-Doppler abdominal, aconsejando eco-grafía abdominal a todas aquellos pacientes con una dilatación de aorta abdominal mayor de 3cm y menor de 4,4cm, como aconseja la Sociedad Canadiense de Cirugía Vascular14, lo cual ayudaría a un mejor seguimiento de estos pacientes.
Finalmente, reflexionar sobre que, incluso en condiciones óptimas de manejo y experiencia del equipo quirúrgico, los resultados operatorios de AAAR (50%) nunca alcanzarán las cifras de mortalidad de la cirugía electiva (< 5%). Existen esperanzas bien fundadas de que la incorporación de la REVA a los protocolos quirúrgicos mejore estos resultados hasta al menos el 25%, por lo que es preciso insistir en que el mejor tratamiento de la AAAR es la intervención electiva del aneurisma, evitando así la rotura.
ConclusiónLa oclusión intraluminal permite un control rápido y seguro del cuello del AAAR. La utilización de la CEC nos ayuda al restablecimiento rápido de la volemia y a mejorar la hemodinamia del paciente, manteniendo el campo operatorio sin sangre. Hemos apreciado una notable mejoría de la mortalidad operatoria, con una cifra del 37%.