El recambio valvular aórtico con prótesis sin sutura PercevalS se asocia a un aumento en la tasa de bloqueo auriculoventricular postoperatorio que precisa implante de marcapasos definitivo, comparado con las bioprótesis convencionales. En nuestra serie hemos modificado la técnica de implante (mínimo baloneo <5 segundos, decalcificación anular rigurosa, avance de prótesis plegada al tracto de salida del ventrículo izquierdo y reposicionamiento mediante tracción de puntos guía).
ObjetivosAnalizar el impacto de la modificación de la técnica de implante de Perceval en el número de bloqueo auriculoventricular postoperatorio que precisa implante de marcapasos definitivo.
Material y métodosDe 438 pacientes sometidos a recambio valvular aórtico con prótesis Perceval, se excluyeron los correspondientes a la fase inicial del programa (6meses, n=14), cirugía concomitante mitral (n=18) o tricuspídea (n=11) y portadores de marcapasos prequirúrgico (n=11). Se establecieron dos grupos de comparación: grupo estándar (octubre 2013-noviembre 2016, n=209) con técnica de implante estándar, y grupo modificado (diciembre 2016-noviembre 2017, n=184) con técnica de implante modificada. Se analizaron las tasas de implante de marcapasos definitivo (6meses de seguimiento) y variables de interés entre grupos.
ResultadosTasa implante de marcapasos definitivo grupo estándar y modificado: 10,05% vs. 4,35%, p=0,031, respectivamente. Edad (años) grupo estándar y modificado: media 78,15±0,34 vs. media 74,90±0,47, p<0,01, respectivamente. EuroscoreII grupo estándar y modificado: media 3,76±0,24 vs. media 3,00±0,25, p=0,03, respectivamente. No existieron otras diferencias significativas entre variables de interés.
ConclusionesLa modificación de la técnica de implante de Perceval se ha asociado a una reducción estadísticamente significativa de la tasa de bloqueo auriculoventricular postoperatorio que precisa implante de marcapasos definitivo.
Aortic valve replacement with sutureless prosthesis PercevalS is associated with an increase in the rate of postoperative atrioventricular block that requires permanent pacemaker implantation compared to conventional bioprostheses. In our series, we modified the implant technique (minimum ballooning <5seconds, rigorous annular decalcification, advancement of the folded prosthesis to the left ventricle outflow tract and repositioning by traction of guide sutures).
ObjectivesTo analyze the impact of the modification in the Perceval implant technique on the postoperative atrioventricular block rate which requires permanent pacemaker implantation.
Material and methods438 patients underwent aortic valve replacement with Perceval prosthesis, excluding those corresponding to the initial phase of the program (6months, n=14), concomitant mitral surgery (n=18) or tricuspid (n=11) and pre-surgical pacemaker carriers (n=11). Two comparison groups were established; standard group (October 2013-November 2016, n=209) with standard implant technique. Modified group (December 2016-November 2017, n=184) with modified implant technique. We analyzed permanent pacemaker implantation rates (6months follow-up) and variables of interest between groups.
ResultsImplantation rate of permanent pacemaker, standard and modified group (10.05% vs. 4.35%, P=.031, respectively). Age, standard and modified group (mean 78.15±0.34 vs. mean 74.90±0.47, P<.01, respectively). EuroscoreII, standard and modified group (mean 3.76±0.24 vs. mean 3.00±0.25, P=.03, respectively). There were no other significant differences between variables of interest.
ConclusionsModification of the Perceval implant technique has been associated with a statistically significant reduction in the postoperative atrioventricular block rate requiring implantation of permanent pacemaker.
Las prótesis aórticas sin sutura han supuesto uno de los avances más importantes en las últimas décadas en el campo del tratamiento quirúrgico de la valvulopatía aórtica.
La Perceval S (LivaNova, Italia) es una prótesis aórtica biológica, plegable, montada sobre un stent que permite realizar un recambio valvular aórtico (RVA) mediante la técnica convencional (circulación extracorpórea, pinzamiento aórtico y sustitución de válvula aórtica nativa). No obstante, esta prótesis está específicamente diseñada para facilitar abordajes miniinvasivos, beneficiándose de esta técnica especialmente en pacientes de alto riesgo.
A día de hoy, la literatura refiere que las prótesis sin sutura han demostrado no solo buenos resultados en términos de morbimortalidad sino también un excelente comportamiento hemodinámico, especialmente en raíces aórticas pequeñas1-3. Sin embargo, existen factores que todavía hacen dudar si de verdad representan una mejor opción para el tratamiento de la estenosis valvular aórtica severa, en especial si las comparamos con las prótesis con sutura convencionales4. Uno de los principales inconvenientes de las válvulas sin sutura respecto a las válvulas convencionales es la alta tasa de bloqueo auriculoventricular (BAV) postoperatorio. Puede ocurrir como consecuencia inmediata de la liberación de la prótesis, o bien en el período postoperatorio inicial. Finalmente, muchos de estos casos acaban precisando un implante de marcapasos definitivo (MCPD) en el postoperatorio temprano.
En la actualidad existe poca evidencia científica acerca de cómo modificar la técnica de implante con el objetivo de reducir el número de BAV postoperatorios5. Lo mismo ocurre a la hora de establecer una relación entre el aumento de la tasa de esta complicación con algún factor de riesgo inherente al paciente, o bien con la propia técnica de RVA6.
En nuestro centro hemos modificado la técnica de implante (mínimo baloneo inferior a 5segundos, decalcificación anular y medición rigurosa, avance de la prótesis plegada al tracto de salida VI y reposicionamiento mediante tracción de puntos guía).
El objetivo de nuestro estudio es analizar el impacto de la modificación de la técnica quirúrgica en el BAV postoperatorio con necesidad de implante de MCPD.
Material y métodosPacientesEntre octubre de 2013 y noviembre de 2017 fueron realizados en nuestro centro 438 RVA con prótesis PercevalS.
Se excluyeron del análisis estadístico los pacientes que fueron sometidos a una cirugía combinada valvular aórtica junto con cirugía mitral o tricuspídea asociada. También fueron excluidos los pacientes portadores de MCPD previo a la intervención. Además, se excluyó a los pacientes con endocarditis activa en el momento de la cirugía y los RVA realizados en los primeros 6meses del programa (15 casos), dado que se consideraron implantes incluidos en el tiempo correspondiente a la curva de aprendizaje de la técnica quirúrgica.
Se realizó un estudio retrospectivo, no aleatorizado, descriptivo y analítico de la serie. Los datos de todos los pacientes sometidos a cirugía fueron recogidos en nuestra base de datos. Entre los datos recogidos se incluyó: fecha quirúrgica, características del paciente (edad, talla, sexo, EuroscoreI y II, área de superficie corporal, índice de masa corporal, factores de riesgo cardiovascular, enfermedad pulmonar crónica obstructiva, arteriopatía periférica, daño renal previo, ritmo cardíaco previo), características de la ecocardiografía preoperatoria, tiempos de la cirugía, tamaño valvular implantado, complicaciones postoperatorias y características de la ecocardiografía de control al primer mes.
Se establecieron 2 grupos de análisis de tamaño de muestra (n) y sucesivos en el tiempo en función de la técnica quirúrgica utilizada. Se sometieron a los anteriormente citados criterios de exclusión.
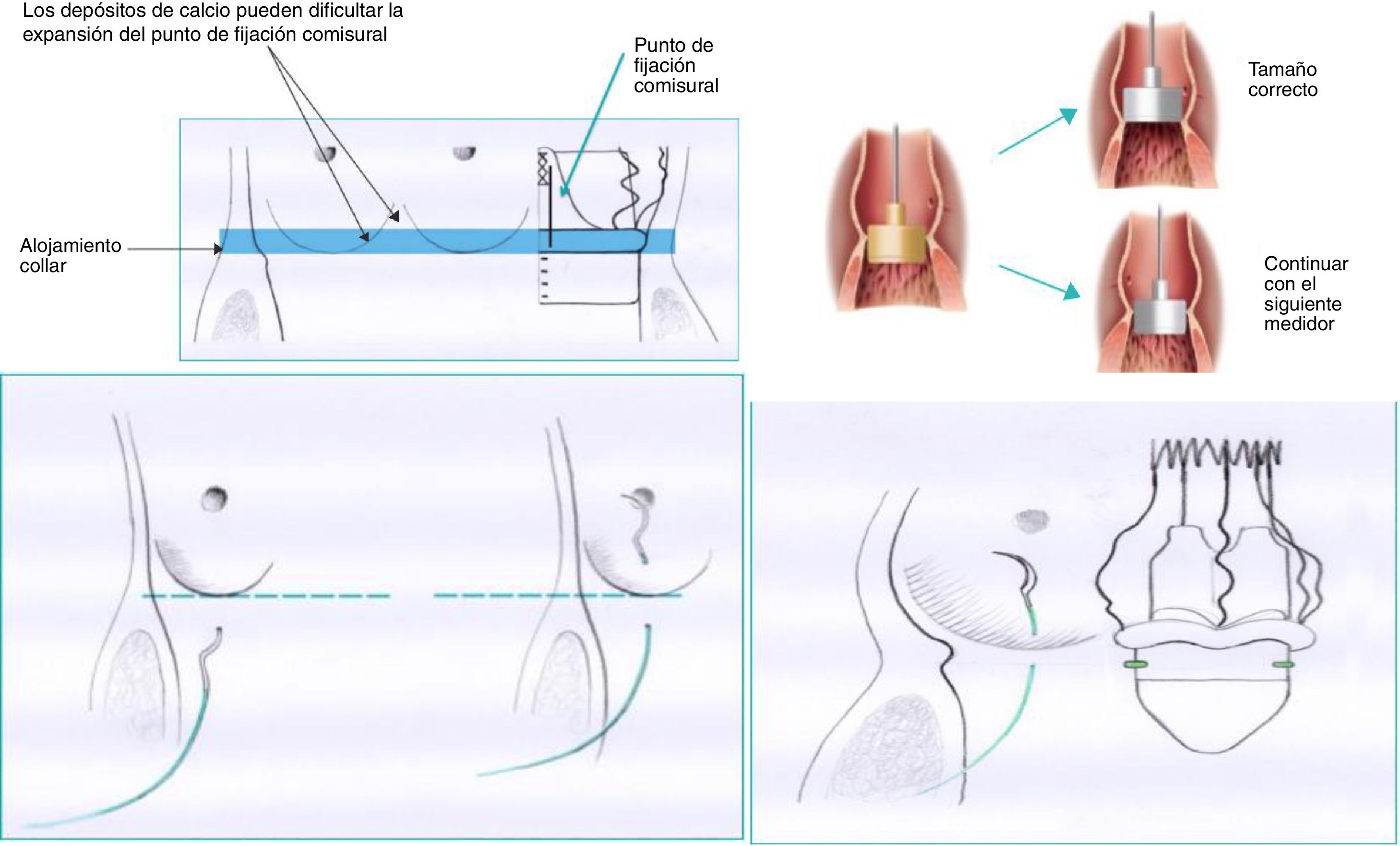
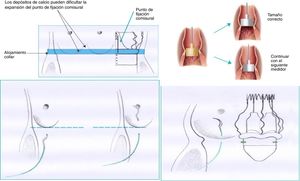
CirugíaGrupo estándar: 209 pacientes sometidos a RVA entre octubre de 2013 y noviembre de 2016. Se utilizó la técnica recomendada por la casa comercial. La técnica descrita recomienda utilizar los medidores de la propia casa comercial. A su vez, cada medidor se encuentra compuesto de dos medidores secundarios para cada tamaño valvular: un primer medidor transparente correspondiente con el diámetro inferior protésico, que debe poder introducirse en el tracto de salida del ventrículo izquierdo (VI), y un segundo medidor opaco, correspondiente al diámetro máximo protésico, que no debe poder introducirse en el tracto de salida del VI. Recomiendan colocar en los respectivos nadires tres puntos que utilizaremos como guía; deben tener 2-3mm de amplitud a ambos lados del anillo valvular. El posicionamiento de la prótesis se debe realizar mediante tracción de suturas previo al descenso de la prótesis. Finalmente se despliega la prótesis y se debe realizar baloneo a 4atmósferas de presión durante 30segundos. En la fase inicial del programa se recomendó una sutil decalcificación del anillo, y más adelante la casa comercial abogó por una decalcificación rigurosa (fig. 1).
Grupo modificado: 184 pacientes sometidos a RVA entre diciembre de 2016 y noviembre de 2017. En este grupo se usó la técnica modificada por nuestro servicio, en la que se realizó una decalcificación rigurosa del anillo valvular, se evitó la sobredimensión del anillo debido al tamaño protésico con una detallada medición del anillo. Creemos que el medidor opaco que simula el diámetro máximo protésico sí debe poder introducirse en el tracto de salida del VI, de forma similar a los medidores de prótesis aórticas convencionales (evitando así la sobredimensión del anillo y la infraexpansión de la prótesis en el despliegue). Se optó por avanzar la prótesis plegada hasta el tracto de salida del VI, reposicionando la prótesis mediante tracción de los puntos guía colocados en sus respectivos nadires inmediatamente por debajo del anillo valvular con escasa profundidad, menor de 2mm de amplitud. Finalmente se realizó un baloneo de la prótesis inferior a 5segundos, llegando durante ese intervalo de tiempo de 0 a 4atmósferas de presión de inflado.
Se utilizaron medidores específicos para PercevalS. En ambos grupos, el tamaño protésico implantado fue acorde a la medición realizada: S (19-21mm de diámetro anular), M (21-23mm), L (23-25mm) y XL (25-27mm).
Análisis estadísticoSe realizó un análisis descriptivo de todas las variables incluidas en el estudio. Las variables cuantitativas se expresaron como media (desviación estándar) o mediana (rango). Las variables cualitativas se expresaron como valor absoluto (n) y porcentaje. La comparación de medias se realizó por medio de la t de Student o test de Mann-Whitney, según procedió. La diferencia entre variables de grupo se analizó mediante el test de la t de Student para datos independientes. La asociación de variables cualitativas se estimó por medio del estadístico chi al cuadrado o Fisher. Un valor de p<0,05 se consideró estadísticamente significativo.
Los factores de riesgo para la presencia de BAV postoperatorio fueron evaluados mediante un análisis de regresión logística multivariante. Se estableció un modelo de regresión de carácter explicativo a partir de todos los modelos posibles a partir de las variables que consideramos influyentes en el BAV, que fueron: edad, talla, tamaño de la prótesis implantada, sexo, ritmo previo y técnica utilizada, así como sus respectivas interacciones de primer orden y la interacción talla con tamaño protésico, que fue considerada de relevancia. Se escogió el mejor modelo siguiendo el criterio del índice de información de Akaike (AIC), criterio de información bayesiana (BIC), test de Hosmer-Lemeshow y capacidad predictiva del modelo (AUC). Se calculó el riesgo relativo mediante regresión de Poisson corregida con estimación robusta de la varianza.
Los valores perdidos fueron tratados estadísticamente como valores desconocidos.
Se empleó el paquete informático StataCorp. 2015. Stata Statistical Software: Release 14. College Station, TX: StataCorp LP para el análisis estadístico.
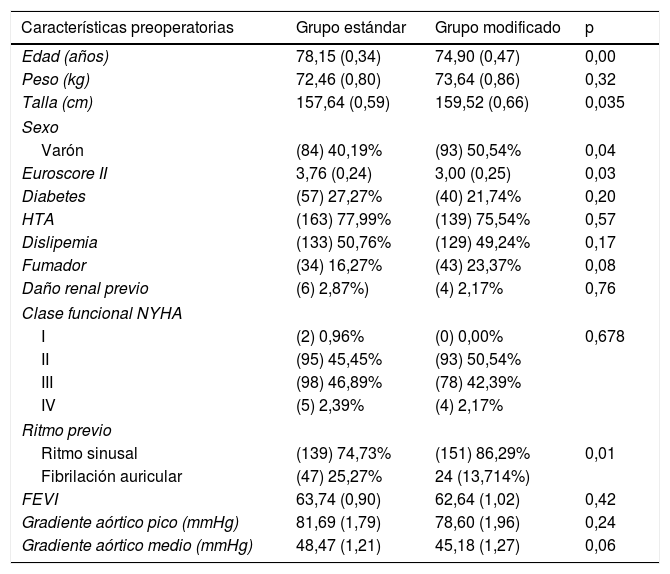
ResultadosSe recogieron las características preoperatorias de los pacientes (tabla 1). Existieron diferencias entre ambos grupos en: edad, 78,15 (0,34) años en el grupo estándar por 74,90 (0,47) años en el grupo modificado (p=0,00); talla, 157,64 (0,59) cm en el grupo estándar por 159,52 (0,66) en el grupo modificado (p=0.035); EuroscoreII, 3,76 (0,24) en el grupo estándar por 3,00 (0,25) en el grupo modificado (p=0,03); ritmo cardíaco previo, 139 (74,73%) en ritmo sinusal en el grupo estándar y 151 (86,29%) en el grupo modificado (p=0,006), y finalmente sexo, 8 (40,19%) varones en el grupo estándar por 93 (50,54%) en el grupo modificado (p=0,04).
Características preoperatorias
| Características preoperatorias | Grupo estándar | Grupo modificado | p |
|---|---|---|---|
| Edad (años) | 78,15 (0,34) | 74,90 (0,47) | 0,00 |
| Peso (kg) | 72,46 (0,80) | 73,64 (0,86) | 0,32 |
| Talla (cm) | 157,64 (0,59) | 159,52 (0,66) | 0,035 |
| Sexo | |||
| Varón | (84) 40,19% | (93) 50,54% | 0,04 |
| Euroscore II | 3,76 (0,24) | 3,00 (0,25) | 0,03 |
| Diabetes | (57) 27,27% | (40) 21,74% | 0,20 |
| HTA | (163) 77,99% | (139) 75,54% | 0,57 |
| Dislipemia | (133) 50,76% | (129) 49,24% | 0,17 |
| Fumador | (34) 16,27% | (43) 23,37% | 0,08 |
| Daño renal previo | (6) 2,87%) | (4) 2,17% | 0,76 |
| Clase funcional NYHA | |||
| I | (2) 0,96% | (0) 0,00% | 0,678 |
| II | (95) 45,45% | (93) 50,54% | |
| III | (98) 46,89% | (78) 42,39% | |
| IV | (5) 2,39% | (4) 2,17% | |
| Ritmo previo | |||
| Ritmo sinusal | (139) 74,73% | (151) 86,29% | 0,01 |
| Fibrilación auricular | (47) 25,27% | 24 (13,714%) | |
| FEVI | 63,74 (0,90) | 62,64 (1,02) | 0,42 |
| Gradiente aórtico pico (mmHg) | 81,69 (1,79) | 78,60 (1,96) | 0,24 |
| Gradiente aórtico medio (mmHg) | 48,47 (1,21) | 45,18 (1,27) | 0,06 |
FEVI: fracción de eyección, ventrículo izquierdo; HTA: hipertensión arterial; NYHA: New York Heart Association.
Sin embargo, no existieron diferencias en el peso ni en la proporción de pacientes con factores de riesgo cardiovascular (diabetes, hipertensión, fumadores), ni respecto a su clase funcional. Tampoco existieron diferencias estadísticamente significativas respecto a la fracción de eyección del VI ni en los gradientes transvalvulares aórticos pico y medio.
Los datos correspondientes al período intraoperatorio se recogen en la tabla 2. Hay que destacar que no existieron diferencias entre grupos (p=0,718).
Datos intraoperatorios
| Características intraoperatorias | Grupo estándar | Grupo modificado | p |
|---|---|---|---|
| Tamaño valvular | |||
| S | 52 (24,88%) | 34 (18,48%) | 0,258 |
| M | 67 (32,06%) | 75 (40,76%) | |
| L | 59 (28,23%) | 50 (27,17%) | |
| XL | 31 (14,83%) | 25 (13,59%) | |
| Cirugía CABG asociada | |||
| RVA aislado | 169 (80,86%) | 152 (81,68%) | 0,718 |
| Bypassx1 | 38 (18,18%) | 30 (16,30%) | |
| Bypassx2 | 1 (0,48%) | 1 (0,54%) | |
| Bypassx3 | 0 (0,0%) | 1 (0,54%) | |
| Bypassx4 | 0 (0,0%) | 0 (0,0%) | |
| Bypassx5 | 1 (0,48%) | 0 (0,0%) | |
CABG: cirugía de revascularización miocárdica con injerto de baipás arterial coronario.
Uno de los factores más importantes a analizar fue el tamaño de válvula implantada. En los grupos estándar y modificado se implantaron respectivamente 52 (24,88%) y 34 (18,48%) PercevalS; 67 (32,06%) y 75 (40,76%) PercevalM; 5 (28,23%) y 50 (27,17%) PercevalL, y 31 (14,83%) y 25 (13,59%) PercevalXL. No existieron diferencias entre grupos (p=0,258).
En relación con los BAV que precisaron implante de MCPD, el grupo estándar presentó 21 (10,05%) pacientes con BAV, mientras que el grupo modificado presentó 8 (4,35%). Existieron diferencias entre grupos (p=0,031).
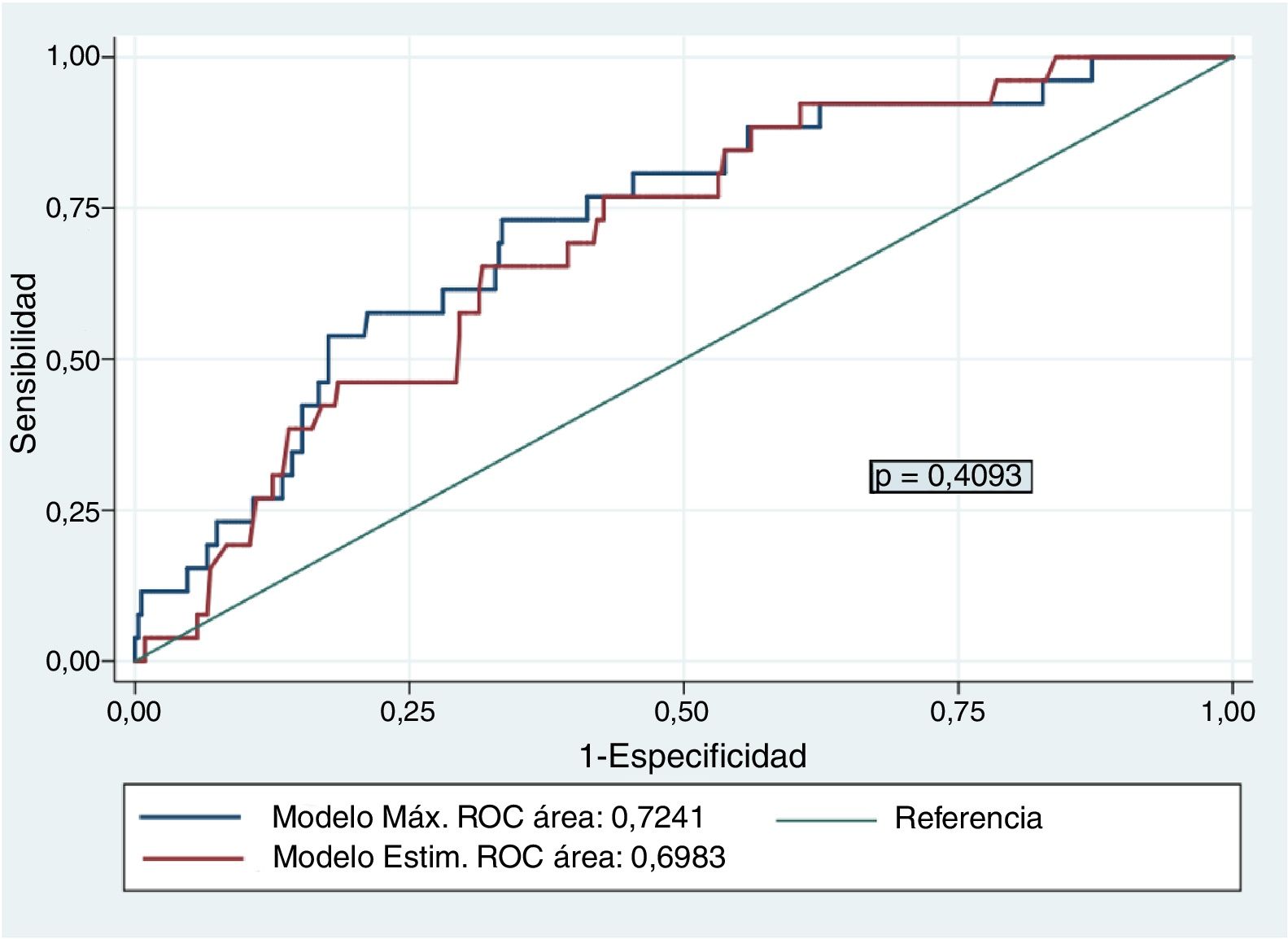
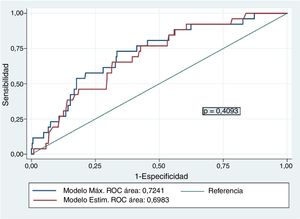
El modelo máximo de regresión logística multivariante para identificar factores que favorezcan el BAV estuvo compuesto por las variables: técnica utilizada, peso, sexo, edad, talla, ritmo cardíaco previo, tamaño protésico e interacción talla-tamaño protésico. El modelo de regresión explicativo escogido a partir de los citados criterios presentó como variables predictoras: técnica utilizada, talla del paciente, tamaño valvular y ritmo previo: AIC=189,8, BIC=217,0, test de Hosmer-Lemeshow >0,10 (p=0,671) y AUC=0,698. No hubo diferencias entre la capacidad de predicción del modelo máximo y el modelo estimado: AUC=0,7241 (0,05) con un intervalo de confianza del 95% (IC95%) de 0,63 a 0,82, frente a un AUC=0,698 (0,05), IC95% de 0,60 a 0,79, respectivamente (p=0,4093) (fig. 2). Consideramos el modelo con una capacidad predictiva promedio, aunque limitada7.
Se calcularon las correspondientes odd ratios (OR) para el modelo de regresión logística escogido. Además, para facilitar la interpretación de los datos se calcularon los riesgos relativos (IRR) mediante regresión de Poisson corregida con estimación robusta de la varianza. Se identificó como único factor de riesgo estadísticamente significativo la técnica de implante. En el análisis multivariante con el modelo de regresión logística de Poisson únicamente resultó estadísticamente significativa la técnica de implante de PercevalS. Realizamos los cálculos tomando como categoría de referencia inicialmente la técnica estándar: coeficiente de regresión beta=−1,103, IC95% de −2,03 a −0,17 (p=0,020); OR=0,31 (0,15), IC95% de 0,12 a 0,79 (p=0,015), e IRR=0,33 (0,16), IC95% de 0,13 a 0,85 (p=0.022). A continuación realizamos los cálculos tomando como categoría de referencia la técnica modificada, ya que el valor recíproco facilita la interpretación de los datos: coeficiente de regresión beta=1,100, IC95% de (0,17 a 2,03) (p=0,020); OR=3,27, IC95% de (1,26 a 8,50), p=(0,015), e IRR=3,01 (1,44), IC95% de 1,18 a 7,69 (p=0,022).
Se apreció una distribución característica en el análisis descriptivo entre talla y tamaño de prótesis implantada. Establecimos 4 grupos de pacientes en función del percentil de la talla de los sujetos y analizamos la distribución de los bloqueos en función del tamaño de las prótesis implantadas en cada uno de los grupos (tabla 3).
Distribución bloqueos
| Tamaño valvular | Q1 talla <152 cm | Q2 talla 152-157 cm | Q3 talla 158-164 cm | Q4 talla >164 cm | Total | |
|---|---|---|---|---|---|---|
| Perceval S | % BAVD | 5 (14,71%) | 0 (0,00%) | 1 (4,55%) | 0 (0,00%) | 6 |
| Total implantes | 34 | 28 | 22 | 2 | 86 | |
| Perceval M | % BAVD | 5 (10,20%) | 4 (11,11%) | 1 (2,86%) | 0 (0,00%) | 10 |
| Total implantes | 49 | 36 | 35 | 22 | 142 | |
| Perceval L | % BAVD | 0 (0,00%) | 3 (14,29%) | 1 (2,94%) | 3 (6,67%) | 7 |
| Total implantes | 9 | 21 | 34 | 45 | 109 | |
| Perceval XL | % BAVP | 0 (0,0%) | 3 (50,00%) | 0 (0,00%) | 3 (9,09%) | 6 |
| Total implantes | 2 | 6 | 15 | 33 | 56 | |
| Total | % BAVP | 10 (10,64%) | 10 (10,99%) | 3 (2,83%) | 6 (5,88%) | 29 |
| Total implantes | 94 | 91 | 106 | 102 | 393 | |
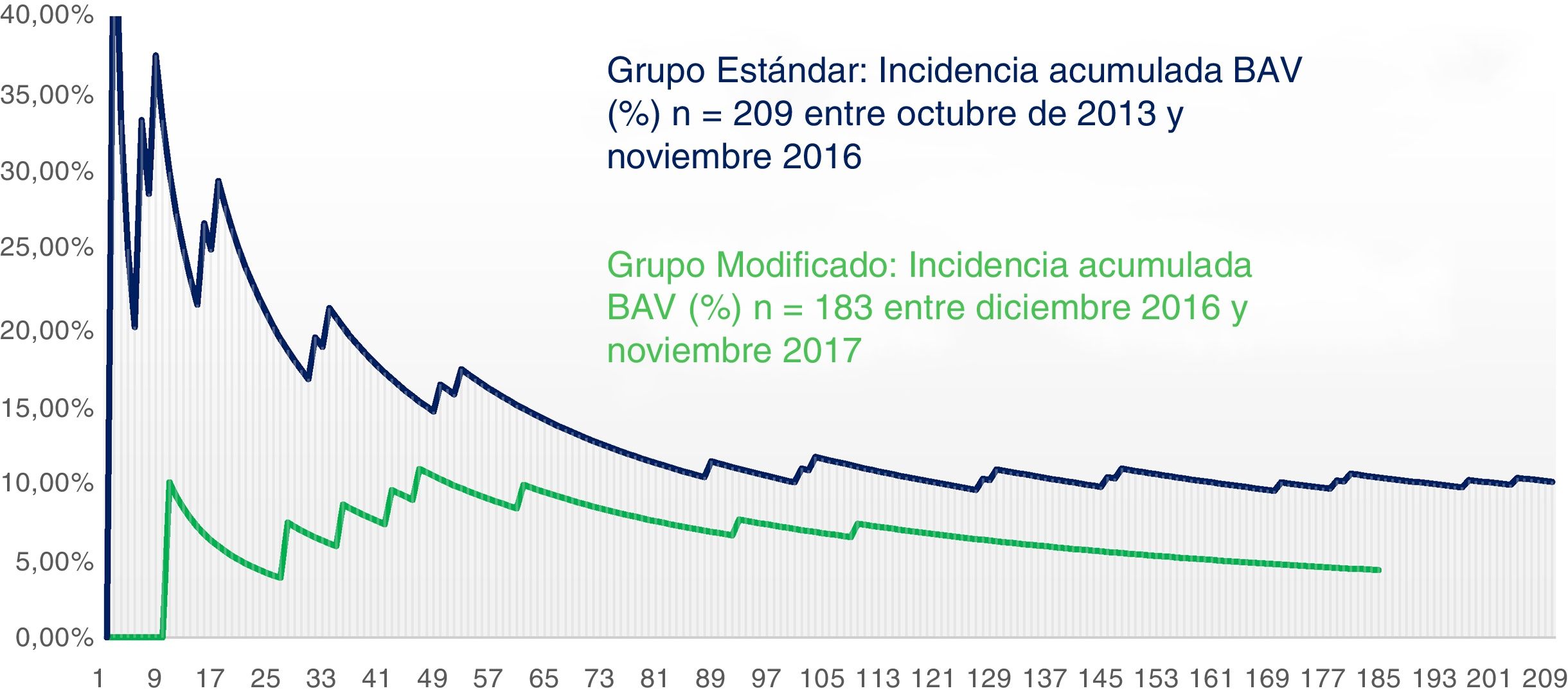
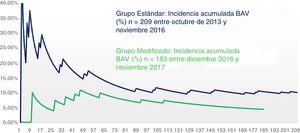
Se estableció una gráfica que mostrase la evolución de la prevalencia acumulada de BAV en el tiempo desglosada por grupo en función de la técnica utilizada (fig. 3). Se comparó gráficamente la prevalencia acumulada desde su primer paciente hasta el último para cada grupo. De forma global, la proporción de BAV se alzó por encima de un 15% en la fase inicial de nuestro programa, para ir poco a poco descendiendo progresivamente hasta encontrarse a día de hoy en un 6% en términos absolutos de nuestra serie. Si nos referimos a los últimos 100 pacientes sometidos a RVA con PercevalS las tasas se reducen por debajo del 3% de BAV. En la figura 3 observamos como en ambos grupos las tasas iniciales de BAV son elevadas, hecho probablemente atribuible a la curva de aprendizaje de ambas técnicas. Después ambas tasas descienden significativamente en el tiempo, existiendo desde el inicio, y a lo largo de toda la curva, una diferencia significativa mantenida en el tiempo entre el grupo estándar y el grupo modificado.
DiscusiónLa prótesis Perceval S comenzó implantándose inicialmente en pacientes de riesgo elevado8. Actualmente se han reportado excelentes resultados en términos de morbimortalidad, complicaciones y comportamiento hemodinámico, por lo que su indicación en el RVA se ha ido expandiendo.
Sin embargo, se ha reportado una alta tasa de BAV postoperatorio que precisa implante de MCPD, alcanzando valores entre el 8 y el 23%6,9-11. Las tasas de implante de MCPD en el RVA convencional se encuentran en torno al 3-4%11. Recientemente se han publicado las consecuencias que sufren los pacientes sometidos a RVA que precisan implante de MCPD postoperatorio, con un aumento de la mortalidad a largo plazo y un aumento de las complicaciones postoperatorias inmediatas12.
Se han intentado definir las causas o factores de riesgo que ocasionan esta alta incidencia de BAV, con el objetivo de identificar a los pacientes de riesgo. La evidencia científica concluye que la fuerza radial que provoca el mecanismo autoexpandible de la prótesis PercevalS podría ser la principal causa del BAV, de la misma forma que ocurre en las TAVI13. Sin embargo, en las prótesis Perceval la tecnología termosensible con Nitinol y la posibilidad de decalcificar el anillo aórtico en lugar de impactar los depósitos de calcio contra el mismo favorecen una tasa de bloqueos menor respecto a las TAVI, que en ocasiones se alza hasta un 20%14.
Nuestro principal objetivo es demostrar cómo podemos disminuir el número de los BAV modificando la técnica de implante. También, intentar identificar factores de riesgo que puedan influir en el BAV tras implante de Perceval S.
Nuestro grupo observó que la tasa de BAV en la fase inicial del programa era elevada, por lo que decidió modificar el protocolo del servicio de la técnica de implante en diciembre de 2016.
Se realizaron una serie de cambios. Se minimizó el tiempo de baloneo de la prótesis, inferior a 5segundos, alcanzando las 4atmósferas en ese intervalo de tiempo, factor que ya fue modificado por otros grupos y descrito en la literatura5,15, demostrándose que no ocasiona un mayor número de fugas ni alteración en el comportamiento hemodinámico de la prótesis. Se realizó una exhaustiva medición del anillo (comprobando que el medidor opaco se introduce y ajusta al anillo aórtico correctamente, como hemos descrito previamente) evitando la sobredimensión del mismo, así como una minuciosa decalcificación. Por tanto, se evitó que la prótesis implantada generase una fuerza radial mayor de la esperada y ocasionase consecuentemente BAV postoperatorio. Se colocaron puntos guía con escasa profundidad (1mm). Finalmente se avanzó la prótesis, plegada, hasta el tracto de salida del VI; se reposicionó a nivel del anillo mediante tracción de los puntos guía, evitando el posicionamiento bajo de la prótesis, lo que podría facilitar que la prótesis contactase con el septo membranoso y comprimiera el nodo auriculoventricular10.
Utilizando esta técnica hemos conseguido reducir la incidencia de BAV a porcentajes similares a los que ocurren en el RVA con prótesis convencional. El pico inicial en ambos grupos podría ser en parte ocasionado por la curva de aprendizaje, y el descenso progresivo, mucho más marcado en el grupo modificado, podría ser atribuible principalmente al uso de nuestra técnica modificada, dada la repercusión estadística.
Si observamos el análisis estadístico, la talla y el tamaño valvular no alcanzan la significación como factores de riesgo, pero descriptivamente, si observamos la tabla 3, destaca la existencia de una incidencia de bloqueos mucho más elevada, principalmente en pacientes de talla baja, sobre todo cuando se colocan prótesis de tamaño grande (L o XL) en pacientes por debajo del percentil 50 de talla (factor relacionado directamente con un anillo valvular pequeño)16,17. En estos pacientes se observan tasas de hasta el 50% de BAV postoperatorio. Podría existir sobredimensión del anillo en muchos de los pacientes que terminan por padecer esta complicación.
ConclusiónProbablemente sería necesario ampliar la serie para identificar otros factores de riesgo sobre el BAV postimplante ocasionado por la prótesis PercevalS.
En nuestra serie, en los pacientes sometidos a RVA con prótesis PercevalS con técnica modificada disminuye el riesgo de presentar BAV postoperatorio respecto a los pacientes operados con la técnica estándar.
LimitacionesLa principal limitación de nuestro estudio es que se trata de un estudio retrospectivo y descriptivo.
A pesar de tener una amplia serie de 438 pacientes, los grupos de comparación se establecieron en función de la técnica utilizada. Existieron ligeras diferencias que alcanzaron la significación estadística en edad, EuroscoreII y ritmo previo.
También existieron diferencias entre grupos en la talla, siendo inferior en el grupo estándar, factor que podría aumentar el riesgo de BAV.
Por último, tampoco disponemos de un estudio electrofisiológico previo a la cirugía de todos nuestros pacientes.
Conflicto de interesesNo existen conflictos de intereses.