La ecocardiografía transesofágica constituye una herramienta diagnóstica esencial en la patología de la aorta, permitiendo un diagnóstico y la instauración de un tratamiento médico o quirúrgico precoz, así como la monitorización durante la cirugía. La ecocardiografía permite un diagnóstico rápido, preciso y aplicable a pacientes inestables hemodinámicamente y con dificultades para ser trasladados para otras pruebas de imagen. El interés en la formación y el reconocimiento de las imágenes ecocardiográficas por parte del cirujano cardiovascular es cada vez mayor. En este artículo revisaremos la identificación de las distintas entidades patológicas aórticas mediante la ecocardiografía transesofágica (disección aórtica aguda, hematoma intramural, úlcera penetrante, aneurismas aórticos, aneurismas de seno de Valsalva, ateroesclerosis aórtica y traumatismos aórticos).
Transesophageal echocardiography is an essential diagnostic tool in the pathology of the aorta allowing early diagnosis and establishment of medical and early surgical treatment and monitoring during surgery. Echocardiography enables fast and accurate diagnoses and it is applicable to haemodynamically unstable patients with difficulties to be transferred for different image test. There is an increasing interest in training and recognition of echocardiographic images by the cardiovascular surgeons. This article will review the identification of aortic pathologies by transesophageal echocardiography (acute aortic dissection, intramural hematoma, penetrating ulcer, aortic aneurysms, aneurysm of sinus of Valsalva, aortic atherosclerosis and aortic trauma).
El interés en la interpretación y la identificación de las imágenes ecocardiográficas por parte del cirujano cardiovascular es cada vez más relevante en la práctica clínica tanto para una mejor comprensión de la patología aórtica como para el diseño de la estrategia terapéutica a seguir.
La aorta presenta distintos tipos de lesiones, desde procesos benignos hasta disecciones que comprometen la vida. Debido a la elevada morbimortalidad de estas entidades y a la necesidad de instaurar un tratamiento médico o quirúrgico de forma precoz, es fundamental disponer de técnicas diagnósticas rápidas y precisas que puedan ser aplicadas en enfermos en situación crítica e inestable hemodinámicamente. La ecocardiografía presenta la ventaja con respecto a otras modalidades diagnósticas (tomografía helicoidal [TAC] y resonancia magnética [RMN]) de permitir la exploración y el diagnóstico a pie de cama. La ecocardiografía transtorácica (ETT) y la transesofágica (ETE) permiten, mediante la adquisición de múltiples planos, la visualización de prácticamente toda la aorta torácica en su extensión, siendo la ETE un modo diagnóstico fundamental para la identificación de la patología aórtica y la comprensión fisiopatológica de estas entidades. Tanto por la utilidad diagnóstica como por su papel en el periodo perioperatorio, la Sociedad de Anestesiólogos Cardiotorácicos (SCA) y la Sociedad Americana de Ecocardiografía (ASE) recomiendan la utilización sistemática de la ETE en todos los procedimientos quirúrgicos sobre la aorta torácica con un grado de evidencia B21. En este artículo revisaremos la identificación de las distintas entidades patológicas aórticas mediante la ETE (tabla 1).
Patología de la aorta
| Síndrome aórtico agudo |
| Disección aórtica |
| Hematoma intramural |
| Úlcera penetrante |
| Aneurismas aórticos, enfermedades del tejido conectivo (enfermedad de Marfan, Ehlers-Danlos), procesos infecciosos (aneurismas sifilíticos o micóticos) |
| Aneurisma de seno de Valsalva |
| Aterosclerosis aórtica |
| Traumatismos aórticos |
La proximidad del esófago a la aorta sin la interferencia de la pared torácica o del pulmón permite obtener imágenes de buena calidad. No obstante, el tercio superior de la aorta ascendente no puede visualizarse con precisión debido a la interposición del bronquio izquierdo entre el esófago y la aorta, lo cual constituye una limitación a tener en cuenta.
Para una correcta valoración es fundamental la utilización de todos los planos posibles. Estos se obtienen mediante la combinación de los movimientos básicos de la sonda ETE en el interior del eje esofagogástrico: 1.Avance y retroceso. 2.Flexión anterior y posterior del transductor (extremo distal). 3.Giro axial a la derecha y a la izquierda de la sonda. 4.Rotación electrónica del plano ecográfico entre 0 y 180°.
Mediante ecocardiografía, la pared torácica mide menos de 3mm. El diámetro de la raíz de la aorta es de menos de 3,1 cm, a nivel de los senos de Valsalva es menor a 4,5 cm y de menos de 3,6 cm a nivel de la porción tubular de la aorta ascendente. La aorta descendente tiene un diámetro normalmente menor de 3,5±2cm.
- •
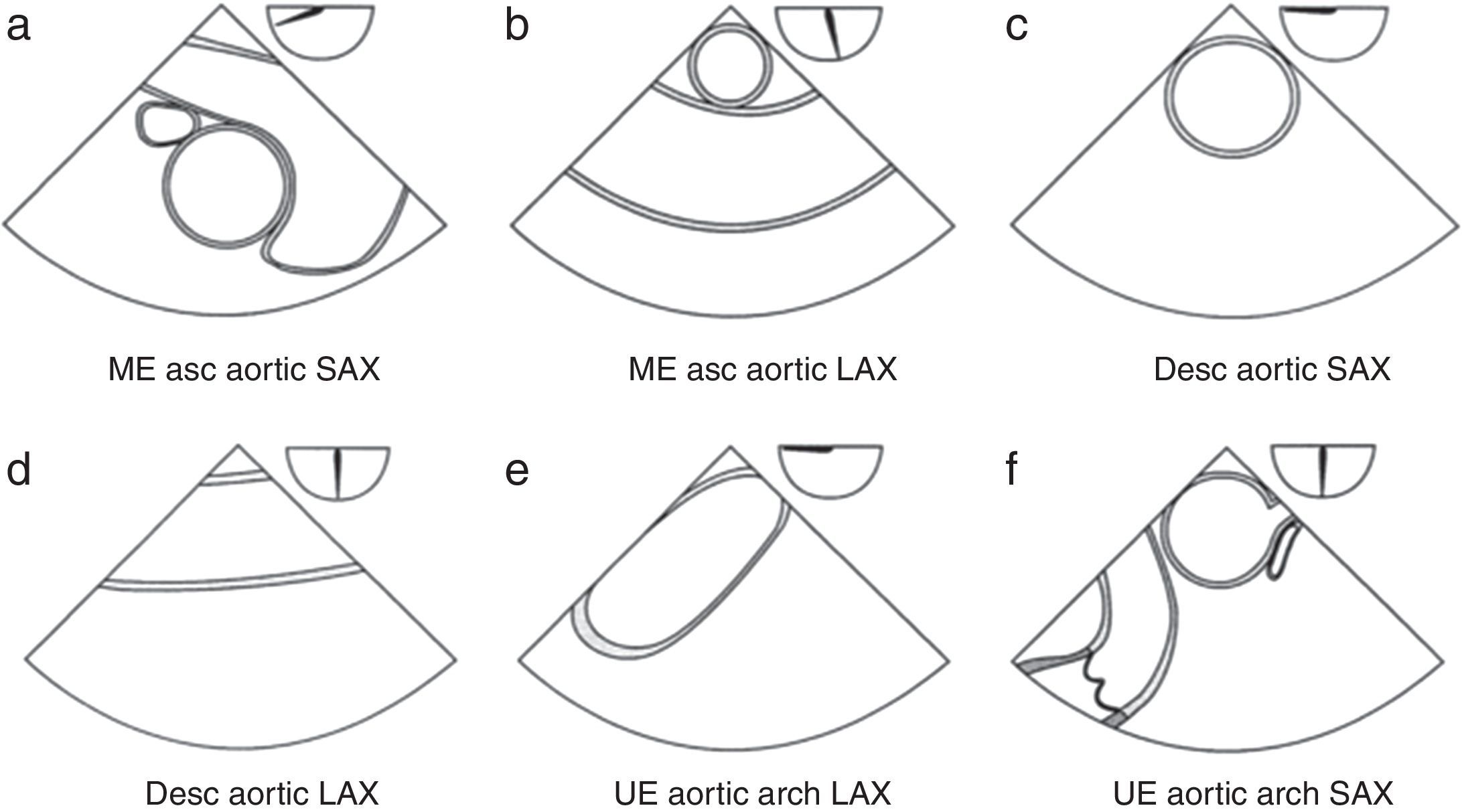
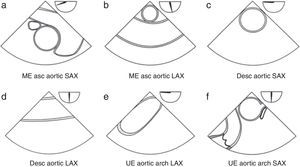
Recomendaciones de examen de la aorta ascendente2,3 (fig. 1)
- 1.
Plano esofágico alto 0-10°: arco aórtico en eje largo (fig. 2a).
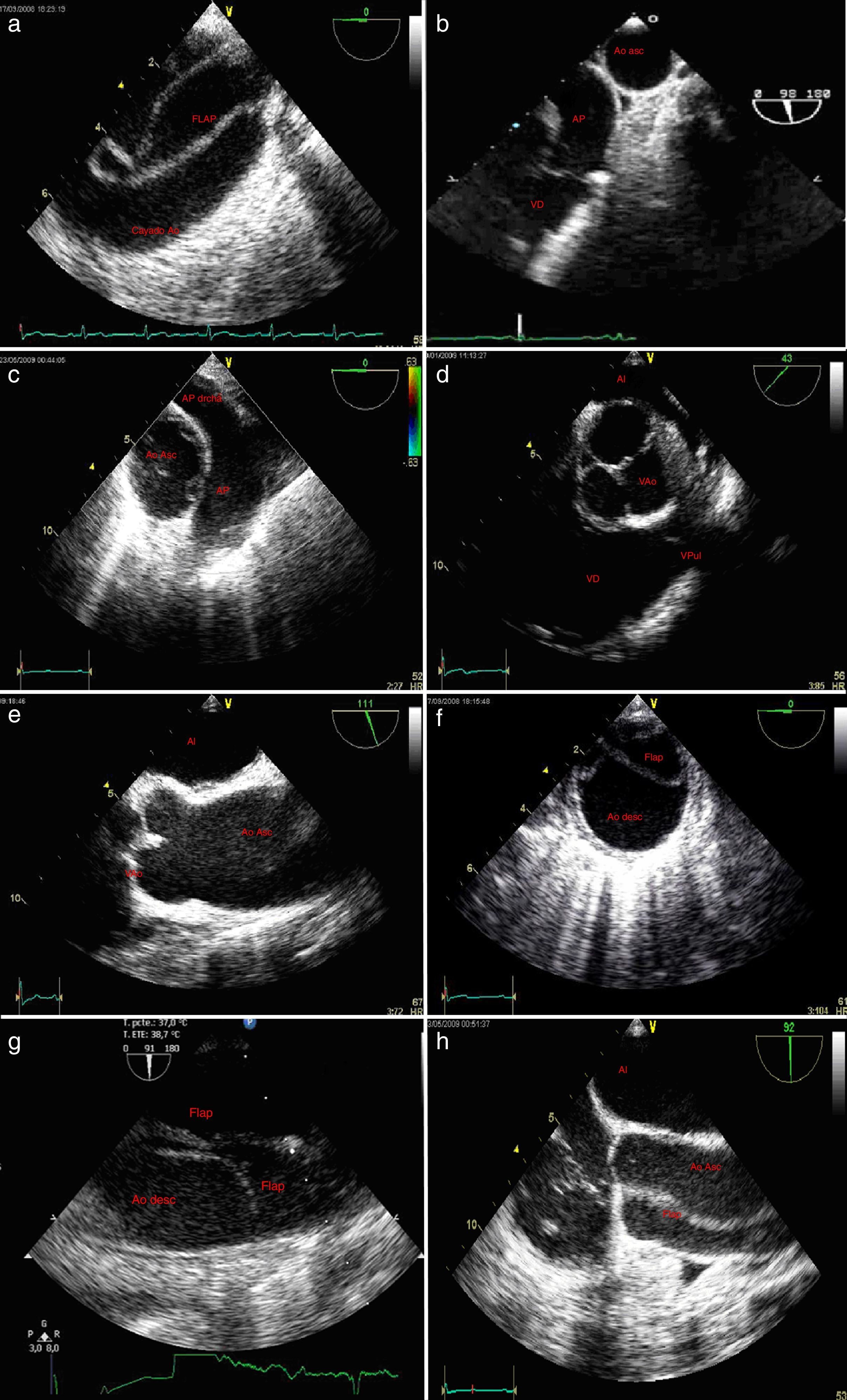
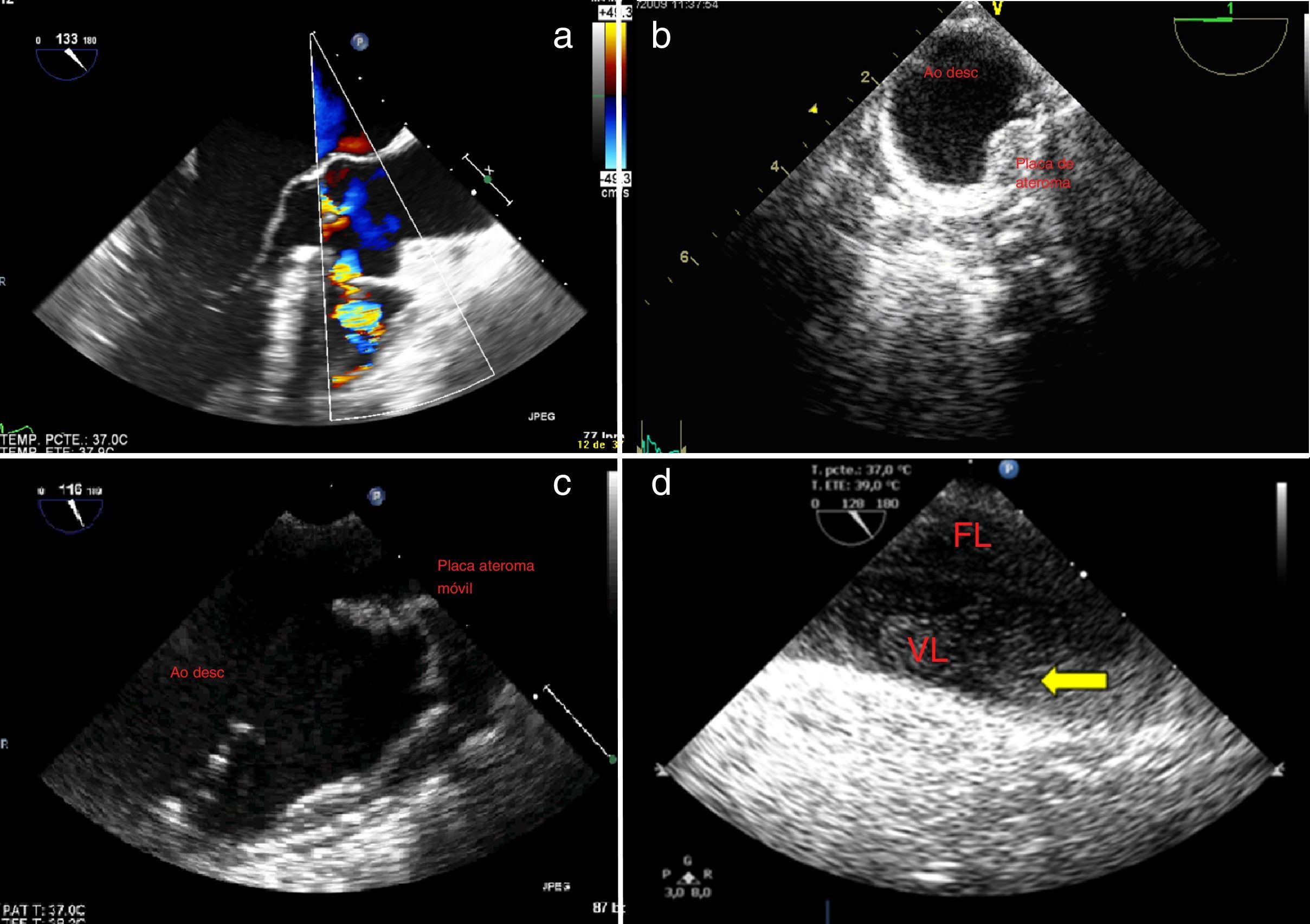
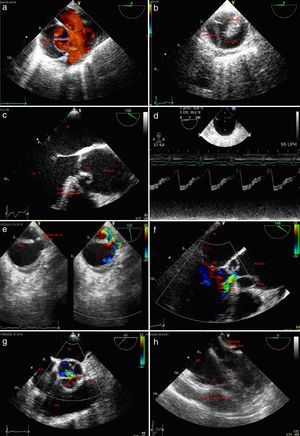
Figura 2.a)Plano esofágico alto 0-10°: arco aórtico en eje largo; disección aórtica con flap intimal. b)Plano esofágico alto 90°: válvula pulmonar y tronco de arteria pulmonar adyacente a aorta ascendente en eje corto. c)Plano medioesofágico 0-10°: aorta ascendente en eje corto adyacente a la arteria pulmonar principal y su rama derecha. d)Plano medioesofágico 30-50°, válvula aórtica eje corto; e)Plano medioesofágico 120°: válvula aórtica eje largo. f)Eje corto de la aorta descendente; evidencia de flap endoluminal. g)Eje largo de la aorta torácica descendente; disección aórtica con flap intimal. h)Plano medio esofágico eje largo de aorta ascendente; disección aórtica con flap intimal.
AD: aurícula derecha; AI: aurícula izquierda; Ao Asc: aorta ascendente; Ao Desc: aorta descendente; AP: arteria pulmonar tronco principal; AP derecha: arteria pulmonar derecha; LF: luz falsa; LV: luz verdadera; S-G: Swan-Ganz; VAo: válvula aórtica, VD: ventrículo derecho; VI: ventrículo izquierdo; VPul: válvula pulmonar.
- 2.
Plano esofágico alto 90°: válvula pulmonar y tronco de arteria pulmonar adyacente a aorta ascendente en eje corto (fig. 2b).
- 3.
Plano medioesofágico 0-10°: aorta ascendente en eje corto adyacente a la arteria pulmonar principal y su rama derecha (fig. 2c).
- 4.
Plano medioesofágico 30-50°, válvula aórtica eje corto (fig. 2d).
- 5.
Plano medioesofágico, válvula aórtica eje largo 120°: permite realizar las mediciones del anillo, de los senos de Valsalva y de la unión senotubular. Desde aquí, mediante la retirada unos centímetros de la sonda y la reducción de unos grados, podemos explorar la aorta ascendente (fig. 2e).
Figura 1.Protocolo de examen recomendado por la Sociedad Americana de Ecocardiografía (ASE) y la Sociedad de Anestesiología Cardiovascular (SCA). Esquemas de la visión transesofágica que componen el examen ecocardiográfico recomendado para la evaluación de la aorta ascendente y descendente.
Asc: ascendente; AV, válvula aórtica; Desc: descendente; LAX: eje largo; ME: esófago medio; SAX: eje corto; TG: transgástrico; UE, esofágico superior.
- 1.
- •
Recomendaciones de examen de la aorta descendente (fig. 1)
- 1.
Eje corto de la aorta descendente. Desde el plano medio esofágico 0° se gira el transductor hacia la izquierda hasta visualizar la aorta descendente en eje corto. Es necesario optimizar la profundidad para una adecuada visualización de la aorta. Avanzado el transductor hacia arriba y hacia abajo se puede visualizar toda la aorta torácica descendente desde el arco aórtico y la parte superior de la aorta abdominal (fig. 2f).
- 2.
Eje largo de la aorta torácica descendente. Desde el plano anterior se rota hasta 90°. Es recomendable usar doppler color en cada uno de los planos (fig. 2g).
- 3.
A nivel esofágico alto 0° desde la posición anterior se puede visualizar el arco aórtico en eje largo (fig. 2a). Rotando al plano de 90° grados se puede visualizar el arco aórtico en eje corto.
- 1.
El síndrome aórtico agudo incluye la disección aórtica, el hematoma intramural y la úlcera penetrante. Estas entidades difieren en su patogenia y en su aspecto ecográfico, aunque frecuentemente se solapan en la presentación clínica, la historia natural del proceso y el manejo. De hecho, estas 3entidades pueden constituir una amenaza para la vida y requieren un rápido diagnóstico y la aplicación de un tratamiento precoz4.
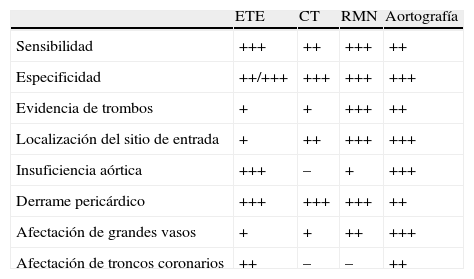
Disección aórticaLa disección aórtica se define como la separación de la capa media de la aorta con presencia de sangre extraluminal entre las capas de la pared aórtica. Su diagnóstico se basa en la demostración del flap intimal que separa la verdadera y la falsa luz. El diagnóstico rápido y exacto es obligado para instaurar el adecuado tratamiento médico y/o quirúrgico. Clásicamente el método diagnóstico de elección había sido la aortografía, actualmente relegada por otras técnicas de imagen como el TAC, la ecocardiografía (ETT y ETE) y la RMN, que se han incorporado como herramientas de extremada utilidad5 (tabla 2).
Diagnóstico de la patología aórtica y sus complicaciones por técnicas de imagen
| ETE | CT | RMN | Aortografía | |
| Sensibilidad | +++ | ++ | +++ | ++ |
| Especificidad | ++/+++ | +++ | +++ | +++ |
| Evidencia de trombos | + | + | +++ | ++ |
| Localización del sitio de entrada | + | ++ | +++ | +++ |
| Insuficiencia aórtica | +++ | – | + | +++ |
| Derrame pericárdico | +++ | +++ | +++ | ++ |
| Afectación de grandes vasos | + | + | ++ | +++ |
| Afectación de troncos coronarios | ++ | – | – | ++ |
ETE: ecocardiografía transesofágica; RMN: resonancia magnética nuclear (+, graduación de la importancia y la sensibilidad en la detección; TAC: tomografía computarizada.
De Khalil et al.8.
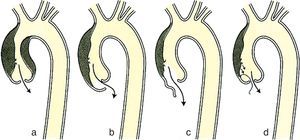
Las disecciones se clasifican mediante 2sistemas en función de dónde se localiza la rotura de la íntima.
- •
Clasificación de Standford:
Tipo A. Afecta a la aorta ascendente con o sin afectación de la aorta descendente.
Tipo B. Afecta a la aorta descendente.
- •
Clasificación de DeBakey:
Tipo I. La disección empieza en la aorta ascendente y afecta a un segmento variable de la aorta descendente.
Tipo II. La disección queda confinada a la aorta ascendente.
Tipo III. La disección se origina distal a la arteria subclavia izquierda y puede quedar limitada a la aorta torácica (tipoiiia) o extenderse hacia la aorta abdominal (tipoiiib).
Como hemos mencionado, las distintas entidades que constituyen el síndrome aórtico pueden ser signos de una disección en progreso. Es por ello que recientemente se ha propuesto una nueva clasificación6:
Clase 1. Disección aórtica clásica. Esta puede dividirse a su vez en comunicantes y no comunicantes.
Clase 2. Hematoma intramural.
Clase 3. Disección aórtica discreta. Se caracteriza por una separación de la íntima con exposición de la media y la adventicia pero sin progresar a la separación de las distintas capas. En estas ocasiones el diagnóstico de certeza solo puede hacerse con aortografía7.
Clase 4. Rotura de una placa y ulceración.
Clase 5. Disección traumática e iatrogénica.
La ETE se ha convertido en la modalidad diagnóstica de primera elección para la evaluación de una disección aguda en un paciente inestable hemodinámicamente y para la evaluación perioperatoria. Su uso está ampliamente extendido, es semiinvasivo, con una adecuada rentabilidad coste-efectividad y puede ser realizado rápidamente a pie de cama. La realización del estudio requiere entre 5 y 20min8. La presencia de un flap endoluminal en al menos 2vistas diferentes permite realizar el diagnóstico. No obstante, la región distal de la aorta ascendente y la proximal del arco aórtico puede no ser adecuadamente visualizadas mediante estas técnicas. La ETE permite asimismo la detección de complicaciones como la insuficiencia aórtica, el derrame pericárdico o la afectación de las arterias coronarias. Del mismo modo, aporta valiosa información sobre la función cardiaca y presencia de otras válvulopatías cardiacas. Los últimos estudios valorando su papel han demostrado una sensibilidad del 86-100%, una especificidad del 90-100%, un valor predictivo positivo del 90-100% y un valor predictivo negativo del 86-100%9-14. En conclusión, por la rapidez, la exactitud y la seguridad en los pacientes con sospecha de disección aguda, fundamentalmente con inestabilidad hemodinámica, la ecografía, especialmente la ETE, es considerada la primera prueba diagnóstica15-17. En pacientes con disecciones crónicas o para evaluación posterior, la RMN parece ser la mejor opción diagnóstica18.
El examen de la aorta debe ser lo más completo y sistemático posible. Dos regiones son especialmente sensibles como punto de entrada de las disecciones y deben ser estudiadas con especial interés: la unión senotubular en la aorta ascendente y la región distal a la salida de la arteria subclavia. Estas 2regiones tienen que ser cuidadosamente examinadas.
El diagnóstico de disección se basa en la demostración del flap intimal que separa la verdadera y la falsa luz (fig. 2a,f,g,h y fig. 3a,c). La evidencia de ese flap en la ecografía y la presencia de flujo mediante doppler color a ambos lados del flap son los hallazgos más importantes ante la sospecha de disección. Sin embargo, estos criterios son demasiado restrictivos y la experiencia ha demostrado que se necesitan criterios más amplios.
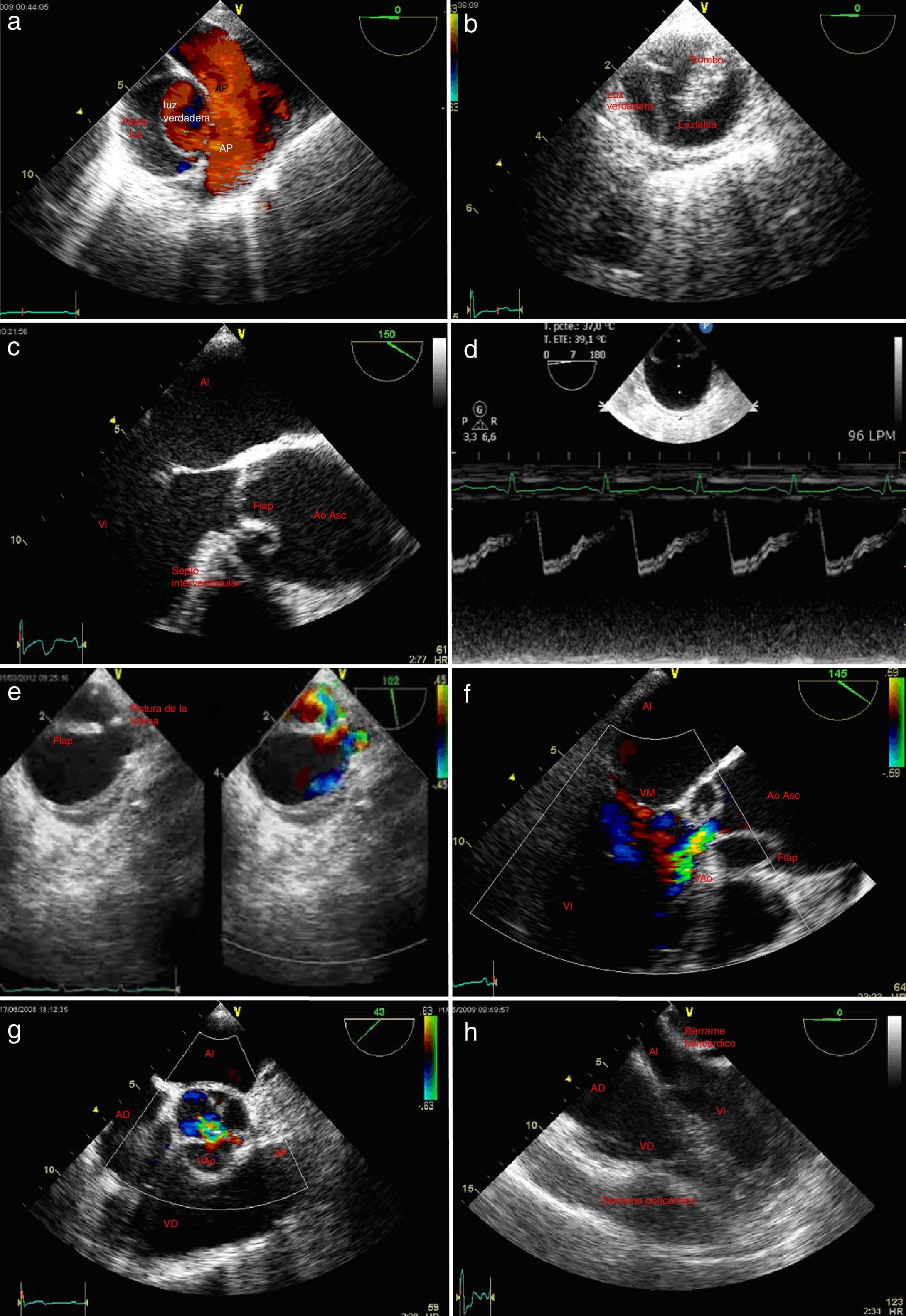
a)Plano medioesofágico aorta ascendente en eje corto y doppler color; disección aórtica con flujo en luz verdadera y arteria pulmonar. b)Eje corto de aorta descendente torácica; disección aórtica con luz falsa parcialmente coagulada. c)Plano medio esofágico eje largo de aorta ascendente; desplazamiento central de la calcificación de la íntima; flap intimal introduciéndose en el tracto de salida del ventrículo izquierdo. d)Imagen 2D y modoM de aorta ascendente en eje corto; evidencia de flap endoluminal; se observa en sístole expansión de la luz verdadera que corresponde a la de menor tamaño. e)Eje corto de cayado aórtico; identificación de la puerta de entrada mediante doppler color. f)Plano medio esofágico eje largo con doppler color; disección aórtica e insuficiencia aórtica. g)Plano medioesofágico 40° eje corto de la válvula aórtica; mediante doppler color se evidencia flujo de regurgitación aórtica central. h)Plano medioesofágico 0°, 4cámaras; derrame pericárdico con colapso de ventrículo derecho y aurícula izquierda.
AD: aurícula derecha; AI: aurícula izquierda; Ao Asc: aorta ascendente; Ao Desc: aorta descendente; AP: arteria pulmonar tronco principal; AP derecha: arteria pulmonar derecha; LF: luz falsa; LV: luz verdadera; S-G: Swan-Ganz; VAo: válvula aórtica, VD: ventrículo derecho; VI: ventrículo izquierdo; VPul: válvula pulmonar.
Otros hallazgos característicos son:
- -
Presencia de trombos o trombosis completa de la luz falsa (fig. 3b). La formación de trombos en la falsa luz depende del tipo de disección y del flujo y localización de la puerta de entrada. La trombosis de la falsa luz es más frecuente en la aorta descendente que en la aorta ascendente. La formación inicial de trombos en la falsa luz ha sido considerada un signo de buen pronóstico a corto plazo y no parece afectar la mortalidad a largo plazo19. Sin embargo, la persistencia de trombosis parcial de la falsa luz en las disecciones crónicas tipoB es un predictor independiente de mortalidad al alta20.
- -
Separación de las paredes de la aorta desde el trombo (fig. 3b).
- -
Desplazamiento central de la calcificación de la íntima con imágenes hiperecogénicas dentro de la aorta (fig. 3c).
- -
Identificación del sitio de entrada y su localización y la extensión de la disección. La identificación de la localización y la extensión son factores muy importantes que determinan el tipo de disección y el abordaje terapéutico. La resección quirúrgica del sitio de entrada, así como la localización y el tamaño de la puerta de entrada tras la cirugía, son factores determinantes del éxito quirúrgico y de la incidencia de complicaciones tardías21.
El sitio de entrada constituye una disrupción o solución de continuidad en el flap. Se identifica mediante el doppler color evidenciando flujo turbulento desde la luz verdadera a la luz falsa (fig. 3e). Habitualmente mide más de 5mm. En aproximadamente el 70% de los casos el desgarro de la íntima ocurre a 1-3cm por encima de seno de Valsalva derecho o izquierdo. En el 30% restante el desgarro suele tener lugar a nivel del ligamento arterioso en la aorta descendente. Para identificar la localización exacta se puede estimar conociendo la profundidad de inserción de la sonda transesofágica en relación a estructuras conocidas, como la arteria subclavia o los senos de Valsalva. En las disecciones tipoB es posible identificar la entrada hasta en el 90% de los casos, y en las de tipoA, en el 83%22.
La utilización del doppler color permite visualizar pequeñas comunicaciones entre luz verdadera y falsa, principalmente en la aorta descendente. Estas comunicaciones suelen ser inferiores a 3mm y en la aorta descendente podrían corresponder a los ostium de las arterias intercostales o lumbares. Es importante diferenciar estas comunicaciones secundarias del desgarro intimal principal.
En ocasiones no es posible la identificación del punto de entrada, y en otras la exploración de la aorta ascendente distal y el tercio proximal del arco aórtico es pobre y no permite su estudio. La mayor parte de los errores diagnósticos publicados son debidos a no diagnosticar la afectación de este segmento en disecciones tipoiii con extensión retrógrada a la parte distal de la aorta ascendente. Para evitarlo es preciso complementar siempre el estudio ETE con un estudio transtorácico utilizando la ventana paraesternal derecha alta2.
En más del 70% de los casos la disección de aorta ascendente se extiende a lo largo de la aorta descendente23,24.
- -
Identificación de la luz verdadera y falsa. La identificación de ambas puede resultar difícil. Múltiples signos indirectos identifican a ambas.
- •
La luz falsa suele ser más grande y tener menos flujo que la luz verdadera.
- •
La luz verdadera se expande en sístole y se comprime en diástole. El modoM permite evidenciar como la íntima se mueve hacia la falsa luz al inicio de la sístole por expansión de la luz verdadera (fig. 3d).
- •
Contraste espontáneo en la luz falsa.
- •
La luz verdadera tiene una capa interna más débil ecogénicamente y la luz falsa presenta una capa más brillante ecogénicamente adyacente a la luz aórtica.
- •
Mediante doppler color, en la luz verdadera se puede observar flujo sistólico laminar, mientras que en la luz falsa el flujo es turbulento y variable. Sin embargo, en las roturas proximales y grandes el flujo en la luz falsa puede tener similar dirección y tiempo con respecto a la sístole en relación al flujo en la luz verdadera. En las disecciones distales con puntos de entrada pequeños el flujo en la luz falsa no es parecido al flujo en la luz verdadera.
- •
Ocasionalmente entre la luz verdadera y la luz falsa se puede identificar flujo bidireccional entre la luz falsa y verdadera.
- •
Trombosis de la falsa luz: es un signo indirecto de disección de aorta. Se manifiesta como una masa en la luz vascular (fig. 3b). Asimismo, un engrosamiento de más de 15mm de la pared aórtica es considerado un signo de disección sugestivo de trombosis de la falsa luz, y en esta situación es difícil evidenciar el movimiento del flap. Las áreas trombosadas tienden a situarse lejos de los puntos de entrada. En la aorta torácica descendente es importante el diagnóstico diferencial con un aneurisma con trombo intraluminal. Habitualmente en las disecciones con la luz falsa trombosada se evidencia flujo turbulento lento, a diferencia del aneurisma. En la aorta ascendente la presencia de trombo es altamente sugestiva de trombosis.
La identificación de la falsa luz es de especial utilidad clínica en determinadas circunstancias. Cuando está afectado el arco aórtico, es necesario conocer si los troncos supraaórticos salen de la falsa luz. Del mismo modo cuando la disección de aorta descendente afecta a las arterias viscerales y existen complicaciones isquémicas puede ser importante identificar la falsa luz antes de la cirugía o del tratamiento con técnicas percutáneas.
- •
Identificación de complicaciones:
- a)
Insuficiencia aórtica. La insuficiencia aórtica (IAo) asociada a la disección aortica se produce entre el 44% de las disecciones de aorta proximal y en el 12% de las disecciones de aorta descendente25. Su presencia conlleva importantes alteraciones en el plan quirúrgico, por lo que la exploración y el análisis de la válvula aórtica es de vital importancia. La ETE es más sensible que la aortografía en la detección de IAo ligera. En el contexto de la disección, la anchura del jet de regurgitación con respecto al tracto de salida es probablemente el mejor método de graduación de la severidad (fig. 3f,g).
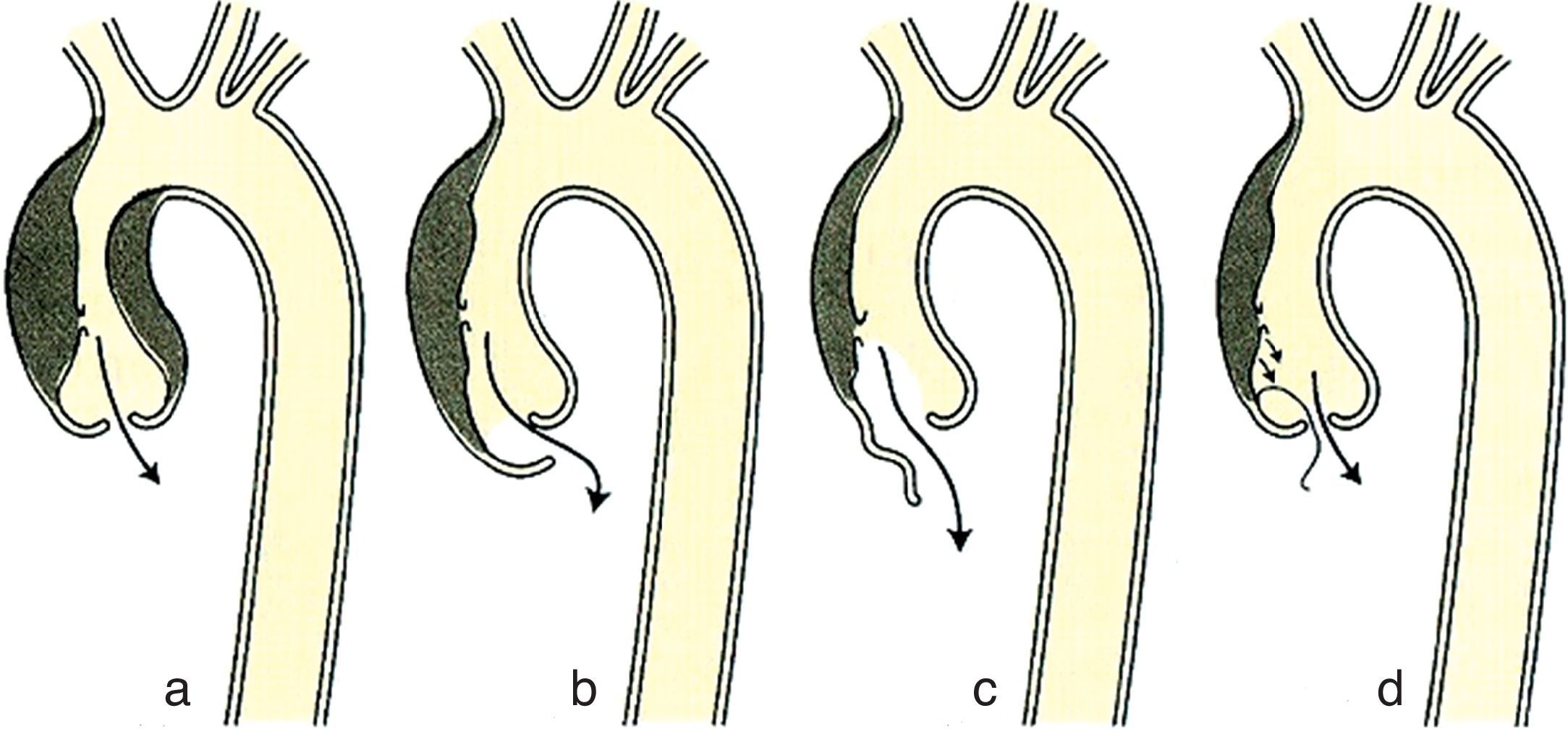
Los mecanismos de la IAo asociada a la disección son los siguientes (fig. 6):
- •
Dilatación de la raíz aórtica con ensanchamiento del anillo y alteración de la coaptación de los velos.
- •
Alteración de la coaptación de los velos por la presencia de hematoma a nivel del anillo.
- •
Alteración de la movilidad de los velos con prolapso de los mismos por la destrucción del soporte que constituye el anillo.
- •
Prolapso del flap de la disección dentro del orificio valvular aórtico y en el tracto de salida con afectación del cierre de los velos.
- •
Valvulopatía aórtica previa.
- a)
Hasta en el 86% de las disecciones tipoA la válvula aórtica puede repararse y resuspender las comisuras logrando una adecuada funcionalidad.
- a)
Afectación de las arterias coronarias. La afectación de las arterias coronarias ocurre entre el 10 y el 20% de los casos de disección aórtica aguda. La arteria coronaria derecha es la que se afecta con mayor frecuencia26,27. Aunque la angiografía es el método diagnóstico de elección, la ETE juega un papel fundamental, sobre todo en los pacientes con inestabilidad hemodinámica. La ETE permite:
- •
La visualización de las arterias coronarias se puede realizar a nivel del plano medio esofágico de la válvula aórtica en eje corto.
- •
Explorar la relación entre el flap de disección y la salida del tronco coronario izquierdo y derecho. Descartar la salida de los troncos coronarios desde la falsa luz.
- •
Explorar la extensión de la disección en las arterias coronarias
- •
Evaluación del grado de la obstrucción.
Por tanto, la ETE es el método diagnóstico de elección en la definición de la anatomía coronaria proximal en el contexto de la disección aguda26.
- •
- b)
Evaluación de la función ventricular. La disfunción ventricular global puede ser secundaria a la isquemia difusa por la disección de los troncos coronarios o en relación con la insuficiencia aórtica aguda descompensada.
Alteraciones de la contractilidad segmentaria se presentan hasta en el 10 al 15% de las disecciones debido a la compresión de las arterias coronarias por la expansión de la falsa luz, por la extensión de la disección hacia las arterias coronarias o por la hipotensión.
- c)
Derrame pericárdico o pleural. La disección de la pared aórtica puede producir la rotura de la adventicia en el sitio de origen de la disección. La extensión proximal de la disección hacia la raíz aórtica puede producir un taponamiento cardiaco por la sangre que penetra en el pericardio (fig. 3h). Sin embargo, la mayor parte de los derrames pericárdicos producidos en las disecciones agudas no se deben a la rotura de la pared sino a la trasudación de líquido en el espacio pericárdico procedente de la pared interna de la falsa luz. En cualquier caso, la presencia de derrame pericárdico en una disección de aorta ascendente es un signo de mal pronóstico que debe hacer suponer la rotura de la falsa luz. La evidencia de signos de taponamiento es indicación de cirugía urgente.En la aorta descendente se puede producir un derrame pleural con hemotórax.
- d)
Rotura aórtica. Su diagnóstico ecográfico puede ser difícil. La presencia de un espacio libre de ecos alrededor de la aorta es sospechosa de hematoma periaórtico (fig. 4a). Mediante el doppler color es posible evidenciar la rotura de aorta a cavidades cardiacas como la aurícula izquierda o el ventrículo derecho.
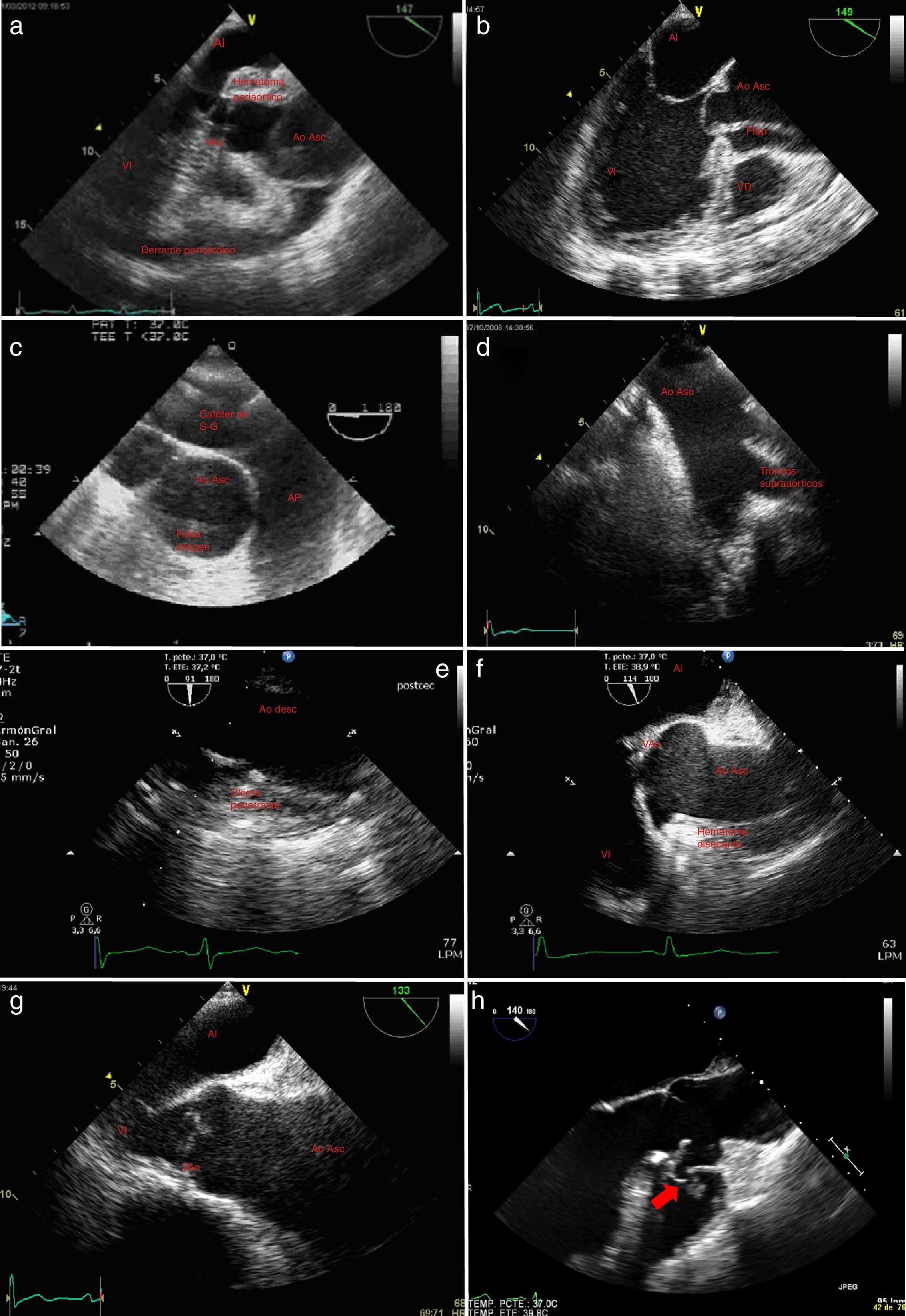
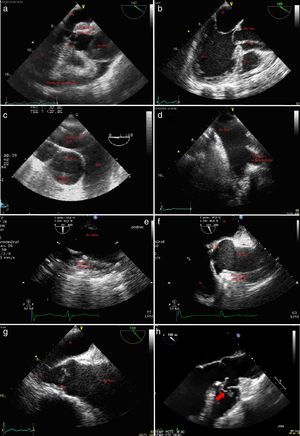
Figura 4.a)Plano medioesofágico 140° eje largo de la válvula aórtica y aorta ascendente; rotura aórtica con signos ecocardiográficos de hematoma periaórtico. b)Plano medioesfoágico eje largo 3cámaras; flap intimal introduciéndose en el tracto de salida del ventrículo izquierdo. c)Plano esofágico alto arteria pulmonar principal en eje largo y aorta ascendente en eje corto; falsa imagen de flap intraluminal por presencia de catéter en la arteria pulmonar. d)Ecografía epiaórtica; troncos supraaórticos. e)Eje largo de aorta descendente; úlcera penetrante en aorta descendente. f)Plano medioesofágico válvula aórtica y raíz aórtica en eje largo; hematoma disecante desde aorta descendente hasta raíz aórtica. g)Plano medio esofágico eje largo de válvula aórtica; aorta ascendente dilatada. h)Plano medioesofágico aorta eje largo: rotura de aneurisma de seno de Valsalva derecho; la flecha indica la rotura.
AD: aurícula derecha; AI: aurícula izquierda; Ao Asc: aorta ascendente; Ao Desc: aorta descendente; AP: arteria pulmonar tronco principal; AP derecha: arteria pulmonar derecha; LF: luz falsa; LV: luz verdadera; S-G: Swan-Ganz; VAo: válvula aórtica, VD: ventrículo derecho; VI: ventrículo izquierdo; VPul: válvula pulmonar.
Una importante limitación de la ETE en el síndrome aórtico es la afectación de los troncos arteriales. La presencia de manifestaciones neurológicas, insuficiencia renal aguda, isquemia mesentérica o de extremidades inferiores sugiere afectación vascular. En estos casos la angiografía es la técnica diagnóstica más exacta. La tomografía computarizada helicoidal es de gran utilidad ser de gran utilidad en este caso. Asimismo el diagnóstico de hematoma periaórtico o del hemomediastino secundario a la rotura aórtica puede ser difícil por ecocardiografía, y la prueba diagnóstica mediante TAC resulta ser más sensible.
Errores diagnósticos y artefactosLa presencia de artefactos se produce cuando las ondas de ultrasonido son reflejadas de atrás hacia adelante por 2superficies altamente reflexógenas. Estos artefactos generan imágenes dentro de estructuras cuando realmente no existen. La generación de artefactos es un problema frecuente en la aorta ascendente, donde existen multitud de interfases entre tejido-fluido y tejido-aire. En la aorta ascendente la generación de artefactos viene determinada por la reverberación causada por la pared aórtica en presencia de ateroesclerosis o calcificación. Del mismo modo, artefactos causados por la presencia de una válvula aórtica severamente calcificada pueden simular un flap intimal.
La principal limitación diagnóstica de la ETE es la disección que afecta únicamente a la aorta ascendente (tipoii). Es por ello que los expertos recomiendan no aceptar como criterio de disección únicamente la presencia de una imagen lineal intraluminal en aorta ascendente.
En la aorta descendente la presencia de artefactos o reverberaciones es rara, aunque se pueden observar imágenes en espejo fáciles de identificar de la luz verdadera por la interfase pulmón-aorta.
En la aorta ascendente, especialmente cuando está dilatada (mayor de 5cm), las imágenes lineales de artefactos son muy frecuentes, observándose en el 44-55% de los estudios. Pueden aparecer en el plano transversal, eje corto o longitudinal. Se recomienda utilizar el patrón de flujo del doppler color y modoM para incrementar la especificidad14.
A menudo los artefactos situados en la raíz aórtica son una reverberación de la pared anterior de la aurícula izquierda. La reverberación se localiza dentro de la luz aórtica cuando el diámetro del vaso es superior al diámetro de la aurícula izquierda. Mediante la ecocardiografía en modoM puede comprobarse que la imagen lineal reverberante está situada a doble distancia del transductor que la aurícula izquierda y su desplazamiento es el doble de amplio. El 40% de los artefactos se localizan en el tercio medio de la aorta ascendente y se deben a reverberaciones de la pared posterior de la arteria pulmonar derecha. La pared posterior de la aorta es equidistante con la pared de la arteria pulmonar y el artefacto. El movimiento dependerá del movimiento de las 2estructuras. Por el contrario, en las disecciones de aorta ascendente el movimiento del flap intrauminal es libre, con una oscilación sistólica típica, y no cumple criterios de reverberación. En ocasiones la íntima tiene un movimiento paralelo a la aorta resultante de disecciones retrógradas o la presencia de trombosis completa de la falsa luz, y se diferencia de los artefactos por su situación dentro de la luz aórtica y su mayor extensión longitudinal.
Se puede distinguir un artefacto de una imagen verdadera de flap:
- •
En el artefacto los bordes son indistintos uno de otro.
- •
Ausencia de rápida oscilación en el movimiento del flap.
- •
Extensión del artefacto hacia la pared aórtica.
- •
Se puede extrapolar el artefacto lineal al inicio del transductor.
- •
Mediante doppler color se puede demostrar flujo homogéneo en ambos lados sin flujos comunicantes.
Otras estructuras que pueden dar lugar a una mala interpretación y a un falso diagnóstico positivo de disección son la vena innominada, el colapso de una lengüeta pulmonar, el derrame pleural, la vena pulmonar izquierda, la vena hemiácigos y la presencia de catéteres en la arteria pulmonar (fig. 4c).
Los expertos recomiendan la valoración de la localización y de la movilidad de las imágenes intraluminales mediante modoM, y su extensión longitudinal atravesando la pared aórtica permite identificar los artefactos de las verdaderas disecciones.
Por otra parte, el diagnóstico diferencial entre trombosis total de la falsa luz y aneurisma trombosado no siempre es fácil por ETE. En los casos de falsa luz trombosada se observa la superficie interna altamente ecogénica, en forma de semiluna y con una superficie lisa, pero estas características no son siempre constantes. La presencia de trombo en los aneurismas de aorta ascendente es excepcional, por lo que se recomienda evaluar otros signos sugestivos de disección retrógrada trombosada10,28.
¿Qué necesita saber el cirujano cardiovascular? Objetivos de la ETE perioperatoria- 1.
Confirmación del diagnóstico (fig. 4b).
- 2.
Determinación del sitio de entrada e identificación de la luz verdadera y falsa (fig. 3e).
- 3.
Evaluar la integridad y la afectación de las ramas de la aorta, en particular los troncos coronarios y los troncos supraaórticos (fig. 4d).
- 4.
Monitorización intraoperatoria: evaluación de la precarga, función sistólica ventricular, alteraciones de la contractilidad segmentaria, presencia de insuficiencia aórtica y sus mecanismos. Evaluar la potencial distensión ventricular si se realiza parada circulatoria.
- 5.
Evaluación de la presencia de derrame pericárdico o derrame pleural (fig. 3h).
- 6.
Identificar la potencial malperfusión cerebral y visceral29.
- 7.
Detección de las complicaciones postoperatorias.
- 8.
Confirmación de la integridad de la reparación quirúrgica: cierre del punto de entrada, reparación de los troncos braquiocefálicos, bypass coronario, recambio o resuspensión de la válvula aórtica y su adecuado funcionamiento posterior. Tras la reparación quirúrgica, la ETE permite valorar la integridad del injerto y detectar flujo residual en la falsa luz. La ausencia de flujo residual en la falsa luz indica el cierre correcto de la comunicación y mejora los resultados a largo plazo, reduciendo el riesgo de rotura y disección26 (fig. 3a).
- 9.
Detección de complicaciones tardías en el postoperatorio: disección recurrente, progresiva dilatación de la aorta, formación de pseudoaneurismas, fugas mediastínicas y regurgitación aórtica. La persistencia de flujo en la falsa luz no es infrecuente tras la cirugía, y es un indicador de peor pronóstico en comparación con la trombosis de la falsa luz21,24.
La exhaustiva evaluación de este tipo de disecciones es de vital importancia, ya que la indicación quirúrgica va a venir determinada por la localización de la rotura intimal primaria y el estado del paciente. La cirugía se indica en30:
- •
Pacientes que presentan complicaciones secundarias a la disección.
- •
Rotura aórtica.
- •
Dolor intractable.
- •
Tamaño de la aorta en expansión.
- •
Hipoperfusión sistémica y visceral.
- •
Pacientes jóvenes con alteraciones del tejido conectivo.
La identificación de los segmentos sanos de la aorta para un pinzamiento seguro es fundamental. La ETE es de importante utilidad durante la circulación extracorpórea y la parada circulatoria, ya que permite una monitorización de la volemia y controlar la dilatación ventricular secundaria a la insuficiencia aórtica. Algunos grupos proponen que evitar el pinzamiento permite una mejor visualización del origen de la disección y facilita la anastomosis proximal, reduciendo el riesgo de disección residual y pseudoaneurismas en esa localización.
Hematoma intramuralEl hematoma intramural agudo puede originarse de un sangrado de los vasa vasorum de la capa media aórtica o de una úlcera arteriosclerótica penetrante (fig. 4e,f). Se clasifican del mismo modo que las disecciones.
Un hematoma intramural se considera una disección de las paredes de la aorta pero sin comunicación con la luz verdadera, y un posible precursor de una disección convencional31. Hasta el 20% de los pacientes con disección aórtica pueden presentar hematoma intramural, que se caracteriza por un engrosamiento de la pared aórtica sin un flap o puerta de entrada para la disección. La falsa luz es secundaria a la rotura de los vasa vasorum, que resulta en una hemorragia masiva dentro de la pared del vaso. La historia natural es la progresión a la rotura o a la disección del 45-60% de los casos en el primer año32-34. De forma similar a la disección de aorta, existe una relación entre el pronóstico y la localización anatómica en la aorta. En la afectación de la aorta torácica ascendente la rotura suele ocurrir en los siguientes días, por lo que el tratamiento es obligado. En la aorta descendente la decisión de tratamiento médico con estricto control de la presión arterial vs tratamiento quirúrgico permanece controvertida35. Recientemente en esta localización se está planteando la opción de tratamiento mediante abordaje endovascular36. Hasta en el 40% de los casos los hematomas pueden reabsorberse en los primeros 6meses.
Las características ecográficas fueron descritas por Mohr-Kahaly37 y se caracterizan por (fig. 4e,f):
• Engrosamiento circular o excéntrico de la pared de la aorta de más de 7mm. Se mide desde el borde interno de la íntima a la parte externa de la adventicia. Habitualmente en la aorta torácica mide 7±2mm y en la aorta descendente 15±7-6mm. Es frecuente la definición de las distintas capas.
• Desplazamiento central de la íntima calcificada.
• Extensión longitudinal de 1 a 20cm.
• Ausencia de flap correspondiente a la íntima endoluminal.
• Ausencia de flujo en su interior.
• Forma de media luna que afecta a parte de la pared aórtica y comprime la luz aórtica.
El diagnóstico diferencial con trombosis intraluminal o con una disección con falsa luz trombosada es difícil.
En ocasiones pueden identificarse zonas localizadas del hematoma que rompen la íntima, generando imágenes saculares que pueden confundirse con úlceras penetrantes. Por otra parte, en una proporción importante de casos de aorta con hematoma (aproximadamente el 10%) pueden coexistir otras zonas con disección clásica de la íntima. En estos casos el diagnóstico que predomina es el de disección aórtica.
El mayor contraste entre tejidos que proporciona la RMN permite diagnosticar pequeños hematomas intramurales no detectados por TAC.
Úlceras penetrantes gigantesEs una condición poco definida que se clasifica en relación con la localización anatómica de la lesión. Ocurre generalmente en pacientes ancianos que tienen hipertensión, dislipidemia y ateroesclerosis difusa10. Esta enfermedad típicamente ocurre en la aorta torácica descendente. Se caracteriza por una pared engrosada con una úlcera discreta. La progresión de la úlcera puede penetrar en la pared aórtica y resultar en un hematoma con debilidad de la pared y la formación de un aneurisma o progresión hacia la disección38 (fig. 4e).
Debe hacerse diagnóstico diferencial entre úlcera arterioesclerótica penetrante, con las úlceras like-projection secundarias a trombos con cavidades en forma de cráter en su superficie y de los hematomas que evolucionan con disrupción localizada de la íntima. La ausencia de placa ateroesclerótica en la íntima es más compatible con el diagnóstico de úlcera like projection.
Aneurismas aórticosLos aneurismas aórticos son hallazgos relativamente comunes en la población mayor debido a la edad, a la hipertensión y la ateroesclerosis. Es frecuente también en los pacientes con valvulopatía aórtica (válvula bicúspide), síndrome de Marfan o anuloectasia, síndrome de Ehlers-Danlos o síndromes de producción inadecuada de fibrina1. Otros procesos inflamatorios, como la arteritis de Takayasu o la arteririts de células gigantes, se asocian a la presencia de aneurismas aórticos (tabla 2).
La Sociedad Americana de Cirugía Vascular define un aneurisma como un incremento de 1,5veces el diámetro normal de la aorta (20-37mm), y una dilatación se define como un incremento de 1,1-1,5veces el tamaño normal (fig. 4g). En los pacientes con válvula aórtica bicúspide, enfermedad de Marfan o Ehlers-Danlos se acepta un diámetro de 4,5cm para evaluación quirúrgica, dado el mayor riesgo de disección.
La clasificación más utilizada es la de Crawford:
Tipo I. Se origina en la aorta torácica descendente proximal y termina por encima de las arterias renales.
Tipo II. Empieza en la aorta torácica descendente proximal y termina por debajo de las arterias renales.
Tipo III. Se origina en la aorta descendente distal (aproximadamente a nivel del sexto espacio intercostal).
Tipo IV. Afecta la mayor parte de la aorta abdominal.
Los hallazgos ecocardiográficos de los aneurismas son:
- •
Dilatación de la aorta (fig. 4g).
- •
Incremento de la ecogenicidad de la pared aórtica.
- •
Presencia de contraste espontáneo.
- •
Presencia de trombo mural: en esta situación el diagnóstico diferencial con disección aórtica puede ser difícil.
La dilatación de los senos de Valsalva puede no dar síntomas y ser un hallazgo incidental. Pueden ser congénitos o adquiridos. Los adquiridos pueden ser consecuencia de un trauma, una infección, endocarditis, sífilis, síndrome de Marfan o degeneración senil. La dilatación del seno derecho puede coexistir con un defecto del septo intraventricular8. En ocasiones los síntomas aparecen como consecuencia de la compresión de estructuras adyacentes, como la aurícula derecha o el ventrículo derecho, o por rotura, habitualmente hacia el septo interventricular. Es importante el diagnóstico diferencial con el aneurisma de la parte membranosa del septo intraventricular (fig. 4h y fig. 5a).
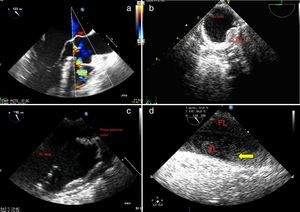
a)Plano medioesofágico aorta eje largo: rotura de aneurisma de seno de Valsalva derecho; flujo con Doppler-color; fistulización hacia el ventrículo derecho. b)Aorta descendente en eje corto; placa de ateroma en aorta descendente torácica. c)Plano medio esofágico 120°; aorta descendente eje largo; placa de ateroma móvil. d)Plano esofágico alto a nivel de cayado aórtico: uso de contraste (SonoVue®); se aprecia relleno inicialmente de la verdadera luz y de la falsa luz; el uso de contraste nos permite diferenciar correctamente ambas luces, así como establecer la dirección del flujo en la falsa luz (llenado anterógrado, puerta de entrada a nivel del cayado proximal).
AD: aurícula derecha; AI: aurícula izquierda; Ao Asc: aorta ascendente; Ao Desc: aorta descendente; AP: arteria pulmonar tronco principal; AP derecha: arteria pulmonar derecha; LF: luz falsa; LV: luz verdadera; S-G: Swan-Ganz; VAo: válvula aórtica, VD: ventrículo derecho; VI: ventrículo izquierdo; VPul: válvula pulmonar.
Las complicaciones neurológicas por infartos tanto precoces como tardíos continúan siendo una complicación grave tras la cirugía cardiaca, ocurriendo aproximadamente en el 1-5% de los pacientes, y con una relación directa con la enfermedad ateroesclerótica30,39. La habilidad para detectar placas de ateroma en la aorta torácica y cambiar el abordaje quirúrgico es una parte importante de la mayor parte de las estrategias para prevenir los accidentes cerebrovasculares (ACVA)31,40. La presencia de calcificación y ateroesclerosis aórtica hace difícil la canulación, la instauración del bypass cardiopulmonar y la realización de las anastomosis. La identificación de estas estructuras puede ayudar a cambiar la estrategia terapéutica y a adoptar medidas que minimicen los riesgos.
Royse et al.41 ha propuesto dividir la aorta en 6zonas correspondientes a los sitios de manipulación quirúrgica.
Zona 1. Región proximal de la aorta ascendente.
Zona 2. Región media de la aorta ascendente.
Zona 3. Región distal de la aorta ascendente. No adecuadamente visualizada mediante ETE.
La zona 1 y 2 son los sitios de incisión para el recambio valvular aórtico. La región2 es también la localización habitual para las anastomosis proximales de los injertos coronarios y para la administración de cardioplejía anterógrada. En la región3 es donde se coloca el clamp aórtico.
Zona 4. Incluye la región proximal del arco. No visualizada adecuadamente mediante ETE.
Zona 5. Incluye la región distal del arco aórtico.
Zona 6. Incluye la región próxima de la aorta descendente (fig. 5b, 5c).
En estas regiones, las placas de ateroma pueden ser desplazadas por la cánula aórtica o por un dispositivo endoluminal (p.ej., balón de contrapulsación aórtico).
La palpación manual de la aorta detecta solo el 50% de las placas de ateroma y la ETE es capaz de visualizar correctamente solo el 42% de la extensión de la aorta ascendente41. Es por ello que cada vez más la ecografía epiaórtica se emplea para la detección de placas en pacientes de alto riesgo42.
Las placas de ateroma pueden ser clasificadas de acuerdo con la clasificación de Katz43 (tabla 3).
Clasificación de Katz de la ateromatosis aórtica
| Grado | Descripción |
| 1 | Aorta normal (grosor de la íntima <3mm) |
| 2 | Engrosamiento excesivo de la íntima (>3mm) |
| 3 | Placa de <5mm |
| 4 | Placa de >5mm |
| 5 | Placa de ateroma móvil |
De Katz et al.43.
En una serie de 1.200 pacientes de edad mayor de 50años en los que se empleó la ecografía epiaórtica se observaron placas moderadas (3-5mm) o severas (>5mm, placas ulceradas o placas móvil o placas circunferenciales) que afectaban la aorta ascendente hasta en el 19% de los pacientes44. Los pacientes con ateromas grado5 presentan una incidencia de ACVA del 25%; sin embargo, en el resto de los grados, de solo el 2%. Otros estudios han señalado que placas de ateroma >5mm incrementan el riesgo perioperatorio de ACVA por 6, y por 2 el de la mortalidad perioperatoria43. Asimismo, la identificación de la morfología de la placa es importante. La evidencia de placas ulceradas con material móvil presenta un riesgo alto de embolización.
Otro grupo de expertos en la evaluación de la enfermedad ateroesclerótica en los pacientes sometidos a cirugía cardiaca han cuantificado que la localización de ateromas en los segmentos distales e izquierdos de la aorta torácica inmediatamente antes del origen de la arteria innominada incrementan 5veces el riesgo de ACVA tardío45.
La exploración ecográfica mediante sondas epiaórticas que emplean de 5-15MHz directamente en contacto con la aorta ascendente ha demostrado ser más fiable que la ETE para identificar placas de ateroma en la aorta media y distal ascendente, en segmentos difíciles de escanear por la interposición de la tráquea y el bronquio principal derecho44,46 y de gran manipulación quirúrgica. Los grupos de expertos han propuesto la realización de ecografía epiaórtica en los siguientes casos45:
- •
Los pacientes que presenten placas de ateromas moderada o severa en las regiones5 y 6 ateroma. Si en las regiones visualizadas (1, 2, 5 y 6) no hay evidencia de ateroma, no sería necesario realizar ecografía epiaórtica.
- •
Otro factor de riesgo de ateromas es la calcificación valvular, por lo que algunos autores proponen la realización de ecografía epiaórtica en este subgrupo de pacientes cuando la calcificación de la válvula aórtica o del anillo mitral es severa.
- •
Pacientes mayores de 60años con calcificación del botón aórtico o calcificaciones palpables en la aorta ascendente.
- •
Severa vasculopatía periférica.
- •
ACVA previos.
Las lesiones traumáticas de la aorta ocurren hasta en el 20% de las muertes por accidente de tráfico31. La mortalidad sigue siendo muy elevada tras el ingreso en el hospital. La lesión se produce habitualmente en el istmo aórtico, donde el ligamento arterioso y la arteria subclavia fijan firmemente la aorta a la caja torácica. En los pacientes con trauma torácico y sospecha de rotura aórtica inestables hemodinámicamente la ETE constituye el método diagnóstico de elección como triaje en los pacientes con trauma torácico, complementado por la información aportada por el TAC y en casos seleccionados por la aortografía8,31,47. Es importante recordar las limitaciones de la ecografía en la visualización de la aorta ascendente y el arco aórtico, frecuentemente implicados en este tipo de lesiones.
Las lesiones ecocardiográficas descritas tras estos episodios son:
- -
Gruesas líneas en el lugar de la rotura correspondientes a una disección subadventicial.
- -
Disección con un flap intraluminal correspondiente a la íntima; estos tienen mejor pronóstico.
- -
Aneurismas fusiformes8.
- -
Presencia de pseudoaneurismas con distorsión de la aorta.
- -
Presencia de sangre en mediastino (medida ecográficamente como espacio anecoico de más de 7mm)48.
- -
Hallazgos infrecuentes son: trombos intraluminares, hematomas en la media, obstrucción completa de la aorta.
Recientemente la introducción de medios de contraste ecográfico nos ha permitido obtener una mejor visualización de estructuras localizadas en las cavidades cardíacas (especialmente el borde endocárdico ventricular izquierdo) y en la aorta. Se trata de líquidos que llevan pequeñas burbujas de gas. Inyectados en vena periférica, las burbujas menores de 10μm son capaces de atravesar los capilares pulmonares. Cuando el haz de ultrasonidos interfiere con las burbujas disueltas en la sangre se genera una gran dispersión de ecos, aumentando la señal reflejada hacia el transductor. Utilizadas habitualmente para delimitar el endocardio izquierdo en casos de visualización subóptima con el eco convencional49, su aplicación en el diagnóstico de disección de aorta tanto en estudios transtorácicos como transesofágicos ha permitido mejorar la sensibilidad y la especificidad tanto para diferenciar ambas luces como para localizar la puerta de entrada y para establecer la dirección del flujo en el caso de disección retrógrada50. En el grupo español de Evangelista y colaboradores, incluso con el uso de ETE se pueden obtener falsos positivos (por reverberaciones de pared), y en algunos casos no se pudo identificar la verdadera de la falsa luz (por íntima inmóvil). Con el uso de contraste todas estas dificultades fueron superadas e incluso se estableció correctamente la dirección del flujo en la falsa luz en todos los casos (fig. 5d).
Papel de la eco 3DLa utilización de la ETE3D en el estudio de los síndromes aórticos todavía no ha sido suficientemente establecida, si bien algunos grupos refieren su utilidad en el diagnóstico de disección aórtica tanto en el estudio transtorácico como transesofágico51,52. En una reciente publicación del grupo de Evangelista53, la utilización de la ecografía 3D fue especialmente útil en la cuantificación del tamaño de la puerta de entrada, con una alta concordancia con la tomografía y en la identificación de ambas luces en disecciones espiroidales (fig. 6).
Mecanismos de insuficiencia aórtica en la disección de aorta ascendente.Modificado de Braunwald58.
Otros trabajos han mejorado la resolución de las imágenes en la localización de la puerta de entrada mediante el uso de 3D epicárdica durante la intervención54.
ConclusionesAnte la sospecha de síndrome aórtico agudo, la realización de un TAC es la prueba diagnóstica más utilizada. El papel de la ETE una vez diagnosticada por TAC depende de la calidad del estudio y de si se trata de una patología de aorta ascendente o descendente. En la aorta ascendente la ETE tiene un papel fundamental para identificar la puerta de entrada antes de iniciar el tratamiento quirúrgico, la presencia de derrame pericárdico, presencia de insuficiencia aórtica, la presencia de derrame pericárdico, la evaluación de la función ventricular y de los resultados quirúrgicos.
En la aorta descendente la realización de la ETE es aconsejable realizarla cuando el paciente esté estabilizado y determinar todas las características anatómicas y hemocinéticas, diseñar la estrategia terapéutica y plantear la posibilidad de implantación de endoprótesis.
Numerosos grupos de expertos proponen que en hospitales en los que se dispone de cirugía cardiaca y suficiente experiencia en ETE, esta debería realizarse como técnica diagnóstica de primera elección para la evaluación de la aorta, dado que en la mayoría de los casos su información es suficiente para indicar el tratamiento médico o quirúrgico10,15,47,55,56. Cuando existe la sospecha de afectación de los troncos arteriales principales el TAC debería complementar a la ETE57. La combinación de estas 2pruebas sirve para evitar falsos positivos y discriminar los casos de hematoma intramural o úlcera penetrante. La angiografía ha dejado de ser la técnica de elección, quedando limitada cuando existe trombosis de la falsa luz o se trata de disecciones atípicas. La RMN aporta información valiosa, pero su utilidad en situaciones de urgencia es limitada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.