La regeneración cardíaca requiere una cascada compleja de acontecimientos con numerosos factores, la mayoría aún no clarificados, que limitan la terapia celular y su traslación a la práctica clínica. Las células tienen que injertarse, sobrevivir e integrarse funcionalmente en el órgano para restaurar su función. De la misma manera que en los tejidos originales, un sistema complejo de señales bien definidas, muchas de ellas generadas desde la matriz extracelular, son necesarias para desarrollar una fisiología celular normal. El planteamiento de combinar conocimientos de biología celular e ingeniería con materiales biocompatibles para restaurar tejidos biológicos y mejorar su función es el fundamento de la ingeniería tisular que define un nuevo abordaje de la regeneración cardíaca.
La investigación y desarrollo de un miocardio bioartificial tiene gran interés clínico. La estrategia es el uso de biomateriales para desarrollar una microatmósfera que proporcione a las células endógenas y exógenas un ambiente óptimo para la reparación de tejidos. Los conocimientos adquiridos en el desarrollo de biomateriales aportan las bases para desarrollar matrices 3D que ofrecen el ambiente idóneo para la liberación de células y genes que dirijan las células terapéuticas hacia el fenotipo funcional. La descelularización de órganos para construir nuevas matrices es un nuevo concepto de investigación, desarrollado gracias al desarrollo de nanomateriales que aseguran un nicho celular apropiado para la diferenciación celular y la terapia génica o farmacológica.
Cardiac regeneration requires a complex cascade of events. There are many factors, most of them still no clarified, that limit the effectiveness of the stem cell therapy and their translation to the clinic. Cells should graft, survive and functionally integrate to the target organ in order to have a chance to restore its function. As in original tissues, a complex and well defined set of signals, many of them coming from the extracellular matrix, is required for normal cell physiology. The idea of combining principles from cell biology and engineering of biocompatible materials in order to create biologic replacement structures that restore, maintain, or improve tissue function, is at the basis of the tissue engineering and defines a different approach to the cardiac regeneration.
Research and development of bioartificial myocardium is of great clinical interest. The rationale for the use of specific biomaterials is to allow the creation of a microatmosphere where the exogenous and endogenous cells find the microenvironment optimal for repair. Biomaterials science gives us important tools to build this extracellular matrix. Functionalized 3D systems can provide the correct environment and act as a delivery system for cells and genes, guiding the therapeutic cells to the functional phenotype. Organ decellularization for bioscaffolds fabrication is a new investigated concept. nanomaterials are emerging as the main candidates to ensure the achievement of a proper instructive cellular niche with good drug release/ administration properties.
La ingeniería de tejidos es una disciplina nueva que asocia la biología celular y la ingeniería con materiales biocompatibles con el objetivo de reparar o sustituir tejidos-órganos y mejorar su función. La estrategia clásica consiste en aislar células de un determinado órgano para cultivarlas en un soporte tridimensional y finalmente posicionar la matriz celularizada resultante en la localización seleccionada para tratamiento.
La ingeniería tisular no es sinónimo de «terapia celular», cuyo objetivo es mejorar la función de un tejido o promover la formación de nuevos tejidos a través del aislamiento de células y su administración al órgano tratado por inyección directa o infusión. La ingeniería tisular está basada en generar un entorno funcional 3D adecuado para el cultivo-crecimiento celular y fabricar sustitutos tisulares in vitro antes de ser implantados, o bien utilizar biomateriales directamente en el área lesionada. El abordaje de la ingeniería tisular adquiere un valor adicional al considerar la posibilidad de reproducir, utilizando diferentes tipos de matrices, la matriz extracelular, crucial para la restauración de los tejidos.
La investigación y el desarrollo de un miocardio bioartificial tiene gran interés clínico. La estrategia es el uso de biomateriales para desarrollar una microatmósfera que proporcione a las células endógenas y exógenas un ambiente óptimo para la reparación de tejidos. El entorno celular debe ser diseñado para obtener la liberación de factores, el control de la adhesión celular y la función mecánica. En este sentido, es lógico proponer el uso de una matriz exógena celularizada como suplemento de la terapia celular intramiocárdica; esta matriz puede ajustar la proporción del colágeno tipo I y III en la cicatriz del infarto y en las regiones remotas, contribuyendo así al proceso de regeneración1.
Composición de la matriz extracelular cardíacaEl remodelado del ventrículo izquierdo en la insuficiencia cardíaca (degradación excesiva de la matriz extracelular y fibrosis miocárdica) contribuye a la dilatación y disfunción ventricular. La matriz extracelular está constituida por una red de proteínas y proteoglucanos que mantienen la estructura de los tejidos y regulan la expresión de funciones específicas de las células con las que interaccionan. Hay un activo intercambio entre las células y la matriz. Las primeras organizan la matriz y ésta efectúa la regulación celular.
La matriz extracelular contiene como componentes la sustancia fundamental amorfa (glucosaminoglucanos, proteoglucanos); proteínas fibrosas (colágeno); proteínas de adhesión (fibronectina, laminina, tenascina, nidógeno), células fijas (fibroblastos, fibrocitos, mesenquimales) y células errantes (macrófagos). Hay dos tipos de fibras de colágeno en el corazón normal: tipos I y III sintetizados por los fibroblastos y miofibroblastos2. Las fibras de colágeno tipo I representan el 80% del colágeno cardíaco y el tipo III el 10%. El colágeno tipo I tiene a su cargo el soporte estructural y el alineamiento espacial de los cardiomiocitos, mientras que el colágeno tipo III desarrolla su papel en el acortamiento del miocito interrelacionado con la función ventricular eyectiva3. En el infarto de miocardio, la matriz extracelular está modificada con una reducción del colágeno tipo I del 80 al 40%1,3.
El colágeno tipo I es sintetizado por los fibroblastos cardíacos y tiene una vida media de 100días. La degradación de las fibras de colágeno es realizada por las colagenasas específicas (MMP). La demostración en modelos experimentales de que la inhibición de MMP atenúa la dilatación ventricular ha llevado a proponer el uso terapéutico de inhibidores de MMP en los pacientes con riesgo de desarrollar insuficiencia cardíaca después del infarto agudo de miocardio. Esta propuesta está apoyada también por presencia de un incremento de actividad MMP en los pacientes con rotura cardíaca después de un infarto agudo de miocardio4,5.
Las interacciones entre los cardiomiocitos y los no miocitos se realizan a través de señalizaciones compuestas de proteínas (fibronectina, laminina, vitronectina), moléculas de adhesión (integrinas), proteínas citoesqueléticas (actina, a-actinina) y otros mediadores como las cinasas de adhesión local. El gradiente de materia y energía entre la matriz extracelular y los cardiomiocitos, es decir, entre células menos diferenciadas y más diferenciadas, mantiene un flujo de comportamiento que va desde lo menos estable y más lejos del equilibrio hacia lo más estable y cercano al equilibrio. Dicha matriz genera sustancias químicas (señalizadores) que estimulan el crecimiento, y a la vez ofrece soporte físico a las células6.
Biomateriales y célulasLa elección de los biomateriales tiene un papel principal en la ingeniería de tejidos porque deben servir no sólo de apoyo físico a las células, sino también tienen que proveer las sustancias químicas y biológicas necesarias para guiar el crecimiento, diferenciación, implantación, distribución y organización de las células. Igualmente, los biomateriales que podrían denominarse biomiméticos deben ser capaces de responder a estímulos celulares específicos, facilitar la formación de una red vascular capaz de proporcionar oxígeno y nutrientes necesarios para el metabolismo celular, y finalmente favorecer la actividad electromecánica desarrollada por las células.
Entre los biomateriales empleados y las células en ellos implantadas deben establecerse interacciones a nivel molecular y ultraestructural, capaces de mimetizar los procesos fisiológicos que se verifican en los tejidos de nuestro organismo. Los compuestos constitutivos de las matrices deben poseer la especificidad biológica de los componentes fundamentales de la matriz extracelular, tales como colágeno de tipo I, y deben tener propiedades fisicoquímicas que aseguren una resistencia adecuada durante un periodo determinado, para dar lugar final-mente a la integración funcional y a la degradación que debe realizar con la cinética adecuada, sin generar productos de degradación tóxicos ni desencadenar una respuesta inmunológica en el huésped7.
Después del implante de pequeñas porciones de miocardio humano y de rata en un modelo experimental de infarto de miocardio en la rata, realizado por Leor, et al.8, numerosos grupos se interesaron por la ingeniería de tejidos con tres estrategias desarrolladas para construir un miocardio bioartificial:
- –
Implante de células en matrices preformadas.
- –
Implante de células en matrices solubles.
- –
Superposición de estratos de células.
La utilización de matrices preformadas tiene la ventaja de poder construir tejidos de distintas formas y dimensiones con el inconveniente de la nutrición y oxigenación celular, que aumenta a medida que se incrementa el espesor de la matriz utilizada. Ha sido descrita una cierta restricción de la actividad contráctil y una pobre diferenciación de las células implantadas9. El implante en matrices solubles consiste en posicionar las células en una matriz compuesta por fibras de colágeno tipo I. El cultivo celular debe ser estimulado con un marcapasos, y las matrices con forma circular favorecen el desarrollo de las fuerzas de contracción eventualmente presentes en las células implantadas10. Shimizu, et al.11 han utilizado otro método que consiste en el desarrollo de tejidos de recambio, gracias a la superposición de estratos de células. La mayor ventaja es la posibilidad de superponer estratos de diversos tipos celulares. Con este método se han obtenido tejidos con características similares al miocardio, córnea y vejiga. El uso de biorreactores celulares permite el implante y posterior cultivo de las células en condiciones de estrés mecánico, porque los frascos de cultivo son agitados a una velocidad determinada. La obtención de matrices celularizadas en estos frascos ha demostrado mejorar la actividad metabólica, el aspecto morfológico y el contenido de ADN de las células así cultivadas12.
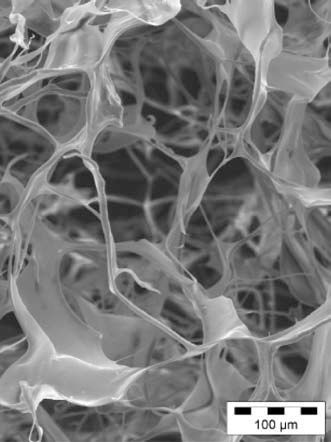
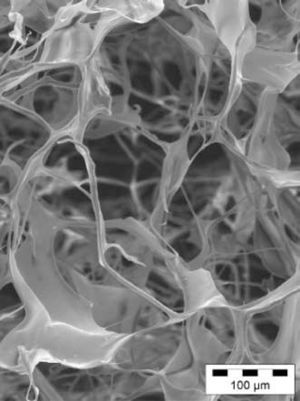
Un grupo muy amplio de biomateriales que van desde el colágeno, fibrina o ácido hialurónico hasta la descelularización de tejidos han sido evaluados2,7,13,14 (Tabla I). Los biomateriales como el hidrogel o matrigel de colágeno actúan como matriz de soporte para las células que pueden reparar o regenerar el tejido infartado13,14. Los polímeros hidrolíticos degradables compuestos por ácido poliláctico (PLA), ácido poliglicólico (PGA) y su copolímero PLGA han sido estudiados con varias técnicas de procesamiento para adquirir propiedades mecánicas y elásticas que cumplan la función cardíaca. Varias poblaciones de células madre han sido injertadas en parches biodegradables PGA o en matrices de colágeno13,14 (Fig. 1). La supervivencia e integración de las células trasplantadas puede mejorar si son embebidas en matrices de colágeno, matrigel o implantando las células en matrices monocapa15.
Matrices desarrolladas en ingeniería de tejidos
| Naturales |
| – Matrices de colágeno hidrogel o matrigel |
| – Matrices de fibrina |
| – Matrices gelatinosas |
| – Matrices porosas de alginato |
| – Matrices gelatinosas de alginato y polietilenglicol |
| Sintéticas |
| – Compuestos de PLA |
| – Compuestos de PGA y su copolímero PLGA |
| – Matrices de gelatina, alginato, ácido poliláctico y/o colágeno |
| – Matrices de poliuretano |
| – Matrices de alcohol polivinílico |
| – Matrices de isómeros del caprolactone láctico y carbonato |
| Descelularización celular |
Una de las propiedades más importantes de la matriz celularizada es la capacidad de acoger y formar una red vascular capaz de proporcionar el aporte energético y nutritivo necesarios al metabolismo celular. La angiogénesis puede verificarse por la formación de nuevos capi-lares a partir de vasos persistentes o por la incorporación de progenitores endoteliales circulantes. La importancia de este proceso depende no sólo de estos dos fenómenos, sino también de los factores de crecimiento liberados por las células implantadas en la matriz y por las células que integran el tejido huésped. Varios factores angiogénicos, tales como el factor de crecimiento derivado de los fibroblastos (bFGF), el factor de crecimiento derivado del endotelio vascular (VEGF) y el factor de crecimiento derivado de las plaquetas (PDGF), han sido incorporados en las matrices con el objetivo de estimular la angiogénesis. Otras estrategias son la formación de una red vascular previa al implante de las células en la matriz y la incorporación de progenitores endoteliales circulantes7.
Los biomateriales pueden ser injertados con factores de crecimiento, citocinas y fármacos, obteniendo así sistemas de liberación de fármacos capaces de liberar moléculas en función de los requerimientos ambientales. Las células genéticamente modificadas pueden ser utilizadas en la ingeniería de tejidos con capacidades diferenciadas de regeneración, reparación o secreción15. Esta terapia molecular ofrece la interacción específica de estas sustancias con las células y los biomateriales utilizados, para así estimular el crecimiento, la proliferación y la diferenciación de las células y de la matriz extracelular. El uso de matrices bipoliméricas funcionantes como sistemas liberadores genéticos es muy excitante porque representa un abordaje para modular el entorno y guiar la función celular. La activación de los genes responsables de estos procesos podría aportar la base necesaria para la concepción de materiales biológicos de tercera generación.
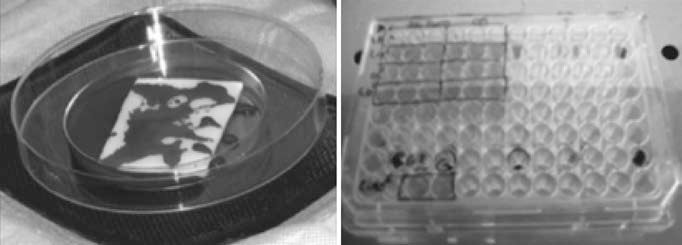
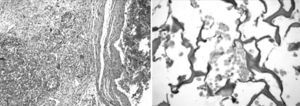
Resultados preliminares del ensayo magnumNuestro grupo ha evaluado la seguridad y eficacia de una matriz biodegradable de colágeno tipo I (Pangen 2, Laboratoires Urgo, Chenove, Francia) impregnada con células mononucleares de médula ósea (CMNMO) e injertada en el epicardio del ventrículo infartado. A 45 ratas Sprague Dawley se les realizó ligadura de la arteria descendente anterior y 2semanas más tarde recibieron, a través de punciones subepicárdicas, 5 × 106 CMNMO suspendidas en medio M199 con un volumen total de 15μl, que se complementó con la impregnación de la matriz de colágeno con CMNMO (0,5% CD34+ determinadas por citometría) (Fig. 2). Después de aleatorización fueron distribuidas en cuatro grupos: grupo A, inyección de 15μl de M199 sin células; grupo B: inyección de 5 × 106 CMNMO; grupo C: inyección de 5 × 106 CMNMO y fijación en el epicardio de la matriz de colágeno impregnada con CMNMO; grupo D: matriz de colágeno sin células fijada en el epicardio7.
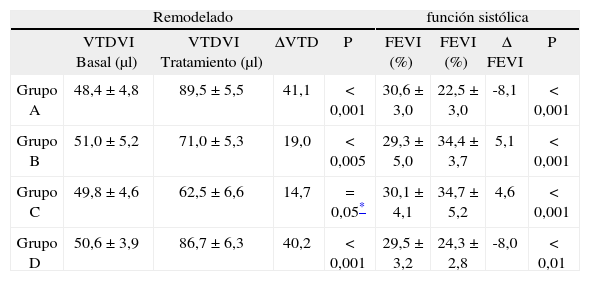
Los resultados están representados en la tabla II. La fracción de eyección del ventrículo izquierdo (FEVI) tuvo un incremento significativo en los dos grupos de tratamiento con respecto a los valores basales y sin diferencias significativas entre los dos grupos (grupo B: 34,46±3,77% vs 29,3±5%; grupo C: 34,74±5,23% vs 30,1±4,1%; p<0,001). En los grupos A y D no hubo ningún incremento significativo de la FEVI (grupo A: 22,56±3,02% vs 30,6±3%; grupo D: 24,31±2,8% vs 29,5±24,31±2,8%), y los valores postratamiento fueron significativamente menores que los grupos B y C (p<0,0002). El grupo C (CMNMO + matriz de colágeno) mostró un volumen telediastólico del ventrículo izquierdo (VTDVI) (62,52±6,67μl) menor que el grupo B (CMNMO) (71,09±5,3μl; p<0,005), el grupo A (control) (89,52±5,6μl; p<0,0001) y el grupo D (matriz sin células) (86,75±6,3μl). El grosor de la pared ventricular en la región del infarto fue significativamente mayor en el grupo C (0,75±0,016mm) que en el grupo A (0,56±0,014mm; p<0,001), grupo B (0,57±0,013mm; p<0,001) y grupo D (0,59±0,018; p<0,001).
Resultados de la matriz de colágeno + cmnmo en infarto de miocardio
| Remodelado | función sistólica | |||||||
| VTDVI Basal (μl) | VTDVI Tratamiento (μl) | ΔVTD | P | FEVI (%) | FEVI (%) | Δ FEVI | P | |
| Grupo A | 48,4±4,8 | 89,5±5,5 | 41,1 | < 0,001 | 30,6±3,0 | 22,5±3,0 | -8,1 | < 0,001 |
| Grupo B | 51,0±5,2 | 71,0±5,3 | 19,0 | < 0,005 | 29,3±5,0 | 34,4±3,7 | 5,1 | < 0,001 |
| Grupo C | 49,8±4,6 | 62,5±6,6 | 14,7 | = 0,05* | 30,1±4,1 | 34,7±5,2 | 4,6 | < 0,001 |
| Grupo D | 50,6±3,9 | 86,7±6,3 | 40,2 | < 0,001 | 29,5±3,2 | 24,3±2,8 | -8,0 | < 0,01 |
VTDVI: volumen telediastólico de ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo.
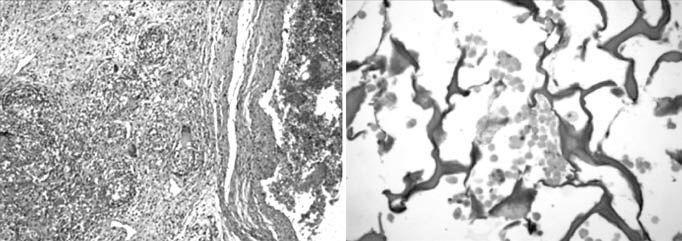
La histología mostró la matriz de colágeno protegiendo la escara del infarto. Los segmentos de la matriz estaban alineados a lo largo de la pared del ventrículo izquierdo y las células agrupadas en grandes poblaciones entre las fibras de colágeno (Fig. 3). La arquitectura del colágeno estuvo mejor preservada en el grupo C con un contenido mayor de colágeno. El tricrómico de Masson mostró la incorporación de fibras desde la matriz al área de infarto. En el grupo D (matriz sin células), la matriz se había reabsorbido totalmente a los 45días, sin ningún residuo en la cicatriz del infarto, observándose solamente finas adherencias epicárdicas.
Los resultados experimentales de la matriz de colágeno asociada a CMNMO nos ha llevado a desarrollar el ensayo clínico MAGNUM (Myocardial Assistance by Grafting a New Bioartificial Upgraded Myocardium). El objetivo es evaluar y comparar los cambios anatomofuncionales que se producen con la terapia celular con y sin la aposición, sobre la superficie de la escara fibrótica, de la matriz de colágeno tipo I biodegradable, embebida con una suspensión concentrada de células en pacientes con cardiopatía isquémica y disfunción sistólica de ventrículo izquierdo. Presentamos los resultados a medio plazo del grupo inicial CMNMO + matriz (posteriormente se ha ampliado el ensayo a nuevos grupos como mioblastos + matriz de colágeno).
Los pacientes presentaban una miocardiopatía isqué-mica con antecedente de infarto de miocardio de evolución superior a 1mes, segmentos ventriculares acinéticos o discinéticos sin viabilidad, clase funcional II-III de la New York Heart Association (NYHA), disfunción sistólica de ventrículo izquierdo con FEVI inferior al 40% e indicación de cirugía de revascularización por evidencia de isquemia residual (Fig. 4). Desde abril de 2003 hasta julio de 2006 han sido incluidos 22 pacientes, aleatorizados en dos grupos6:
- –
Grupo I (sin matriz): 12 pacientes (edad 53,75±10,76 años) a los que se realizó revascularización quirúrgica de la arteria descendente anterior, asociada a implante intramiocárdico de CMNMO, mediante la aplicación de 34±8,6 inyecciones transepicárdicas. El volumen inyectado fue 5,1±1,7ml, conteniendo 202±11 × 106 CMNMO. El 0,7% implicaba células CD34+.
- –
Grupo II (con matriz): 10 pacientes (56,1±7,63 años). Después de la revascularización quirúrgica de la arteria descendente anterior, se implantó 15,7±4,5ml de una suspensión conteniendo 716±324 × 106 CMNMO, correspondiendo el 1,2% a células CD34+. El 40% de esta suspensión se inyectó por vía transepicárdica en 21,5±7,5 sitios en forma perimetral y en el interior de la escara. El 60% restante se utilizó para embeber la matriz de colágeno, que fue colocada sobre la escara fibrótica.
No hubo complicaciones referidas a la punción medular ni a la cirugía de revascularización coronaria asociada a la terapia celular con CMNMO. No se registraron arritmias malignas ni otras complicaciones relacionadas con el procedimiento. La asociación de la terapia celular no modificó la evolución postoperatoria ni prolongó la estancia hospitalaria. Con un seguimiento medio de 357±162días, la clase funcional NYHA pasó de 2,4±0,5 a 1,1±0,3 (p<0,0001) en el grupo I y de 2,5±0,7 a 1,2±0,4 (p<0,0001) en el grupo II. En el grupo I la FEVI aumentó de 24,8±6,0% a 36,5±13,4% y el diámetro telediastólico del ventrículo izquierdo disminuyó de 63,5±9,2 a 60,5±9,1mm (p = ns). En el grupo II, la FEVI aumentó de 31,6±14,9% a 39,3±18,4% (p = 0,01) y el diámetro diastólico del ventrículo izquierdo disminuyó de 63,2±8,72 a 60,2±9,7mm (p = 0,02)6.
La regeneración cardíaca no debe quedar reducida al implante de células, y es necesaria también la regeneración de la matriz extracelular. Los resultados del estudio en ratas y los resultados preliminares del ensayo MAGNUM demuestran que la matriz de colágeno, además de mejorar el injerto de las células, contribuye a reconstruir la matriz extracelular cardíaca y mejorar el remodelado, efecto no demostrado con las células madre de médula ósea sin matriz. Sin embargo, la matriz de colágeno aislada sin células no modifica ni la función sistólica ni el remodelado del ventrículo izquierdo.
Fabricación de matrices por descelularización de órganosEl uso de matrices sintéticas y naturales aplicadas a la bioingeniería de órganos sólidos ha estado limitada por la ausencia de integración de una trama vascular. La fabricación de matrices con un árbol vascular está en desarrollo en órganos como hígado16, corazón17 y córneas18. Los animales donantes de tejidos y órganos han sido perfundidos con soluciones descelularizantes para eliminar selectivamente los componentes celulares de los tejidos, dejando intacta la matriz extracelular con la vascularización integrada. La circulación se realiza a través de un vaso central eferente conectado a un extenso lecho capilar, cuyo retorno se realiza a través de un único vaso aferente.
El corazón bioartificial es una alternativa teórica al trasplante o la asistencia ventricular definitiva. Su desarrollo requiere ingeniería de la arquitectura cardíaca, constituyentes apropiados celulares y la función de bomba. Los corazones son descelularizados por perfusión coronaria con detergentes, preservando la matriz extracelular y produciendo una arquitectura vascular acelular, válvulas competentes y geometría intacta de las aurículas y ventrículos. La reconstrucción se realiza por perfusión coronaria de células cardíacas y endoteliales durante 28días en un biorreactor que simula la fisiología cardíaca. Se puede observar contracción macroscópica a partir del día 4; a partir del día 8 se genera, bajo estimulación eléctrica, la función de bomba equivalente al 2% de la función cardíaca del corazón adulto17.
Bioingeniería cardíaca con nanobiomaterialesHasta ahora, la matriz celularizada óptima para restaurar y mantener un robusto miocardio no ha sido identificada. Nuestro grupo está evaluando nanobiomateriales con membranas sobre polímeros para obtener una liberación controlada de fármacos del parche con otras funciones adicionales, como la atracción celular (actividad proangiogénica) y diferenciación (precardiomiocitos). La inyección de células madre en el corazón es insuficiente debido a la pobre capacidad de injertarse y supervivencia. Para mejorar la capacidad de injertarse y la función, la ingeniería de tejidos necesita cierto grado de vascularización precoz.
Nuestro grupo está desarrollando plataformas con células madre preacondicionadas mediante electroestimulación para resistir la implantación en un tejido de gran estrés19. Las células son incorporadas en la nueva matriz biodegradable que mantiene la supervivencia celular, diferenciación cardiomiogénica propia e instrucción extracelular precoz. Esta estructura debe inducir una vascularización precoz para asegurar el remodelado del tejido y la regeneración en el nuevo miocardio funcional16.
Nuevos progresos en el diseño y fabricación de biomateriales sintéticos han sido abordados en el campo de la nanotecnología para aplicación directa en biomedicina. El objetivo de estos materiales es aportar propiedades estructurales y funcionales similares a las matrices extracelulares, conteniendo verdaderos sistemas tridimensionales con control en la liberación y concentración efectiva de «fármacos terapéuticos»20,21. Los nanomateriales sintéticos son plataformas atractivas por su composición pura, especificidad, bajo coste y control de la degradación. Las proteínas, péptidos y polisacáridos son prioritarias en el diseño y fabricación por su versatilidad22,23. La investigación en las propiedades electrofisiológicas del miocardio bioartificial es un objetivo prioritario de las próximas investigaciones. Un electrodo múltiple que asegure la estimulación eléctrica debe ser incluido para optimizar el acoplamiento de las células madre injertadas y los cardiomiocitos residentes para mejorar las propiedades locales del miocardio isquémico.
ConclusiónLa terapia con células madre ha mostrado hasta ahora beneficios hemodinámicos limitados en las enfermedades miocárdicas5,24. El desarrollo de tejido miocárdico a través de la ingeniería de tejidos ofrece nuevas perspectivas en el tratamiento de las enfermedades cardiovasculares. Los desarrollos futuros dan la prioridad a la utilización de plataformas de bioingeniería y nanotecnología con células madre preacondicionadas por electroestimulación para resistir su implantación en el tejido miocárdico.