El tratamiento de elección para las infecciones de los dispositivos de estimulación cardiaca, a día de hoy, es la tracción percutánea endovascular con vainas de disección mecánicas o láser, que en manos expertas tiene una tasa de éxito de casi el 98% y una mortalidad inferior al 1%. El éxito del procedimiento depende fundamentalmente de la experiencia del operador y de las características propias del dispositivo (marcapasos/desfibrilador, lado y tiempo de implante, tipo, número y estado de los electrodos). Para realizar una extracción segura con vainas mecánicas es necesario conocer las herramientas usadas en el procedimiento, tener una sistemática de trabajo (que comprenderá todas las precauciones posibles) y conocer bien las posibles complicaciones que puedan surgir.
A lo largo de esta revisión daremos respuesta a múltiples preguntas: ¿qué hacer antes de empezar?, ¿cómo realizamos la extracción?, ¿por qué usar vainas mecánicas y cuáles son sus ventajas frente a las vainas láser?, ¿por dónde empezar y cómo terminar? De todo ello concluiremos que en manos expertas y siguiendo un protocolo de trabajo, la extracción con vainas mecánicas es una técnica segura, con relativamente pocas complicaciones, aunque no por ello dejemos de estar siempre alerta ante ellas y saber cómo solucionarlas de la manera más rápida posible en un entorno quirúrgico adecuado.
The treatment of choice for infections of cardiac pacing devices is currently percutaneous endovascular traction with mechanical or laser dissection sheaths, which in experienced hands has a success rate of almost 98% and a mortality rate of less than 1%.The success of the procedure depends mainly on the experience of the operator and the characteristics of the device itself (pacemaker/defibrillator, side and time of implantation, type, number and condition of the electrodes). Safe extraction with mechanical sheaths requires knowledge of the tools used in the procedure, a systematic approach (including all possible precautions), and a good understanding of the possible complications that may arise. It is also necessary to have the means available for early diagnosis and treatment.Throughout this review we will answer many questions: What to do before we start? How do we perform the extraction? Why use mechanical sheaths and what are their advantages over laser sheaths? Where to start and how to finish?
La tracción percutánea endovascular (TPE), a día de hoy, es sin duda la técnica de elección para la extracción de electrodos de dispositivos de estimulación cardiaca (DEC), ya que en manos expertas tiene una tasa de éxito de casi el 98% y una mortalidad inferior al 1%1.
El fundamento de su utilidad es que permite la liberación de las adherencias fibrosas y calcificadas que se producen tras el implante de los electrodos, usando vainas de disección mecánicas autorrotatorias o vainas láser.
Cuando se implanta un electrodo, su extremo proximal queda unido al generador, su extremo distal anclado en el endocardio y su cuerpo flotando por el torrente circulatorio. A medida que pasa el tiempo, se van creando adherencias fibrosas e incluso calcificadas entre los diversos electrodos o bien entre el electrodo o los electrodos y la pared de las diversas venas que recorren: vena subclavia, vena innominada, vena cava superior (VCS) y la pared del endocardio, en la aurícula o el ventrículo derecho (VD) o bien en seno coronario en casos de terapia biventricular.
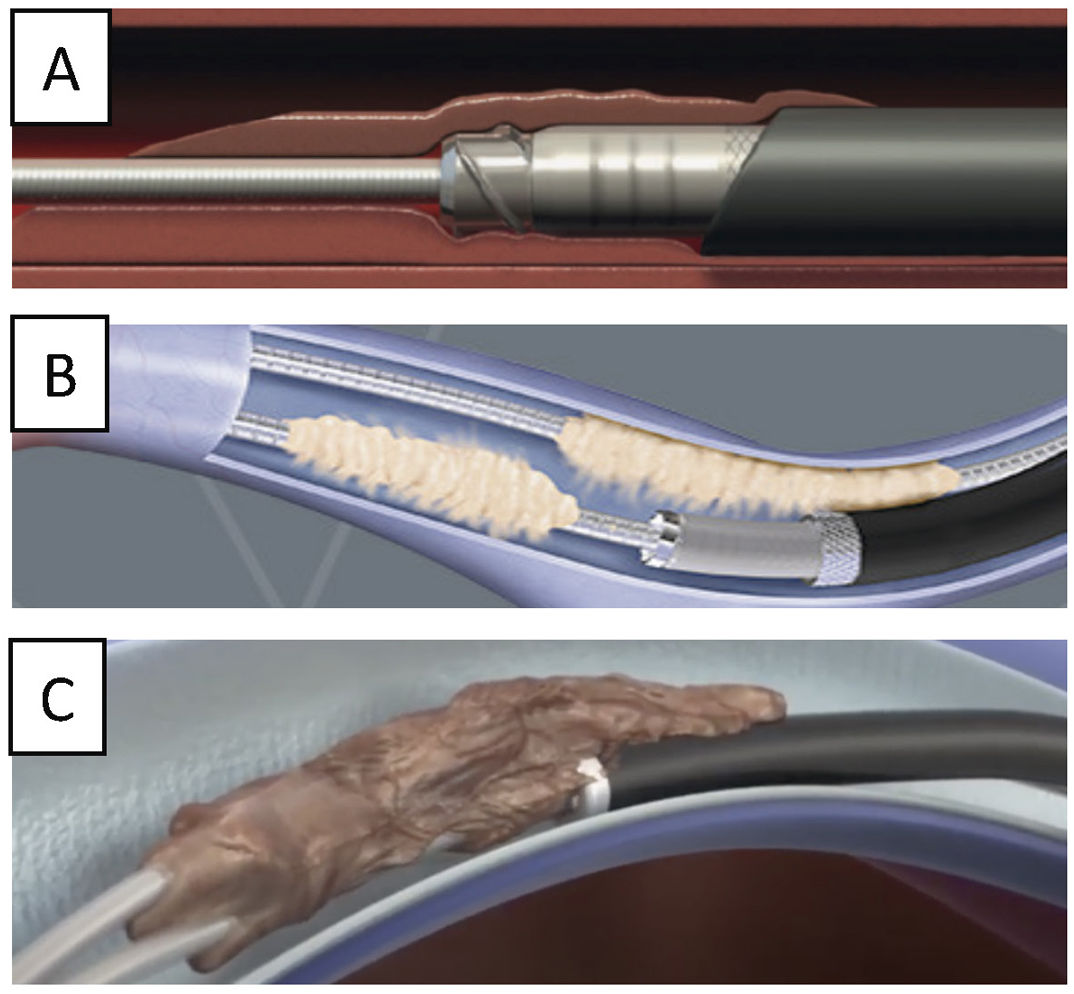
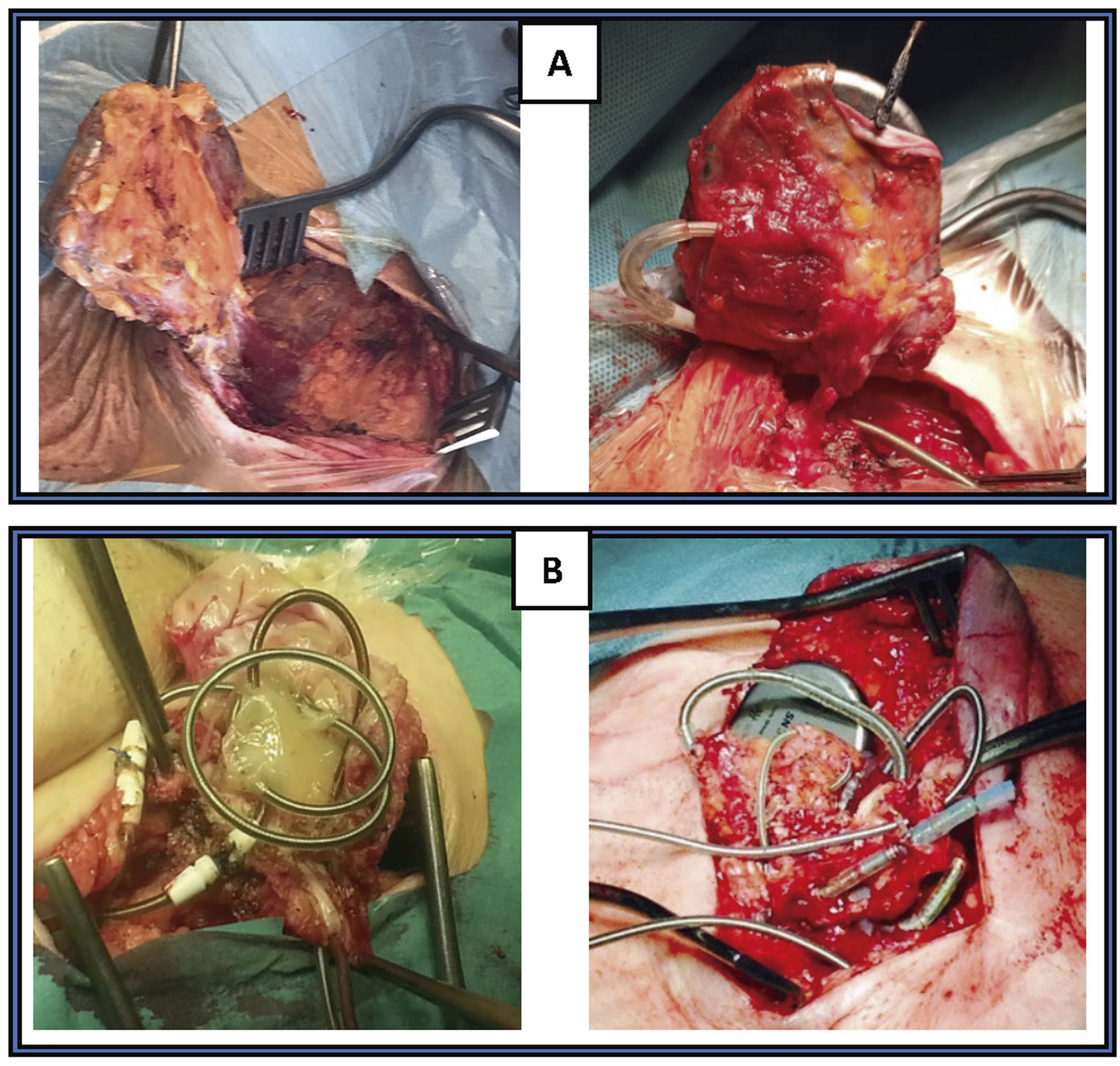
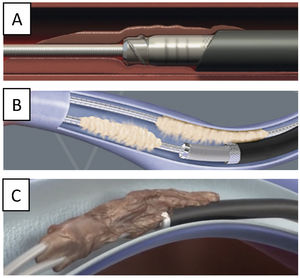
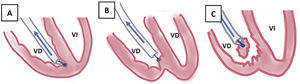
La TPE con vainas mecánicas autorrotatorias consiste en la liberación de las adherencias fibrosas, mediante una tracción sostenida del electrodo usando un estilete de tracción introducido por el conductor del cable y 2vainas telescopadas de teflón, una externa, que va separando parcialmente las adherencias, y otra interna, que posee en su extremo distal unas cuchillas metálicas que van cortando de manera giratoria bidireccional (horaria-antihoraria), a golpe de gatillo, las adherencias existentes. A veces, liberando solo las adherencias vasculares se puede conseguir la extracción de los electrodos, pero en otras ocasiones es preciso progresar hasta la misma inserción de los cables en el endocardio, tirando y empujando a la vez con la vaina externa para evitar la eversión del VD en un proceso que se denomina contratracción2 (figs. 1 y 2).
Extracción por tracción percutánea con vainas mecánicas. A) Uso de liberator y vaina para extracción de electrodo de VD. B) Salida del electrodo con ligera contratracción. C) Eversión y rotura de VD al realizar la tracción del electrodo sin contratracción adecuada.
VD: ventrículo derecho; VI: ventrículo izquierdo.
La probabilidad de éxito de la extracción, considerada como la retirada completa del torrente circulatorio de todos los electrodos o la permanencia de un fragmento<4cm, depende de varios factores1:
- a.
Lado de implante: siempre son más difíciles las extracciones de los electrodos implantados por el lado derecho, por la curvatura existente entre la vena subclavia derecha y la VCS que forman un ángulo casi recto (90°), dificultando la progresión de algunas vainas que tienen una flexibilidad limitada.
- b.
Años de implante: cuanto mayor sea el número de años implantados, mayor será la cantidad de adherencias que se desarrollen. Con implantes inferiores a un año habitualmente se suelen explantar el 99%, a los 10-15 años se consigue la extracción completa en el 75% y por encima de los 15 años se reduce casi al 50% en determinados electrodos. Esto es debido a que el tiempo de implante influye decisivamente sobre la resistencia del cable a la tracción por el acúmulo y dureza de las adherencias, así como por la debilidad progresiva del cable a la tracción («fatiga» del metal), lo que hace más fácil su rotura.
- c.
Características del electrodo:
- 1.
Tipo de electrodo: los electrodos de los desfibriladores automáticos implantables (DAI) generan mayor cantidad de adherencias en la zona de las bobinas que es donde poseen mayor diámetro y una superficie más rugosa.
Los electrodos de marcapasos (MP) poseen un diámetro constante en toda su longitud y habitualmente forman menos adherencias que los de DAI en las mismas circunstancias. Existe excepción en los electrodos VDD que tienen un engrosamiento a nivel del sensor auricular que, al ser punto de conexión, constituye un punto de debilidad y de aumento de adherencias.
- 2.
Tipo de fijación: la extracción de electrodos con fijación pasiva que están anclados entre las trabéculas del VD es más difícil que la de los de fijación activa, que tienen menos superficie de adherencia al desplegar su hélice y en los que, además, generalmente, es posible recogerla de forma total o parcial. Además, estos electrodos son isodiamétricos (al contrario que los de fijación pasiva, que son más gruesos en la punta) siendo, por tanto, más fácil su salida del túnel que forma su endotelización.
- 3.
Número de electrodos: a mayor número de electrodos mayor dificultad de extracción por las adherencias surgidas entre los propios electrodos.
- 4.
Estado de los electrodos: en electrodos elongados o rotos se dificulta la extracción por la imposibilidad de usar algunas de las herramientas necesarias para llevar a cabo el procedimiento como el estilete tractor, que en ellos no puede introducirse a través del orificio del conductor del cable, siendo necesario recurrir a otras técnicas alternativas, como el lazo femoral.
- d.
Experiencia del operador: el procedimiento es complejo y precisa de una habilidad notable, por lo que se exige una curva de aprendizaje de 40 extracciones (1-2 años de entrenamiento) con mantenimiento de un número de 40 extracciones/año hasta dominar bien la técnica. Por esta razón está accesible en muy pocos centros de nuestro país3,4.
Antes de proceder a la extracción del dispositivo es conveniente tener en cuenta varios factores para minimizar la aparición de posibles complicaciones o contratiempos5:
- a.
Telemetría: es necesario valorar si el paciente es MP dependiente o si, por el contrario, tiene ritmo propio o de escape. En el caso de un DAI o terapia de resincronización (TRC) hay que tener en cuenta, además, si precisa o no un nuevo implante, por haber tenido descargas o ser un buen respondedor de la TRC.
- b.
Hemocultivo: antes de proceder a la extracción hay que asegurarse de que los hemocultivos llevan negativos 72 h, sobre todo si se va a hacer el implante en el mismo acto.
- c.
Ecocardiografía transtorácica/transesofágica (ETT/ETE): en los pacientes con sospecha de infección sistémica, hay que realizar una ecocardiografía para valorar posibles verrugas, afectación valvular o existencia de derrame pericárdico previo al procedimiento.
- d.
Anticoagulación/antiagregación:
- -
La anticoagulación debe ser retirada antes de la cirugía (48-72 h antes los dicumarínicos, 24-48 h los nuevos anticoagulantes orales de acción directa y 12 h antes la heparina de bajo peso molecular) y no reanudarla hasta pasadas 48-72 h. Es recomendable evitar la estrategia «puente» y reanudar la anticoagulación oral a partir de las 48 h.
- -
La antiagregación con ácido acetilsalicílico (AAS) puede mantenerse, pero no la doble antiagregación (AAS+clopidogrel, por ejemplo), que debe retirarse 3-5 días antes. No reanudar la doble antiagregación hasta pasadas 48-72 h.
Para realizar una extracción por TPE es imprescindible tener el control del electrodo, que se consigue con los estiletes de tracción, que actúan como un «rail» por el que se desplazan las vainas de disección que rompen las adherencias1,6,7.
- a.
Estiletes de contratracción:
- -
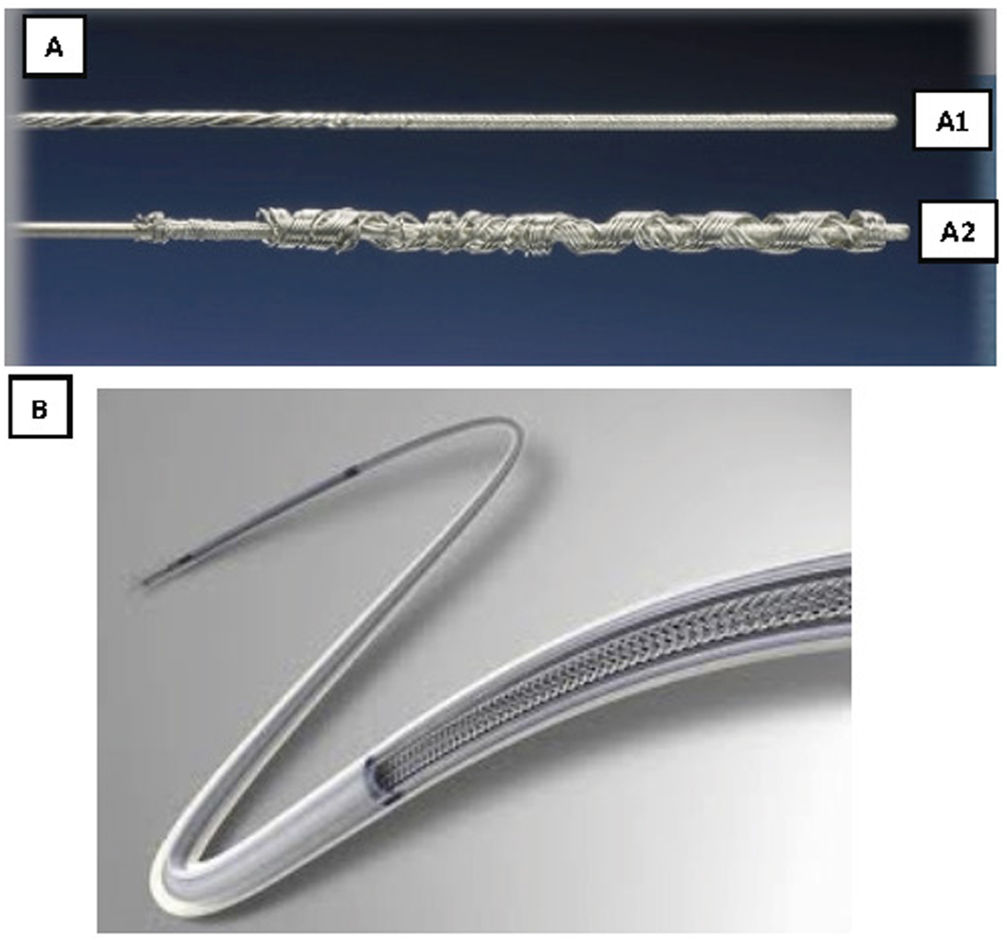
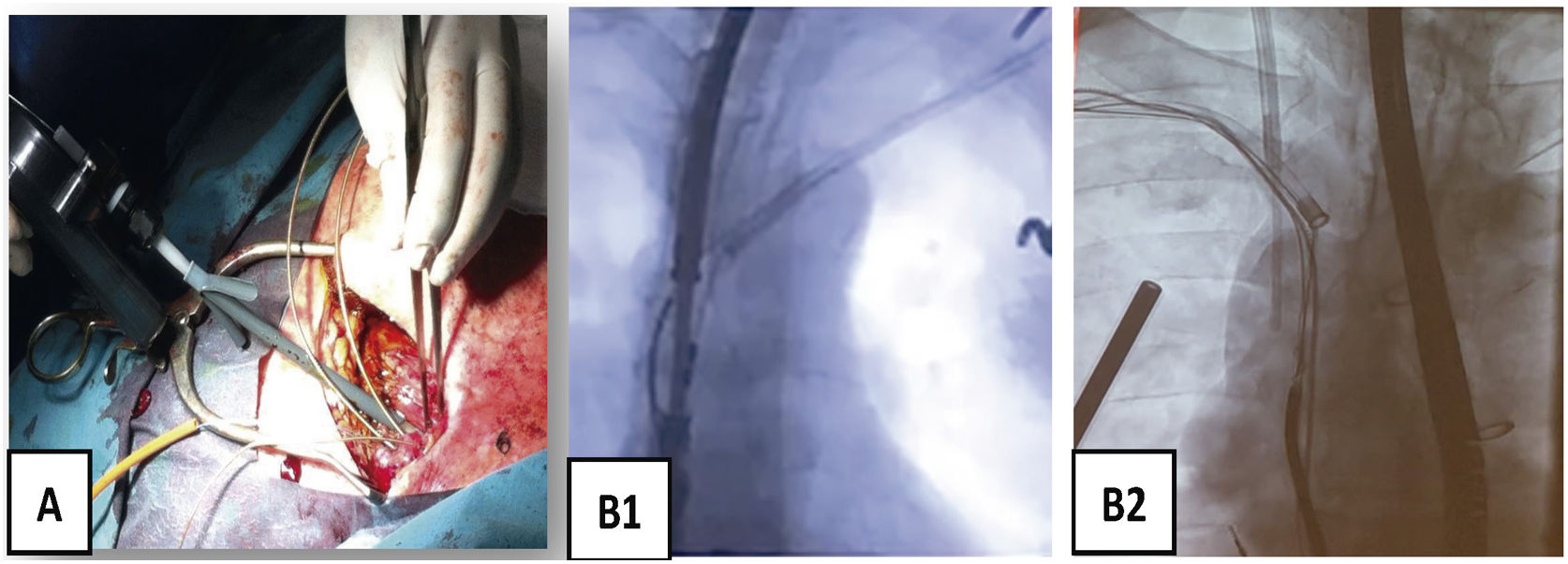
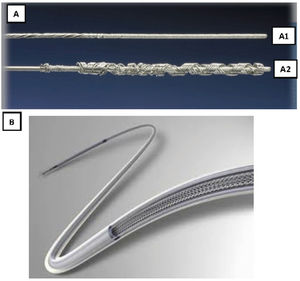
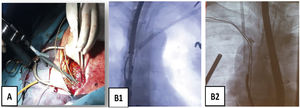
Son guías de acero inoxidable que se introducen por el conductor del electrodo y que tras su despliegue permiten tener control del mismo (fig. 3).
- -
Existen 2tipos distintos, comercializados por 2casas comerciales diferentes:
- 1.
Liberator® Beacon Tip Locking Stylet (Cook Medical, Bloomington, Indiana, EE. UU.). Se despliega un ovillo distal de forma irreversible que ancla el extremo distal del electrodo y permite una tracción fundamentalmente desde la punta.
- 2.
LLD® Lead Locking Device (Philips Company, San Diego, California, EE. UU.) (originariamente fabricado por Spectranetics y después por Biomenco). Se trata de un estilete que se despliega aumentado su diámetro de manera reversible a todo lo largo del cable, lo que permite una tracción sostenida en toda su longitud.Ambos, tras su despliegue, deben fijarse también al electrodo en su parte proximal, bien con una sutura de hilo o un alambre de acero inoxidable (One Tie® Compression Coil [Cook Medical, Bloomington, IN, EE. UU.]), para que la tracción sea efectiva tanto proximal como distal y funcionen como un único elemento.
- b.
Vainas mecánicas autorrotatorias:
- -
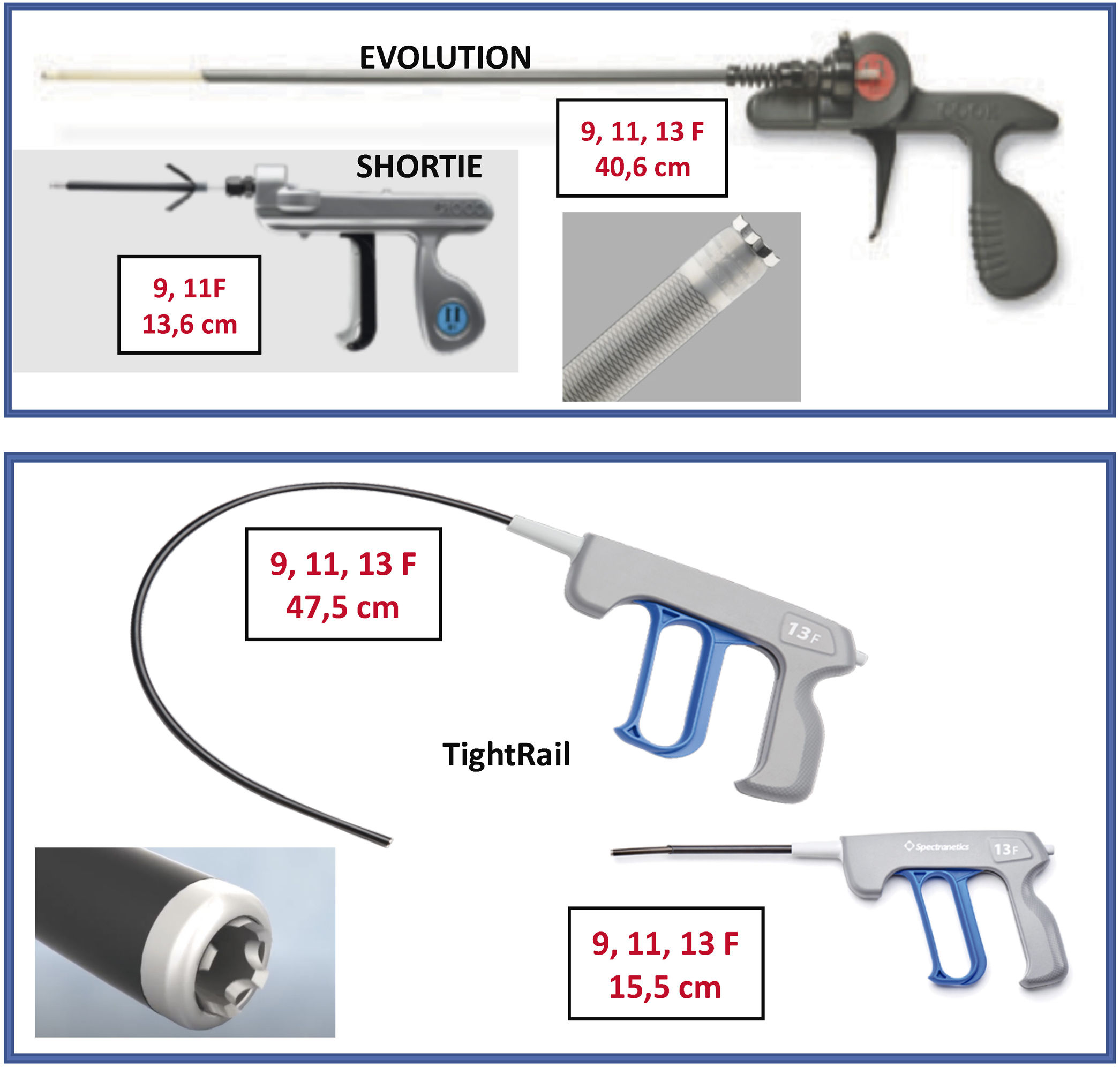
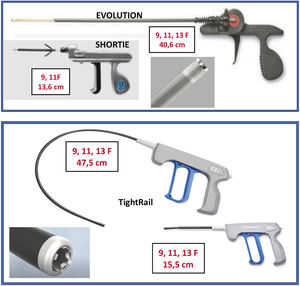
Son 2vainas telescopadas de teflón: 1) una vaina externa, que puede terminar o no con una punta metálica, y 2) una vaina interna que posee en el extremo distal unas cuchillas metálicas que giran a golpe de gatillo de forma bidireccional (sentido horario y antihorario), seccionando las adherencias. Existen 2longitudes, unas cortas (13-15cm) y otras largas (40-47cm) y también de varios diámetros que oscilan entre los 9 a los 13 french (Fr).
- -
Están distribuidas por 2casas comerciales:
- 1.
Cook: Evolution® Shortie RL 9-11 Fr y Evolution® RL RL 9-11-13 Fr (Cook Medical, Bloomington, IN, EE. UU.).
- 2.
Biomenco/Philips (antes Spectranetics): TightRailTM Sub-C 9-13 Fr y TightRailTM 9 -13 Fr (Philips Company, San Diego, California).Ambas son similares en cuanto al mecanismo de acción y la diferencia fundamental radica en la forma de las cuchillas: las de Cook son unas cuchillas dentadas de punta roma que al girar de forma bidireccional van rompiendo las adherencias, mientras que las de Philips son pequeñas cuchillas individuales que al girar protruyen 0,02” en la luz vaso para después recogerse, de manera que salen y entran de la vaina interna con cada golpe de gatillo. Esta vaina es además más flexible, por lo que se adapta mejor en las angulaciones más pronunciadas, como las de subclavia derecha con VCS (figs. 4 y 5).
- c.
Otros elementos:
- -
Guías simples de acero inoxidable de 0,356mm de diámetro con una longitud de 52 a 60cm (las mismas que se usan para el implante) que permiten comprobar la permeabilidad del conductor.
- -
Alambres de ensamble (Bulldog Lead Extender®, Cook Medical, Bloomington, IN, EE. UU.). Son elementos de acero inoxidable que se insertan sobre los cables y permiten la tracción sobre electrodos elongados en los que no ha podido introducir el estilete tractor a través del orificio del conductor.
- -
Lazo femoral o yugular (Needle's Eye Snare®, Cook Medical, Bloomington, IN, EE. UU.), para la extracción de electrodos rotos intravasculares o intracardiacos: se trata de un dispositivo que permite recuperar en ocasiones los fragmentos retenidos de cables.
Aunque el procedimiento se puede realizar en laboratorios de electrofisiología, nosotros recomendamos hacerlo en un quirófano de cirugía cardiovascular, donde el paciente está con anestesia general, canalización de vena femoral izquierda para infusión de líquidos o fármacos, monitorización electrocardiográfica y de tensión arterial invasiva (por arterial radial generalmente), así como oximetría. Todo el procedimiento se desarrolla con control de ETE, colocación de MP transcutáneo (por si se produce un fallo en la estimulación eléctrica endovascular), bomba de circulación extracorpórea (CEC) y recuperador de sangre preparados. En algunos casos, especialmente complicados como DAI bibobinas muy añosos e introducidos por lado derecho en pacientes jóvenes, podemos realizar un control más exhaustivo del procedimiento mediante la visualización a través de una toracoscopia derecha intraoperatoria7.
Antes de iniciar la extracción del DEC, preferimos realizar el reimplante del nuevo DEC por la subclavia contralateral o bien por la región femoral derecha, en caso de no poder usar aquella. Independientemente de la vía, colocamos siempre electrodos de fijación activa que se implantan en el mismo acto, excepto en la estimulación del ventrículo izquierdo (VI) en los que se usan de fijación pasiva y se demora el implante entre 24-48 h, dependiendo de la dificultad de su retirada para minimizar los riesgos de rotura del seno coronario. Solo nos interesa inicialmente, dejar anclado en endocardio y normofuncionante, el electrodo de VD con despliegue de su hélice en el lugar donde los parámetros eléctricos sean adecuados y el umbral <1voltio (V). Lo conectamos mediante pinzas al analizador y lo dejamos activado a una frecuencia de 50 latidos por miny una salida de 5 V para garantizar la estimulación durante la extracción, en caso de enfermos MP dependientes. No lo fijamos al subcutáneo ni anclamos el resto de los electrodos ni los unimos al generador, hasta que no se ha terminado la extracción de todos los cables. De esta manera se agiliza la recolocación del electrodo de VD, si se disloca durante la extracción1,8.
¿Cómo extraer?Colocación guía Emeral® por vena femoralDespués de asegurar la monitorización y la estimulación cardíaca por vía contralateral al lado de la extracción, colocamos una guía de diagnóstico (p. ej., Emerald® guía de acero inoxidable recubierto de PTFE con diámetro externo de 0,035” y 180mm de longitud, de Cordis) desde vena femoral derecha hasta VCS, por si fuese necesario la colocación de un balón oclusor en caso de rotura de VCS (Bridge Occlusion balloon 20×80mm, Philips Company, San Diego, California) o disponer de una vía venosa accesoria. Su paso a través de la VCS también nos aporta información sobre la permeabilidad de la misma.
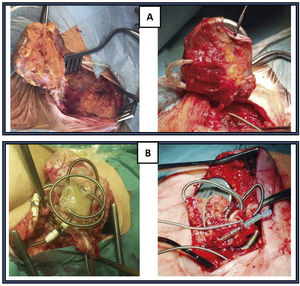
Exéresis del bolsilloLo ideal es que procedamos a retirar el bolsillo del generador, haciendo una disección cuidadosa de todo el bloque hasta llegar a la cara anterior del músculo pectoral mayor, evitando en lo posible romper la bolsa y traccionar de los electrodos. Sin embargo, esto a veces es totalmente imposible porque ya existe extrusión del generador o electrodos (fig. 6).
Disección de electrodosUna vez retirado el bolsillo, hacemos una disección meticulosa de los electrodos para separarlos del magma fibroso que lo envuelve, evitando en todo momento hacer tracciones de los mismos y llegando hasta el lugar de entrada en la vena subclavia. Posteriormente retiramos las palometas de fijación subcutánea, en caso de existir.
Tras comprobar, que el electrodo nuevo de VD (que hemos colocado previamente por lado contralateral o femoral) funciona correctamente, y que la estimulación está por tanto asegurada, desconectamos los electrodos a extraer del generador. Si son de fijación pasiva, los podemos cortar a unos 15-20cm de su entrada en subclavia, pero si son de fijación activa hay que disecarlos en toda su longitud, para intentar el repliegue de la hélice de fijación. Siempre, durante todo el procedimiento, hay que evitar la tracción y elongación del conductor y la rotura del aislante de los cables.
Comprobación mediante guía simpleUna vez que tenemos los electrodos libres, en cada uno de ellos introducimos una guía simple, igual que la que se emplea para el implante, por el conductor, para comprobar la permeabilidad del mismo, la existencia de pus en su interior, recoger la hélice en la fijación activa y comprobar si salen con tracción suave.
Introducción del estilete tractorSi los cables no salen con una tracción suave, cambiaremos la guía por un estilete tractor. Introduciremos uno en cada uno de los electrodos que tengamos que extraer, siempre bajo control de escopia, vigilando la progresión de su punta y asegurándonos bien que llegue hasta el final del electrodo. Después desplegamos el estilete y lo fijamos al electrodo, bien con un hilo de sutura o con un One Tie Compression Coil® (Cook Medical, Bloomington, IN, EE. UU.). Posteriormente, hacemos una tracción ligera de los mismos (< 1,5 KP). Si no sale, entonces es el momento de usar las vainas mecánicas1.
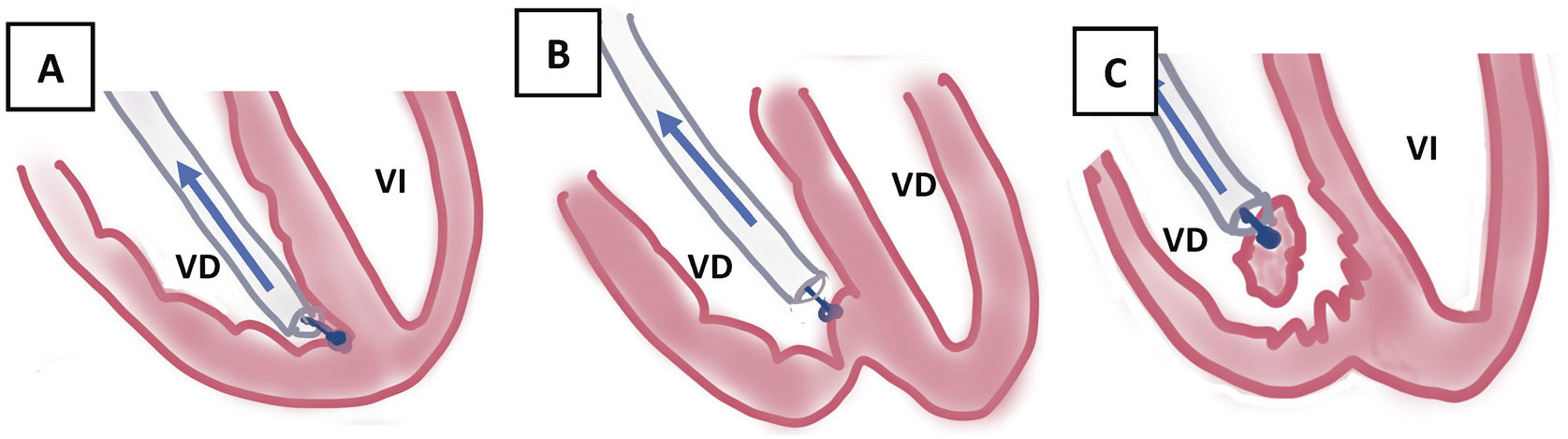
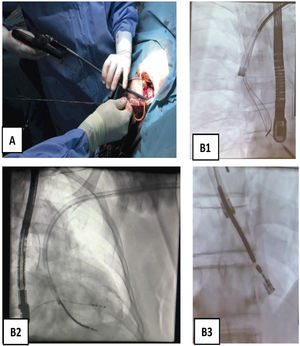
¿Cómo usar las vainas mecánicas?Entrada en vena subclaviaSi con tracción simple o con el estilete tractor no salen, es que hay adherencias que lo impiden. Generalmente hay un callo fibroso al inicio de la subclavia y adherencias en vena innominada que se pueden solventar con las vainas cortas tanto de Cook (Shortie®) como de Phillips (TigthRail®). Nosotros solemos comenzar por la Shortie de 11 Fr hasta llegar al ángulo con la VCS, en cuyo caso cambiamos por una vaina larga de 13 Fr (Evolution® de Cook o TightRail® de Phillips). A partir de aquí, hay que tener mucho cuidado con la tracción de los electrodos, que pueden producir la eversión del VD, responsable de hipotensión grave por bajo gasto (si no hay gasto derecho, no puede haber gasto izquierdo y se produce el shock hemodinámico) (fig. 7).
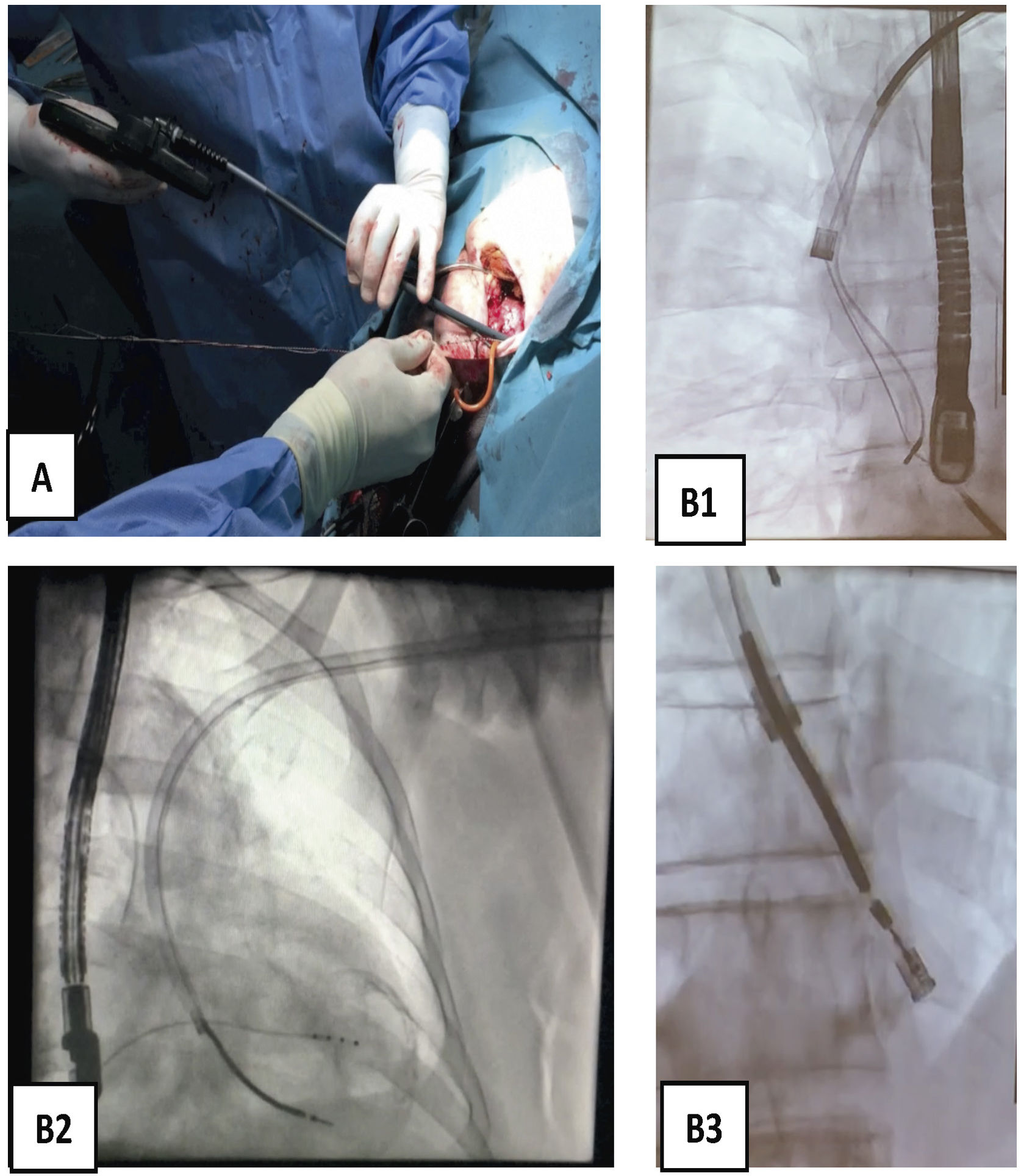
Progresión endovascular o endocárdicaLa progresión de las vainas siempre debe hacerse desde el primer momento hasta el final del procedimiento, bajo control de escopia, siguiendo el trayecto axial de las venas a través del estilete tractor (que actúa como un raíl de conducción para las vainas), traccionando siempre suavemente para evitar que las vainas corten en el proceso de disección al electrodo (fig. 8).
Extracción de electrodos con vaina mecánica larga. A) Vaina Evolution de COOK 13 Fr. B) Imagen radioscópica de progresión de la vaina mecánica en B1 pasando la VCS y la AD, en B2 el VD y en B3 incluyendo en la vaina interna la bobina distal de electrodo de DAI traccionado y anclado en el VD.
AD: aurícula derecha; Fr: french; VCS: vena cava superior; VD: ventrículo derecho.
Si no podemos avanzar con las vainas puede ser debido a que existen:
- –
Fuertes adherencias (en ocasiones calcificadas) a la pared e incluso entre los propios cables.
- –
Embotamiento de las cuchillas tras un periodo intenso de trabajo en adherencias muy duras.
- –
Acúmulo de material (fragmentos fibrosos rotos y que se desprenden con el proceso) que se va disponiendo alrededor del electrodo y que hace que su diámetro sea mayor que el de la vaina, impidiendo la progresión telescopada de esta.
En estos casos, aconsejamos cambiar por una vaina de mayor calibre y, si los electrodos están adheridos entre sí, intentar la tracción con 2 electrodos introducidos de forma simultánea en la misma vaina y con la misma sistemática (tracción axial y disección) hasta llegar a la VCS, y continuar luego progresivamente liberando todas las adherencias, hasta el lugar de anclaje en endocardio, donde en ocasiones, para despegar el electrodo hay que realizar una contratracción empujando con la vaina externa, a la par que se realizan disparos muy suaves con la interna.
En todo el proceso la monitorización mediante ETE es fundamental, ya que nos va a aportar información sobre la eversión del VD o las posibles complicaciones valvulares (daño en la tricúspide) o endocárdicas (roturas que motivarían hipotensión progresiva y aparición de derrame pericárdico).
Durante la progresión de las vainas merece la pena resaltar algunas peculiaridades específicas en cada zona de paso:
- –
Entrada en vena subclavia izquierda e innominada: a veces el callo fibroso de entrada es extraordinariamente duro y puede romper la vaina externa y embotar la interna, por lo que hay que retirarla, limpiarla y cambiar la vaina externa de teflón por una de punta metálica.
- –
Entrada en vena Subclavia derecha y VCS: se produce un ángulo agudo donde suelen existir mucha fibrosis y confluencia generalmente de varios cables, por lo que el avance y la entrada hasta coger el plano axial de progresión en VCS debe ser muy lento y cuidadoso, con tracción suave para rectificar un poco el angulado trayecto vascular y sin forzar nada. Con las vainas de Cook, a veces es necesario progresar solo con la vaina interna para ganar en flexibilidad y facilitar el paso por la zona. Las vainas de Philips son más flexibles en estas circunstancias.
- –
VCS: antes de pasar a esta zona es importante definir por ETE en el plano bicava, el grosor de la pared, la movilidad de los cables en su interior y las adherencias entre ellos. En casos de 3-4 electrodos por VCS, sobre todo si hay alguno de DAI bibobina pueden existir grandes adherencias que obstruyen la luz casi en su totalidad. Con paciencia se va pasando la vaina y si no progresamos, la extraemos para limpiarla y repetimos la maniobra. Cuando hay buena movilidad de los electrodos en el interior de la luz podemos suponer que están alejados de la pared y que tienen pocas adherencias, por lo que, aunque el procedimiento siempre debe hacerse con precaución, nos permite una progresión más relajada con menos riesgo de rotura.
- –
Aurícula derecha (AD): generalmente las adherencias en AD son débiles, por lo que si el electrodo no sale tras la liberación de VCS es necesaria la contratracción en el lugar de anclaje. Hay que tener cuidado cuando están implantados en la pared libre de la orejuela, ya que puede acompañarse de roturas (habitualmente pequeñas) que producen derrames pericárdicos, pero con estabilidad hemodinámica y que son controlados por el trombo generado en su pared. En los grandes, es necesario la apertura (esternotomía media inmediata) para la sutura de la pared.
- –
Seno coronario: los electrodos de estimulación del VI suelen salir tras liberar las adherencias en el eje subclavio-innominado-VCS. En caso contrario, progresamos las vainas hasta la entrada del seno coronario donde realizamos la contratracción. No aconsejamos progresar las vainas por el interior de seno por la fragilidad de su pared y el alto riesgo de rotura. En caso de electrodos con fijación activa (tipo Starfix®) puede intentarse, pero requiere mucha experiencia y los riesgos son muy altos9.
- –
Válvula tricúspide: salvo que el electrodo haya perforado algún velo durante el implante, el despegamiento de las adherencias fibrosas con las vainas se suele hacer con facilidad, sin que exista deterioro de la válvula. En caso de perforación, estaremos obligados a realizar una reparación quirúrgica mediante cirugía cardiaca abierta.
- –
VD: debemos tener precaución especial en electrodos muy adheridos al endocardio de VD (DAI bibobina, fijación pasiva, mucho tiempo de implante), en los que durante la tracción y progresión de las vainas se puede producir eversión de VD con hipotensión transitoria que revierte con el cese de la tracción y que requieren habitualmente la progresión de las vainas hasta el endocardio donde se hace contratracción. Durante esta fase es aconsejable tener un equilibrio, entre la tracción que rectifique el electrodo y facilite el paso de la vaina y la hipotensión producida por la eversión de VD asociada1.
Cuando tenemos varios electrodos, implantados en años distintos, debemos comenzar la extracción por el que lleva menos años colocado, que es el que a priori debe tener menos fibrosis y saldrá con mayor facilidad. Cuando todos tienen el mismo tiempo, nosotros preferimos empezar por el de AD, seguido de VD y finalmente el de seno coronario. Cuando existen electrodos de MP y de DAI, sobre todo si son bibobina preferimos comenzar por el de MP, que presumiblemente tendrá menos adherencias.
Especial atención hay que tener con:
- 1.
Los electrodos de seno coronario que son muy delgados y especialmente frágiles. Habitualmente, intentamos introducir el estilete tractor solo hasta el origen del seno coronario y cuando está muy adherido lo intentamos extraer asociado a otro electrodo para evitar su rotura.
- 2.
Los electrodos de DAI, que a nivel de las bobinas de desfibrilación tienen mayor diámetro, con más adherencias, por lo que puede ser más difícil la progresión de las vainas y generalmente es necesario usar unas vainas de mayor diámetro (13F)1.
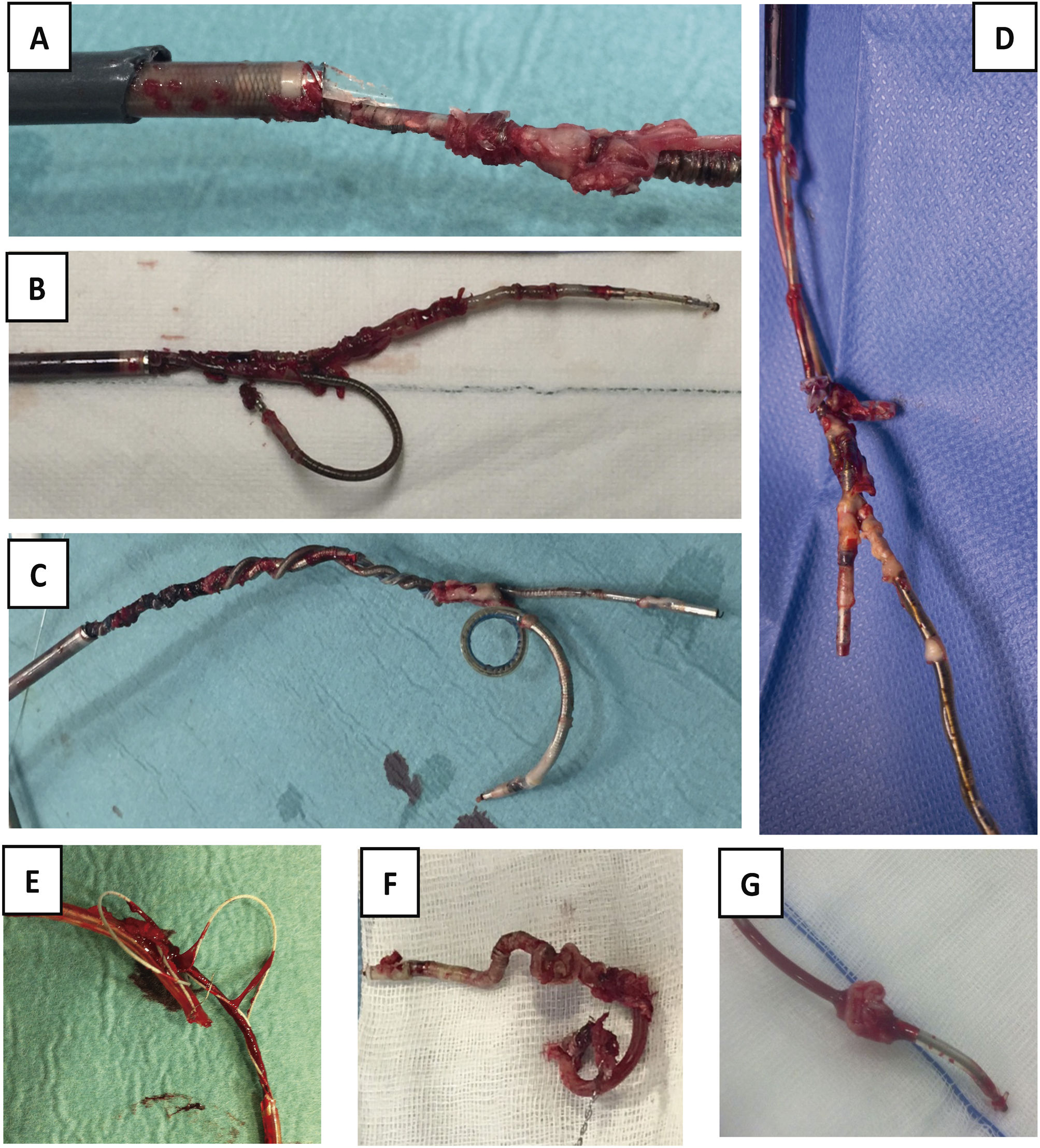
Una vez resecado el bolsillo y extraídos todos los electrodos (fig. 9), se realiza una hemostasia cuidadosa del lecho quirúrgico y se cierra por primera intención, con puntos sueltos reabsorbibles en subcutáneo (evitando dejar espacios muertos que favorezcan la aparición de seromas), piel con grapas e infiltración con anestesia local (para disminuir algo el dolor en la zona, una vez despertado en paciente).
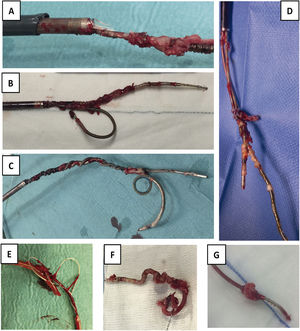
Electrodos extraídos. A) Electrodo con gran cantidad de adherencias sobre bobina de DAI, sobre cuchillas de vaina interna y con rotura de vaina externa. B) Extracción conjunta de 2electrodos de fijación pasiva, uno de DAI y otro de AD por adherencias de ambos en VCS, que impiden la progresión de las vainas por separado. C) Extracción conjunta de 2electrodos de fijación activa, uno de DAI y otro de MP de VD, con enrollamiento de los 2durante todo el recorrido. D) Extracción conjunta de 2electrodos de MP con importantes adherencias entre ellos a nivel de AD. E) Fragmento de electrodo de MP extraído con desestructuración de toda su envoltura de silicona. F) Bobina distal de DAI totalmente recubierta de tejido fibroso y retraída por su paso por el interior de la vaina interna. G) Verruga sobre electrodo de MP de fijación pasiva.
AD: aurícula derecha; DAI: desfibrilador automático implantable; MP: marcapasos; VD: ventrículo derecho; VCS: vena cava superior.
Posteriormente, volvemos a comprobar el umbral correcto del nuevo electrodo de VD contralateral y terminamos de posicionar el resto de los electrodos necesarios, para finalmente conectarlos al nuevo generador, que se ubicará en la región subcutánea correspondiente.
Terminado el procedimiento y después de comprobar la normofunción del nuevo dispositivo implantado, la estabilidad hemodinámica del paciente y la ausencia de complicaciones por ETE, se despierta al paciente y se traslada a la Sala de Recuperación Postoperatoria (Despertar), ya que en muy pocas ocasiones es necesario su paso a la Unidad de Cuidados Inetensivos.
Resultados de la TPE con vainas mecánicasActualmente sabemos que la extracción de electrodos mediante la TPE en manos experimentadas ofrece buenos resultados y escasas complicaciones, ya sea con vainas de disección mecánicas autorrotatorias o láser, pero también sabemos que ambos procedimientos pueden asociarse a complicaciones graves e incluso mortales.
Elegir entre unas vainas u otras va a depender en parte del precio (bastante más elevado en las vainas láser) y de la experiencia del operador, ya que la eficacia de ambas es muy similar, con quizás un poco menos de complicaciones con las mecánicas8.
En un reciente metaanálisis9 donde se analizan 48 estudios en los que se incluyen a 1.098 pacientes y 1.955 electrodos extraídos con vainas mecánicas y a 7.775 pacientes con 12.339 electrodos extraídos con vainas láser, a pesar de que el tiempo de implante era mayor en los electrodos extraídos con vainas mecánicas (7,2 años vs. 6,3 años), la extracción completa fue ligeramente superior con las vainas mecánicas (95,1% vs. 93,4%), con una mortalidad menor (0,09% vs. 0,85%), lo que se traduce en un riesgo de muerte 9,3 veces mayor con las vainas láser10.
Este aumento de mortalidad (más de 9 veces) con las vainas láser también se ve reflejado en otro estudio reciente11 en el que se analizaron 50.545 extracciones (36% con vainas mecánicas y 64% con vainas láser) y en el que se encontró que el número de muertes asociado a las vainas láser era mayor que el de las vainas mecánicas (167 vs. 13) con lo que el riesgo relativo de muerte era 7,2 veces mayor con vainas láser (intervalo de confianza del 95%, 4,1-12,7, p <0,0001)12.
Posiblemente esto se deba a que las vainas láser disecan gracias a una fuente externa de potencia, mientras que en las mecánicas la fuerza de disección la imprime el propio operador a golpe de gatillo, lo que permite (gracias al sentido del tacto) una percepción mayor del grado de dureza de la fibrosis a la que nos enfrentamos. En ocasiones, las adherencias tienen incluso una dureza cálcica que fácilmente percibimos, por lo que con las vainas mecánicas vamos ajustando, tanto la tracción como el avance de la vaina externa e interna con los disparos rotatorios que realizamos y la fuerza que aplicamos. En cambio, el calentamiento «a distancia» originado por la punta de la vaina láser sobre la adherencia no es percibido igual por el operador, y en casos de que haya calcio, el calor va a generar una resistencia aún mayor del molde, lo que en ocasiones puede concluir en la rotura del vaso por el calentamiento excesivo. De hecho, en estas ocasiones, la manera de salir del paso es recurriendo a la vaina mecánica autorrotatoria, para una vez sorteado el obstáculo, seguir con la vaina láser.
DiscusiónComo hemos visto, la TPE realizada con un adecuado procedimiento de trabajo y por manos expertas es la técnica de elección para la retirada de los electrodos, existiendo pocas limitaciones para su uso. En un estudio reciente de 16 revisiones sistemáticas, en las que se incluye a 3.354 pacientes de infecciones DEC que requirieron extracción, el 92% se realizó con TPE y el 8% restante por esternotomía2. La cirugía cardiaca se realizó por fallo de la TPE, vegetaciones grandes, roturas vasculares o cardiacas durante el procedimiento, la necesidad de implantar electrodos epicárdicos o la presencia de daños concomitantes valvulares2.
En cuanto a las vegetaciones grandes que en ocasiones se observan en las infecciones sistémicas, durante un tiempo se recomendó, por parte de autores franceses, limitar su uso cuando el diámetro de la vegetación adherida al cable era mayor de 1cm, por el riesgo de embolia pulmonar13. Sin embargo, bastaba revisar la serie para comprobar que este límite arbitrario propuesto no se cumplía ni siquiera por los mismos autores, ya que la mayoría de los cables extraídos presentaban vegetaciones mayores, sin que se registraran complicaciones. Por esta razón, de nuevo arbitrariamente se elevó el límite a 2cm de diámetro14,15, también sin ninguna evidencia. En nuestra experiencia, la mayoría de estas embolias son asintomáticas e incluso las que se producen con vegetaciones> 2cm tienen escasa repercusión clínica y se recuperan espontáneamente en pocos días, no influyendo por tanto en el pronóstico, como así se ha demostrado en otros estudios16,17. Teniendo en cuenta que la cirugía cardíaca (que sería la opción alternativa en este caso) presenta una mortalidad cercana al 10%18-20 y no por ello está exenta de estas complicaciones embólicas21,22, pensamos que debe ser siempre una decisión individualizada. En caso de vegetaciones enormes (> 4cm), se han diseñado también sistemas para su extracción endovascular23,24.
Aunque en manos expertas la TPE tiene escasas complicaciones, estas pueden oscilar entre un 0,5 a un 15% según las series americanas o europeas2. Y, afortunadamente, no todas son de la misma gravedad. Así, pueden aparecer complicaciones menores, entre un 3-14,7%, entre las que se incluyen el hematoma del bolsillo o la trombosis de vena subclavia. Pero también podemos encontrarnos con complicaciones mayores en el 0,5 al 4,8%, entre las que se encuentran los desgarros vasculares de vena subclavia, innominada o VCS o bien roturas cardiacas a nivel de AD o VD que conllevan a derrames pericárdicos de diferente magnitud y repercusión, siendo obligatorio en los casos más graves recurrir a la cirugía cardiaca para su reparación. Se ha propuesto una puntuación de estratificación del riesgo para clasificar a los pacientes en riesgo bajo, moderado y alto de extracción de cables. La puntuación de dificultad de extracción de electrodos propuesta por Bontempi et al.25,26 se definió como: número de electrodos extraídos en un procedimiento+edad del electrodo (años desde el implante)+1 si hay doble bobina –1 si hay vegetación. Este método identificó a los pacientes de alto riesgo si la puntuación era> 10. Fu et al.27 han obtenido resultados similares (alto riesgo si el electrodo tiene más de 10 años en un MP o más de 5 años en un DAI). Esta estrategia puede orientar sobre qué extracción es mejor realizar en el quirófano en lugar de en la sala de electrofisiología.
En todo caso, y aun cuando no tengamos durante la extracción complicaciones mayores, el riesgo de rotura de los cables va a estar siempre presente con dispositivos implantados por encima de los 10 años. Se suele considerar una extracción incompleta cuando el fragmento intravascular o endocavitario retenido es mayor de 4 cm8. Si no podemos extraerlo mediante el uso de asas o lazos femorales, nuestra actitud va a depender de si existe una infección subyacente y su tipo.
En infecciones locales podemos adoptar una actitud expectante, ya que la mayor parte del cable habrá sido extraída y la infección está limitada «teóricamente» a la bolsa del generador y la porción de los cables próxima al generador. Sin embargo, esto no es tan claro y puede que en el momento de la extracción, aunque no existan síntomas sistémicos (fiebre, elevación de reactantes de fase aguda, embolias, etc.), la infección ya haya progresado de manera silente hasta la porción intravascular de los cables. En nuestra experiencia, hasta en un 30% de las ocasiones se produce la recidiva1 muchas veces meses más tarde y en forma de infección sistémica, que no siempre es fácil de reconocer (fiebre sin focalidad aparente).
En caso de que los fragmentos queden retenidos tras una TPE y lazos femoral-yugular fallidos en el curso de una infección sistémica, la recaída es entonces la normal, por lo que nos deberemos siempre plantear la cirugía cardiaca como único medio de resolver el problema y en caso de que no sea viable (pacientes muy deteriorados), recurrir a un tratamiento antibiótico supresivo crónico con la ayuda de un infectólogo experto. Por ello, nunca se insistirá bastante en la necesidad de un seguimiento multidisciplinar de estos pacientes, hasta asegurar su curación completa o al menos garantizar su supervivencia.
ConclusiónActualmente la TPE es, sin duda, la técnica de elección para la extracción de electrodos de DEC, ya que en manos expertas tiene una tasa de éxito de casi el 98% y una mortalidad inferior al 1%.
Es obligatorio realizar una planificación del procedimiento antes de su ejecución, tener una curva de aprendizaje suficiente y disponer de las herramientas necesarias para llevarlo a cabo, así como estar disponibles para tratar las posibles complicaciones que pudieran surgir, sobre todo cuando se pueda requerir cirugía cardiaca abierta.
Siempre hay que tener un control del electrodo y de la progresión de las vainas de disección mediante la radioscopia y anticiparnos a las posibles complicaciones mediante una monitorización invasiva, la ETE e incluso en ocasiones puede ser necesaria la toracoscopia.
Pero quizás lo más importante de todo es entender qué está pasando en cada momento, entender que las adherencias de mucho tiempo van a requerir casi siempre un procedimiento prolongado y que nunca, nunca, hay que tener prisa. Hay que evitar siempre las tracciones intensas o las maniobras bruscas que no hacen más que favorecer la aparición de complicaciones.
Conflictos de interesesNo hay conflictos de intereses con los autores.