Los injertos de vena safena (IVS) son los conductos más frecuentemente utilizados en la cirugía de revascularización. Sin embargo, su tasa de fallo es del 35-50% a 5-10años, debido en parte a la hiperplasia intimal secundaria al estrés parietal. Diferentes exostents han sido desarrollados a fin de paliar este efecto. Se realizó una búsqueda sistemática en Pubmed con diferentes combinaciones de palabras clave para identificar los estudios sobre el uso de exostents. Se realizaron dos metaanálisis, uno basado en la permeabilidad de los injertos y otro sobre el desarrollo de hiperplasia intimal patológica, correspondiéndose con los gradosII-III de la clasificación de Fitzgibbon. Se realizó una puesta al día de la evidencia en torno a los 5exostents disponibles. Se seleccionaron 10 trabajos comparativos controlados para los metaanálisis. La utilización de exostents resultó perjudicial en términos de permeabilidad (RR: 1,67; p=0,03). No obstante, en el análisis de subgrupos, los dispositivos VEST® no mostraron diferencias significativas respecto del grupo control (RR: 1,11; p=0,59). Además, estos dispositivos permitieron mantener un mayor porcentaje de injertos en gradoI de hiperplasia intimal frente a los injertos no soportados (RR: 0,53; p=0,02). Se concluyó que los exostents, globalmente considerados, no mejoran la permeabilidad de los IVS a corto-medio plazo. Con el seguimiento realizado, algunos dispositivos como VEST® han demostrado limitar el desarrollo de hiperplasia intimal, lo cual podría comportar beneficios en cuanto a permeabilidad de los injertos en la prolongación del seguimiento de los trabajos en curso.
Saphenous vein grafts (SVI) are the most common conduits used in revascularization surgery. However, its failure rate is 35-50% at 5-10years, partially due to intimal hyperplasia secondary to shear wall stress. Different exostents have been developed in order to amend this effect. A systematic review was performed in Pubmed with different combinations of keywords to identify all studies about the use of exostents. Two meta-analyses were performed, one based on the patency of the grafts and another focused on the development of pathological intimal hyperplasia, corresponding to gradesII-III of the Fitzgibbon classification. An update of the evidence was carried out regarding the 5 exostents already available. Ten controlled comparative studies were selected for the meta-analyses. The use of exostents was detrimental in terms of patency (RR: 1.67; P=.03). However, in the subgroup analysis, the VEST® devices did not show significant differences compared to the control group (RR: 1.11; P=.59). Furthermore, these devices allowed maintaining more grafts in gradeI of intimal hyperplasia, compared to unsupported grafts (RR: 0.53; P=.02). To conclude, exostents, globally considered, do not improve IVS patency in the mid-short term follow-up. However, some devices such as VEST®, have shown to limit the development of intimal hyperplasia, which may improve graft patency in the extension of the follow-up of ongoing studies.
Los injertos de vena safena (IVS) siguen siendo los conductos más frecuentemente utilizados en la cirugía de revascularización miocárdica1. A pesar de los avances en el conocimiento de su biología y los cambios fisiopatológicos tras su utilización como injertos coronarios, su tasa de fallo se mantiene de forma precoz en el 18%, alcanzando el 35-50% a 5-10años tras la intervención2. El fallo de los IVS está relacionado con cambios adaptativos de la pared a nuevas condiciones de presión arterial, que incluyen el desarrollo de una respuesta inflamatoria acompañada de la aparición de hiperplasia intimal, que son la base para el desarrollo de aterosclerosis acelerada que conducen al fallo del injerto. Los soportes externos de los IVS han surgido con un enfoque prometedor para reducir el desarrollo de hiperplasia intimal, dotando a la pared de la vena safena de propiedades que reduzcan el estrés que comporta su implante en territorio arterial3,4. Tras experiencias con prototipos en modelos animales5,6 se han desarrollado diferentes dispositivos basados en diferentes diseños y materiales con aplicación en seres humanos. Entre ellos, destacan los soportes de poliéster Extent® (Vascutek®, Inchinnan, Reino Unido) y Tricomed® (Lodz, Polonia) y los stents externos de nitinol eSVS Mesh® (Kips Bay Medical®, Minneapolis, EE.UU.), de polímero plástico ProVena® (B.Braun®, Melsungen, Alemania) y de cromo-cobalto VEST® (Vascular Graft Solutions®, Tel Aviv, Israel).
Este trabajo pretende realizar una revisión bibliográfica sistemática para actualizar la evidencia con este tipo de dispositivos, realizándose un análisis pormenorizado de las características de cada uno de ellos y sus resultados clínicos, tanto individuales como agregados en un diseño de metaanálisis.
MétodosEstrategia de búsqueda bibliográficaSe planteó el problema de estudio como pregunta PICO: en pacientes sometidos a cirugía de revascularización miocárdica, ¿el uso de dispositivos de soporte exterior de los IVS reduce el desarrollo de hiperplasia intimal y mejora su permeabilidad? Los términos integrantes de la pregunta PICO, así como su traducción a lenguaje normalizado según el tesauro MeSH, se recogen en la tabla 1. Se realizó una búsqueda bibliográfica en Pubmed realizando diferentes combinaciones de términos MeSH: 1)«CABG», «coronary artery bypass»; 2)«external stent», «VEST», «eSVS», y 3)«vein graft», «saphenous vein», a fecha de 20 de abril de 2023, sin aplicarse filtros en lo referente al diseño de los trabajos, al límite en su fecha de publicación o a la lengua de publicación del trabajo, siendo traducidos al inglés aquellos que no se presentaran en inglés o en español.
Pregunta PICO, lenguaje común de cada uno de sus elementos y traducción a términos MEsH para la búsqueda bibliográfica
| Lenguaje común | Términos MEsH | ||
|---|---|---|---|
| P | Pacientes sometidos a cirugía de revascularización miocárdica | Enfermedad arterial coronaria, cirugía de bypass coronario | «Coronary artery disease», «coronary artery bypass grafting», «CABG» |
| I | Manejo conservador de los IVS | Injerto de vena safena | «Saphenous vein graft» |
| C | Soporte externo de los IVS | Soporte externo | |
| O | Mejora de la permeabilidad, reducción de hiperplasia intimal | Permeabilidad de injertos, hiperplasia intimal | «Vein graft failure», «graft patency», «intimal hyperplasia», «intimal thickening» |
Nótese la ausencia de término MEsH para denominar los dispositivos de soporte externo de los IVS.
Dos investigadores (EM y MC) realizaron un cribado jerárquico de los artículos obtenidos de la búsqueda, inicialmente por su título, posteriormente por la evaluación de sus resúmenes y finalmente por la evaluación del trabajo completo. Se seleccionaron aquellos estudios que ofrecían una comparación entre los resultados de permeabilidad de IVS soportados con dispositivos externos frente a aquellos sin dicho soporte. Tras la exclusión de los trabajos duplicados, se analizó el contenido para determinar su elegibilidad. Las divergencias entre investigadores fueron resueltas por consenso. Se analizaron trabajos de revisión previos para identificar otros artículos potencialmente seleccionables, así como se consultó la base de datos ClinicalTrials.gov para obtener información sobre los trabajos registrados como ensayos clínicos aleatorizados por medio de su código de referencia.
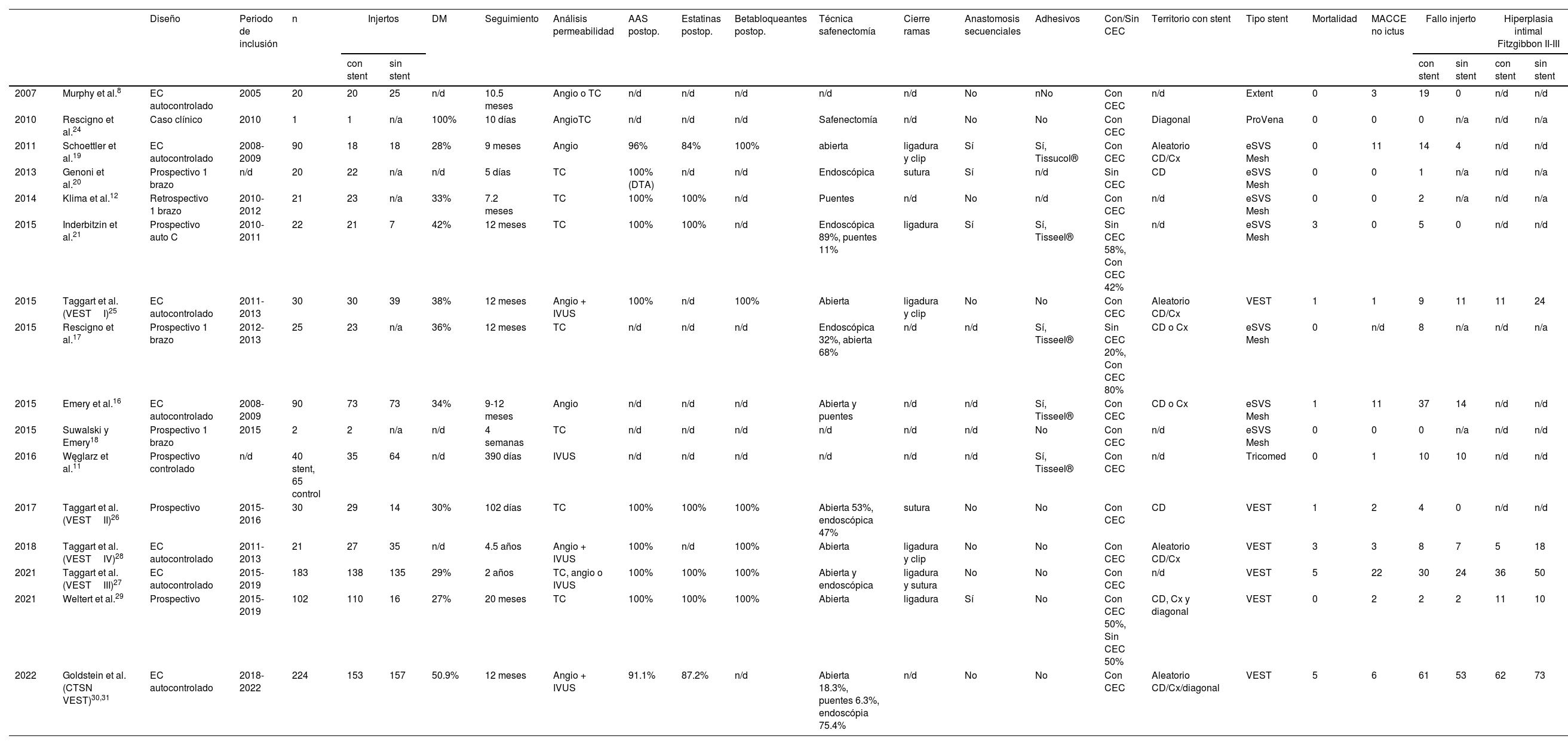
Recogida de datos y características de los estudios incluidosSe consideraron las siguientes características de los trabajos analizados: año de publicación; primer autor; diseño del estudio; periodo de inclusión; número de pacientes incluidos; tasa de pacientes diabéticos; tratamiento postoperatorio con antiagregación, estatinas y/o betabloqueantes; número de IVS con y sin soporte externo; seguimiento realizado para determinar la permeabilidad de los injertos y metodología para determinar dicha permeabilidad (angiografía, IVUS y/o tomografía); territorio coronario de implante de los IVS; tipo de soporte externo; aspectos técnicos de la safenectomía: técnica abierta, endoscópica y/o abierta con puentes cutáneos, realización de anastomosis secuenciales, método de cierre de las ramas laterales; utilización de sellantes para limitar la migración del soporte; técnica de revascularización con o sin circulación extracorpórea; variables clínicas, como mortalidad y eventos cardiovasculares no cerebrovasculares (nuevo infarto de miocardio, nueva revascularización), tasa de fallo de los injertos soportados y no soportados (definida como oclusión o presencia de estenosis >50%); así como desarrollo significativo de hiperplasia intimal de los injertos soportados y no soportados medida según la clasificación de Fitzgibbon7 (gradoI: sin irregularidades luminales; gradoII: irregularidades luminales <50%; gradoIII: irregularidades luminales >50%). Todas las anteriores variables quedan recogidas en la tabla 2.
Tabla resumen de los principales hallazgos de la revisión de la literatura
| Diseño | Periodo de inclusión | n | Injertos | DM | Seguimiento | Análisis permeabilidad | AAS postop. | Estatinas postop. | Betabloqueantes postop. | Técnica safenectomía | Cierre ramas | Anastomosis secuenciales | Adhesivos | Con/Sin CEC | Territorio con stent | Tipo stent | Mortalidad | MACCE no ictus | Fallo injerto | Hiperplasia intimal Fitzgibbon II-III | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| con stent | sin stent | con stent | sin stent | con stent | sin stent | ||||||||||||||||||||
| 2007 | Murphy et al.8 | EC autocontrolado | 2005 | 20 | 20 | 25 | n/d | 10.5 meses | Angio o TC | n/d | n/d | n/d | n/d | n/d | No | nNo | Con CEC | n/d | Extent | 0 | 3 | 19 | 0 | n/d | n/d |
| 2010 | Rescigno et al.24 | Caso clínico | 2010 | 1 | 1 | n/a | 100% | 10 días | AngioTC | n/d | n/d | n/d | Safenectomía | n/d | No | No | Con CEC | Diagonal | ProVena | 0 | 0 | 0 | n/a | n/d | n/a |
| 2011 | Schoettler et al.19 | EC autocontrolado | 2008-2009 | 90 | 18 | 18 | 28% | 9 meses | Angio | 96% | 84% | 100% | abierta | ligadura y clip | Sí | Sí, Tissucol® | Con CEC | Aleatorio CD/Cx | eSVS Mesh | 0 | 11 | 14 | 4 | n/d | n/d |
| 2013 | Genoni et al.20 | Prospectivo 1 brazo | n/d | 20 | 22 | n/a | n/d | 5 días | TC | 100% (DTA) | n/d | n/d | Endoscópica | sutura | Sí | n/d | Sin CEC | CD | eSVS Mesh | 0 | 0 | 1 | n/a | n/d | n/a |
| 2014 | Klima et al.12 | Retrospectivo 1 brazo | 2010-2012 | 21 | 23 | n/a | 33% | 7.2 meses | TC | 100% | 100% | n/d | Puentes | n/d | No | n/d | Con CEC | n/d | eSVS Mesh | 0 | 0 | 2 | n/a | n/d | n/a |
| 2015 | Inderbitzin et al.21 | Prospectivo auto C | 2010-2011 | 22 | 21 | 7 | 42% | 12 meses | TC | 100% | 100% | n/d | Endoscópica 89%, puentes 11% | ligadura | Sí | Sí, Tisseel® | Sin CEC 58%, Con CEC 42% | n/d | eSVS Mesh | 3 | 0 | 5 | 0 | n/d | n/d |
| 2015 | Taggart et al. (VESTI)25 | EC autocontrolado | 2011-2013 | 30 | 30 | 39 | 38% | 12 meses | Angio + IVUS | 100% | n/d | 100% | Abierta | ligadura y clip | No | No | Con CEC | Aleatorio CD/Cx | VEST | 1 | 1 | 9 | 11 | 11 | 24 |
| 2015 | Rescigno et al.17 | Prospectivo 1 brazo | 2012-2013 | 25 | 23 | n/a | 36% | 12 meses | TC | n/d | n/d | n/d | Endoscópica 32%, abierta 68% | n/d | n/d | Sí, Tisseel® | Sin CEC 20%, Con CEC 80% | CD o Cx | eSVS Mesh | 0 | n/d | 8 | n/a | n/d | n/a |
| 2015 | Emery et al.16 | EC autocontrolado | 2008-2009 | 90 | 73 | 73 | 34% | 9-12 meses | Angio | n/d | n/d | n/d | Abierta y puentes | n/d | n/d | Sí, Tisseel® | Con CEC | CD o Cx | eSVS Mesh | 1 | 11 | 37 | 14 | n/d | n/d |
| 2015 | Suwalski y Emery18 | Prospectivo 1 brazo | 2015 | 2 | 2 | n/a | n/d | 4 semanas | TC | n/d | n/d | n/d | n/d | n/d | n/d | No | Con CEC | n/d | eSVS Mesh | 0 | 0 | 0 | n/a | n/d | n/d |
| 2016 | Węglarz et al.11 | Prospectivo controlado | n/d | 40 stent, 65 control | 35 | 64 | n/d | 390 días | IVUS | n/d | n/d | n/d | n/d | n/d | n/d | Sí, Tisseel® | Con CEC | n/d | Tricomed | 0 | 1 | 10 | 10 | n/d | n/d |
| 2017 | Taggart et al. (VESTII)26 | Prospectivo | 2015-2016 | 30 | 29 | 14 | 30% | 102 días | TC | 100% | 100% | 100% | Abierta 53%, endoscópica 47% | sutura | No | No | Con CEC | CD | VEST | 1 | 2 | 4 | 0 | n/d | n/d |
| 2018 | Taggart et al. (VESTIV)28 | EC autocontrolado | 2011-2013 | 21 | 27 | 35 | n/d | 4.5 años | Angio + IVUS | 100% | n/d | 100% | Abierta | ligadura y clip | No | No | Con CEC | Aleatorio CD/Cx | VEST | 3 | 3 | 8 | 7 | 5 | 18 |
| 2021 | Taggart et al. (VESTIII)27 | EC autocontrolado | 2015-2019 | 183 | 138 | 135 | 29% | 2 años | TC, angio o IVUS | 100% | 100% | 100% | Abierta y endoscópica | ligadura y sutura | No | No | Con CEC | n/d | VEST | 5 | 22 | 30 | 24 | 36 | 50 |
| 2021 | Weltert et al.29 | Prospectivo | 2015-2019 | 102 | 110 | 16 | 27% | 20 meses | TC | 100% | 100% | 100% | Abierta | ligadura | Sí | No | Con CEC 50%, Sin CEC 50% | CD, Cx y diagonal | VEST | 0 | 2 | 2 | 2 | 11 | 10 |
| 2022 | Goldstein et al. (CTSN VEST)30,31 | EC autocontrolado | 2018-2022 | 224 | 153 | 157 | 50.9% | 12 meses | Angio + IVUS | 91.1% | 87.2% | n/d | Abierta 18.3%, puentes 6.3%, endoscópia 75.4% | n/d | No | No | Con CEC | Aleatorio CD/Cx/diagonal | VEST | 5 | 6 | 61 | 53 | 62 | 73 |
AAS: ácido acetilsalicílico; Angio: angiografía; CD: arteria coronaria derecha; CEC: circulación extracorpórea; Cx: arteria circunfleja; DM: diabetes mellitus; EC: ensayo clínico; IVUS: ecografía endovascular; MACCE: eventos cardiovasculares mayores; n/d: datos no disponibles; TC: tomografía computarizada.
La validez interna y el riesgo de sesgos de los estudios incluidos fueron analizados de acuerdo con las guías propuestas por la Cochrane Collaboration Methods por otros cuatro revisores independientes (JG, PM, GL y LC), resolviendo asimismo las diferencias surgidas por consenso. En el análisis estadístico, los sesgos de publicación fueron analizados gráficamente mediante funnel-plot. La heterogeneidad fue medida mediante el estadístico Q de Cochran. La inconsistencia fue medida mediante el estadísticoI2.
Análisis de datosSe llevó a cabo un análisis estadístico mediante la plataforma RevMan Versión 5.3 (RevMan, Cochrane Collaboration, Oxford, Reino Unido), en conformidad con lo establecido según la Quality of Reporting of Meta-Analyses guidelines (QUORUM) y la Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA). La magnitud de efecto fue expresada como riesgo relativo (RR) junto a su correspondiente valor de intervalo de confianza al 95% (IC95%), adoptando valores: <1 y sin inclusión en IC95%, que se interpretó como la proporción en que el soporte externo redujo significativamente la tasa de fallo de los IVS, o >1 y sin inclusión en el IC95%, que se interpretó como las veces que el manejo conservador reduce la tasa de fallo de los IVS, siendo superior a la aplicación de soportes externos. El cálculo de la misma se llevó a cabo por medio del test de Mantel-Haenszel, en base a un modelo de efectos aleatorios cuando la inconsistencia estadística fue alta (I2≥25%) o de efectos fijos cuando fue baja (I2<25%). El análisis de sensibilidad se llevó a cabo por medio de la exclusión secuencial de cada uno de los trabajos incluidos en el modelo, repitiendo el metaanálisis y comprobando la influencia en el resultado global de la magnitud de efecto.
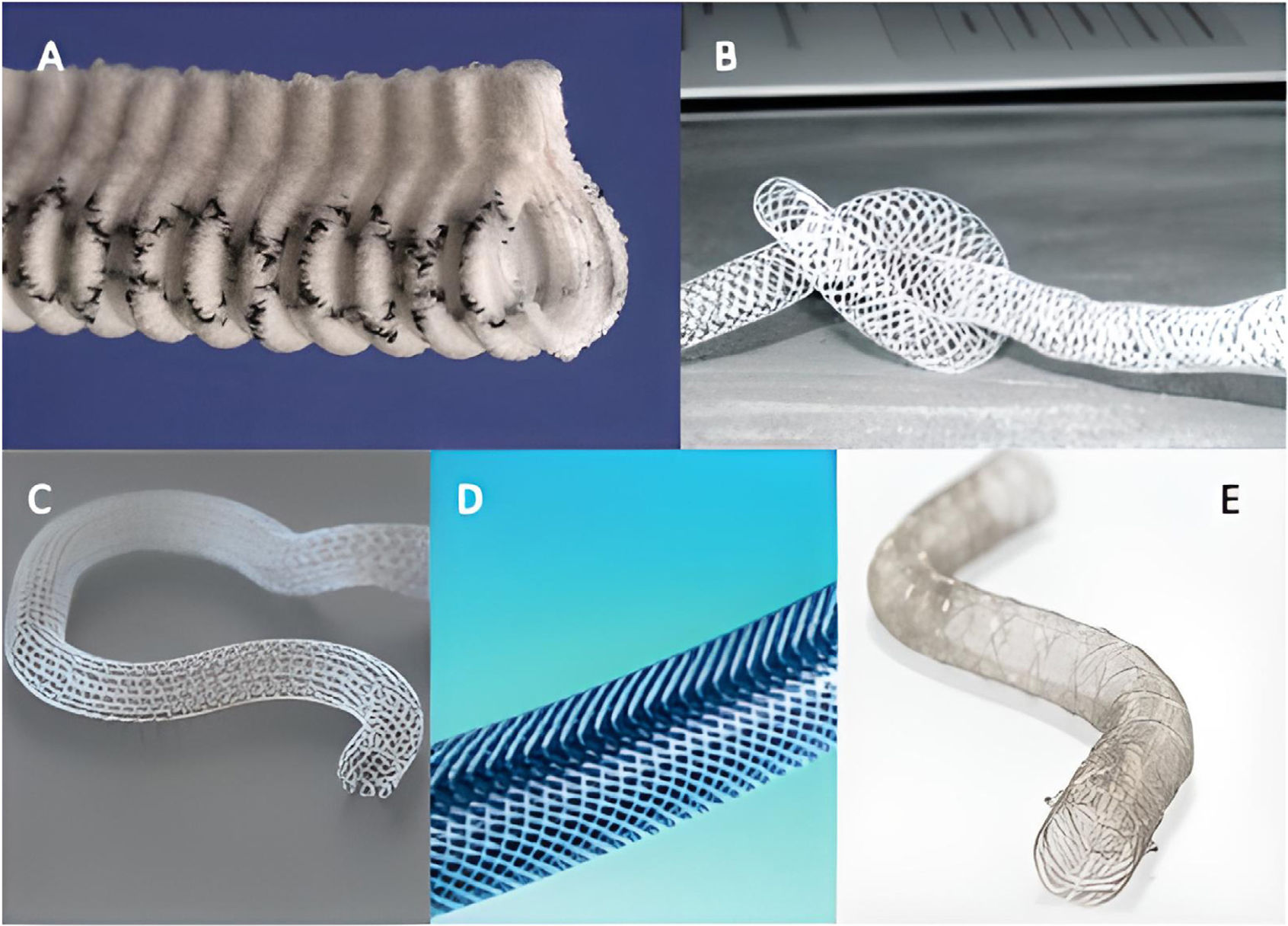
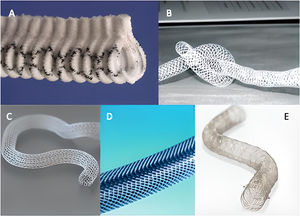
ResultadosAnálisis de los dispositivos de soporte externo de los injertos de vena safenaExtent®Es un dispositivo, desarrollado por Vascutek®, consistente en un conducto abierto longitudinalmente de poliéster (dacrón) cubierto por una estructura de politetrafluoroetileno circular, a modo de arcos con una separación de aproximadamente 1cm, coincidentes con el corrugado del conducto. Los extremos de cada arco contactan formando un borde o espina que da estructura al conjunto (fig. 1A). Existen dos tamaños de injertos, los de 8mm y los de 6mm, según el calibre del segmento de vena safena. La espina dotaría de resistencia a la torsión de la vena a la vez que permitiría mantener cerrado el conducto alrededor del injerto. El dispositivo se desarrolló con la intención de no ejercer compresión sobre el IVS, dejando hasta 1mm de margen entre el soporte y la adventicia del injerto. Su implante se llevaría a cabo una vez realizadas las anastomosis proximal y distal y tras reversión de la heparina con protamina. Una vez determinada la longitud necesaria, los extremos proximal y distal del soporte podría ser fijados a la adventicia aórtica y/o epicardio para evitar la migración. La espina sería dispuesta de acuerdo a la posición que menos torsión causara sobre la curvatura del injerto.
Solo dispone de la evidencia descrita por Murphy et al8. en un ensayo clínico autocontrolado de limitado tamaño. Los resultados fueron malos para los injertos tratados, con la práctica oclusión de la totalidad en menos de un año. Diferentes causas atienden a este fenómeno, entre ellas:
- •
El ambiente interno proinflamatorio9,10 que comporta el aislamiento del injerto venoso en un conducto de dacrón, además de la imposibilidad para el desarrollo de colateralidad nutricia desde su adventicia.
- •
La excesiva rigidez del diseño, que podría causar distorsión del injerto debido al tamaño del soporte y a que el implante se lleva a cabo una vez se han completado las dos anastomosis previamente al cierre de la cavidad torácica (el prototipo se desarrolló en un tramo vascular recto como es el modelo porcino de sustitución de un tramo de arteria carótida interna).
- •
La falta de aposición continua del injerto sobre la pared venosa, dejando un efecto de descarga del estrés parietal irregular a lo largo de la longitud, con el consiguiente desarrollo de hiperplasia intimal focal, sin un verdadero efecto remodelador del injerto.
Los autores proponen modificaciones alternativas con un soporte no restrictivo, flexible, biodegradable y macroporoso (Vicryl®, Ethicon®, Somerville, Nueva Jersey, EE.UU.) del que los autores no han reportado experiencias posteriores en la literatura revisada.
Tricomed®El soporte fue desarrollado por la colaboración de la empresa Tricomed® y la Universidad de Katowice. Consistió en una malla de poliéster que deja espacios romboidales vacíos por medio del entrelazado de sus fibras (fig. 1B). Se conseguiría así una estructura tubular flexible que permitiría dar soporte al injerto en su interior, siendo resistente a la flexión y a la torsión, a la vez que tendría capacidad de adaptar su diámetro al del injerto, reduciendo las fuerzas de cizallamiento sobre su pared. La vena sería introducida en el stent inicialmente y ajustada la longitud según necesidad una vez se realizasen secuencialmente cada una de las anastomosis. La fijación del stent a la pared del injerto se realizaría aplicando una capa de sellante (Tissucol®, Baxter® Healthcare, Deerfield, Illinois, EE.UU.) para evitar la migración.
La experiencia en la literatura con este dispositivo también se resume a un único trabajo prospectivo controlado no aleatorizado de Węglarz et al.11, con tasas de fallo del 28% y del 15% para los injertos soportados y no soportados, respectivamente, a 13meses. Los autores destacan lo limitado del desarrollo de la hiperplasia intimal en los conductos que permanecieron permeables, si bien atribuyen el fallo de los injertos al posible entorno proinflamatorio causado por el contacto de la adventicia del injerto con el poliéster9,10. En el análisis histológico de injertos de experiencias previas se apreció buena aposición del injerto, pero presencia de una proliferación reactiva de fibroblastos adventiciales con desarrollo de esta túnica que podría conducir a la reducción del calibre luminal.
eSVS Mesh®Se trata de un stent externo de nitinol, disponible en medidas de 3,5, 4 y 4,5mm (fig. 1C). El tamaño a elegir se determina por medio del uso de un calibre. Se contraindica en aquellos injertos de menos de 3,5mm o más de 7mm de diámetro y en aquellos cuya medición del doble espesor de la pared fuera mayor de 1,4mm. El stent tiene función constrictiva debido a la naturaleza del nitinol, produciendo compresión del 35% del diámetro luminal y permitiendo un 8% de expansión máxima con la pulsatilidad12. La medición Doppler de flujos intraoperatorios no se ve alterada por la presencia del stent13. La técnica de implante ha sido cuidada y ampliamente descrita por Emery et al.15 con una descripción inicial en 201214, a la cual se realizaron modificaciones técnicas en 2015 basada en los resultados subóptimos de este autor16 y otros grupos12,17-21. Se describe la técnica de control de ramas con ligaduras de 6/0 dejando el mínimo perfil posible, así como las técnicas de anastomosis, inicialmente incluyendo el stent y posteriormente sin incluirlo, dejando una adecuada morfología en «cabeza de cobra». El stent es colocado previamente a la realización de cualquiera de las dos anastomosis, procediéndose a la distensión del injerto por presurización hasta conseguir un contacto adecuado. Se recomienda la realización de la anastomosis distal primero para determinar mejor la longitud del injerto. Finalmente, para limitar la migración, se recomienda fijar el stent en vecindad a la anastomosis a la adventicia con clips en la versión de la técnica de 2015 que no incluía el stent en la misma, así como aplicar una capa de sellante Tissucol®. Posteriormente, Suwalski y Emery18 demuestran la ausencia de migración del stent sin necesidad de aplicar sellantes.
Desde la primera experiencia en humanos publicada por Schoettler et al.19, Emery et al.16 y Genoni et al.20 múltiples autores han comunicado su experiencia con este dispositivo, sin demostrar un claro beneficio. Las experiencias iniciales determinaron la necesidad de excluir los injertos de menos de 3mm debido a la falta de contacto con el stent de 3,5mm, y a la consiguiente necesidad de rellenar el espacio con sellante, cuyo uso es controvertido y se ha asociado con la oclusión de injertos coronarios22,23. Ninguna de las experiencias publicadas con el dispositivo mejora los resultados de permeabilidad respecto del manejo convencional de los injertos tras seguimientos de menos de un año.
ProVena®Se define por el fabricante como una prótesis de poro abierto en panal de abeja fruto del trenzado de fibras de polímero (fig. 1D). Su material biocompatible no produce reacción inflamatoria con la pared del injerto, siendo de fácil aplicación y extensión sobre el mismo. Existe una amplia variedad de tamaños, entre los 4 y los 10mm, para ajustarlo al tamaño de la vena. Incorpora unos aplicadores que se introducen por la luz del injerto para tallarlo y ayudar a la introducción por dentro del soporte. En la técnica de introducción, el injerto se repliega sobre dicho aplicador para posteriormente estirarlo ya dentro del conducto mallado. Ello implica una notable manipulación del injerto, con riesgo de lesión endotelial.
La experiencia en la literatura se limita a un caso clínico publicado por Rescigno et al.24, por lo que carece de estudios comparativos o seguimiento. En la técnica de implante descrita destaca la cobertura del injerto previa a la realización de las anastomosis y la inclusión del mallado del dispositivo en ambas anastomosis proximal y distal.
VEST®Es un stent de cromo-cobalto que, al igual que el anterior, se dispone externamente al IVS (fig. 1E). Realiza un remodelado del injerto, dotándole de mayor regularidad y limitando su dilatación con presión arterial. Tras una primera versión del dispositivo (tipo1), actualmente se dispone de stents con diámetros de 3mm a 5,5mm y de 5,5mm a 8mm, con longitudes de 4cm a 23cm. Se dispone de una herramienta de medida para determinar el diámetro y la longitud más adecuados según las características del injerto. A diferencia de los anteriores dispositivos, este stent se encuentra en posición comprimida, pudiendo ser estirado con los dedos a lo largo de la longitud del injerto. Con este gesto reduce su diámetro hasta ajustarse al del injerto y aumenta su longitud para cubrirlo. A raíz del estudio VESTI25 se propuso el control de las ramas laterales preferentemente con ligaduras con bajo perfil o sutura para evitar la protrusión hacia la luz de los clips, ya que presenta un mallado mucho más denso que los anteriores. Debido a la naturaleza del material, carece de memoria, por lo que no ejerce constricción sobre el injerto, permaneciendo en la posición con la que se dejó ajustado. Las anastomosis deben quedar libres de stent en una longitud de aproximadamente 10mm26, y no se recomienda la aplicación de sellantes, ya que tampoco se han descrito fenómenos de migración. La técnica quirúrgica permite adaptar su uso a las diferentes variantes de la cirugía de revascularización. Generalmente, es preferible realizar una de las dos anastomosis para proceder a cubrir el injerto con stent, determinar la longitud y completar la segunda anastomosis. En las experiencias reportadas no se ha contemplado la realización de anastomosis secuenciales, a diferencia del dispositivo eSVS Mesh®. También se ha comprobado la ausencia de interferencia con la medición Doppler de flujos intraoperatorios, a pesar de la densidad de su mallado27.
La experiencia con VEST® se resume en los trabajos de Taggart et al. con los estudios VESTI25, experiencia inicial en humanos y su seguimiento a medio plazo en el VESTIV28; VESTII26, incorporación de modificaciones técnicas y del nuevo diseño en el único trabajo no aleatorizado, y VESTIII27, el estudio aleatorizado de mayor volumen, multicéntrico, con seguimiento a 2años. En los diferentes trabajos no se obtuvo beneficio significativo en términos de permeabilidad con el dispositivo, identificándose una oclusión precoz de los injertos (VESTI25, <1año) que no se manifestaba en la extensión del seguimiento posterior (VESTIV28). Weltert et al.29 realizan un análisis análogo al diseño VESTI25 yIII27, sin aleatorización en la asignación del territorio portador de los IVS soportados, con un análisis de permeabilidad y de desarrollo de hiperplasia intimal similar en metodología y criterios a los anteriores trabajos. Este último trabajo obtiene buenos resultados de permeabilidad con este dispositivo. Sin embargo, la versión americana (CTSN VEST30,31) no mostró diferencias en el desarrollo de hiperplasia o en la permeabilidad en el seguimiento a un año. No obstante, en el resto de la experiencia con VEST® se comprueba una consistente reducción de la hiperplasia intimal, con mayor regularidad de la pared vascular según la clasificación de Fitzgibbon7.
Resultados de la búsqueda bibliográficaSe obtuvieron 58 trabajos de la estrategia de búsqueda inicial. Tras una primera selección y supresión de los duplicados, 24 fueron elegidos, de los cuales 17 fueron finalmente seleccionados para análisis a texto completo8,11,12,16-21,24-31 e incluidos en la revisión (tabla 2). Diez trabajos8,11,16,19,21,25-27,29,31 que incluían grupo control con injertos sin soporte externo fueron finalmente incluidos en el metaanálisis.
Características cualitativas y cuantitativas de los estudios seleccionadosLos estudios incluidos se caracterizaron por presentar muestras de pacientes reducidas con n entre 2 y 183, siendo todos ellos de reciente publicación (2007-2022). Ocho trabajos tuvieron un diseño de ensayo clínico aleatorizado y autocontrolado8,16,19,25,27,28,31, donde cada paciente fue portador de injertos soportados y no soportados que actuaban como controles de los primeros; 4 trabajos más se correspondieron con diseños prospectivos, análogos a los anteriores, pero sin aleatorización en la asignación de los injertos soportados y no soportados11,21,26,29; finalmente, 5 presentaron diseños prospectivos o retrospectivos con un solo brazo de injertos soportados sin grupo control12,17,18,20,24.
Los pacientes se correspondieron con enfermos consecutivos sometidos a cirugía de revascularización coronaria, con características superponibles a nuestra población. El seguimiento fue limitado en la mayoría de los estudios, si bien fue igual o superior a un año en 9 trabajos11,16,17,21,25,27-29. La metodología para análisis de la permeabilidad de los injertos fue diversa, con angiografía con/sin IVUS y/o tomografía computarizada. Existió una notable heterogeneidad en la técnica quirúrgica, tanto de revascularización en sí misma como de manejo del IVS, que queda resumida en la tabla 2.
Análisis de los resultados clínicos y metaanálisis de la permeabilidad de los injertosDe los 11 trabajos controlados8,11,16,19,21,25-29,31, se incluyeron 108,11,16,19,21,25-27,29,31 en el metaanálisis al corresponder la muestra de los trabajos VESTI25 y VESTIV28 a los mismos pacientes. Las pérdidas en el seguimiento de VESTIV28 y la ausencia de diferencias significativas en términos de permeabilidad de injertos al prolongar el seguimiento motivaron la inclusión del VESTI25. Se incluyeron 672 pacientes, con 474 injertos soportados y 391 no soportados. La tabla 2 resume la mortalidad y los eventos cardiovasculares atribuibles al fallo de los injertos (nuevo infarto de miocardio, necesidad de nueva revascularización). Si bien no se estableció la relación de estos eventos clínicos con el fallo de los injertos, la permeabilidad de los injertos arteriales fue próxima al 100% en todas las series y la mortalidad fue baja. Los datos de estudio CTSN VEST fueron obtenidos de 2 trabajos30,31.
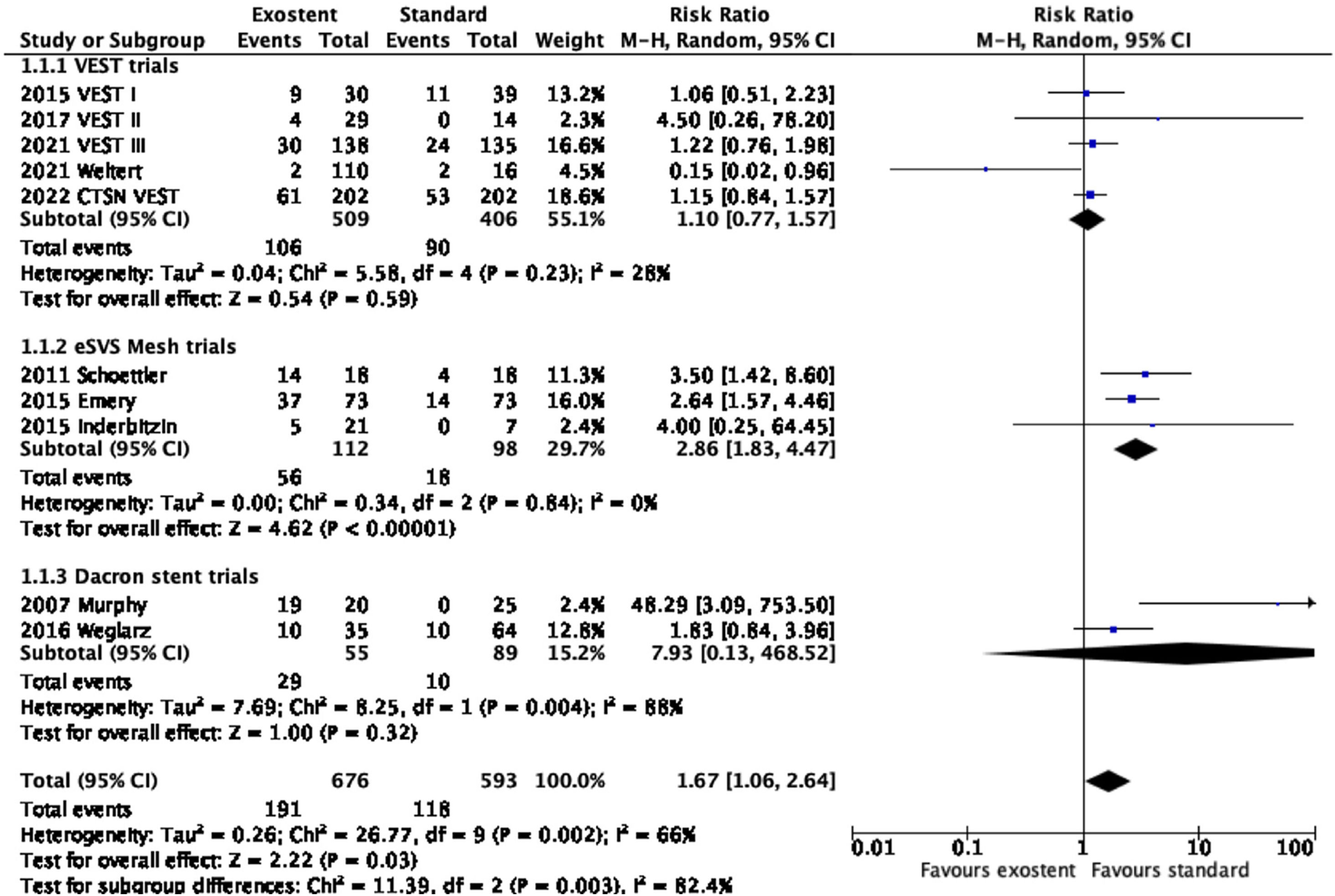
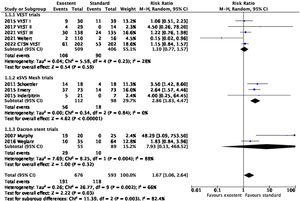
En el metaanálisis (fig. 2), la utilización de soportes externos para los IVS, globalmente considerada, resultó perjudicial en términos de permeabilidad (RR: 1,67; IC95%: 1,06-2,64; p=0;03; I2=66%). No obstante, el análisis de subgrupos según el modelo de stent utilizado demostró ausencia de diferencias significativas con los dispositivos VEST® (RR: 1,11; IC95%: 0,77-1,57; p=0,59; I2=28%). Los trabajos basados en stents de poliéster (RR: 7,93; IC95%: 0,13-468,5; p=0,32; I2=88%) así como los del soporte eSVS Mesh (RR: 2,86; IC95%: 1,83-4,47; p<0,0001; I2=0%) mostraron efectos significativamente perjudiciales en términos de permeabilidad.
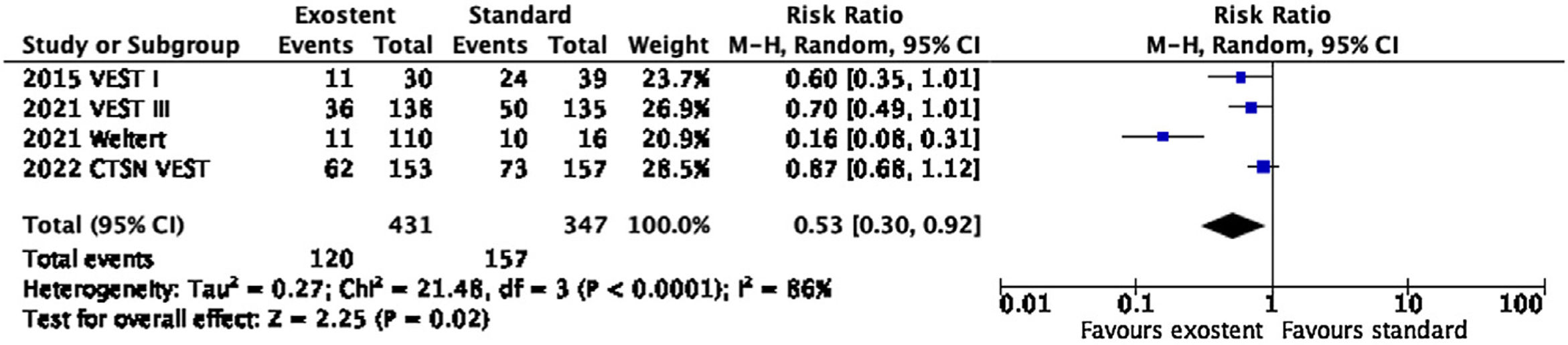
El análisis del desarrollo de hiperplasia intimal fue realizado en 4 trabajos del soporte VEST® (fig. 3). De acuerdo con la clasificación de Fitzgibbon7, la aplicación del stent exterior mantuvo mayor porcentaje de injertos en gradoI frente a los no soportados, que presentaron más frecuentemente gradosII yIII durante el seguimiento (RR: 0,53; IC95%: 0,30-0,92; p=0,02; I2=86%).
DiscusiónParsonnet et al.32. introdujeron el concepto de aplicar soportes externos para contrarrestar el estrés parietal de los IVS y mejorar su permeabilidad. Tras una experiencia inicial en los años sesenta, la técnica fue abandonada. Tras estudios en modelos animales9,10, diferentes grupos han desarrollado soportes basados en diferentes materiales, pero bajo el mismo principio original, con aplicación a la cirugía de revascularización tanto miocárdica como de enfermedad arterial periférica.
Hasta donde conocemos, esta es la revisión más extensa publicada hasta la fecha sobre este tipo de dispositivos33 y el único metaanálisis publicado en la literatura que aglutina todos los trabajos publicados. Existe otro trabajo, de Gemelli et al.34, que aglutina los resultados de los tres ensayos clínicos VEST y que no encuentra beneficio en términos de permeabilidad o desarrollo de hiperplasia intimal de los injertos. Por el momento, en los trabajos individuales los soportes externos de los IVS no han mostrado beneficio clínico significativo en términos de permeabilidad, siendo incluso perjudiciales en el caso del stent eSVS Mesh® de nitinol. Sin embargo, VEST® ha demostrado cumplir la función de mantener la uniformidad de la luz venosa, limitando el desarrollo de hiperplasia intimal.
La oclusión de los IVS es un fenómeno multifactorial que atiende a múltiples factores de la técnica quirúrgica, intrínsecos a la propia enfermedad coronaria o relacionados con el tratamiento médico, entre otros. Estudiar el efecto de estos dispositivos sobre el desarrollo de la hiperplasia intimal de los IVS en territorio arterial requeriría del control de los otros factores para conseguir analizarlo individualmente. Poder determinar su relevancia clínica en términos de mejorar la permeabilidad y que este hecho tenga repercusión en la reducción de eventos cardiovasculares o mortalidad en el seguimiento, necesitaría mayor homogeneidad en el diseño de los estudios, mayor volumen de injertos y seguimientos más prolongados. Entre las medidas que se han mostrado eficaces en mejorar la permeabilidad de los injertos figuran la introducción precoz en el postoperatorio de tratamiento antiagregante y el mantenimiento de tratamientos betabloqueante e hipolipemiante con estatinas a largo plazo35-37. Desde el punto de vista técnico, la disección de la vena safena con técnica no touch, conservando la integridad de su túnica adventicia, ha mostrado beneficios38 que contrastan con la extracción endoscópica36,37, técnica controvertida ampliamente presente en los trabajos analizados, con resultados desiguales en la literatura39,40. De hecho, Sandner et al.41 realizan un subanálisis del VESTIII28 con marcada mejoría de los resultados de permeabilidad con el soporte cuando la vena se extraía por técnica abierta en lugar de endoscópica. Esta misma conclusión se obtiene del subanálisis del estudio CTSN VEST31, donde la extracción endoscópica se mostró como un factor de riesgo independiente en los peores resultados de permeabilidad de los injertos. La aplicación sistemática de sellantes sobre los injertos soportados con eSVS Mesh® podría estar relacionada con los malos resultados de permeabilidad22,23, así como las modificaciones técnicas introducida por Emery et al. en la técnica de implante14,15 que no fueron incorporadas en las experiencias iniciales de algunos grupos19. Otros dispositivos, como VEST®, han presentado diferentes versiones a lo largo de su desarrollo y adaptación de la técnica quirúrgica durante su utilización tras los resultados de las experiencias iniciales25,26.
El trabajo de revisión en general y de metaanálisis en particular atiende a diferentes limitaciones. Primera, los estudios disponibles son limitados y presentan un volumen de pacientes incluidos reducido. Sin embargo, el objeto del análisis se centró en determinar la permeabilidad de los injertos, agregando más de 800 injertos entre soportados y no soportados. Segunda, la heterogeneidad técnica presente en los diferentes trabajos fue paliada realizando un análisis de subgrupos con cada uno de los diseños de los dispositivos. Si bien no pudieron considerarse las diferentes versiones de algunos de ellos por separado, la técnica quirúrgica aplicada fue bastante homogénea en lo que respecta a cada uno de los soportes, en particular con eSVS Mesh® y con VEST®. Tercera, el seguimiento realizado para estudiar un fenómeno como es el fallo de los IVS fue limitado. Sin embargo, en 9 trabajos el seguimiento fue igual o superior a un año. En los trabajos VESTI25 yIV28, la prolongación del seguimiento evidenció que la oclusión precoz de los injertos ocurría fundamentalmente a lo largo del primer año, con mínimos cambios posteriores 4,5años después. Cuarta, no ha sido posible realizar un análisis de la repercusión clínica de los injertos ocluidos, dado que no fue el objetivo de los estudios realizados. En los controles de permeabilidad solo se pudo constatar que dichos eventos no fueron atribuibles a los injertos arteriales al mostrar permeabilidades próximas al 100%.
ConclusionesLos exostents considerados en su conjunto no mejoran la permeabilidad de los injertos venosos a corto y a medio plazo. Con el seguimiento realizado, algunos dispositivos, como VEST®, han demostrado limitar el desarrollo de hiperplasia intimal con mantenimiento de la regularidad luminal de los IVS. Este hecho podría comportar beneficios en cuanto a permeabilidad de los injertos en la prolongación del seguimiento de los trabajos en curso. Son necesarios más trabajos, de mayor tamaño, de diseño aleatorizado controlado y con seguimiento más prolongado para poder determinar la utilidad clínica de los soportes externos de los IVS.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.