La efectividad final de los procedimientos de ablación de las arritmias depende de la posterior comprobación de su eliminación y no inducción. Esta práctica metodológica, habitual en la ablación con catéter, requiere de la formación específica del cirujano en las diferentes formas de arritmias quirúrgicas. La nueva tecnología para la ablación intraoperatoria es cada vez más simple y con mínima morbilidad, y permite tratar la mayoría de arritmias. Aunque la fibrilación auricular (FA) es la que con mayor frecuencia trata la cirugía cardíaca, es necesario conocer los procedimientos de control postablación en el resto de arritmias. En este trabajo exponemos el estado actual en la metodología electrofisiológica de la ablación quirúrgica y revisamos los mecanismos relacionados con las recurrencias.
The effectiveness of the treatment of arrhythmias is based in the demonstration of elimination and non-induction following ablation. The methodology to assess ablation efficacy requires the training of cardiac surgeons in electrophysiology and arrhythmia surgery. The current methods and techniques enable simpler and more efficacious elimination of most cardiac arrhythmias during heart surgery. Atrial fibrillation is the most commonly treated arrhythmia in the surgical theatre, but electrophysiological evaluation of other ar-rhythmic substrates is also necessary. We herein review the methodological requirements needed to rigorously perform surgical arrhythmia elimination and review the mechanisms involved in recurrences.
La ablación quirúrgica de las arritmias ha experimentado un notable aumento en los últimos años. Y aunque el tanto por ciento de efectividad es cada vez mayor, no es infrecuente el fracaso inicial de la ablación o la recurrencia tardía de la arritmia. Diferentes factores están implicados en el resultado final de la ablación. Depende de la experiencia del operador, pero también está en relación con el tipo de arritmia y sus peculiaridades anatómicas y electrofisiológicas. En otras ocasiones la tecnología no alcanza los propósitos deseados, como la transmuralidad. En la cirugía de las arritmias, podríamos añadir otro factor de suma importancia, la ausencia de comprobación intraoperatoria rutinaria de la eficacia de los procedimientos antiarrítmicos.
Mejorar los resultados de la ablación quirúrgica requiere de formación, experiencia, técnicas protocolizadas y de un trabajo de equipo con los electrofisiólogos clínicos. En este artículo exponemos la metodología general utilizada durante la ablación quirúrgica de arritmias y la posterior evaluación de su eficacia, así como los aspectos electrofisiológicos relacionados con las recurrencias postablación.
Metodología general en ablación de arritmiasLa comprobación de la eficacia de la ablación cardíaca es primordial para un tratamiento efectivo de las arritmias. Este simple concepto de ablación-comprobación no siempre es presente durante la cirugía, y puede limitar el resultado del procedimiento. Inclusive en la FA el resultado a largo plazo de la ablación pare-ce estar relacionado, según algunos autores, con la respuesta a las pruebas de inducción postablación1. Las circunstancias particulares que concurren en la cirugía impiden en ocasiones realizar protocolos de comprobación similar a la ablación por catéter, pero, en la mayoría de las arritmias, deberíamos evitar la ablación a ciegas, es decir, sin realizar pruebas de comprobación intraoperatorias.
El protocolo del estudio electrofisiológico (EEF) intraoperatorio debe adaptarse a las necesidades de cada caso. Es importante que esté dirigido por alguien con amplia experiencia en electrofisiología cardíaca, ya que requiere analizar de visu los datos que se van obteniendo y ordenar la secuencia de pruebas de acuerdo con estos datos. Es aconsejable que tanto la ablación como la comprobación intraoperatoria sean realizadas por el cirujano asistido, a ser posible, por un electrofisiólogo, conocedor del tipo de protocolo y análisis del EEF. El electrofisiólogo clínico asistirá al cirujano en el análisis e interpretación de arritmias espontáneas o provocadas utilizando distintos métodos de estimulación programada y sistemas de navegación.
En la actualidad, el tratamiento quirúrgico de la mayoría de las arritmias quirúrgicas está precedido de uno o varios EEF y/o ablaciones percutáneas previas, durante los cuales ya han sido definidos los mecanismos de la taquicardia así como su forma de iniciación y terminación. Los sistemas de navegación electroanatómicos utilizados durante los procedimientos percutáneos permiten con frecuencia dirigir el mapeo intraoperatorio hacia la estructura que requiere de ablación. Posterior-mente, consideramos estrictamente necesario comprobar la efectividad de la ablación quirúrgica. No obstante, en algunas formas de arritmias, como por ejemplo la FA permanente, es difícil realizar la comprobación postoperatoria.
Un protocolo de comprobación intraoperatorio plan-tea una cronología de los tiempos quirúrgicos diferente del habitual. Hay que considerar las alteraciones electrofisiológicas que pueden generarse durante el procedimiento quirúrgico, debidas por ejemplo a la cardioplejía, la manipulación del miocardio, la hipotermia, la isquemia miocárdica, fármacos, etc. Habitualmente, la mayo-ría de las cirugías de arritmias se pueden realizar en normotermia a corazón latiendo con o sin ayuda de la circulación extracorpórea. Y, a ser posible, la ablacióncomprobación ha de realizarse antes que los procedimientos quirúrgicos asociados.
Comprobación de la ablación quirúrgica de las arritmiasNo existe un único protocolo o prueba de comprobación común a todos los tipos de arritmias. Cada grupo medicoquirúrgico establece los propios en función de la arritmia y de la experiencia de cada laboratorio de electrofisiología, un ejemplo en el apéndice I. El tipo de protocolo del EEF, tanto para registro y estimulación como para comprobación postablación, depende del tipo de arritmia. La eficacia del procedimiento debe basarse no sólo en la eliminación de la arritmia durante la ablación sino también en la realización de test de comprobación. La comprobación se basa en un protocolo básico de estimulación programada consistente en la estimulación de las cámaras cardíacas durante un cierto tiempo con frecuencias progresivamente crecientes, superiores a la frecuencia espontánea del corazón y/o en la administración de trenes con extraestímulo/s acoplados. A continuación desglosamos la base de los diferentes estudios según los tipos de arritmias.
Taquicardia auricular focalEl origen de la taquicardia auricular focal, independientemente del mecanismo responsable (automatismo anormal, actividad desencadenada o microrreentrada), se localiza en los sitios de activación endocárdica auricular más precoz que preceden a la onda P del electrocardiograma de superficie (ECG) durante la taquicardia. Pueden tener cualquier origen anatómico, aunque se agrupan en áreas de cambio en el tipo de fibras y la orientación. Específicamente, la mayoría de las taquicardias auricu-lares de aurícula derecha derivan de la cresta terminal en la unión del tejido trabeculado y liso. En la aurícula izquierda, de paredes más lisas, se localizan con mayor frecuencia en la entrada u orificios de las venas pulmonares (VP), aunque también a nivel de la orejuela izquierda o el anillo mitral.
La ablación, idealmente, se debe realizar durante la taquicardia. Un excelente signo de éxito inminente es la aceleración de la arritmia al inicio de la ablación por radiofrecuencia, probablemente porque el automatismo del foco aumenta con el calentamiento, seguida de terminación brusca de la taquicardia. En las taquicardias próximas al nodo sinusal, la energía de elección es la crioablación, que permite lesiones reversibles(criomapping) cuando la aplicación es corta, y con ello evitar la lesión del propio nodo2.
La comprobación de la eficacia de la ablación depende de la técnica empleada para el desencadenamiento de la arritmia. En la ablación focal auricular existen dos opciones:
- –
En el caso de taquicardias desencadenadas antes de la intervención con estimulación programada, la comprobación consistirá en repetir el protocolo de estimulación auricular con trenes de estímulos o trenes y extrasístoles acoplados.
- –
En caso de taquicardias no inducibles mediante estimulación, habitualmente debidas a automatismo aumentado, se efectúa una perfusión con isoproterenol (2–5μg/min). En aquellos casos en los que la ablación quirúrgica de la taquicardia se realiza mediante el aislamiento de un área auricular (auriculotomía/auriculectomía), por ejemplo apendicetomía auricular por taquicardia desde la orejuela, la comprobación requiere testar el aislamiento del tejido mediante la verificación de una estimulación no conducida.
La dilatación auricular y la existencia de escaras y/o cicatrices auriculares dan lugar a la aparición de distintos tipos de arritmias supraventriculares, cuyo mecanismo responsable más frecuente es la macrorreentrada, siendo el flutter auricular típico el paradigma de ellas. La evaluación electrofisiológica permite mapear el circuito auricular en la mayoría de ellas e identificar estructuras susceptibles de ablación con unos excelentes resultados clínicos. Sin embargo, la eficacia de la ablación percutánea en macrorreentradas relacionadas con la cirugía de cardiopatías congénitas complejas, o la implantación de prótesis valvulares, tiene una tasa de éxito más baja. Las razones son un acceso intracavitario dificultoso, la presencia de múltiples circuitos y escaras, así como la existencia de un sustrato auricular izquierdo más complejo con mayor remodelado.
La macrorreentrada puede tener un recorrido estable y único, en cuyo caso la ablación del istmo o punto crítico finaliza la arritmia. Este punto suele corresponder con el corredor o pasillo auricular más estrecho (istmo) por donde circula la reentrada. La ablación requiere la creación de una lesión lineal del istmo que una, al menos, dos estructuras anatómicas eléctricamente silentes, por ejemplo orificios de VP, cavas, fosa oval y anillos mitral o tricúspide. La facilidad que ofrece el abordaje quirúrgico hace aconsejable la ablación de al menos dos istmos de la reentrada, para incrementar la eficacia del procedimiento.
El protocolo de comprobación para este tipo de reentrada consiste en evaluar la ausencia de conducción a través de la línea de lesión creada mediante ablación, demostrando la existencia de bloqueo bidireccional de la conducción a nivel istmo sometido a ablación. Esto se lleva a cabo mediante la estimulación a ambos lados de la lesión, comprobando la presencia de dobles electrocardiogramas y la ausencia de conducción a nivel de la zona ablacionada. Finalmente, se realizará estimulación auricular programada mediante un protocolo de estimulación a frecuencias crecientes, y estimulación trenes y extras, para demostrar que la arritmia ha dejado de ser inducible.
Las macrorreentradas formadas por dos o más circuitos, en especial, si son inestables o cambiantes en su recorrido, pueden requerir la creación de patrones de lesión más extensos, como el procedimiento Maze. En otras palabras, unir por líneas de ablación los orificios auriculares (ostium de VP, cavas, fosa oval, anillos mitral o tricúspide) para evitar la aparición de circuitos de reentrada a su alrededor. En este caso, el protocolo de comprobación es más complejo, ya que debería chequear la continuidad de cada una de las líneas de ablación creadas.
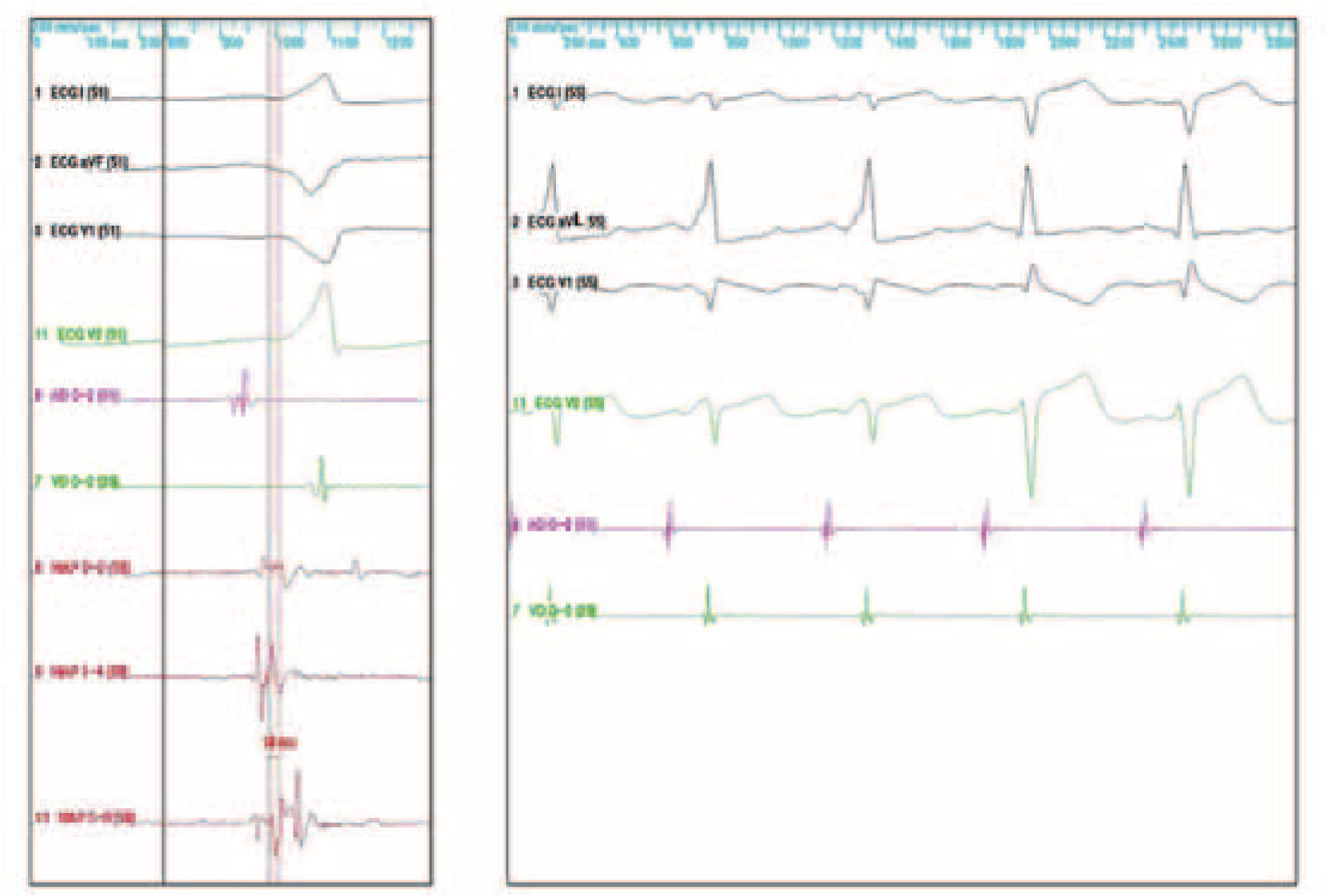
Vías accesorias auriculoventricularesComo sucede en las macrorreentradas, la evaluación electrofisiológica de las vías accesorias permite mapear su localización y con ello su ablación con catéter, de excelentes resultados en la actualidad. La localización de las vías accesorias con conducción retrógrada se realiza mediante cartografía de activación de la inserción ventricular, registrándose puntos en los que la activación ventricular local preceda al inicio del QRS de superficie en más de 15ms (Fig. 1, panel izquierdo). Tras el abordaje y ablación quirúrgica de la vía, la prueba de comprobación es necesaria para confirmar la ablación bidireccional de la vía y descartar la existencia de otras vías ocultas. En el caso de vías accesorias con conducción anterógrada, el protocolo de estimulación auricular a frecuencias crecientes, desde la aurícula derecha y/o izquierda, permite comprobar si existen uno o varios patrones de activación ventricular que sugieran la existencia de una vía accesoria. La estimulación ventricular, con trenes y/o trenes y extras, sirve para evaluar la secuencia de activación auricular retrógrada y así confirmar o descartar la existencia de una vía accesoria oculta. La introducción de trenes con extraestímulos acoplados desde el ápex del ventrículo derecho suele ser suficiente para la demostración y desencadenamiento de taquicardias ortodrómicas mediadas por una vía accesoria con conducción oculta.
Fibrilación auricularLa ablación de la FA es un procedimiento creciente, en expansión, aunque por el momento los mecanismos involucrados en su origen y mantenimiento son mal conocidos3. Al contrario de lo que acontece en otras arritmias, existen diversos procedimientos de ablación, y con frecuencia los patrones de lesiones tienen un fundamento meramente empírico. En los últimos años hemos empezado a conocer algunos de estos mecanismos, como el origen focal desde las VP4. La FA paroxística parece estar desencadenada en su mayoría por focos o automatismos, localizados en un 90% en los orificios de las VP4. Con el tiempo, las descargas repetidas de este foco pueden llegar a alterar las condiciones electrofisiológicas del miocardio auricular (remodelado eléctrico), convirtién-dose la FA en persistente. En esta fase final, los mapeos endocavitarios auriculares describen múltiples reentradas circulantes (no fijas), aunque en otras ocasiones se han registrado patrones organizados5,6. Además, estudios recientes han puesto de manifiesto el papel relevante que el sistema autónomo vegetativo desempeña como factor modulador, en especial en la FA paroxística. La denervación cardíaca, según algunos autores, podría incrementar la efectividad de los procedimientos7. Igual sucede con las técnicas de reducción de tejido auricular mediante la normalización de la masa crítica auricular8,9.
Por todo ello, existen en la actualidad diversidad de técnicas de ablación, con diferentes resultados según se apliquen en FA paroxística, persistente o persistente de larga duración (permanente). Las pruebas de comprobación son diversas en función del procedimiento de ablación. La ablación tiene diversas estrategias y objetivos según el tipo de FA:
- –
Completar el patrón de lesiones. Aislamiento de las VP en la FA paroxística, así como la creación de líneas de ablación adicionales en la FA persistente y de larga duración10.
- –
Eliminación de la FA durante el procedimiento11.
- –
La no inducibilidad postablación12. La verificación de la ablación es de gran importancia para prevenir la aparición de nuevas arritmias o de recurrencias tardías. Todavía existe debate en torno al valor predictivo de la eliminación durante la ablación o la no inducibilidad de la FA postablación, aunque parecen ser sucesos favorables a largo plazo10.
El objetivo de la ablación en la FA es la eliminación y modificación del sustrato utilizando la menor cantidad de lesiones. Según el procedimiento seleccionado la comprobación es diferente.
- –
El aislamiento de las VP y/o cara posterior de la aurícula izquierda. El criterio de valoración más objetivo es la comprobación de la disociación o ausencia de potenciales registrados en el interior del área aislada, es decir, la desconexión eléctrica13,14. Otro criterio es la reducción de la amplitud de registros bipolares igual o superior al 90% o con un valor mínimo entre 0,05-0,1mV en el interior de la zona lesionada15. Y el criterio más empleado en la cirugía es la comprobación del bloqueo de salida mediante la estimulación dentro del área aislada (bloqueo de salida de todas las VP), aunque este método tiene limitaciones por cuanto en ocasiones es difícil capturar y estimular el miocardio de las VP. En la ablación por catéter, aun cumpliendo con los tres criterios antes mencionados, el 63–52% de los pacientes presenta reconexión de las VP a los 2 años del procedimiento16. Por ello, en la actualidad, la desconexión se considera tan sólo como un indicador agudo en el grado de lesión de la ablación. Probablemente, hay otros mecanismos implicados en la eliminación real de la FA, como puede ser el remodelado inducido en el entorno de la zona de ablación, que no son valorados adecuadamente durante la ablación.
- –
En los pacientes con FA persistente y de larga duración, las líneas adicionales deben ser completas y comportarse como barreras eléctricas continuas que impidan la aparición de macro-rreentradas17. El objetivo de la comprobación es demostrar la existencia de bloqueo bidireccional de la línea, maniobra similar a las pruebas de comprobación del flutter descritos en apartado anteriores18.
- –
La denervación y gangliectomía epicárdica se comprueba mediante la estimulación de las vías aferentes y su respuesta en frecuencia, aunque desconocemos la sensibilidad de esta práctica. El plexo gangliónico autonómico cardíaco (PGAC) está presente en la grasa epicárdica, a menudo agrupado en torno a las VP, y se puede identificar mediante estimulación de alta frecuencia (EHF), con estímulos de duración del ciclo 50ms, 12V, 1–10ms ancho de pulso, emitidos con un catéter. La EHF en los ganglios lleva a la inducción de la FA y/o bradicardia o bloqueo auriculoventricular (AV) por el aumento del tono vagal. La ablación con radiofrecuencia a este nivel elimina la respuesta vagal. La EHF se repite y se aplican nuevas ablaciones si encontramos otros puntos de respuesta ganglionar positiva. No está claro si los PGAC deben ser específicamente ablacionados o han de eliminarse en su conjunto.
La comprobación de no inducibilidad postablación de la FA12 es un test habitual sólo en algunos laboratorios. Diversos estudios, basados en la inducción con isoproterenol, han demostrado a medio plazo mayor efectividad en los casos no inducibles postablación1. Estos protocolos no son habituales durante la cirugía, y desconocemos su sensibilidad en nuestro medio quirúrgico.
Taquicardia ventricularLa práctica de la ablación quirúrgica de la taquicardia ventricular (TV) comprende los siguientes pasos: a) inducción de la TV con estimulación, infusión de isoproterenol, o ambos; b) registro ECG para realizar la cartografía de activación o de estimulación, y seleccionar el punto de ablación; c) ablación y/o resección del sustrato arritmogénico, y d) comprobar la no inducción de la taquicardia.
La localización o cartografía quirúrgica de la TV se lleva a cabo de dos posible formas:
- –
Cartografía de activación durante taquicardia, para lo cual utilizaremos una malla de registro epicárdico multielectrodos. Permite delimitar el circuito de la taquicardia y el canal de conducción lenta mediante el registro del electrograma más precoz con respecto al inicio del complejo QRS y el registro de potenciales fragmentados mesodiastólicos.
- –
Cartografía de estimulación o topoestimulación, rastreando el sustrato mediante la estimulación a una frecuencia semejante a la de la taquicardia, y que da lugar a un complejo QRS con morfología igual a la observada durante la misma.
El protocolo de inducción de la TV consiste en la estimulación ventricular, con trenes y trenes con extraestímulos acoplados; en casos resistentes, podemos repetir la estimulación programada tras la infusión de isoproterenol. La inducción de la TV con estimulación se realiza mediante trenes de 10–20 estímulos, con ciclo inicial unos 20ms inferior al ciclo de la taquicardia, y se van acortando en 10–20ms. En el anexo 1 está expuesto un ejemplo de protocolo, aunque es variable según la experiencia de cada grupo de trabajo.
- –
La estimulación eléctrica programada se realiza introduciendo estímulos de 1ms de duración al doble del umbral diastólico. El protocolo de estimulación programada auricular para la inducción de taquicardias macrorreentrantes consiste en la administración de trenes de estímulos (ocho latidos) a frecuencias crecientes, así como la aplicación de trenes de estímulos habitualmente a dos frecuencias (600 y 400ms), con extraestímulos acoplados (hasta tres extras). Este mismo protocolo puede repetirse tras infusión de isoproterenol en caso de ausencia de inducibilidad basalmente.
- –
Los protocolos utilizados para la inducción de FA son variables. Para la demostración del aislamiento de VP se estimula a una frecuencia superior a la sinusal con impulsos de 2ms de duración y voltajes de salida de 10mA. Si pretendemos demostrar la ausencia de inducibilidad de FA tras la ablación, el protocolo de estimulación consiste en la administración de hasta cinco trenes de impulsos auriculares a la longitud de ciclo más corta que dé lugar a captura local 1:1 durante 15–30s (intensidad 10mA; duración 2ms) desde la aurícula izquierda, el seno coronario o la aurícula derecha60.
- –
La estimulación eléctrica programada se realiza introduciendo estímulos de 1ms de duración al doble del umbral diastólico. El protocolo de estimulación programada consiste en la aplicación de extraestímulos únicos, dobles y triples sobre ritmo sinusal y sobre trenes base de ocho latidos, habitualmente a dos frecuencias (600 y 400ms), de forma alternativa desde el ápex y tracto de salida del ventrículo derecho. En los pacientes en los que la TV clínica no se induce mediante estimulación del ventrículo derecho se repite el protocolo de estimulación ventricular desde el ventrículo izquierdo.
- –
Si la taquicardia se interrumpió durante la aplicación de la ablación, se repite el protocolo de estimulación programada descrito anteriormente y, en caso de no inducción de la taquicardia, se vuelve a repetir la estimulación ente 10–30min después de la última ablación con el fin de valorar el resultado. Si la taquicardia objeto de ablación sigue siendo inducible, se intenta localizar mediante cartografía posiciones más idóneas y realizar nuevas aplicaciones de ablación.
Cuando la ablación se efectúa durante la taquicardia y alcanza a ser efectiva, la arritmia finaliza bruscamente o tras un periodo de inestabilidad. La comprobación de la efectividad de la ablación comprende la repetición de todo el protocolo de estimulación utilizando los mismos parámetros que basalmente desencadenó la taquicardia. La posibilidad de cura definitiva es del 98% si en el campo quirúrgico la arritmia no es inducible después de la ablación19. En el postoperatorio, a partir del tercer mes, puede repetirse el EEF habiéndose documentado inducción de TV postablación en el 20–25% de casos, tanto por ciento muy inferior si lo comparamos con el 50–70% de la ablación con catéter20. En estos casos, si se repite el EEF asociando tratamiento farmacológico se logra reducir la tasa de inducibilidad a menos del 5%19.
La TV asociada a aneurisma es la arritmia ventricular quirúrgica más frecuente. En estos casos de aneurisma ventricular algunos autores consideran no necesarios la inducción y el registro intraoperatorio previo a la ablación, por cuanto existe una alta probabilidad de que la reentrada asiente en los bordes del aneurisma20.
En la cirugía de la displasia arritmogénica del ventrículo derecho el objetivo es eliminar los potenciales circuitos responsables de la taquicardia, así como lograr la desconexión eléctrica de la zona. La comprobación consiste en un test de estimulación dentro del área aislada, que no deberá conducir al resto de ventrículos y no inducir TV.
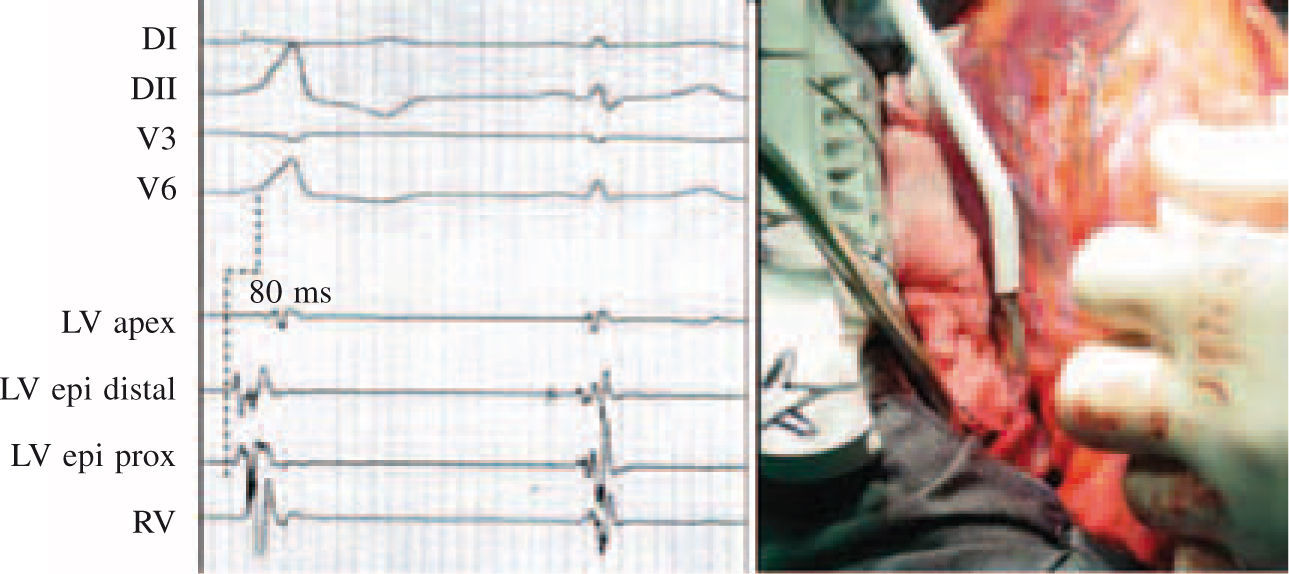
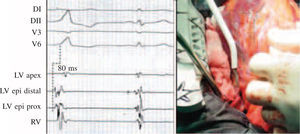
Aunque poco frecuente, la TV idiopática puede en ocasiones requerir el abordaje quirúrgico para su eliminación, como en los casos de foco localizado en epicardio y/o en la proximidad de estructura vital como las arterias coronarias (Fig. 2, panel derecho). La inducción de este tipo de taquicardia requiere habitualmente la infusión de isoproterenol, siendo menos frecuente su inducibilidad con estimulación programada. En este caso, la cartografía de activación durante TV permite identificar el punto con activación ventricular más precoz respecto del inicio del QRS de superficie (Fig. 2, panel izquierdo). La ablación a este nivel suele dar lugar a una aceleración seguida del cese de la taquicardia. La comprobación de la eficacia de la ablación consiste en demostrar la ausencia de taquicardia inducible en las condiciones en que basalmente lo era, con infusión de isoproterenol y/o estimulación ventricular programada.
Recurrencia precoz y tardíaLos sistemas de ablación quirúrgicos no están diseñados para comprobar y asegurar in situ la creación de lesiones transmurales, continuas, y eléctricamente eficientes. Varios estudios histológicos han mostrado poca homogeneidad y transmuralidad en las lesiones quirúrgicas por ablación, y por experiencia clínica conocemos del riesgo de recurrencia postablación21,22.
Las recurrencias en la ablación de arritmias pueden ser precoces o tardías, respecto al tiempo de la ablación. Esta clasificación es arbitraria, y no tiene la misma cronología para todas las arritmias por cuanto el mecanismo de las recurrencias, su pronóstico y tratamiento es diferente para cada una de ellas. Las recurrencias precoces pueden tener diversos mecanismos, entre ellos:
- –
El error en la técnica incluye la incorrecta ablación por parte del cirujano, bien por imprecisión en el procedimiento o por inadecuada técnica, es decir, inadecuado patrón de lesión.
- –
La lesión no efectiva corresponde al fallo en la ablación del sustrato, bien por protocolo de ablación insuficiente, o un tipo de fuente de energía no apropiada para la arritmia y la vía de abordaje.
- –
La existencia de otros sustratos no diagnosticados preoperatoriamente puede ser motivo del fracaso de la técnica.
En las recurrencias tardías los mecanismos son distintos, principalmente por la aparición de nuevos sustratos arrítmicos durante la evolución de la cardiopatía, o bien por la expresión tardía de otros focos silentes iniciales.
El tipo de recurrencia puede estar relacionado con el tipo de arritmia. Por ejemplo, en los procedimientos de ablación de vías accesorias AV la recurrencia suele ser por una incorrecta técnica, un inadecuado protocolo de comprobación postablación, o a la falta de diagnóstico de otras vías accesorias ocultas. Sin embargo, en la ablación de la FA, no es infrecuente generar nuevas arritmias macrorreentrantes a través de los gaps en las lesiones de ablación. Existe poca documentación acerca de los mecanismos de las recurrencias postablación quirúrgica, y por ello es interesante conocer la experiencia de la ablación con catéter. Detallamos a continuación la incidencia de recurrencia en los principales tipos de arritmias quirúrgicas.
FlutterLa ablación percutánea con catéter del flutter típico tiene un elevado grado de efectividad23. Su recurrencia suele ser precoz y debido a un grosor o anatomía ad-versa del istmo para la ablación. A medio plazo, la ablación del flutter típico se asocia con frecuencia a la aparición de FA, en algunos casos del 68% a los 3 años de seguimiento24,25. El remodelado eléctrico, con el acortamiento de los periodos refractarios, inducido con anterioridad por el flutter, podría predisponer al desarrollo tardío de FA. Esta evolución puede plan-tear realizar desde un inicio, junto a la ablación quirúrgica del istmo, técnicas para prevenir la FA, en especial en los pacientes con antecedentes de FA paroxística. Esta propuesta ya tiene su consideración en la ablación con catéter26.
Fibrilación auricularLa eficacia de la ablación de la FA es difícil de establecer por cuanto en la literatura no existe consenso en los patrones de lesión, en los criterios de éxito y modo de seguimiento clínico.
La mayoría de recurrencias precoces (< 1 año) responden a gaps en las líneas de ablación, patrones incompletos de lesión, reconexión eléctrica de las líneas, áreas auricu-lares de fibrosis con lenta conducción, y focos ectópicos de la aurícula izquierda (dentro y fuera de VP). Aunque es escasa la información que tenemos de recurrencias tardías (> 1 año), su incidencia parece ser menor que las precoces, y habitualmente son en forma de reentradas de la aurícula izquierda o por focos ectópicos en la derecha18,27.
Las recurrencias son de dos tipos:
- –
Recidiva de la FA, o fallo en la ablación. Su incidencia es variable entre los grupos quirúrgicos, del 10–30%28–32. Los modernos sistemas de monitorización ECG continuo, de 24–48h, 7 o 15 días mejoran la sensibilidad para detectar recurrencias con cortos episodios de FA, con nula relación con la sintomatología del paciente33,34. La monitorización del ritmo auricular con marcapasos ha mostrado que sólo los episodios de FA mayores de 5min están asociados a complicaciones cardiovasculares35–37. Necesitamos más estudios para delimitar mejor la trascendencia clínica de estos episodios y cuál deberá ser su tratamiento farmacológico, en especial entre los pacientes con episodios asintomáticos.
En las recidivas de FA postablación se han descrito factores predictores preoperatorios como la antigüedad de la FA, tamaño auricular (> 55mm), edad del paciente (> 65 años), tipo de FA, cardiopatía reumática, etc. Otros autores han descrito como factor predictivo postoperatorio la recurrencia precoz hospitalaria de la FA con 37 frente a 10% de recurrencia de la FA al año de seguimiento entre los que no presentaron recurrencia38,39. En la ablación con catéter la no inducibilidad postablación de FA también es un factor predictivo a largo plazo, 10 frente a 40% a 1 año de seguimiento entre los que se inducía recurrencia postablación1.
- –
Génesis de nuevas arritmias postablación. La incidencia de aparición de flutter/macrorreentrada auricular postoperatoria es del 8–16%40–43. En estos pacientes el mecanismo es variable, aunque predominan las macrorreentradas31,43–45 (Fig. 3). La incidencia de macrorreentradas es tres veces mayor en los protocolos de ablación que asocian líneas frente al aislamiento único de las VP17,46. El análisis histológico de las lesiones quirúrgicas en estos casos ha mostrado que las lesiones son incompletas hasta en un 30–25% de ocasiones21,22,47. Magnano, et al., en 14 pacientes con recurrencia a los 9 meses postablación, describen un 64% de macrorreentradas en aurícula izquierda, 21% por taquicardia focal de aurícula izquierda, 42% flutter típico de aurícula derecha, y un 7% flutter atípico de aurícula derecha, tratadas con ablación percutánea efectiva en el 72% de su conjunto45. Deneke, et al., en nueve pacientes con recurrencia a los 12 meses postablación, describen como mecanismo recurrente un 33% de macrorreentrada de aurícula izquierda, 33% flutter típico de aurícula derecha, un 22% flutter atípico de aurícula derecha, y un 11% por taquicardia focal de aurícula derecha, tratadas con ablación percutánea efectiva en un 77%31. Para Magnano, et al., el mecanismo principal de las macrorreentradas izquierdas fue gaps en la conducción de las VP45, mientras que para Deneke, et al. no fue los gaps sino zonas de fibrosis auricular. Probablemente, el mecanismo es variable según el tipo de arritmia, y depende del patrón de lesiones, la transmuralidad de la energía empleada, de áreas de fibrosis auricular preexistente, la experiencia del cirujano, etc.31. Todo ello sugiere la necesidad de utilizar algún método de control intraoperatorio.
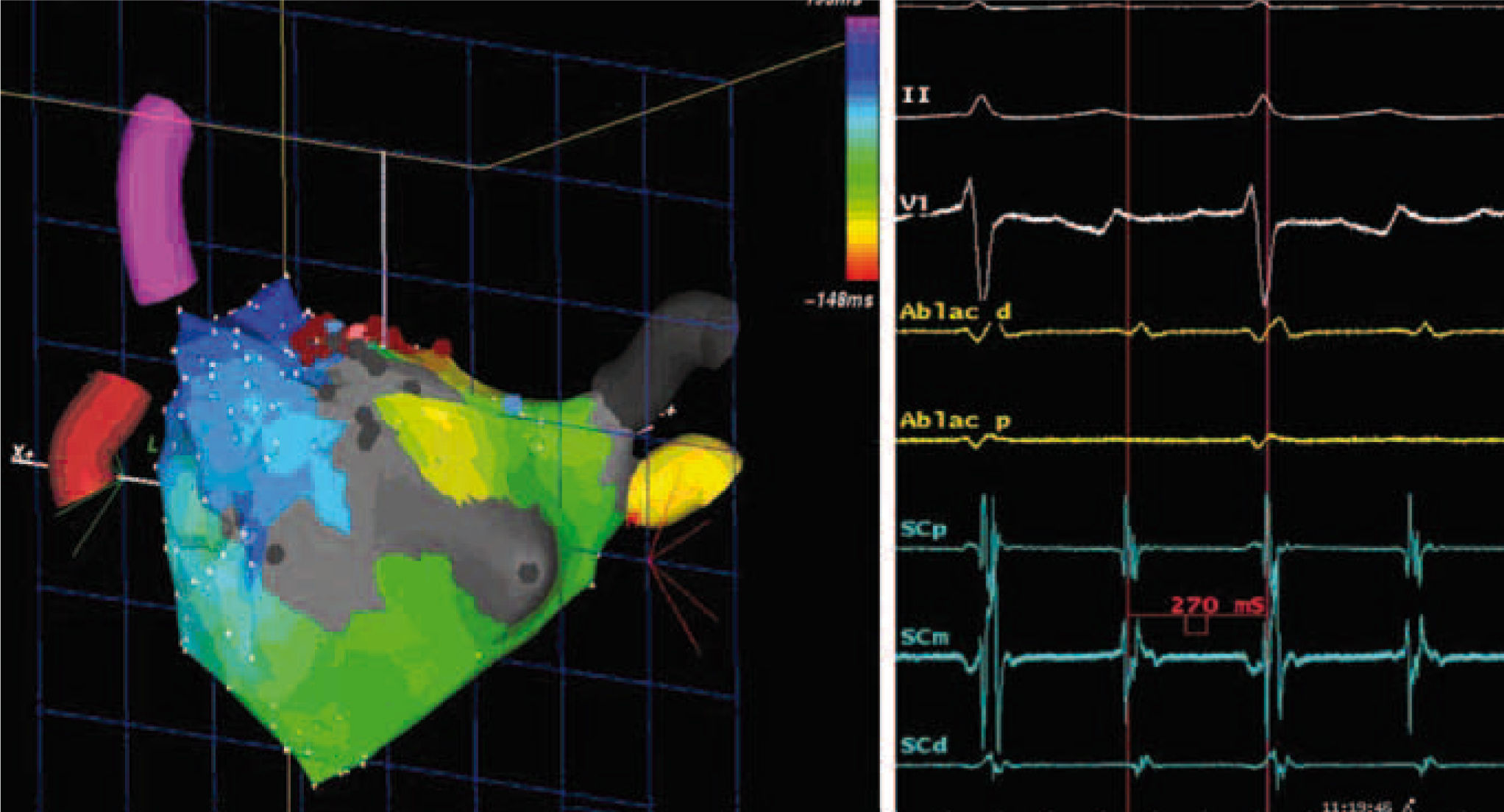
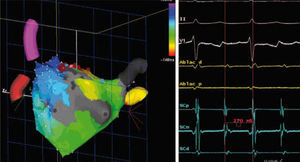
Figura 3.Flutter auricular izquierdo periincisional postablación quirúrgica de FA. Izquierda, muestra el mapa de activación endocárdica durante un flutter auricular izquierdo, observándose macrorreentrada alrededor de cicatriz en la pared posterior de la aurícula izquierda en paciente sometida con anterioridad a procedimiento de valvuloplastia mitral y ablación quirúrgica de FA. En este caso, la arritmia fue eliminada mediante la creación de una línea de ablación desde la cicatriz al anillo mitral superior. Derecha, ECG y registros intracavitarios durante el flutter auricular izquierdo.
La mayoría de estas taquicardias macrorreentrantes son resistentes al tratamiento farmacológico, siendo necesaria la cardioversión eléctrica externa. El proceso de maduración de las lesiones, entre 2–3 meses, puede solventar la arritmia, aunque pasado este periodo habrá que considerar la ablación con catéter, en especial de los casos con taquicardias organizadas sintomáticas. Dependiendo del mecanismo implicado en la recurrencia, la estrategia de la ablación con catéter necesitará repetir el aislamiento de las VP, ablacionar áreas de fibrosis con lenta conducción eléctrica (potenciales fragmentados), o eliminar focos o istmos anatómicos en el caso de flutter y macrorreentradas27,48.
La eficacia de la ablación TV depende del sustrato y cardiopatía estructural subyacente. En corazones sanos con TV idiopáticas la efectividad es elevada, comparable a la obtenida en otras arritmias supraventriculares, como las vías accesorias. En la TV asociada a cardiopatía isquémica y otros tipos de cardiopatías existen dificultades tecnológicas que hacen que los resultados de la ablación no sean tan consistentes. El sustrato anatómico de esta arritmia es complejo y algunas veces de gran tamaño, y las zonas críticas de conducción anormal con frecuencia son intramurales, y en ocasiones subepicárdicas. La ablación quirúrgica de la TV isquémica es un tratamiento altamente efectivo a largo plazo. La visualización y escarectomía con ablación de las aéreas limítrofes suele ser suficiente para la eliminación del sustrato arritmogénico49. A largo plazo, 36 meses, menos del 6,2% sufrieron TV recurrente50–52, con una tasa anual de muerte súbita del 0,7%19,53–57. La efectividad de la ablación con catéter es algo menor del 60–70%, y la tasa de recurrencia variable, dependiendo del tipo de cardiopatía, entre 0–31% según series57–59.
En la actualidad el tratamiento de la recurrencia posquirúrgica pasa por la ablación con catéter o la implantación de un sistema de desfibrilador automático implantable (DAI), según cada caso.