La insuficiencia cardíaca avanzada es una enfermedad de elevada prevalencia y mal pronóstico, asociada al deterioro funcional significativo y a la alta mortalidad. En los últimos años, el desarrollo de dispositivos de asistencia ventricular izquierda (DAVI) ha mejorado la supervivencia y ha estabilizado a los pacientes en situación terminal, ya sea como puente al trasplante cardíaco o como terapia de destino.
El HeartMate 3™ es un DAVI de flujo continuo con tecnología centrífuga y levitación magnética completa, diseñado para minimizar riesgos como la trombosis y la hemólisis, frecuentes en modelos previos.
Sin embargo, este dispositivo no está exento de complicaciones. Entre las mecánicas destacan el fenómeno de succión del inflow y la estenosis del conducto de salida (outflow), que pueden comprometer gravemente su funcionamiento, y requerir abordajes terapéuticos complejos.
Este artículo presenta 2 casos clínicos tratados en nuestro centro con dichas complicaciones. Se describe el enfoque terapéutico aplicado y la evolución clínica, en el contexto de una revisión de la literatura.
Presentación de casos clínicosSe realizó un estudio descriptivo retrospectivo de 2 pacientes varones con insuficiencia cardíaca terminal, portadores de asistencia ventricular izquierda tipo HeartMate 3™. Se analizaron sus antecedentes clínicos, técnica de implante, evolución, complicaciones mecánicas presentadas, intervenciones realizadas y evolución clínica posterior.
Caso clínico 1Paciente varón de 63 años con miocardiopatía dilatada de origen isquémico en fase terminal de insuficiencia cardíaca. Presentaba enfermedad coronaria avanzada, disfunción severa del ventrículo izquierdo, fracción de eyección del 20%, fibrilación auricular, hipertensión arterial y un deterioro progresivo de su capacidad funcional. Permanecía en lista de espera para trasplante cardíaco en clase funcional III (NYHA), con episodios sincopales recurrentes y dificultades para encontrar un donante compatible debido a sus características antropométricas.
En junio de 2019, los estudios mostraron un ventrículo derecho ligeramente dilatado con función sistólica conservada y un ventrículo izquierdo severamente dilatado con hipoquinesia global y fracción de eyección del 20%. El gasto cardíaco era de 4,14l/min y el índice cardíaco de 1,9ml/min/m2. La presión arterial pulmonar media fue de 23mmHg y la presión capilar pulmonar de 15mmHg, con resistencias pulmonares de 1,69UW. La coronariografía no mostró lesiones nuevas y el stent previo en la circunfleja estaba permeable. Se valoró como candidato adecuado para soporte mecánico de larga duración con un dispositivo HeartMate 3™, como posible puente al trasplante.
El implante del dispositivo HM3™ se llevó a cabo el 10 de septiembre de 2019, siendo el primer procedimiento de este tipo realizado en el centro y marcando el inicio del programa de asistencia ventricular de larga duración. La cirugía se realizó siguiendo la técnica estándar y la evolución postoperatoria fue favorable, sin complicaciones inmediatas y con buena adaptación al soporte mecánico.
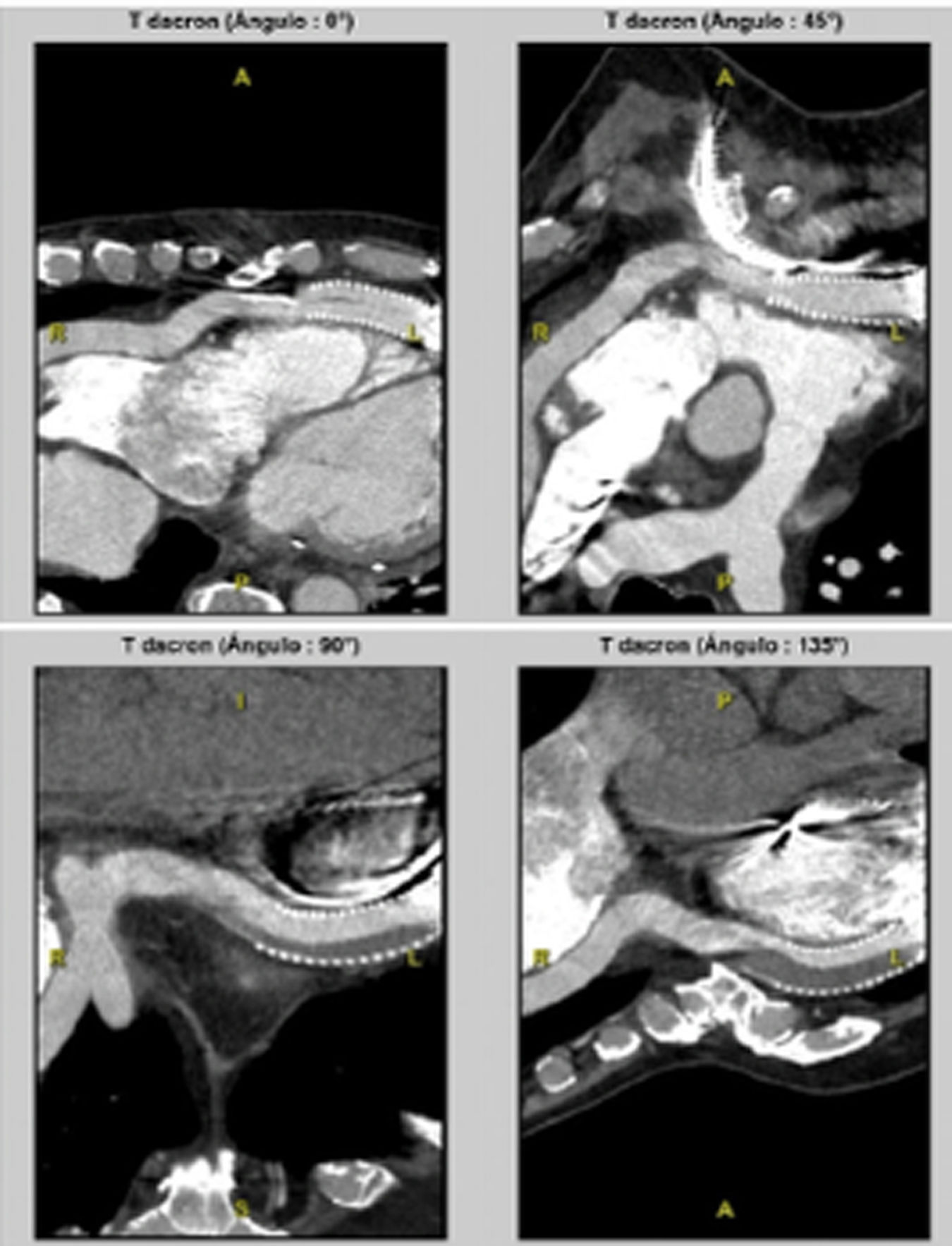
Durante el seguimiento, la ecocardiografía transtorácica del 11 de julio de 2023 mostraba un remodelado ventricular izquierdo con fracción de eyección del 10%, pero sin signos de descompensación. Se le practicó una cardioversión eléctrica por arritmia auricular persistente, y el dispositivo mantenía un funcionamiento adecuado. Sin embargo, a lo largo del tiempo presentó varios ingresos por insuficiencia cardíaca congestiva. El 27 de mayo de 2024 ingresó de forma urgente por un cuadro de congestión grave que no respondió a diuréticos. El angioTAC torácico (fig. 1), evidenció una importante reducción de la luz en el conducto de salida del dispositivo (outflow), lo que dificultaba la descarga del ventrículo izquierdo, imagen que se evidenció en la angiografía realizada al paciente (fig. 2). Esta situación fue compatible con un cuadro de External Outflow Graft Obstruction (EOGO), una complicación infrecuente pero descrita en la literatura reciente, caracterizada por compresión dinámica o estructural del injerto de salida, con repercusión hemodinámica significativa. Ante la disfunción del DAVI, se incluyó en alarma 0A para trasplante cardíaco urgente.
El 14 de junio de 2024 se realizó en el quirófano hibrido un procedimiento conjunto entre cirugía cardiovascular y los radiólogos vasculares, siendo este el primer caso en España en el que se plantea tratamiento endovascular para la resolución de una obstrucción crítica del conducto de salida de un dispositivo HeartMate 3™. Se accedió a través de la arteria femoral derecha, con un introductor de 8Fr, y se avanzó una guía de alto soporte tipo Amplatz Super Stiff™ de 0,035”, que proporcionó estabilidad para el despliegue de los dispositivos sin interferir con el rotor del DAVI. Se implantó un stent BeGraft de 20×48mm en la porción distal del conducto, y más proximalmente, en dirección a la bomba, se colocaron 2 stents recubiertos VBX® de 11×79mm y 11×39mm. Todo el procedimiento fue guiado por fluoroscopia y finalizó con un control angiográfico que confirmó la adecuada expansión de los stents y la restauración del flujo a través del outflow graft, sin complicaciones inmediatas.
No obstante, 2 semanas más tarde, se detectó una nueva caída en el flujo del dispositivo, acompañada de un soplo sístolo-diastólico, confirmado posteriormente por la TAC. Se evidenció un colapso del stent previamente implantado, comprometiendo más del 90% de la luz del injerto a nivel retroesternal, probablemente por compresión dinámica externa entre el ventrículo derecho y la apófisis xifoides.
Ante esta situación, el 28 de junio de 2024 se llevó a cabo un nuevo procedimiento híbrido. Esta vez se realizó un abordaje quirúrgico mediante exposición de la arteria subclavia izquierda, donde se introdujo un introductor arterial de 8Fr y se avanzó nuevamente una guía de alto soporte tipo Amplatz Super Stiff™ de 0,035”. Tras la navegación cuidadosa del trayecto estenótico, se practicó una angioplastia progresiva con balones de 8 a 12mm. A continuación, se implantaron múltiples prótesis endovasculares recubiertas tipo BeGraft (14×49mm, 14×39mm y 12×49mm), algunas de las cuales presentaron migración parcial. Para asegurar la estabilidad y la expansión homogénea del conducto, se colocó finalmente un stent venoso autoexpandible tipo Sinus Venous de 18×80mm, que solapó todo el montaje previo (fig. 3). El resultado angiográfico final fue satisfactorio y se constató una mejoría hemodinámica significativa, con incremento del gasto cardíaco de 3,5 a 5,4l/min/m2.
Finalmente, el 11 de julio de 2024 se realiza trasplante cardíaco ortotópico sin incidencias intraoperatorias. La técnica se efectúa mediante esternotomía media con técnica bicava. Tras el trasplante, el paciente presenta un episodio de fallo primario del injerto leve, resuelto con soporte inotrópico. Posteriormente desarrolla hematoma femoral izquierdo tras la retirada de un catéter arterial, que requiere intervención quirúrgica por el servicio de cirugía vascular. El paciente es dado de alta el 20 de agosto de 2024, con evolución clínica favorable, buena función del injerto y seguimiento ambulatorio en consulta de trasplantes.
Caso clínico 2Se presenta el caso de un paciente varón de 67 años con antecedentes de miocardiopatía isquémica severa, múltiples revascularizaciones coronarias y diversos factores de riesgo cardiovascular. Se encontraba en estado terminal de insuficiencia cardíaca (clase funcional IV según la NYHA), a pesar de recibir tratamiento médico óptimo, con ingresos frecuentes por descompensación.
Ante el fracaso del tratamiento convencional, se decidió implantar un dispositivo de asistencia ventricular izquierda tipo HeartMate 3™ como terapia de destino. El ecocardiograma mostró un ventrículo izquierdo dilatado, con fracción de eyección menor al 20%, disfunción biventricular y signos clínicos de bajo gasto. Los análisis reflejaban una insuficiencia renal moderada y niveles de NT-proBNP superiores a 15.000pg/ml.
El 31 de julio de 2023 se realizó el implante del HeartMate 3™ mediante esternotomía media, con asistencia circulatoria extracorpórea y sin complicaciones intraoperatorias. La evolución inicial fue favorable con aparente buen posicionamiento del HM3™ (fig. 4).
Sin embargo, 3 meses después de la intervención (el 16 de octubre de 2023), el paciente acudió a urgencias con síntomas compatibles con bajo gasto cardíaco. Los análisis no mostraban alteraciones relevantes, salvo un ligero aumento en el nivel de lactato. El controlador del dispositivo registraba oscilaciones en el flujo, con episodios transitorios de caída, pero sin alarmas por trombosis o fallo del rotor.
El ecocardiograma transtorácico reveló un colapso dinámico del ventrículo izquierdo, con la cánula de entrada (inflow) orientada hacia el tabique interventricular, sin presencia de trombos, insuficiencia valvular ni dilatación de cavidades derechas. La fracción de eyección continuaba muy deprimida y se detectó una malposición del inflow, con orientación anterior y lateral, generando fenómenos de succión y reduciendo el flujo del dispositivo a valores entre 1,8 y 2,2l/min.
La radiografía de tórax confirmó que el cuerpo del DAVI estaba correctamente posicionado, sin desplazamientos ni signos de neumotórax o derrames. La TAC torácica corroboró que la entrada aórtica del dispositivo estaba bien situada, y la cánula de inflow se encontraba dentro del ventrículo izquierdo, dirigida hacia el septo medio.
Los parámetros registrados por el HeartMate 3™ mostraban un flujo variable entre 3,2 y 4,5l/min, con velocidad de rotor constante. Las caídas intermitentes del flujo eran compatibles con eventos de succión.
Ante esta situación, el 19 de octubre de 2023 se decidió realizar una reintervención quirúrgica a través de una toracotomía submamaria izquierda en el quinto espacio intercostal. No fue necesario utilizar circulación extracorpórea, ya que se optó por una técnica extra-cardiaca para corregir la posición de la cánula, evitando la manipulación intracavitaria. Durante la intervención, se identificó una orientación septal del inflow, que estaba afectando el llenado del ventrículo izquierdo. Se liberó cuidadosamente el dispositivo, sin desmontar el anillo de sujeción ni intervenir el outflow. Como solución, se aplicaron 2 cintas de cérvix alrededor del driveline a la altura de su salida torácica. Estas se fijaron con sutura directa a la pared costal, anclándolas sobre la costilla inferior, lo que permitió traccionar el inflow de forma controlada hacia el centro de la cavidad ventricular (fig. 5).
A diferencia de otras técnicas más invasivas descritas en la literatura, como las cintas de Dacron® en forma de «U» ancladas directamente al miocardio, esta variante evitó la manipulación intra-cardiaca y redujo los riesgos quirúrgicos. Las costillas no se cerraron completamente para mantener cierto margen de flexibilidad en la tracción de las cintas. Al finalizar, se colocó un drenaje pleural derecho.
Durante el postoperatorio, el paciente evolucionó de forma favorable, sin nuevos episodios de succión ni complicaciones mecánicas. El ecocardiograma posterior mostró una posición correcta del inflow, con flujo laminar y un adecuado drenaje ventricular (flujo medio de 4,2l/min, índice de pulsatilidad 5,5, velocidad del rotor 52.00rpm). Se redujo progresivamente la necesidad de inotrópicos y se optimizó el tratamiento médico. El drenaje pleural se retiró al tercer día.
En las pruebas de control, el inflow se mantuvo bien orientado y no se observaron colapsos del ventrículo izquierdo. Los parámetros del dispositivo se estabilizaron, con flujo constante de 4,5l/min. El paciente fue dado de alta a los 10 días, en clase funcional II de la NYHA. Las imágenes de seguimiento como la radiografía (fig. 6) y la TAC torácica, confirmaron una orientación adecuada del dispositivo. El último control, realizado en febrero de 2025, mostró el HeartMate 3™ correctamente implantado en el ápex cardíaco, con orientación óptima y sin evidencia de estenosis ni presencia de materiales residuales (biodebris) en el outflow.
Ambos casos reflejan la diversidad y la potencial gravedad de las complicaciones mecánicas asociadas al dispositivo HeartMate 3™, subrayando la importancia de una detección precoz mediante la realización de pruebas de imagen de control y de una estrategia terapéutica individualizada basada en un abordaje multidisciplinar.
DiscusiónEl HeartMate 3™, tercera generación del DAVI, ha demostrado una clara ventaja respecto a modelos anteriores en términos de seguridad y eficacia.
Diversos registros y estudios clínicos, como el ensayo MOMENTUM 3, han confirmado su superioridad, especialmente con una menor incidencia de complicaciones como la trombosis de la bomba, el ictus y el fallo del dispositivo. Estos beneficios se atribuyen principalmente a su tecnología de levitación magnética completa y su diseño centrífugo1. A pesar de estos avances, el HeartMate 3™ no está exento de riesgos. Se siguen describiendo complicaciones mecánicas significativas, como el fenómeno de succión en la cánula de entrada (inflow) o la estenosis del conducto de salida (outflow graft). Estas complicaciones pueden tener consecuencias clínicas relevantes y requieren un abordaje individualizado y especializado.
Una de las complicaciones menos frecuentes, pero potencialmente graves, es el fenómeno de succión del inflow. Este puede generar inestabilidad hemodinámica y suele estar relacionado con factores como la hipovolemia, un mal posicionamiento de la cánula, o cambios estructurales en el ventrículo izquierdo. Por ejemplo, se ha descrito un caso en el que un exceso de tejido fibrótico en el VI obstruía la cánula, lo que obligó a realizar una miectomía y una valvuloplastia mitral para su resolución2. Estudios como los de Loforte et al.3 y Milwidsky et al.4 subrayan la utilidad de la ecocardiografía, especialmente la transesofágica, para diagnosticar con precisión esta complicación y guiar un tratamiento eficaz, que puede incluir el reposicionamiento quirúrgico del inflow. Nuestro equipo trató un caso similar mediante toracotomía y re-anclaje de la cánula con reorientación septal, con buenos resultados.
La malposición de la cánula de entrada del DAVI, aunque infrecuente, puede aparecer tanto en el postoperatorio inmediato como diferido. Diversos factores pueden contribuir a este desplazamiento, incluso si el implante inicial fue técnicamente correcto. Entre ellos destacan la pérdida ponderal significativa, que altera la disposición torácica y el anclaje del dispositivo5; la parálisis diafragmática unilateral, ya sea por lesión quirúrgica u otras causas que pueden modificar la posición del diafragma y, en consecuencia, afectar la orientación de la cánula; y el remodelado ventricular progresivo, bien sea por dilatación o por hipertrofia6. Para prevenir esta complicación, se recomienda: una técnica quirúrgica meticulosa, asegurando una adecuada alineación de la cánula orientándola hacia el centro de la cavidad ventricular y evitando su contacto con el septo interventricular o la pared libre; una fijación segura del dispositivo durante el implante7; un seguimiento estricto mediante imagen seriada (radiografías de tórax o ecocardiografías); y la consideración de maniobras quirúrgicas adicionales (como la plicatura diafragmática) en los pacientes seleccionados8.
Otra complicación importante es la obstrucción del conducto de salida, una condición que puede tener múltiples causas: desde torsiones o compresiones externas por estructuras anatómicas cercanas, hasta defectos en el trayecto del injerto o acumulación de material trombótico.
El estudio multicéntrico de Wert recopiló más de 25 casos en los que se resolvió esta complicación mediante angioplastia y colocación de stents. La prevalencia de obstrucción externa del outflow en los pacientes con HeartMate 3™ alcanza el 3%, con mayor incidencia a partir del primer año de soporte. Un diagnóstico precoz, usando técnicas de imagen como la TAC y la angiografía, es clave para actuar a tiempo. Dependiendo de la causa y la gravedad, el tratamiento puede ser quirúrgico o percutáneo9.
En nuestro caso, optamos por un abordaje endovascular, que en principio fue eficaz, aunque posteriormente fue necesaria una segunda intervención debido al colapso parcial del stent, un problema también descrito en la literatura reciente10. Este tipo de complicación se engloba dentro del concepto de EOGO, entidad recientemente reconocida y asociada a factores como compresión extrínseca por estructuras anatómicas (como puede ser el esternón o el ventrículo derecho), angulación anómala del injerto o defectos en la técnica quirúrgica. En este contexto, se han propuesto estrategias preventivas que podrían minimizar el riesgo de aparición de este evento adverso. Entre ellas, destaca la multiperforación del bend relief, componente de alivio de curvatura que recubre el injerto de salida11. Esta técnica, recomendada por la propia casa comercial y respaldada por publicaciones recientes, consiste en realizar múltiples fenestraciones durante la implantación del dispositivo para facilitar la evacuación de fluidos o biodebris que pudieran acumularse entre el injerto y el bend relief. Algunos estudios han demostrado que la ausencia de perforaciones en este componente se asocia a una mayor incidencia de obstrucción extrínseca del graft, mientras que su fenestración ofrece una protección mecánica más eficaz frente al colapso. Estas recomendaciones han sido incorporadas en las guías actualizadas de implante del HeartMate 3™, y su aplicación podría contribuir de forma significativa a la prevención de esta complicación.
Aunque el diseño del HeartMate 3™ ha reducido notablemente la incidencia de trombosis de bomba, las complicaciones hemorrágicas y tromboembólicas continúan siendo una preocupación significativa. La necesidad de anticoagulación crónica en estos pacientes, fundamental para prevenir eventos tromboembólicos, incrementa el riesgo de sangrado, lo que exige un equilibrio terapéutico delicado. Recientemente, se ha investigado el uso de anticoagulantes orales directos, como apixabán, en portadores de DAVI, con resultados prometedores en cuanto a hemocompatibilidad, aunque su aplicación clínica aún no está plenamente estandarizada12. Se debe realizar un equilibrio cuidadoso en la gestión de la anticoagulación es fundamental para minimizar ambos riesgos.
El manejo de las complicaciones mecánicas asociadas al HeartMate 3™ requiere de un trabajo coordinado entre distintas especialidades. La experiencia clínica ha demostrado que la colaboración entre cardiólogos, cirujanos cardiovasculares, expertos en imagen cardíaca e intervencionistas estructurales es esencial para detectar precozmente cualquier signo de disfunción y aplicar tratamientos de forma rápida y eficaz13.
El seguimiento periódico mediante técnicas de imagen como la ecocardiografía transtorácica y la TAC torácica (realizado anualmente en nuestro centro), junto con la valoración clínica continua, permite optimizar el manejo terapéutico y mejorar la calidad de vida del paciente. Diferentes registros han reforzado esta idea, mostrando que una colaboración estructurada e interdisciplinar favorece la toma de decisiones clínicas individualizadas y oportunas14.
Desde el punto de vista pronóstico, la aparición de complicaciones mecánicas se asocia con un mayor riesgo de hospitalización prolongada, infecciones relacionadas con el dispositivo y, en algunos casos, un retraso o contraindicación para el trasplante cardíaco. Por eso, es fundamental establecer protocolos de seguimiento estructurado, combinando valoraciones clínicas, ecocardiográficas y tomográficas de forma regular.
La coordinación entre las unidades de insuficiencia cardíaca avanzada, imagen cardiaca, cirugía cardiovascular e intervencionismo estructural es clave para garantizar una atención integral y ofrecer la mejor oportunidad de éxito terapéutico.
ConclusionesLas complicaciones mecánicas del HeartMate 3™, aunque infrecuentes, pueden comprometer gravemente la eficacia del soporte circulatorio. En nuestra experiencia, la succión del inflow y la estenosis del outflow representan retos que requieren intervenciones adaptadas.
La detección precoz mediante imagen y el manejo coordinado por equipos multidisciplinares son fundamentales para mejorar resultados clínicos. Protocolos de seguimiento estructurado permiten anticipar disfunciones y ajustar terapias, ya sea en los pacientes en lista de trasplante o en terapia de destino.
AutoríaTodos los autores del manuscrito han participado de forma equitativa en su elaboración.
FinanciaciónLos autores declaran que no existen fuentes de financiación relacionadas con este estudio.
Consideraciones éticasLos autores declaran que el estudio ha sido evaluado y aprobado por el Comité de Ética de Investigación Clínica del Hospital Universitario Marqués de Valdecilla. La investigación se ha llevado a cabo conforme a los principios éticos establecidos en la Declaración de Helsinki. Los pacientes incluidos otorgaron su consentimiento informado por escrito, incluyendo la autorización específica para la publicación de los datos clínicos recogidos en el presente trabajo. Se ha garantizado la confidencialidad y el anonimato de la información en todo momento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.