En este capítulo se realizará una revisión general de las técnicas de circulación extracorpórea y de protección miocárdica en la población pediátrica. La complejidad, diversidad y diferente fisiología del niño, hace que los métodos de circulación extracorpórea y el manejo de la canulación sean distintos.
A systematic review will be done in this chapter about cardiopulmonary bypass techniques and myocardial protection strategies in pediatric population. Complexity, diversity and different physiology in children, cause that Cardiopulmonary bypass methods and cannulation techniques are distinct.
Ante la cuestión de si la circulación extracorpórea (CEC) y la protección miocárdica tienen connotaciones especiales que las diferencian del adulto, probablemente y de una manera intuitiva, la mayoría de cirujanos cardiacos responderíamos de manera afirmativa. Sin embargo, no debemos olvidar que tanto la CEC como la protección miocárdica pediátricas deben perseguir los mismos principios y objetivos que la cirugía del adulto, como son básicamente aportar un campo quirúrgico exangüe que nos facilite la adecuada exposición quirúrgica y preservar adecuadamente todos y cada uno de los órganos y sistemas del paciente.
Pero vamos a tratar de razonar esa respuesta afirmativa que hemos dado anteriormente de un modo intuitivo:
Particularidades de la cirugía cardiaca pediátricaLo primero que debemos tener presente es que la cirugía cardiaca pediátrica tiene unas particularidades que la van a diferenciar de la cirugía cardiaca del paciente adulto. Esas particularidades diferenciadoras vienen impuestas por varias razones (fig. 1):
Variabilidad de pacientesExiste una población muy heterogénea en la cirugía cardiaca pediátrica que viene dada por el abanico tan amplio de edades en pediatría, que actualmente oscila en nuestro medio desde el periodo neonatal hasta los 14 años, lo que hace que exista un vasto rango de pesos en nuestros pacientes, desde los 2 o 3kg del neonato hasta el peso equivalente a un adulto en nuestros pacientes adolescentes. Por otro lado, con frecuencia la cardiopatía congénita no se presenta de modo aislado, sino que se asocia a otros síndromes polimalformativos o cromosomopatías.
Complejidad y diversidad de la enfermedad pediátricaLas cardiopatías congénitas son en general procesos patológicos más complejos que la enfermedad adquirida del adulto; sirva como ejemplo que si analizamos la extensión de las cardiopatías congénitas en cualquier tratado de cirugía cardiaca estas ocupan una mayor extensión respecto a la enfermedad adquirida del adulto, a pesar de la mayoritaria prevalencia de esta última. Además, existe una gran variabilidad de espectros dentro de una misma cardiopatía congénita, a lo que se puede sumar la concurrencia de diversas cardiopatías congénitas en un mismo paciente, dando lugar en ocasiones a cardiopatías muy complejas.
Fisiología diferente del niñoExisten unas diferencias fisiológicas entre la población infantil y adulta que vienen dadas por la volemia más reducida y la inmadurez de órganos de la primera, que es tanto más acusada cuanto menor es la edad y peso del paciente, siendo estas diferencias más extremas en el neonato.
Mercado comercial reducidoLa cirugía cardiaca infantil representa menos del 10% del conjunto de la actividad quirúrgica cardiaca1; ese marcado predominio de la actividad quirúrgica del adulto ha hecho para las grandes empresas del sector poco atractiva, comercialmente hablando, la cirugía cardiaca pediátrica, lo que se ha traducido en una menor inversión en investigación y desarrollo para la cirugía cardiaca infantil por parte de dichas empresas. Ello ha obligado al uso o adaptación de circuitos o sistemas de CEC inicialmente más diseñados para adultos, lo que se traduce en una mayor respuesta inflamatoria sistémica a la CEC, especialmente en nuestros pacientes más pequeños (neonatos, lactantes).
Corrección completa a edades más tempranasEn los últimos tiempos ha existido una tendencia generalizada a la corrección completa de las cardiopatías congénitas a edades cada vez más tempranas, con la idea de evitar los efectos deletéreos sobre el niño de las cirugías paliativas antiguamente realizadas o de la propia cardiopatía congénita no corregida.
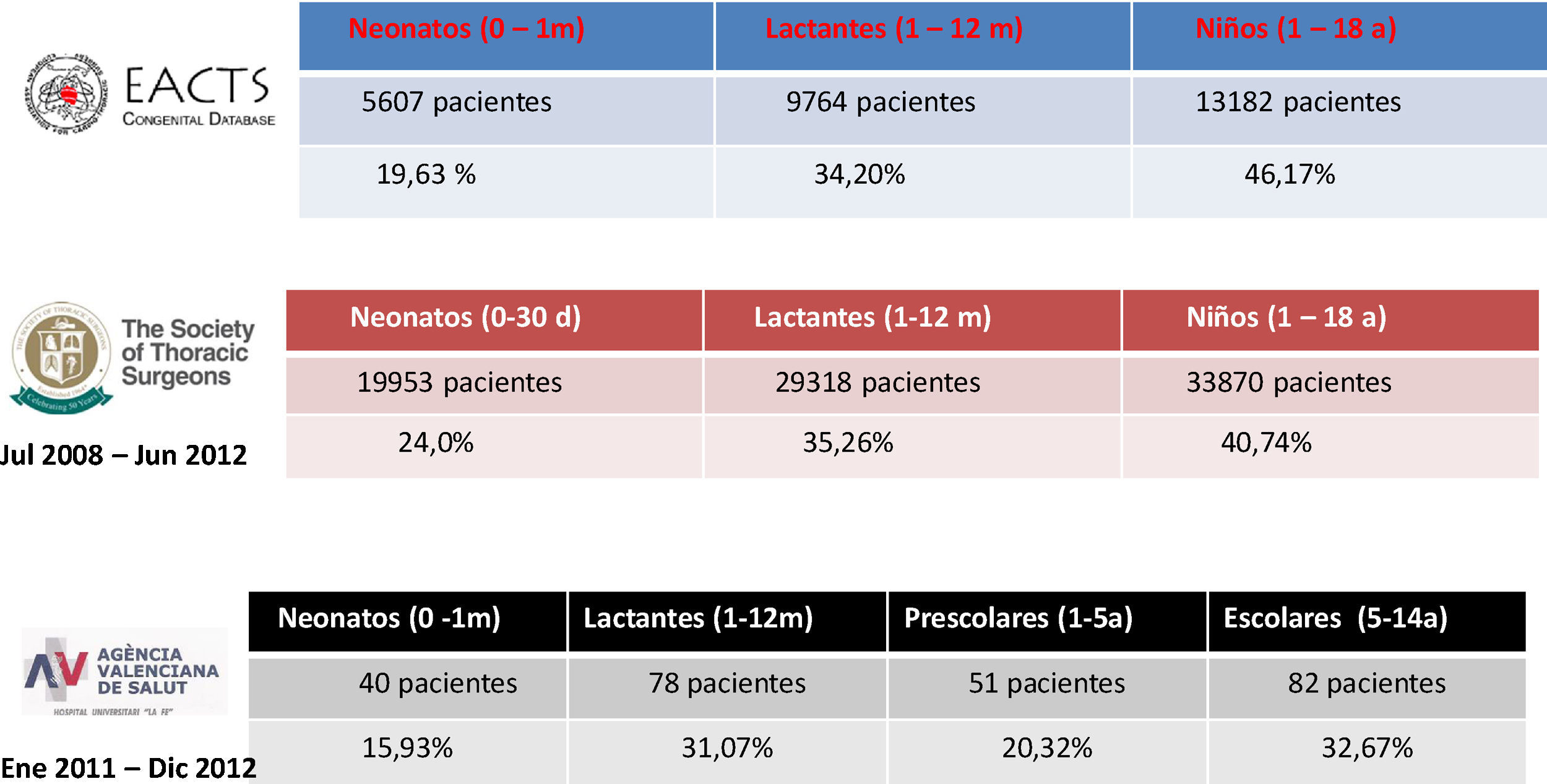
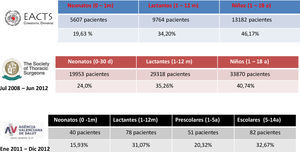
Ello se traduce, como podemos apreciar en la figura 2, en que la mayor parte de la actividad quirúrgica pediátrica actualmente se concentra en los grupos de edad más reducida, concretamente en torno al 50% o más se realiza por debajo del año de vida, y por tanto, son estos los pacientes que tienen una fisiología más diferenciada con respecto al adulto, y por ello son estos grupos de edades donde resulta más desafiante el empleo de la CEC.
Desafíos del empleo de la circulación extracorpórea en la población pediátricaLos problemas más importantes, entre otros, que plantea el uso de la CEC en la población pediátrica son: hemodilución, flujo —temperatura—, presión de perfusión y manejo de gases en sangre. Vamos a tratar estos aspectos de la CEC pediátrica en comparación con el adulto:
HemodiluciónQuizá sea el mayor problema planteado en la CEC pediátrica; este problema es tanto más acusado cuanto menor sea el peso del paciente, que se traduce en una menor volemia2,3, por ello estará más acentuada en neonatos y lactantes que, por otro lado, como hemos comentado anteriormente, representan más del 50% del total de la actividad quirúrgica pediátrica.
La hemodilución aparece como consecuencia de la necesidad de cebar el circuito de CEC con una solución de cebado para eliminar el aire del interior de este circuito, y evitar el fenómeno de embolismo aéreo al conectar el circuito de CEC con el torrente sanguíneo del paciente. Al iniciarse la CEC se mezcla la volemia del paciente con la solución de cebado, resultando en una hemodilución. Esta hemodilución puede ser calculada mediante fórmulas que tienen en cuenta la volemia estimada, el hematocrito del paciente (previo al entrar en CEC) y el volumen total de cebado del circuito de CEC.
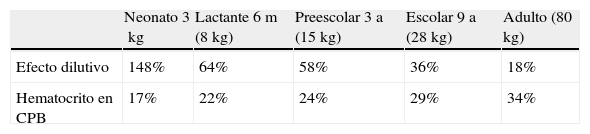
Lógicamente, como se puede apreciar en la tabla 1, el impacto de esa hemodilución es tanto mayor cuanto menor es el peso del paciente, siendo muy acusada en neonatos y lactantes. Además, el efecto dilutivo y hematocrito resultante en CEC mostrado en la tabla 1 se ha calculado partiendo de valores de hematocrito normales, pero con frecuencia en el niño cardiópata los hematocritos están por debajo de valores normales como consecuencia de su cardiopatía, lo que aún acentúa más el efecto hemodilutivo.
Efecto de la hemodilución sobre el hematocrito al entrar en CEC
| Neonato 3kg | Lactante 6m (8kg) | Preescolar 3 a (15kg) | Escolar 9 a (28kg) | Adulto (80kg) | |
| Efecto dilutivo | 148% | 64% | 58% | 36% | 18% |
| Hematocrito en CPB | 17% | 22% | 24% | 29% | 34% |
El efecto dilutivo y el hematocrito previsto en CEC han sido calculados tomando de base para cada grupo de edad un paciente tipo con edad y peso que se refleja en la tabla, y un hematocrito inicial normal para la edad.
Este efecto hemodilutivo tiene una serie de importantes consecuencias clínicas negativas sobre el paciente, que son mucho más acusadas y graves en nuestro grupo mayoritario de pacientes como son neonatos, lactantes y preescolares, y que hacen más desafiante la CEC infantil respecto a la del adulto2,3.
La hemodilución clínicamente se traducirá en:
Anemia por dilución: implicará una disminución de la capacidad de transporte de oxígeno a los tejidos4 y una mayor necesidad de transfusiones sanguíneas para combatirla.
Dilución de factores de coagulación y plaquetas: conlleva un mayor riesgo de coagulopatía y hemorragia en el postoperatorio inmediato que implicará mayor requerimiento transfusional de hemoderivados (plasma, plaquetas, fibrinógeno…) para atajarlas. Esa mayor necesidad transfusional tiene también unos conocidos efectos deletéreos sobre el organismo.
Dilución proteínas plasmáticas: provoca una disminución de la presión oncótica plasmática que se traduce en el escape de líquido desde el espacio intravascular al extravascular con necesidades altas de cargas de volumen exógeno para mantener la hemodinámica en el postoperatorio inmediato, lo que conlleva la aparición de edema intersticial que será más acusado en el neonato5. Esta mayor necesidad de aporte de volumen requiere con frecuencia el uso de diuréticos a dosis altas para intentar forzar balances negativos, y ello se traduce en un mayor riesgo de disbalance hidroelectrolítico.
Mayor respuesta inflamatoria a la CEC: la hemodilución también se correlaciona con la mayor activación del complemento y una liberación más marcada de hormonas del estrés como respuesta a la CEC6, y eso podría en parte explicar que la respuesta inflamatoria sistémica a la CEC sea más acusada en la población pediátrica respecto a la adulta, especialmente en las primeras etapas de la vida. La respuesta inflamatoria a la CEC provoca también un estado de mayor permeabilidad capilar y contribuye, junto a la disminución de la presión oncótica, anteriormente mencionada, al síndrome de fuga capilar responsable del edema intersticial observado tras la CEC en la población pediátrica de corta edad.
Mayor riesgo de infección: debido a la dilución de las inmunoglobulinas7.
Es indudable que la hemodilución tiene una serie de consecuencias clínicas que son bastante deletéreas para la población pediátrica respecto del adulto; por tanto, es necesario en la CEC pediátrica adoptar una serie de medidas para combatir dicha hemodilución y sus consecuencias. Así, entre las medidas destinadas a prevenir la hemodilución están: reducción del volumen de cebado, empleo de coloides y sangre en la solución de cebado y las técnicas de ultrafiltración.
La reducción del volumen de cebado es un detalle importante a la hora de ensamblar el circuito de CEC pediátrico, y podemos lograrlo con detalles tales como acortar y simplificar al máximo las líneas del circuito, reducir al máximo el diámetro de las líneas del circuito (línea arterial de 3/16 y venosa de ¼ en pacientes con peso menor a 5kg), seleccionar el oxigenador de volumen de cebado más bajo posible, reducción al máximo del volumen inicial de cebado del reservorio, etc.
El empleo de coloides (generalmente albúmina) y sangre en la solución de cebado es casi una constante en la CEC pediátrica a diferencia de la del adulto. El empleo de coloides persigue obtener unas proteínas totales en la solución de cebado en torno a 6g/dl con la idea de obtener en dicha solución una presión oncótica similar al plasma. La adición de concentrado de hematíes a la solución de cebado está destinada a mantener un nivel de hematocrito determinado durante la CEC. La cifra de hematocrito óptimo a conseguir durante la CEC ha sido objeto de numerosos estudios y debate a lo largo del tiempo, y entre los diferentes grupos de trabajo. Actualmente parece existir un consenso entre la mayoría de grupos para mantener un hematocrito entre el 25-30% durante cualquier fase de la CEC, y mayores a 30-35% durante la fase de recalentamiento y desconexión de la CEC8,9.
El empleo de técnicas de ultrafiltración, bien ultrafiltración convencional bien ultrafiltración modificada, cada una con sus ventajas e inconvenientes respectivos, es una constante en la CEC pediátrica, con un empleo superior al 90% de las perfusiones pediátricas frente a menos del 20% en adultos. La finalidad de estas técnicas es la extracción de agua corporal para lograr una mayor hemoconcentración10.
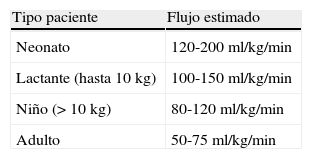
Flujo, temperatura y presión de perfusiónLa población pediátrica, y especialmente el neonato, tienen una tasa metabólica más elevada que el adulto, lo que se traduce en unas mayores necesidades de oxígeno respecto a la población adulta3. Por ello, durante la CEC se precisarán flujos más elevados en esta población pediátrica, que serán tanto más altos cuanto menor sea la edad del paciente (tabla 2).
Así, durante la CEC pediátrica lo ideal sería trabajar con flujos altos e hipotermia ligera, pero como hemos comentado anteriormente, uno de los aspectos particulares de la enfermedad cardiaca infantil al que nos enfrentamos es su gran variabilidad y complejidad, que con frecuencia nos obliga a adaptar el flujo y consecuentemente la temperatura a cada situación y paciente, con objeto de lograr un campo quirúrgico lo más exangüe posible que nos permita realizar eficientemente el procedimiento quirúrgico perseguido. Esto se traduce, a diferencia de la CEC del adulto, en una mayor necesidad de bajar y subir los flujos y temperaturas durante el desarrollo de las intervenciones quirúrgicas, incluso con fases de flujo bajo en hipotermia profunda o parada circulatoria completa para lograr una adecuada exposición quirúrgica, como puede ocurrir en cardiopatías congénitas cianóticas con abundante circulación colateral aortopulmonar. Lógicamente, la disminución del flujo se traducirá en disminución de la temperatura de perfusión, debido a la reducción del metabolismo proporcionado por la hipotermia11.
Durante la conducción de la CEC pediátrica también existen diferencias respecto a la CEC del adulto, en cuanto a la presión de perfusión «ideal» a mantener. En general, cuanto menor es la edad, y especialmente para neonatos y lactantes, es más importante mantener un flujo adecuado más que una presión de perfusión «ideal» debido a la elasticidad y vasoespasticidad de los vasos sanguíneos en las edades tempranas de la vida, lo que obliga a un mayor uso de vasodilatadores (bloqueo alfa adrenérgico) durante la perfusión pediátrica2,12. Por el contrario, en la población adulta se persigue mantener una presión de perfusión «ideal» en torno a 50-80mmHg que mantenga la «autorregulación» cerebral y de otros órganos de la economía como el riñón; para ello es más frecuente usar vasoconstrictores debido a la aterosclerosis de sus vasos13.
Por tanto, en el grueso de nuestros pacientes pediátricos, pacientes menores de 4-5 años, debido a su corta edad en el momento de la intervención quirúrgica buscaremos un «flujo adecuado» más que una «presión de perfusión ideal» durante la conducción de la CEC, actuando sobre el flujo, temperatura, gases, nivel de hematocrito y disminuyendo las resistencias vasculares sistémicas mediante bloqueo alfa adrenérgico que permita un flujo adecuado hacia todos los órganos. Además del bloqueo alfa adrenérgico con urapidilo o fenoxibenzamina, también contribuyen a disminuir las resistencias vasculares sistémicas y mejorar el flujo hacia todos los órganos medidas tales como el uso de hipotermia moderada con flujos altos, evitando siempre que sea posible la hipotermia profunda con o sin parada circulatoria completa, realización de las fases de calentamiento y enfriamiento del paciente de modo homogéneo y global, uso preoperatorio de corticoides, uso rutinario de técnicas de ultrafiltración…
Para controlar que estamos obteniendo un flujo «adecuado» durante toda la CEC, por un lado monitorizaremos constantemente la saturación venosa mixta de oxígeno (manteniéndola por encima del 70%) y la presión venosa de oxígeno (manteniéndola por encima de 30mmHg) mediante el empleo de un gasómetro en línea; y por otro lado, emplearemos la monitorización constante de la saturación regional cerebral de oxígeno mediante técnica de espectrometría cercana al infrarrojo (NIRS), con el objeto de evitar caídas mayores del 40% en valores totales o descensos mayores del 20% respecto al valor basal.
Manejo de gases en sangreLa regulación del flujo cerebral durante la CEC está muy influido por la presión arterial de CO2 (PaCO2); a su vez, al descender la temperatura corporal se produce un descenso de la PaCO2 en sangre, lo que se traduce en el aumento de su pH. Así, el manejo del pH óptimo durante la CEC con hipotermia ha sido y resulta controvertido, existiendo 2 estrategias a tal efecto: alfa-stat y pH-stat.
La estrategia pH-stat produce una pérdida de la «autorregulación» cerebral, con un aumento global del flujo cerebral y redistribución del mismo hacia áreas más profundas del cerebro, lo que implica un enfriamiento cerebral más homogéneo y rápido junto a un mejor aporte cerebral de oxígeno14. Esto, en estudios experimentales y clínicos9, se ha traducido en mejores resultados postoperatorios inmediatos a nivel hemodinámico y de desarrollo neurocognitivos a medio-largo plazo en la población pediátrica menor de 9 meses.
La estrategia alfa-stat permite conservar la «autorregulación» cerebral y la actividad enzimática celular15. Al conservarse dicha «autorregulación» cerebral el flujo sanguíneo hacia el cerebro es acorde a las necesidades metabólicas del mismo en cada momento, y por tanto, y a diferencia de la estrategia pH-stat, no existe un exceso de flujo cerebral, con lo que disminuye el riesgo de microembolismos cerebrales y así mejoran los resultados neurocognitivos en la población adulta sometida a CEC con estrategia alfa-stat.
Probablemente, y dentro de la controversia existente, en la población infantil, especialmente en neonatos, cuando se precise hipotermia profunda con flujos bajos sea más idóneo recurrir a la estrategia pH-stat. Por el contrario, en niños mayores y adultos, sea mejor en general recurrir a la estrategia alfa-stat, pudiendo combinarse ambas estrategias en los casos donde se prevea la necesidad de emplear hipotermia profunda con flujos bajos o parada circulatoria.
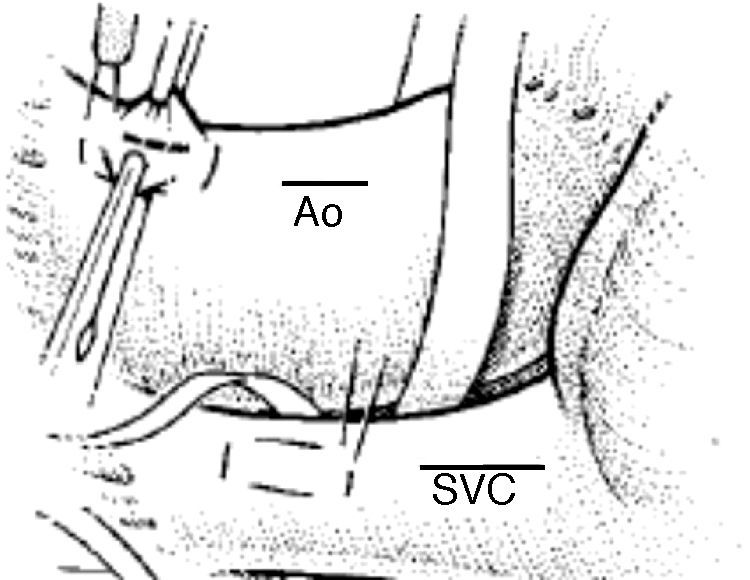
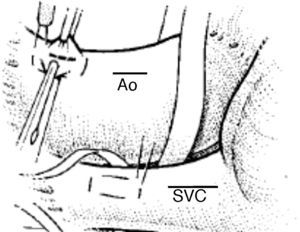
Aspectos quirúrgicos de la circulación extracorpórea. CanulaciónLa canulación en la CEC pediátrica presenta algunos aspectos que la diferencian de la del adulto. Así, la canulación pediátrica suele ser más demandante técnicamente debido al reducido calibre y el carácter más elástico de los vasos, que obliga a lograr un adecuado equilibrio entre el diámetro de las cánulas elegidas y el diámetro del vaso canulado para evitar problemas de perfusión durante la CEC. En este sentido, es importante tener presente que la cánula arterial es probablemente el punto más estrecho del circuito de CEC, y es un lugar importante de hemólisis, por lo que se debe elegir una cánula de diámetro lo más amplio posible acorde al peso del niño, flujo a administrar y diámetro de la aorta a canular, existiendo una tendencia al uso de cánulas de pared fina, alambrada y flexible (fig. 3).
Las cardiopatías congénitas con frecuencia conllevan anatomías arteriales o venosas complejas debido a situaciones tales como heterotaxias, situs inversus, persistencia de vena cava superior izquierda… que junto al compromiso de espacio inherente a lo reducido de la caja torácica del paciente pediátrico de corta edad, hacen más dificultosa respecto al adulto la canulación, desarrollo de la CEC y del propio procedimiento quirúrgico.
La gran diversidad de procesos patológicos y situaciones en la población pediátrica hace que la estrategia de canulación sea muy variable, siendo muy frecuente la necesidad de empleo del «VENT», el control de shunts aorto-pulmonares (ductus permeable, fístulas sistémico-pulmonares…), empleo de canulación arterial doble (por ejemplo interrupción del arco aórtico), necesidad de disección y cerclaje de ramas pulmonares al establecer la CEC (por ejemplo corrección del truncus arterioso), etc.
La canulación aórtica se suele realizar bastante alta en la mayoría de casos (próxima a la base del tronco braquiocefálico) para disponer de longitud suficiente de aorta para pinzarla, administrar la cardioplejía y tener espacio para el desarrollo del procedimiento quirúrgico. Se debe ser exigente al confeccionar las «bolsas» para canular, realizándolas lo más ajustadas posible al diámetro de las cánulas, sobre todo a nivel de la aorta donde la bolsa debe tener forma alargada, y en el caso de neonatos se suele confeccionar una sola «bolsa», todo ello destinado a evitar posteriores estenosis en los puntos de canulación (fig. 4).
Protección miocárdica pediátricaAl analizar la protección miocárdica pediátrica debemos tener presente que existen unas diferencias entre la población pediátrica y la adulta. Así, en la población pediátrica contamos con las ventajas de un árbol coronario normal que permite una distribución homogénea de la cardioplejía por vía anterógrada y una función cardiaca generalmente normal. Por el contrario, en el adulto es más frecuente la ateromatosis coronaria que a pesar de combinar las diferentes vías de administración de la cardioplejía (anterógrada/retrógrada/injertos coronarios) pueden provocar áreas miocárdicas mal protegidas; además, no es infrecuente encontrarnos con cardiopatías adquiridas que ya han deteriorado la función cardiaca en el momento de la intervención quirúrgica, lo que conlleva mayor riesgo de disfunción miocárdica en el postoperatorio inmediato.
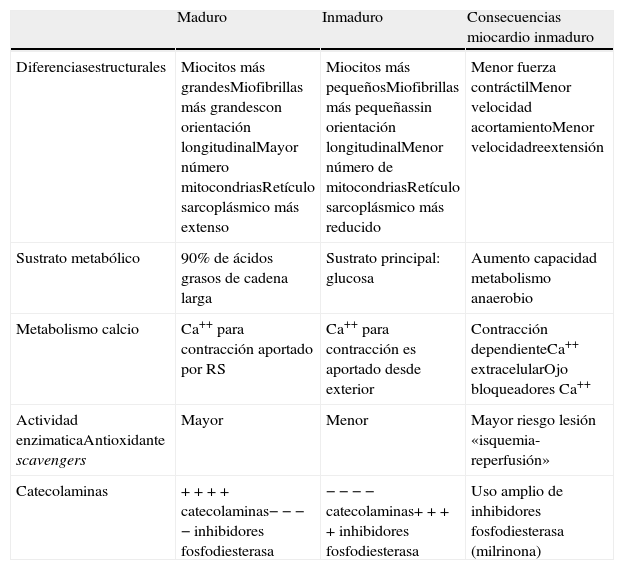
Otra diferencia importante es la existencia de un miocardio inmaduro durante los primeros meses de vida, que tiene unas particularidades y un comportamiento diferente al miocardio maduro16 (tabla 3) y que nos obliga a confeccionar la técnica de protección miocárdica de acuerdo a la edad del paciente. No existe un acuerdo respecto al momento en el que se produce la transición de miocardio inmaduro a maduro, pero parece que se completa durante el primer año de vida, y muy probablemente dentro de los 3 primeros meses de vida17,18.
Diferencias entre el miocardio maduro e inmaduro
| Maduro | Inmaduro | Consecuencias miocardio inmaduro | |
| Diferenciasestructurales | Miocitos más grandesMiofibrillas más grandescon orientación longitudinalMayor número mitocondriasRetículo sarcoplásmico más extenso | Miocitos más pequeñosMiofibrillas más pequeñassin orientación longitudinalMenor número de mitocondriasRetículo sarcoplásmico más reducido | Menor fuerza contráctilMenor velocidad acortamientoMenor velocidadreextensión |
| Sustrato metabólico | 90% de ácidos grasos de cadena larga | Sustrato principal: glucosa | Aumento capacidad metabolismo anaerobio |
| Metabolismo calcio | Ca++ para contracción aportado por RS | Ca++ para contracción es aportado desde exterior | Contracción dependienteCa++ extracelularOjo bloqueadores Ca++ |
| Actividad enzimaticaAntioxidante scavengers | Mayor | Menor | Mayor riesgo lesión «isquemia-reperfusión» |
| Catecolaminas | + + + + catecolaminas− − − − inhibidores fosfodiesterasa | − − − − catecolaminas+ + + + inhibidores fosfodiesterasa | Uso amplio de inhibidores fosfodiesterasa (milrinona) |
El miocardio inmadur,o debido a que sus miocitos y miofibrillas son más pequeñas, posee un menor número de mitocondrias y las miofibrillas carecen de orientación longitudinal, va a tener una menor fuerza contráctil y menor velocidad de acortamiento16. Este miocardio inmaduro posee una menor actividad enzimática antioxidante, por lo que tiene un mayor riesgo de lesión por el fenómeno de «isquemia-reperfusión» que el miocardio maduro. Sin embargo, el miocardio inmaduro tiene aumentada la capacidad de usar el metabolismo anaerobio, por lo que soporta mejor la hipoxia respecto al miocardio adulto o del niño mayor. La contractilidad del miocardio inmaduro es muy dependiente de la concentración de calcio extracelular al disponer de un retículo sarcoplásmico más reducido que el maduro, por lo que al salir de CEC debemos estar pendientes de la calcemia en estos pacientes; además, debemos tener presente que el miocardio inmaduro es mucho menos sensible a las catecolaminas que el maduro, aunque sin embargo responde con la misma efectividad a los inhibidores de la fosfodiesterasa (por ejemplo milrinona) que el miocardio maduro, por lo que en general en estos pacientes se tenderá al uso de dichos inhibidores de la fosfodiesterasa como inotropo de entrada al salir de CEC y durante el postoperatorio (tabla 3).
Protección miocárdica pediátrica: principiosLos principios de la protección miocárdica pediátrica son coincidentes con los del adulto y persiguen lograr:
- -
Una parada electromecánica cardiaca en diástole, mediante el empleo de cardioplejía de inducción con niveles altos de potasio.
- -
Descompresión ventricular que evite la lesión por estiramiento.
- -
Reducción de la demanda metabólica miocárdica mediante la hipotermia.
A pesar de los numerosos estudios experimentales publicados en la literatura desde los inicios de la cirugía cardiaca pediátrica, no existe un consenso respecto a una estrategia universalmente aceptada de protección miocárdica pediátrica, existiendo en este sentido diversidad en las estrategias usadas entre los diferentes grupos de trabajo. Sin embargo, y a pesar de esa diversidad de estrategias, el fallo cardiaco primario es una causa infrecuente de mortalidad en la práctica de la cirugía cardiaca infantil19, siendo las causas más frecuentes de mortalidad la persistencia de defectos residuales o las cirugías paliativas o incompletas19.
No obstante, la mayoría de pacientes pediátricos sometidos a cirugía cardiaca experimentan un cuadro de bajo gasto cardiaco en el intervalo entre las 6 a 24 primeras horas del postoperatorio20. El conocimiento de esas causas de bajo gasto cardiaco y la actuación sobre las mismas nos puede ayudar a combatir ese bajo gasto cardiaco postoperatorio, y por ende, a proteger mejor el miocardio.
Causas del bajo gasto cardiaco postoperatorioLesión por tracción miocárdicaSi bien el miocardio inmaduro es mucho más resistente a la hipoxia que el maduro, este miocardio inmaduro es muy sensible a la lesión por tracción. Dos son los mecanismos de lesión por tracción: distensión ventricular y retracción miocárdica.
La distensión ventricular se produce en aquellas situaciones donde existe un retorno sanguíneo aumentado hacia el ventrículo izquierdo (por ejemplo cardiopatías cianóticas con abundante circulación colateral aortopulmonar, insuficiencia valvular aórtica o truncal, shunts sistémico-pulmonares…); esa sobrecarga de volumen ventricular progresivamente no puede ser eyectada por el ventrículo izquierdo conforme disminuye su fuerza contráctil al iniciarse la CEC y comenzar la fase de hipotermia, lo que se traduce en una distensión ventricular que provocará isquemia subendocárdica y aumento del consumo energético del miocardio por el aumento de su tensión parietal. Debemos combatir enérgicamente esa distensión ventricular mediante la colocación precoz del «VENT», control previo al inicio de la CEC o incluso preoperatoriamente de shunts o colaterales aorto-pulmonares, pinzado aórtico precoz en el caso de insuficiencia valvular aórtica, etc.
La retracción miocárdica está causada por las maniobras y fuerzas aplicadas sobre el miocardio (aplicación de puntos de tracción, separadores…) destinadas a exponer los defectos intracardiacos a través de incisiones limitadas (por ejemplo acceso vía atriotomía derecha y válvula tricúspide para exponer y cerrar una CIV) o maniobras de luxación o volteo del corazón para exponer determinadas zonas cardiacas. El miocardio del neonato o lactante es muy delicado y apenas ofrece resistencia a las fuerzas de retracción, por lo que es fácilmente lesionable por la aplicación de unas fuerzas de tracción o separación excesivas, lo que se traduce en un miocardio contundido, equimótico y frecuentemente excitable y proclive al desarrollo de arritmias (por ejemplo taquicardia ectópica de la unión). Por ello, debemos aprender desde el principio, ya que la lesión por tracción es muy dependiente del equipo quirúrgico y fácilmente prevenible, a manipular lo menos posible y de la forma más delicada que se pueda el corazón pediátrico, monitorizando constantemente la fuerza de tracción aplicada.
Reparación incompletaLa persistencia de defectos residuales, o la necesidad de realizar cirugías paliativas o incompletas, imponen generalmente al corazón sobrecargas de volumen o poscarga que condicionan bajo gasto cardiaco, siendo según la literatura la reparación incompleta la causa más frecuente de bajo gasto cardiaco en el postoperatorio de la cirugía infantil19.
VentriculotomíaSe deben diseñar estrategias quirúrgicas que eviten la realización de ventriculotomías (por ejemplo cierre de CIV por atriotomía derecha en vez de ventriculotomía derecha, abordaje de CIV apicales por intervencionismo, etc.); y en el caso de ser estrictamente necesarias se deben realizar lo más limitadas posible, evitando traccionar de sus bordes y ubicándolas respetando al máximo la circulación coronaria.
Edema miocárdicoEl edema miocárdico está muy relacionado con la duración de la CEC e isquemia miocárdica, así como con los factores de la perfusión ya comentados. Algunos estudios apuntan a que la estrategia pH-stat previene mejor el edema miocárdico9.
CardioplejíaSegún algunos estudios parece que el miocardio inmaduro tolera peor las dosis repetidas de cardioplejía que el miocardio maduro, y se protege en buena parte por grados marcados de hipotermia. A la vista de estas observaciones algunos grupos están diseñando estrategias de protección miocárdica empleando dosis únicas de cardioplejía de larga duración (por ejemplo Custodiol®, Celsior®) para pacientes pediátricos con cardiopatías complejas que exigen tiempos de pinzado aórtico prolongados.
Respecto al vehículo de la cardioplejía, si bien en el adulto parecen estar demostradas las ventajas de la cardioplejía hemática, por el contrario en el niño no están tan claras, y parece que solo aportaría ventajas en cirugías complejas con tiempos de isquemia largos.
A lo largo del tiempo han surgido numerosos estudios con respecto a la composición de la cardioplejía, aditivos de la misma… pero a fecha de hoy podemos afirmar que no existe una composición de la cardioplejía universalmente aceptada en la cirugía pediátrica. Así mismo, y especialmente en neonatos y lactantes de corta edad, parece existir un acuerdo en la importancia de mantener un grado adecuado de hipotermia local a nivel del miocardio en aras de lograr una mejor protección miocárdica; así, se debe mantener el corazón dentro del saco pericárdico sin voltearlo fuera del mismo, irrigándolo periódicamente con suero frío y manteniendo una temperatura ambiental en el quirófano adecuada, evitando temperaturas demasiado altas que puedan calentar excesivamente el corazón.
Consideraciones finalesProbablemente, después de la lectura de estos párrafos, tengamos unos argumentos más sólidos para considerar que la CEC y la protección miocárdica pediátrica sí tienen unas particularidades que las hacen especiales respecto a la cirugía cardiaca del paciente adulto. Esas particularidades son tanto más acusadas cuanto menor es la edad y peso del paciente pediátrico, haciéndose especialmente marcadas en los neonatos o lactantes de corta edad, en los que la CEC y la protección miocárdica resultarán especialmente más desafiantes.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.