La ecocardiografía, sobre todo la transesofágica, tiene un papel de primer orden en el diagnóstico de la enfermedad aórtica, tanto en la valoración de la anatomía de la raíz y de la gravedad de la regurgitación aórtica como en el diagnóstico del síndrome aórtico agudo. Su papel está definido y consolidado desde hace muchos años. El ecocardiograma tridimensional transesofágico en tiempo real puede ser una aportación insustituible en el futuro. La tomografía axial (TC) multicorte y la resonancia magnética nuclear (RM) son técnicas precisas frecuentemente utilizadas en el síndrome aórtico agudo. Todas estas tecnologías requieren unidades de imagen cardíaca multidisciplinarias y cooperativas que ayuden a la formación de los futuros especialistas. La cambiante y compleja cirugía aórtica, con el nuevo auge de la cirugía reparadora de la raíz de la aorta y el tratamiento más extenso y combinado de los síndromes aórticos agudos, requiere que los especialistas de imagen cardíaca proporcionen a los cirujanos una información de calidad, útil y rápida.
Echocardiography, especially transesophageal echocardiography, plays a leading role in the diagnosis of aortic pathology, in the evaluation of the anatomy of the aortic root and in the severity of aortic regurgitation as in the diagnosis of aortic acute syndrome. Its role is defined and consolidated over the years. Real-time three-dimensional transesophageal echocardiography can be an irreplaceable contribution in the future. Multislice computed tomography and magnetic resonance imaging are accurate techniques frequently used in acute aortic syndrome. All these technologies require multidisciplinary and cooperative cardiac imaging units assisting in the training of future specialists. The changing and complex aortic surgery, with the renewed interest in surgical repair of the root and the more extensive and combined treatment of the acute aortic syndromes require cardiac imaging specialists to provide surgeons with a high quality, useful and quick information.
Se ha producido una verdadera eclosión de artículos sobre técnicas de imagen en cardiología y, en concreto, sobre las aplicaciones clínicas cardiológicas de la RM (cardio-RM) y, en menor cuantía, pero también de gran relevancia, sobre TC con multidetectores (cardio-TC). El avance y la importancia de estas dos últimas técnicas, demostrados en varios terrenos del diagnóstico cardiológico, especialmente en la enfermedad aórtica, ha determinado la elaboración y la publicación de un documento conjunto de la European Association of Echocardiography (EAE) con los grupos de trabajo implicados en el diagnóstico por la imagen, como el de cardio-RM, Computers en cardiología y de isótopos en cardiología de la Sociedad Europea de Cardiología, junto con la Asociación Europea de Cardiología Pediátrica1. Este documento es una declaración de todas las entidades europeas implicadas en el diagnóstico por imagen cardíaca con varias intenciones. La primera es una llamada a la colaboración y a la no competición entre todos los profesionales que trabajan en las diferentes modalidades de imagen representados en ellas. Es también un documento de propuestas para una correcta utilización de las pruebas diagnósticas que pueden realizarse en el estudio de la enfermedad cardiovascular. Por último, recomiendan la integración en servicios de diagnóstico clínico donde colaboren los expertos en dichas modalidades y donde se formen los futuros profesionales especialistas en diagnóstico por imagen2. En la práctica cardiológica diaria el estudio mediante ecocardiografía con análisis Doppler es, con mucho, el primer estudio solicitado si hay una sospecha de enfermedad cardiológica, sobre todo en las valvulopatías. Los importantes avances en el campo de los ultrasonidos han abierto nuevos horizontes en la investigación y la práctica clínica que nos han hecho entender mejor las enfermedades cardíacas, la aparición del ecocardiograma 3D ha sido el avance de más impacto y con seguridad se incorporará de forma paulatina a la práctica habitual. Este breve artículo se refiere a las aportaciones de la ecocardiografía en el estudio de la raíz aórtica como causa prevalente de insuficiencia aórtica (IAo) y en el síndrome aórtico agudo (SAA); estas enfermedades son indicaciones de primer orden para ecocardiografía transtorácica (ETT) y sobre todo transesofágica (ETE), que es muy superior en el estudio de la aorta distal al plano valvular.
Estudio de la raíz aórticaEl objetivo es, por un lado, las medidas convencionales a este nivel, valorar la presencia y gravedad de IAo y asegurar que la regurgitación tiene origen en la disfunción de esta unidad anatomofuncional. La evolución de la etiología en la IAo ha cambiado últimamente igual que lo ha hecho en la regurgitación mitral.
Estamos asistiendo a la regresión de la enfermedad valvular reumática, que ha dejado de ser la principal causa de IAo crónica3. Progresivamente, la enfermedad de la aorta proximal, como el caso del síndrome de Marfan o aneurismas de la aorta ascendente en pacientes sin síndrome de Marfan (p. ej. hipertensión arterial), se ha convertido en la primera causa de IAo en los países desarrollados. Junto a la endocarditis infecciosa, la valvulopatía aórtica congénita por válvula bicúspide, frecuentemente asociada también a dilatación de aorta ascendente, se ha convertido en una de las formas más comunes de IAo en el adulto. En la actualidad, al menos el 25% de casos de IAo son de causa «funcional» secundarias a dilatación de la raíz aórtica4,5. Por lo tanto, cuando hablamos de IAo crónica en la actualidad nos referimos con mucha frecuencia a dos tipos de poblaciones claramente distintas:
- –
Pacientes jóvenes, con baja prevalencia de enfermedad reumática y de disfunción ventricular izquierda, escasa comorbilidad y frecuente enfermedad congénita que afecta a la aorta proximal.
- –
Pacientes de edad avanzada, generalmente con hipertensión arterial y enfermedad coronaria asociada, función ventricular izquierda deprimida y formas degenerativas de IAo.
Estos cambios en la etiología y perfil clínico van a tener implicaciones en el manejo de estos pacientes. En primer lugar, en aquellos casos en que existe enfermedad concomitante de la raíz aórtica o de la aorta ascendente, las decisiones sobre tratamiento médico e indicación quirúrgica deben tener en cuenta ambas condiciones6. En general, se acepta que la cirugía está indicada en aquellos casos de IAo en los que existe dilatación de raíz aórtica igual o superior a 50mm. En segundo lugar, en estas formas de IAo el mecanismo responsable no es, generalmente, la lesión estructural de los velos valvulares, sino los cambios geométricos de la raíz. Hasta ahora sustituíamos en muchos casos una válvula «regurgitante» sana dejando atrás el verdadero problema, una raíz aórtica enferma7. En estos momentos se conservan los velos sin lesión estructural, corrigiendo las alteraciones geométricas de la raíz aórtica que dan lugar a la aparición de la incompetencia valvular.
Estructura de la raíz de aortaLa raíz aórtica es la porción del tracto de salida del ventrículo izquierdo (VI) que se origina a nivel de la inserción de los velos valvulares hasta la unión sinotubular (UST). El conocimiento de su estructura, dimensiones, así como de las relaciones geométricas existentes es fundamental para comprender el mecanismo dinámico de apertura y cierre valvular.
Los velos valvulares son tres estructuras laminares con forma semilunar que separan hemodinámicamente el VI y la aorta.
- –
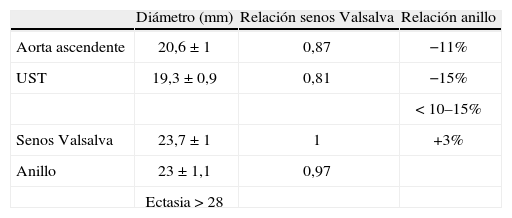
Los senos de Valsalva corresponden a las protuberancias laterales de la pared. Son la zona de mayor diámetro de la raíz, siendo por término medio un 3–5% mayor que el diámetro del anillo aórtico8.
- –
La UST es el cinturón distal rico en fibras elásticas que separa la raíz y la aorta ascendente. Su diámetro es el más pequeño de toda la raíz, siendo aproximadamente un 10–15% más pequeño que el anillo aórtico.
Las proporciones han de ser muy estables para evitar la disfunción de esta unidad anatomofuncional9 (Tabla I).
- –
La longitud del borde libre de los velos debe ser igual o superior al diámetro del anillo aórtico y, por lo tanto, también igual o superior al diámetro de la UST (en caso de ser menor indicaría una retracción de los velos o una dilatación del anillo o de la UST).
- –
La zona de inserción de cada velo en la raíz debe ser al menos una vez y media el borde libre del velo (en caso de ser menor indicaría que los velos son redundantes y con alta posibilidad de prolapso).
- –
La altura del velo (distancia desde el nadir del velo en la zona de inserción hasta el nódulo de Arancio, normalmente 12–18mm) debe ser al menos la mitad del diámetro (el radio) del anillo (en caso de ser menor, la coaptación puede ser inadecuada).
Las medidas de las distintas estructuras están estandarizadas desde hace años10 y las podemos realizar adecuadamente frecuentemente en ETT y sistemáticamente en ETE (Fig. 1). Se considera que al menos los diámetros del anillo aórtico y a nivel de los senos de Valsalva se pueden medir en ETT, excepto en el 0,7% de la población por mala ventana11.
Fisiología de la raíz aórticaLa raíz aórtica se encarga de la transmisión unidireccional y laminar del flujo que procede del VI en cada embolada sistólica, ofreciendo la menor resistencia posible a su paso. Además, mantiene un adecuado flujo coronario y evita el daño tisular de los velos valvulares con los cambios frecuentes y enormemente variables de las condiciones clínicas.
Hoy en día se acepta que los movimientos de apertura y cierre de los velos valvulares durante el ciclo cardíaco son prácticamente pasivos12. La UST sometida a los cambios de presión en la aorta se expande en sístole, tirando de las comisuras y abriendo los velos valvulares. Por el contrario, el anillo aórtico depende de los cambios de presión en el VI13, se contrae en sístole y se dilata en diástole, cuando se produce el llenado ventricular, tirando de la base de los velos y contribuyendo al cierre. Finalmente, en los senos de Valsalva, se generan corrientes circulares o vórtices14 que evitan que los velos se acerquen a la pared de la raíz aórtica y ocluyan los orificios coronarios y que contribuyen al cierre valvular desde la mesotelesístole a la diástole.
Mecanismos de la insuficiencia aórticaEl Khoury (Tabla II) hace extensivos los mecanismos fisiopatológicos descritos por Carpentier en la regurgitación mitral a la IAo15. En la IAo con mecanismo tipo I la regurgitación es central; se habla de mecanismo tipo IA cuando existe una dilatación a partir de la unión sinotubular y corresponde típicamente a los aneurismas de aorta ascendente (Fig. 2). En el mecanismo tipo IB, existe dilatación propiamente dicha de los senos de Valsalva; es la anuloectasia aórtica propia de los cuadros marfanoides (Fig. 3). El mecanismo tipo IC es la dilatación aislada del anillo; es rara, y frecuentemente se asocia a alteraciones tipo IB del síndrome de Marfan y a válvula bicúspide.
Mecanismos de regurgitación valvular
| Disfunción | Válvula mitra | Válvula aórtica |
| Tipo I | – Dilatación del anillo | – Dilatación supravalvular |
| No coaptación | – Perforación de valvas | – Dilatación raíz aórtica |
| Movilidad normal | – Disrupción de valvas | – Perforación o rotura valvular |
| Tipo II | – Rotura o elongación de cuerdas | – Prolapso |
| Prolapso de valvas | – Rotura músculo papilar | – Disrupción comisural |
| ↑ motilidad | – Traumática | |
| Tipo III | – Fusión comisural | – Fusión comisural |
| Restricción movilidad | – Engrasamiento de valvas | – Engrosamiento o calcificación valvas |
| – Fusión o calcificación de cuerdas | – Valvulopatía congenita |
Cada vez encontramos con más frecuencia regurgitaciones aórticas «funcionales» en pacientes con enfermedad de la aorta proximal, que se producen cuando velos intrínsecamente normales no coaptan adecuadamente en diástole16. Furukawa, et al.17 demostraron que la IAo funcional es más frecuentemente una enfermedad de la UST y no del anillo aórtico. El cierre incompleto diastólico de los velos valvulares se produce como consecuencia de la distorsión de la geometría de las inserciones de los velos valvulares, por otro lado intrínsecamente normales, al nivel de la UST. Es decir, es evidente que la dilatación de la UST desplaza las comisuras hacia fuera y evita la coaptación central de los velos valvulares, provocando típicamente un chorro regurgitante central. Este fenómeno se asocia con procesos patológicos tan prevalentes en nuestro medio como la hipertensión arterial, el envejecimiento, la arteriosclerosis sistémica o la insuficiencia renal crónica11,18. Los cambios geométricos que se producen en los aneurismas aórticos de larga evolución resultan en incompetencia valvular. Cuando el mecanismo último de la regurgitación es la dilatación de la aorta ascendente basta con el remodelado de la UST mediante una prótesis supracoronaria para restablecer la competencia valvular. Sin embargo, se requieren técnicas quirúrgicas más complejas, como procedimientos de remodelado de la raíz aórtica o reimplantación de la válvula nativa en una prótesis vascular, cuando también existe dilatación simétrica de los tres senos de Valsalva o anuloectasia aórtica16.
Además de distorsiones de la anatomía de los velos y de la enfermedad de la aorta proximal, otro hallazgo común en los casos de regurgitación aórtica sin lesión macroscópica o estructural de los velos valvulares es la presencia de prolapso valvular (mecanismo tipo II). Generalmente se producen asociados a distorsiones asimétricas de los senos de Valsalva, aunque, en la mayor parte de los casos, se mantiene la proporción adecuada entre la UST y el anillo aórtico19. Por otra parte, distensiones muy prolongadas de los velos en los casos de aneurismas aórticos de larga evolución y desgarros de las inserciones de una comisura por disección aórtica pueden dar lugar a la aparición de prolapso valvular. En este caso se requiere asociar una resección o resuspensión de los velos a la cirugía de remodelado de la raíz aórtica para corregir eficazmente la regurgitación20. Otra causa de prolapso es la asociación a válvula bicúspide. El ETE permite una excelente valoración de los mecanismos de regurgitación, especialmente en los prolapsos, y se considera indispensable su utilización si pensamos en la reparabilidad de la válvula/raíz21.
Cuantificación de la gravedadProbablemente sea éste uno de los problemas más difíciles en la valoración de las valvulopatías. Sin embargo, tiene un valor incuestionable. La aparición de técnicas incruentas que cuantifican con precisión la gravedad de la regurgitación ha permitido el desarrollo de estudios mejor cualificados22 de historia natural de pacientes asintomáticos con IAo grave y, por lo tanto, el descubrimiento de aquellos factores pronósticos y predictores del riesgo del desarrollo de síntomas y/o disfunción ventricular izquierda. A la dificultad en la valoración de la gravedad contribuye el hecho de que no existe un verdadero patrón oro (gold standard) y de que la gravedad depende de las condiciones hemodinámicas en el momento de la evaluación. Históricamente se han empleado el cateterismo cardíaco y la aortografía para valorarla, pero con estos medios no se alcanzaba más que una modesta correlación con los índices cuantitativos. Actualmente, la ecocardiografía Doppler se está empleando como el procedimiento de elección en la evaluación clínica de la gravedad de la IAo integrando toda la información recogida durante la exploración23. En todos los casos, debería realizarse rutinariamente, además del registro de Doppler pulsado del tracto de salida de VI, de la aorta torácica descendente, de la aorta abdominal y el registro Doppler continuo del flujo regurgitante, una evaluación de las dimensiones y función del VI, de la anchura proximal del chorro regurgitante y, si es posible, de la vena contracta en paraesternal eje largo. En aquellos casos en que estos datos sugieran que la IAo es más que ligera se hace imprescindible el empleo de métodos cuantitativos que incluyen el volumen, la fracción y el orificio regurgitante22. Parece increíble que la toma de decisiones quirúrgicas en las regurgitaciones valvulares se siga manteniendo con parámetros clásicos de diámetros obtenidos mediante ecocardiografía en modo M24. De momento, el ecocardiograma 3D no parece una técnica ideal en la valoración de la válvula aórtica, aunque la ETE 3D en tiempo real obtiene con frecuencia imágenes incontrovertibles25.
ConclusionesLa ecocardiografía, sobre todo el ETE, permite una buena valoración de la raíz aórtica, del mecanismo de regurgitación y de su gravedad. La reparación valvular aórtica irá aumentando en frecuencia y eficacia. Para este cambio de paradigma, la evaluación valvular mediante técnicas de imagen ha de ser perfecta; quizás haya que aplicar técnicas de imagen aditivas en el proceso diagnóstico.
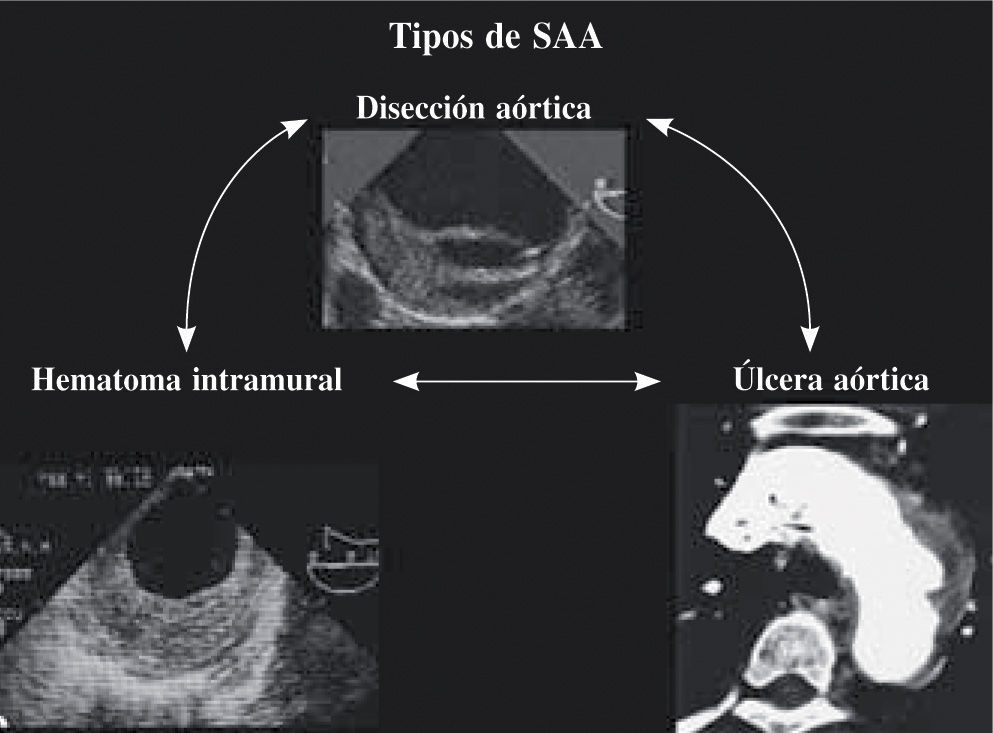
Utilidad de la ecocardiografía en el diagnostico del síndrome aórtico agudoLos síndromes aórticos se clasifican en agudos si hasta el diagnóstico desde el inicio de los síntomas han transcurrido 2 semanas o menos, y crónicos a partir de 2 semanas. El síndrome aórtico agudo (SAA) engloba a un grupo heterogéneo de pacientes con un perfil clínico similar que incluye la úlcera penetrante aórtica, el hematoma intramural y la disección aórtica clásica. El mecanismo fisiopatológico que desencadena la aparición de cada una de estas entidades es diferente. Sin embargo, en algunas ocasiones estas enfermedades se imbrican en un mismo paciente (Fig. 4) y, entonces, es difícil saber cuál fue el mecanismo inicial. La disección aórtica (DA) es un proceso infrecuente con una incidencia de 5–30/106 frente a 4.400/106 del síndrome coronario agudo (0,9% población), presenta una evolución espontánea catastrófica y síntomas dramáticos con un dolor aórtico característico que el paciente no había intuido que pudiera existir. Empieza súbitamente, y a medida que van pasando las horas y los días, si el paciente sobrevive, va menguando en intensidad. Está presente en el 75–90% de los casos. Frecuentemente es pulsátil sincronizado con el latido cardíaco. El pico de incidencia de la DA es la sexta década, y excepcional en pacientes jóvenes no portadores de síndrome de Marfan; es más frecuente en varones (2:1). Estos pacientes presentan una evolución impredecible, y su curso clínico es, en muchas ocasiones, desfavorable26. La mortalidad hospitalaria de los pacientes con DA tipo A manejada quirúrgicamente es del 26% frente a los que no recibían cirugía establecida en el 58%; la DA tipo B tratada médicamente tiene una mortalidad del 10,7 frente al 20% de los que requerían cirugía por complicaciones, cuya mortalidad se incrementaba al 31,4%. La DA tipo A tiene una letalidad inicial por rotura y taponamiento, con una mortalidad de 1%/h en las primeras 48h. Por lo tanto, es fundamental la realización de un diagnóstico precoz. Debido a la gravedad de estas enfermedades y a la necesidad de instaurar un tratamiento médico o quirúrgico precozmente, es fundamental disponer de técnicas diagnósticas rápidas, precisas, y que puedan aplicarse a enfermos en situación crítica. La ecocardiografía, sobre todo el ETE, tiene una gran exactitud, rapidez y disponibilidad, frente a otras técnicas diagnósticas muy precisas (TC helicoidal y RM); la ecocardiografía presenta la ventaja de ser aplicable en cualquier dependencia del hospital (urgencias, cuidados intensivos, quirófanos), sin necesidad de trasladar al paciente, que frecuentemente está en una situación hemodinámica inestable, monitorizado y con medicación endovenosa.
La DA se produce bruscamente, la sangre abandona el canal aórtico normal atravesando un punto de rotura de la íntima («puerta de entrada»), constituyendo un hematoma que puede progresar con rapidez anterógrada o retrógradamente disecando longitudinalmente la parte más interna de la capa media y comprometer en su recorrido colaterales, válvula aórtica, pared aórtica, pericardio y espacio pleural. Se caracteriza desde el punto de vista anatomopatológico por una separación de la capa media aórtica de extensión longitudinal y circunferencial variables. Una porción de esta capa formará junto con la adventicia la pared externa del canal disecante («falsa luz»), y el resto de la capa media junto con la íntima constituye el colgajo intimomedial (flap). La clasificación de Stanford27, que es la más utilizada, las categoriza en tipo A, afectación de la aorta proximal o proximal y distal y tipo B, afectación distal al origen de la subclavia izquierda sin extensión proximal. La afectación es independiente de la localización de la puerta de entrada, que, aunque habitualmente es anterógrada, puede ser en menor frecuencia retrógrada.
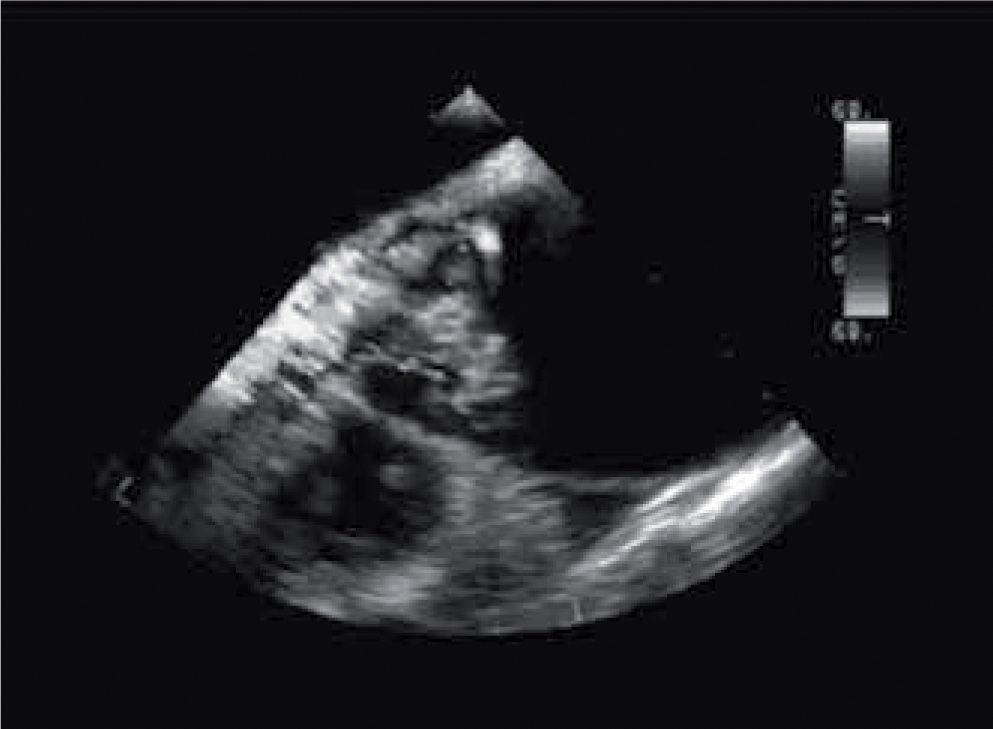
Diagnóstico ecocardiográficoLa división de la capa media es la responsable de los dos signos ecocardiográficos más importantes para el diagnóstico: la presencia del colgajo intimomedial a nivel de la puerta de entrada y la existencia de dos luces o canales aórticos a partir de ahí. El ETT presenta resultados aceptables para el diagnóstico de los SAA, principalmente en la aorta ascendente, pero su utilización en la práctica clínica real ha sido escasa. Actualmente, con las nuevas sondas con imágenes armónicas, se ha incrementado el poder diagnóstico en aorta ascendente y cayado con resultados concluyentes en el 84% de los casos28. Frente a esto, la mayoría de los equipos ecocardiográficos portátiles no producen imágenes de calidad suficiente para el diagnóstico en estas situaciones29. La ETE ha supuesto un avance decisivo en el diagnóstico de la DA (Fig. 5). El primer trabajo que demostró su utilidad fue el estudio multicéntrico europeo publicado en 198930. La sensibilidad fue del 99%, la especificidad del 98%, el valor predictivo positivo del 98%, y el valor predictivo negativo del 99%. Tan sólo hubo un falso negativo en un paciente con una pequeña disección en la raíz aórtica y dos falsos positivos en dos pacientes con ectasia aórtica. Estudios posteriores han confirmado esta exactitud diagnóstica. La baja especificidad de la técnica descrita en algunas series, como la de Nienaber31, se explica por el hecho de considerar como imagen de íntima disecada a la mayoría de las imágenes intraluminales en la aorta ascendente, que incluye muchos artefactos. El grupo del Hospital Vall d'Hebron de Barcelona, uno de los más experimentados del mundo en el diagnóstico de esta enfermedad32, obtiene una sensibilidad y especificidad del 96,8 y 100%, respectivamente.
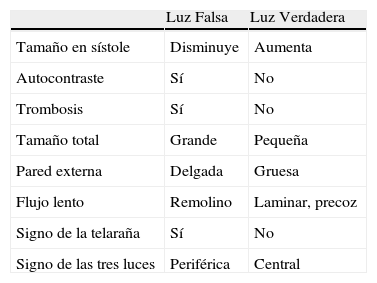
La distinción de la luz falsa y verdadera suele ser fácil (Tabla III). En la mayoría de los casos podemos identificar la luz verdadera por su continuidad con la porción no disecada de la aorta, aunque esto no siempre es posible, particularmente en las disecciones de la aorta torácica descendente y abdominal. La luz falsa suele ser más grande en el 90% de los casos y con flujo más lento y turbulento. El signo de la telaraña (cobweb sign) es exclusivo de la luz falsa, está dado por la presencia de pequeñas imágenes lineales que corresponden a desprendimientos incompletos de la media originados en el momento de la disección. En modo M se evidencia como la íntima se mueve hacia la falsa luz al inicio de la sístole por expansión de la verdadera luz.
Diferencias ecográficas de ambas luces
| Luz Falsa | Luz Verdadera | |
| Tamaño en sístole | Disminuye | Aumenta |
| Autocontraste | Sí | No |
| Trombosis | Sí | No |
| Tamaño total | Grande | Pequeña |
| Pared externa | Delgada | Gruesa |
| Flujo lento | Remolino | Laminar, precoz |
| Signo de la telaraña | Sí | No |
| Signo de las tres luces | Periférica | Central |
La principal limitación diagnóstica del ETE es la disección que afecta únicamente a la aorta ascendente (tipo II). En conjunto, la experiencia acumulada en estos últimos años demuestra que no debe aceptarse como criterio de disección únicamente la presencia de una imagen lineal intraluminal en aorta ascendente. Los diagnósticos falsos positivos pueden ser potencialmente catastróficos dado que el tratamiento de elección de la DA de aorta ascendente es la cirugía. Algunos autores consideran que sólo debería aceptarse el diagnóstico de DA tipo A cuando existen otros hallazgos acompañantes como IAo, puerta de entrada, trombosis intraluminal o derrame pericárdico. No obstante, aunque esto podría aumentar la especificidad, sería a expensas de disminuir considerablemente la sensibilidad de la técnica. En la aorta ascendente, especialmente cuando está dilatada, las imágenes lineales de artefactos son muy frecuentes, observándose en el 44–55% de los estudios32. Pueden aparecer en el plano transversal o en el longitudinal. Aunque mediante sondas multiplanas el 80% de los artefactos son fácilmente diagnosticables, algunos pueden ser difíciles de diferenciar de una íntima disecada. A menudo, los artefactos situados en la raíz aórtica son una reverberación de la pared anterior de la aurícula izquierda. La reverberación se localiza dentro de la luz aórtica cuando el diámetro del vaso es superior al diámetro de la aurícula izquierda. La mitad de los artefactos se producían por este motivo y se localizaban en la raíz aórtica. Utilizando la ecocardiografía modo M puede comprobarse que la imagen lineal reverberante está situada a doble distancia del transductor que la aurícula izquierda, y su desplazamiento es el doble de amplio. Un diámetro de la aorta ascendente superior a 5,0cm, que excede el diámetro de la aurícula izquierda con una relación AI/ AO inferior a 0,6, crea las condiciones acústicas para la reverberación de la interfase aurícula-aorta dentro de la aorta33. Un 40% de los artefactos se localizan en el tercio medio de la aorta ascendente y son debidos a reverberaciones de la pared posterior de la arteria pulmonar derecha. En la mayoría de DA de aorta ascendente, por el contrario, el movimiento de la íntima es libre (83%) y no cumple criterios de reverberación. Los raros casos de DA en que la íntima tiene un movimiento paralelo a la aorta son disecciones retrógradas y se diferencian de los artefactos por su situación dentro de la luz aórtica y su mayor extensión longitudinal. La ETE permite identificar la puerta de entrada en el 78–100% de los casos, suele medir más de 5mm, y acostumbra a localizarse en la parte proximal de la aorta ascendente en las DA tipo A e inmediatamente después de la salida de la arteria subclavia izquierda en las DA tipo B. En ocasiones el ETE no permite visualizar las puertas de entrada localizadas en la parte proximal del arco. El diagnóstico y cuantificación de la gravedad de la IAo puede realizarse correctamente mediante ecocardiografía Doppler tanto por técnica transtorácica como transesofágica. Se ha detectado IAo significativa en el 52% de las DA tipo I, en el 64% de las DA tipo II y en el 8% de las DA tipo III34. Además, el ETE da información de los posibles mecanismos que condicionan la IAo, lo que puede ser de gran ayuda para el cirujano en la decisión de sustituir o reparar la válvula aórtica35. El ecocardiograma detecta con facilidad la presencia de derrame pericárdico, que es un signo inicial de alarma. El ETE está limitado para estudiar gran parte del cayado por interferencia del aire de la tráquea y, por supuesto, para el estudio de los troncos supraaórticos. Toda esta información ecocardiográfica está sólidamente consolidada desde hace más de 10 años; como aportación más reciente hay que destacar la aplicabilidad de las técnicas 3D, sobre todo ETE en tiempo real36, que promete ser de gran utilidad para valorar el tamaño y morfología de la puerta de entrada. Esta información permitirá interpretar mejor la homocinética del flujo de la falsa luz y puede mejorar la utilidad pronóstica de la técnica. La TC es la técnica más utilizada en el diagnóstico de la DA por disponibilidad y precisión. La sensibilidad es superior a 90% y la especificidad del orden de 85% (Tabla IV). La extensión, localización y compromiso de la DA pueden ser determinadas, al igual que signos de alarma. Las limitaciones están relacionadas con el diagnóstico de IAo y con DA discretas. El diagnóstico se fundamenta en la demostración de un colgajo intraaórtico, el cual separa la luz falsa de la verdadera. Otros hallazgos incluyen desplazamiento interno de la íntima calcificada.
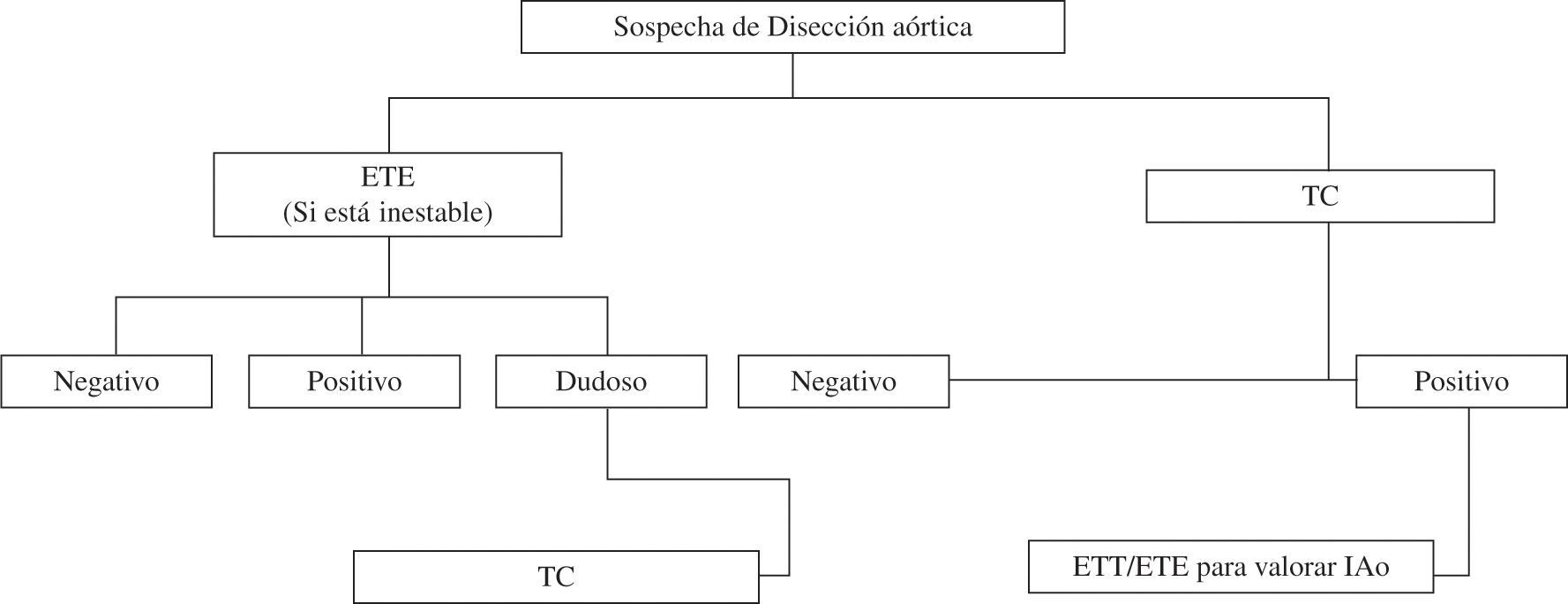
La RM es altamente sensible y específica, pero no está disponible en la mayoría de los servicios de urgencias y tiene limitación en los pacientes inestables. Posee la más alta sensibilidad y especificidad (casi 100%) en todas las formas de DA, excepto las formas discretas. En la estratificación diagnóstica (Fig. 6) la primera prueba a utilizar es la TC o el ETE en caso de paciente crítico o inestable.
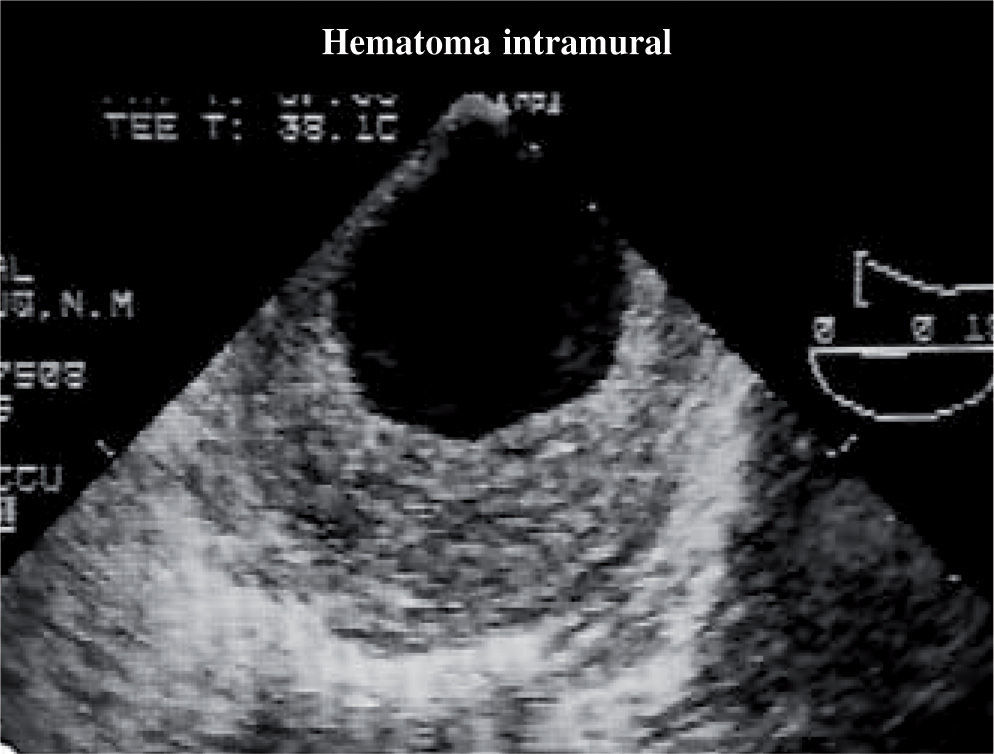
Hematoma intramural aórticoEl hematoma intramural aórtico (HIA) es una de las enfermedades que constituyen el SAA. El diagnóstico mediante ETE se realiza cuando se evidencia en la pared aórtica la presencia de una imagen circular o en semiluna ecolucente y frecuentemente en capas. El grosor de la pared debe ser superior a 7mm y no debe existir flujo en su interior37; antiguamente se denominaban disecciones no comunicantes. El diagnóstico es fácil en los casos típicos (Fig. 7), pero ocasionalmente puede confundirse con la presencia de una trombosis intraluminal o una DA con falsa luz trombosada. Otras técnicas de imagen como la TC, que muestra una zona de señal atenuada, o la RM con una señal hiperintensa, permiten confirmar el diagnóstico. Estas técnicas aportan mejor información en la valoración cronológica del hematoma y en la presencia de hematoma periaórtico38, pero el ETE es la técnica que mejor lo define.
Úlcera penetranteEl diagnóstico de la úlcera penetrante (UP) es controvertido. La presencia de una protrusión sacular por fuera del perfil de la aorta es fácilmente identificable por angiografía y tomografia con contraste. La ETE es menos útil en el diagnóstico de estas imágenes39 protruyentes en el perfil de la aorta, aunque recientemente se ha demostrado su utilidad. No obstante, es de gran valor diagnóstico para diferenciar las UP arterioescleróticas de las UP like-projection secundarias a trombos con cavidades en forma de cráter en su superficie, y de los HIA que evolucionan con disrupción localizada de la íntima. La ausencia de placa arteriosclerótica en la íntima de la pared aórtica debe hacernos sospechar que se trata de una úlcera like-projection y no de una verdadera UP. Las UP también se localizan más frecuentemente en aorta descendente. Tanto el Doppler color como la utilización de contraste ecocardiográfico pueden ser de ayuda al confirmar la presencia de flujo en el interior de la imagen sacular externa a la íntima aórtica.
ConclusionesLa ecocardiografía en todas sus modalidades seguirá siendo una técnica imprescindible y frecuentemente utilizada para valorar la enfermedad aórtica por su resolución, disponibilidad, coste, portabilidad y actual desarrollo tecnológico. La realización e interpretación del ETE en estos casos requiere la presencia de una persona experta, principal mecanismo para evitar los errores de interpretación. A veces se necesita más de una técnica para la correcta valoración del cuadro; la angio-grafía es la técnica con menos peso en el diagnóstico urgente del proceso.