El síndrome de encefalopatía posterior reversible (PRES, en inglés posterior reversible encephalopathy síndrome), se caracteriza por alteraciones neurológicas: cefalea, náuseas, vómito, alteraciones visuales, alteraciones de la conciencia, parestesias o convulsiones. El diagnóstico es clínico-radiológico, ya que los pacientes presentan edema vasogénico de predominio bilateral en la región occipito-parietal en la tomografía axial computarizada de cráneo o resonancia magnética. Los factores de riesgo conocidos incluyen hipertensión arterial, empleo de inmunosupresores, esteroides o quimioterapia. El tratamiento está dirigido a reducir o eliminar los factores desencadenantes. El objetivo de este estudio es determinar los factores de riesgo, describir las características clínico-radiológicas y la evolución en casos estudiados en el Instituto Nacional de Pediatría de la ciudad de México.
MétodoSe revisaron los expedientes clínicos y estudios radiológicos en el Instituto Nacional de Pediatría de enero de 2006 a enero de 2013 de pacientes con diagnóstico probable de PRES. Se realizó el estudio clínico, incluyendo el registro de la presión sanguínea, antecedentes de uso de esteroides, inmunosupresores o quimioterapia. El cuadro clínico puede clasificarse en leve, moderado o severo de acuerdo con la severidad de las manifestaciones. Los hallazgos radiológicos fueron clasificados en 3 grados según la extensión del edema vasogénico en el estudio de imagen.
ResultadosEn 22 pacientes se confirmó el PRES. Todos los pacientes tuvieron un cuadro clínico severo. Siete recibieron inmunosupresores (6 con inhibidores de calcineurina), 12 usaban algún esteroide, y 5 recibieron quimioterapia. Veintiún pacientes tenían el edema vasogénico más allá de la materia blanca.
ConclusiónSe debe realizar una resonancia magnética de cráneo a todo paciente con alguna alteración neurológica que tenga factores de riesgo para PRES, lo cual ayudará a iniciar el tratamiento oportuno para disminuir el riesgo de no reversibilidad o complicaciones.
Posterior reversible encephalopathy syndrome (PRES) is characterized by neurological disorders such as headache, nausea, vomiting, visual disturbances, altered consciousness, paresthesia, or seizures. The diagnosis is clinical and radiological because a predominantly symmetric vasogenic edema in the parietal and occipital lobes is observed in the cranial tomography or in the MRI scans. The risk factors for PRES include, among others, hypertension, use of immunosuppressant drugs, steroids or chemotherapy. The treatment is aimed to reduce or remove the risk factors for PRES. The objective of this study is to determinate the risk factors for PRES, as well as their clinical and radiological characteristics and their evolution.
MethodA review was performed on the clinical and radiographic records of those patients with a probable diagnosis of PRES seen at the National Institute of Pediatrics in Mexico City from January 2006 through January 2013. The neurological symptoms were categorized as mild, moderate, or severe, according to the clinical features of each patient. The radiological findings were classified into three grades, according to the extension of vasogenic edema in the imaging study. Blood pressure, the use of steroids, immunosuppressant drugs or chemotherapy were also analyzed.
ResultsTwenty-two patients were confirmed with PRES. All were classified with severe neurological symptoms. Seven patients received immunosuppressive therapy, (6 with calcineurin inhibitors), 12 with steroids, and 5 also received chemotherapy. Twenty-one patients had vasogenic edema beyond the white matter.
ConclusionAn MRI scan should be performed in all patients with severe hypertension and other risk factor for PRES, which would help to initiate an early treatment to reduce the risk of complications.
El síndrome de encefalopatía posterior reversible (PRES, en inglés posterior reversible encephalopathy síndrome) es un síndrome descrito por primera vez en 1996 por Hinchey et al., quienes observaron en 15 pacientes cefalea, alteración de la conciencia, convulsiones y pérdida de la visión, reversibles en poco tiempo. Un estudio de neuroimagen de los pacientes mostró datos de edema cerebral de predominio en la región posterior del cerebro, lo que dio lugar a la designación de síndrome de leucoencefalopatía posterior reversible1. A partir de los diferentes informes de casos de síndrome de leucoencefalopatía posterior reversible se han sugerido diferentes nomenclaturas como: encefalopatía occipito-parietal reversible, PRES, así como encefalopatía hipertensiva2. El PRES es una patología infrecuente, caracterizada por alteraciones neurológicas: cefalea, alteraciones visuales, alteraciones de la conciencia, parestesias o convulsiones y edema vasogénico en el parénquima cerebral de predominio occipito-parietal. Se observa tanto en la tomografía de cráneo como en la resonancia magnética (RM); por lo tanto, el diagnóstico es clínico-radiológico1-4. Los cambios radiológicos más frecuentes en el PRES se ubican en la sustancia blanca, aunque también pueden afectar al cerebro anterior, la corteza anterior y posterior, el tronco cerebral, el cerebelo o la médula espinal; estas alteraciones pueden ser simétricas o asimétricas. La lesión en la RM se observa como una imagen hipodensa en la secuencia de T1, mientras que en la secuencia de T2, FLAIR y densidad protónica, la lesión se ve como una imagen hiperdensa4-10. Son múltiples los factores causantes del PRES: hipertensión arterial (HTA), el uso de inmunosupresores, administración de dosis altas de esteroides y quimioterapia, entre otros2,4,6-13. El tratamiento está dirigido a la reducción o eliminación de los factores probablemente desencadenantes del síndrome: uso de antihipertensivos si hay hipertensión, anticonvulsivantes en los casos con crisis convulsivas, reducción o suspensión de fármacos que desencadenan el síndrome: inmunosupresores, esteroides, entre otros, con el objetivo de disminuir el riesgo de daño irreversible.
El objetivo de este estudio es determinar los factores de riesgo, describir las características clínico-radiológicas y evolución de los casos estudiados en el Instituto Nacional de Pediatría de la ciudad de México de enero de 2006 a enero de 2013.
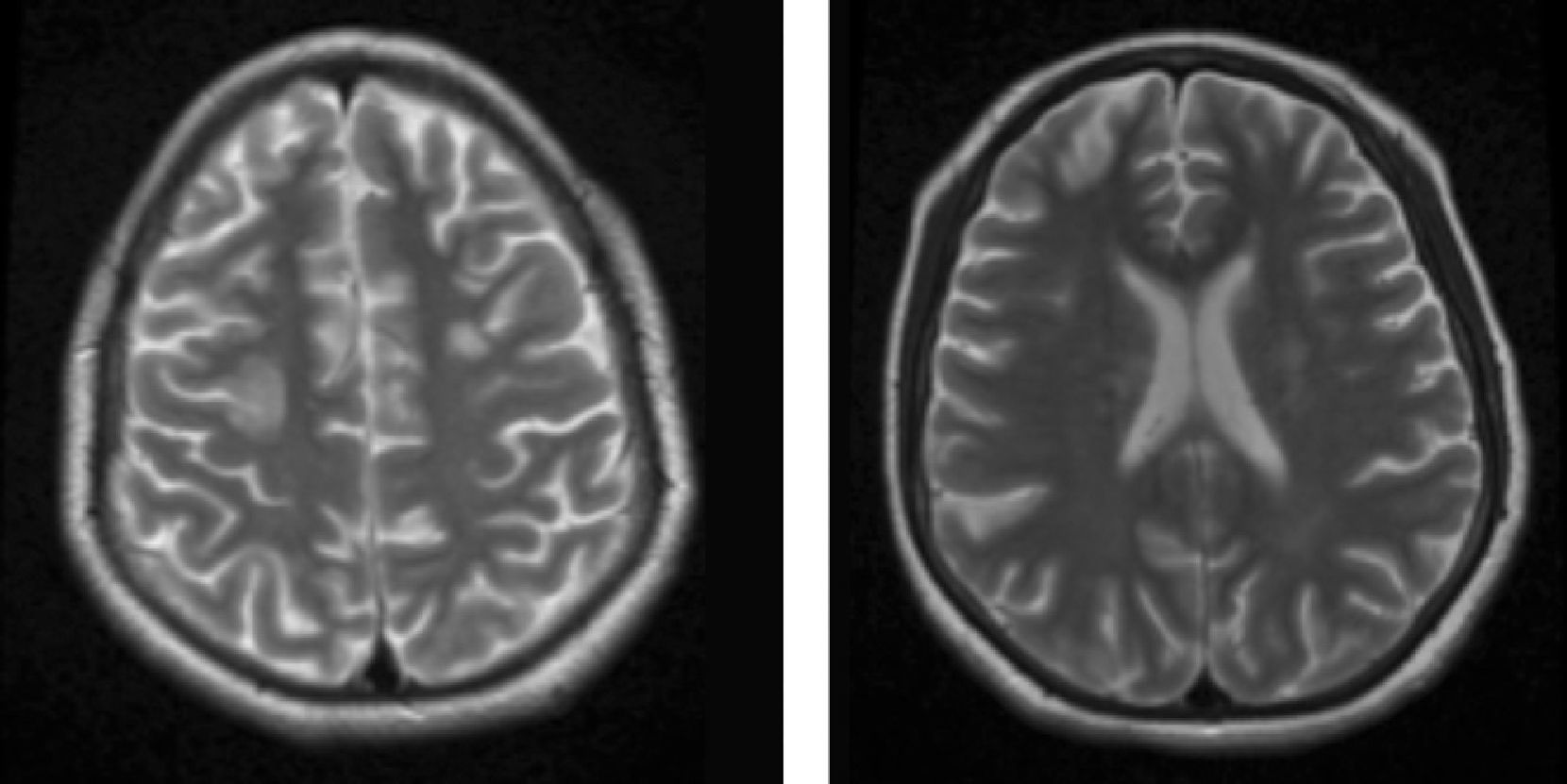
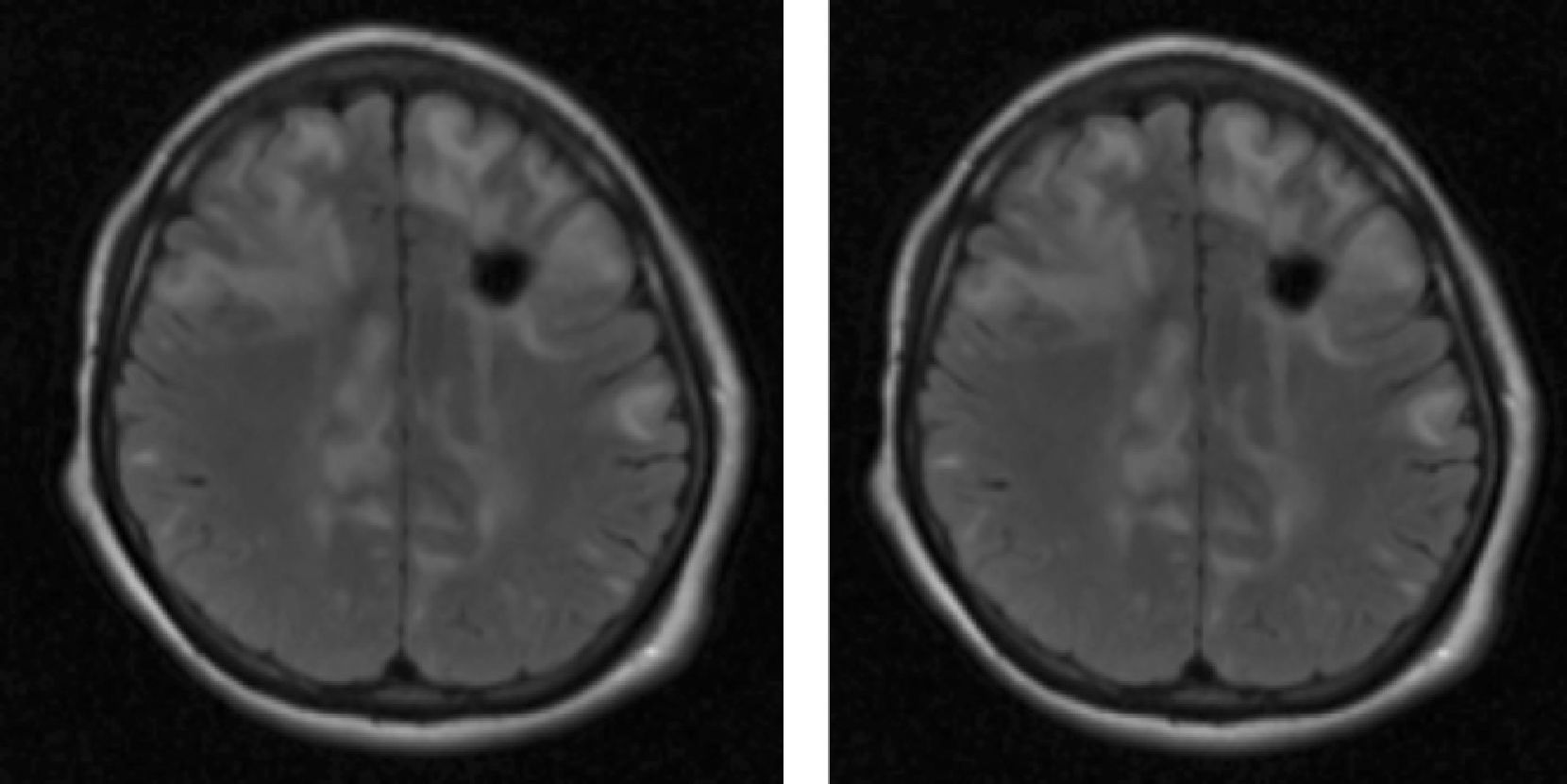
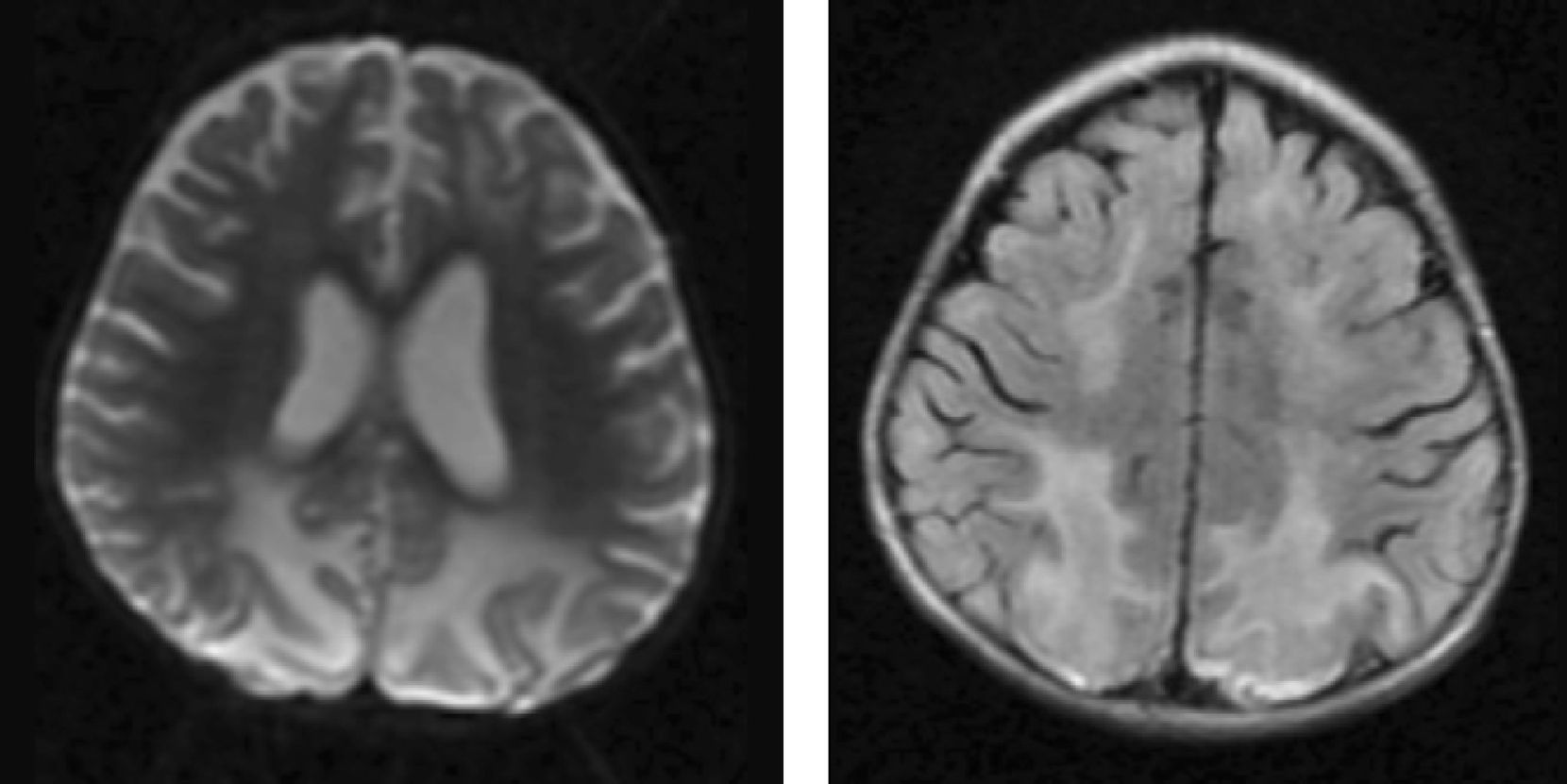
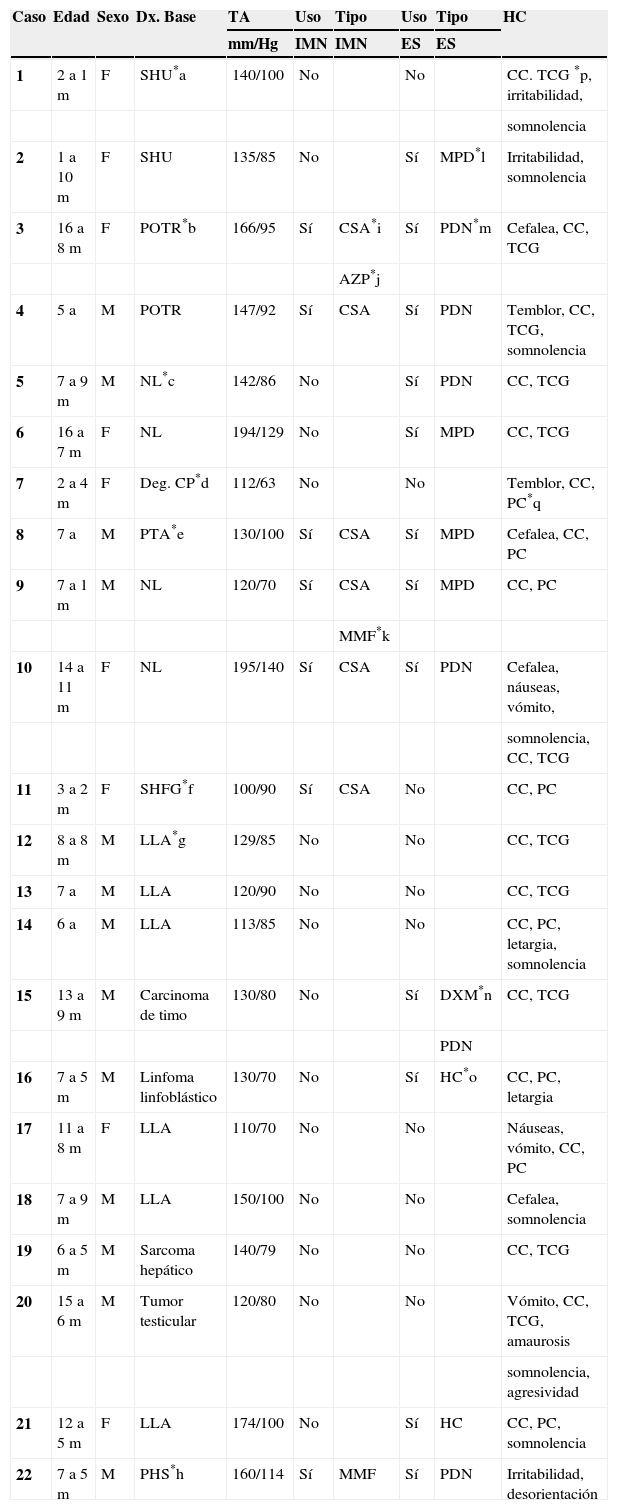
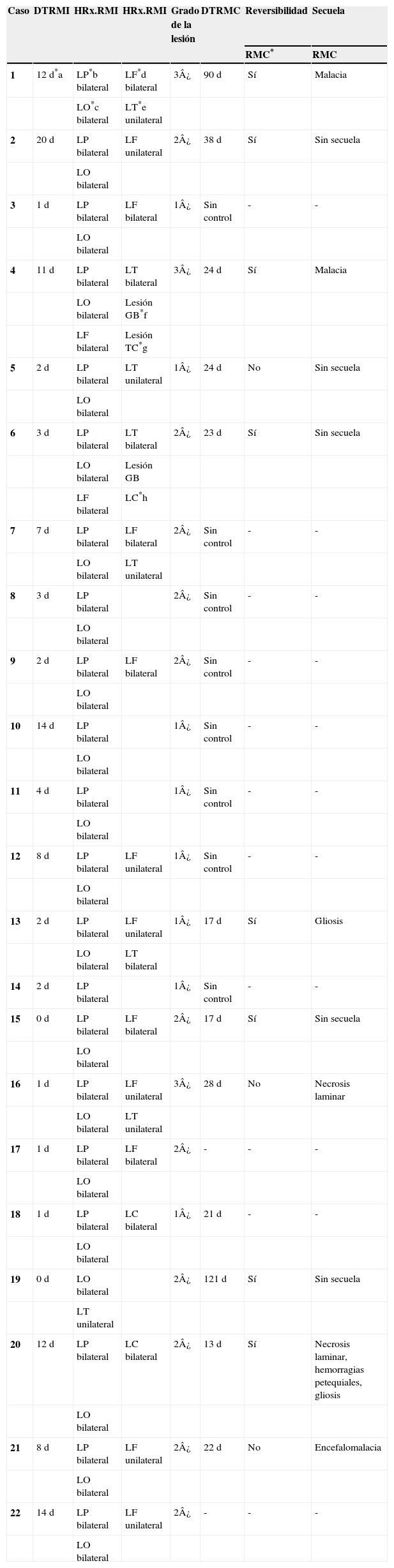
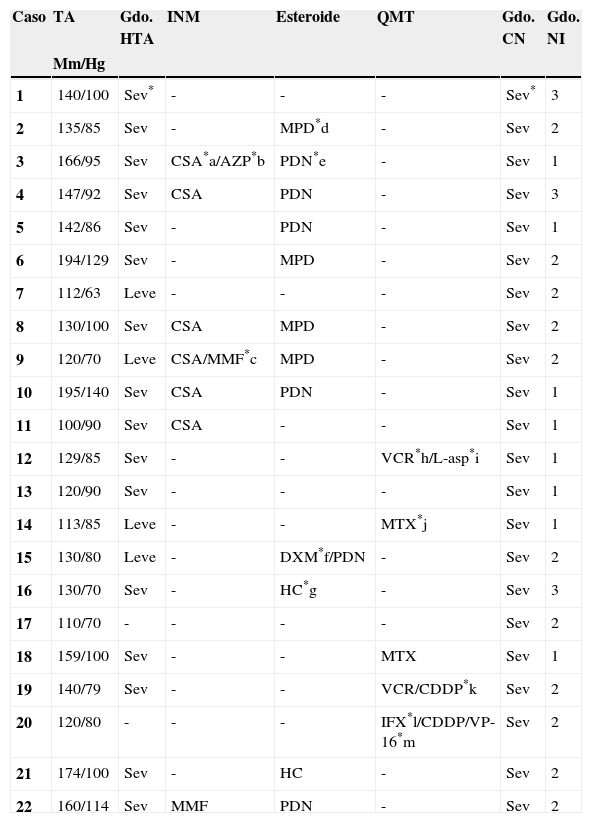
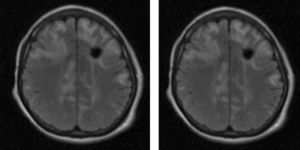
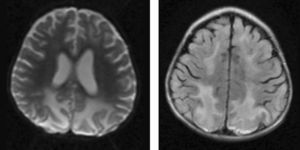
Material y métodosSerie de casos. Se revisaron los expedientes y los estudios de imagen (RM de cráneo) de los pacientes con características clínicas y radiológicas sugestivas de PRES de los Departamentos de Nefrología, Inmunología, Hematología, Oncología y Gastroenterología del Instituto Nacional de Pediatría registrados entre enero de 2006 y enero de 2013. Se encontraron 27 casos en la base de datos con diagnóstico de PRES; sin embargo, solo 22 de ellos cumplieron los criterios clínico-radiológicos para el diagnóstico. Se registraron la edad de los pacientes en el momento del diagnóstico, el sexo, los signos y síntomas tales como HTA, cefalea, náuseas, vómito, alteraciones visuales, parestesias, alteraciones de la conciencia y crisis convulsivas. También se investigaron factores asociados a desarrollar PRES como uso de esteroides, de inmunosupresores o ambos, o haber recibido quimioterapia. El cuadro clínico de cada paciente fue graduado según su severidad, similar a lo realizado en el estudio de Yamada y Ueda13, en el que los signos y síntomas neurológicos fueron clasificados como leves, como cefalea, náuseas, vómito o temblor; moderados, cuando hubo alteraciones visuales, y severos, cuando había alteraciones mentales, síntomas cerebelosos, crisis convulsivas, estupor o coma. La presión arterial fue evaluada y graduada desde el inicio de la presentación del PRES hasta el día que se controló, clasificándose como HTA severa cuando había cifras por encima del percentil 99 para la talla. A todos los pacientes se les realizó RM con las técnicas de T1, T2/FLAIR, difusión y ADC. La realización de RM de control no se pudo hacer a todos. Los hallazgos radiológicos se graduaron como grado 1: cambios sutiles; grado 2: áreas anormales grandes; grado 3: toda la región afectada, tal como lo describieron Yamada y Ueda13 (figs. 1, 2 y 3). Se consignaron los cambios de imagen obtenidos en las RM de control realizadas en diferentes tiempos en cada paciente. Se evaluó la reversibilidad de las lesiones, así como las secuelas en algunos pacientes.
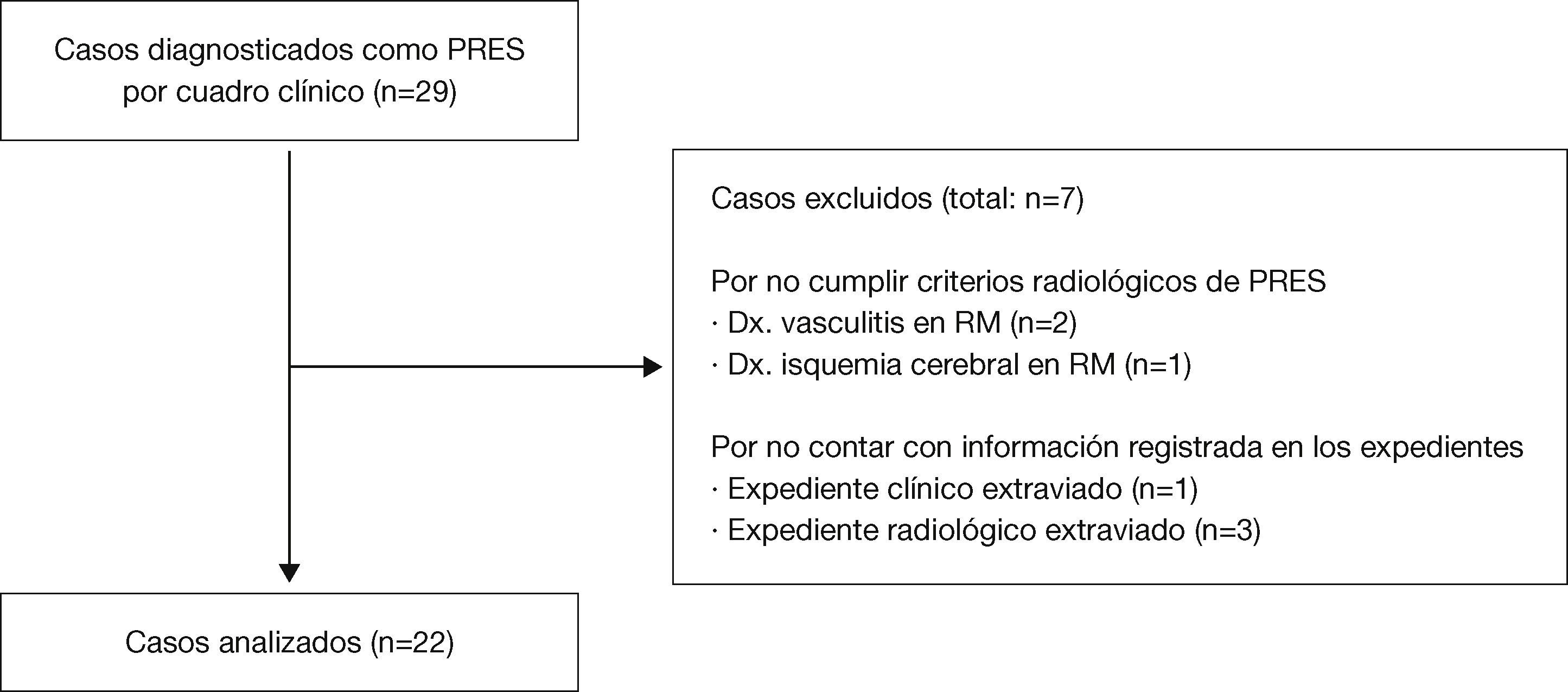
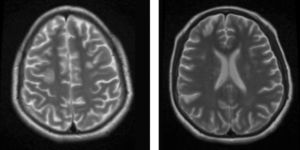
En el Departamento de Radiología e Imagen se registraron 29 pacientes con diagnóstico probable de PRES, a los cuales se les realizó estudio de RM para confirmar el diagnóstico. Veintidós de los 29 expedientes con estudio radiológico reunieron las características del síndrome. De los otros 7, en 3 no se encontraron los estudios de imagen en el archivo radiológico; en otro no se encontró el expediente clínico, y los otros 3 no cumplieron con las características radiológicas de PRES (fig. 4).
Características clínicas y demográficasLa tabla 1 muestra las características clínicas y demográficas de los pacientes. Las enfermedades de base que tenían los pacientes fueron: leucemia linfoblástica aguda en 6 casos, 4 con nefropatía lúpica, 2 postrasplantados de riñón, otros 2 tenían síndrome hemolítico urémico, y se presentó un caso de cada una de las siguientes entidades: carcinoma de timo, degeneración cavernomatosa de la porta, linfoma linfoblástico agudo, púrpura de Henoch-Shönlein, púrpura trombocitopénica autoinmune, sarcoma hepático, síndrome hemofagocítico y tumor testicular. La frecuencia de PRES por servicio de especialidades fue: 32% en Oncología y Nefrología, respectivamente; Hematología, 18%; Inmunología, 14% y Gastroenterología 4.5%. El 59% de los pacientes fueron masculinos. La edad de nuestros pacientes fue desde 1 año y 10 meses hasta 16 años y 7 meses (media de 8.5 años).
Información demográfica, factores de riesgo y hallazgos clínicos de los pacientes con síndrome de encefalopatía posterior reversible
| Caso | Edad | Sexo | Dx. Base | TA | Uso | Tipo | Uso | Tipo | HC |
|---|---|---|---|---|---|---|---|---|---|
| mm/Hg | IMN | IMN | ES | ES | |||||
| 1 | 2 a 1 m | F | SHU*a | 140/100 | No | No | CC. TCG *p, irritabilidad, | ||
| somnolencia | |||||||||
| 2 | 1 a 10 m | F | SHU | 135/85 | No | Sí | MPD*l | Irritabilidad, somnolencia | |
| 3 | 16 a 8 m | F | POTR*b | 166/95 | Sí | CSA*i | Sí | PDN*m | Cefalea, CC, TCG |
| AZP*j | |||||||||
| 4 | 5 a | M | POTR | 147/92 | Sí | CSA | Sí | PDN | Temblor, CC, TCG, somnolencia |
| 5 | 7 a 9 m | M | NL*c | 142/86 | No | Sí | PDN | CC, TCG | |
| 6 | 16 a 7 m | F | NL | 194/129 | No | Sí | MPD | CC, TCG | |
| 7 | 2 a 4 m | F | Deg. CP*d | 112/63 | No | No | Temblor, CC, PC*q | ||
| 8 | 7 a | M | PTA*e | 130/100 | Sí | CSA | Sí | MPD | Cefalea, CC, PC |
| 9 | 7 a 1 m | M | NL | 120/70 | Sí | CSA | Sí | MPD | CC, PC |
| MMF*k | |||||||||
| 10 | 14 a 11 m | F | NL | 195/140 | Sí | CSA | Sí | PDN | Cefalea, náuseas, vómito, |
| somnolencia, CC, TCG | |||||||||
| 11 | 3 a 2 m | F | SHFG*f | 100/90 | Sí | CSA | No | CC, PC | |
| 12 | 8 a 8 m | M | LLA*g | 129/85 | No | No | CC, TCG | ||
| 13 | 7 a | M | LLA | 120/90 | No | No | CC, TCG | ||
| 14 | 6 a | M | LLA | 113/85 | No | No | CC, PC, letargia, somnolencia | ||
| 15 | 13 a 9 m | M | Carcinoma de timo | 130/80 | No | Sí | DXM*n | CC, TCG | |
| PDN | |||||||||
| 16 | 7 a 5 m | M | Linfoma linfoblástico | 130/70 | No | Sí | HC*o | CC, PC, letargia | |
| 17 | 11 a 8 m | F | LLA | 110/70 | No | No | Náuseas, vómito, CC, PC | ||
| 18 | 7 a 9 m | M | LLA | 150/100 | No | No | Cefalea, somnolencia | ||
| 19 | 6 a 5 m | M | Sarcoma hepático | 140/79 | No | No | CC, TCG | ||
| 20 | 15 a 6 m | M | Tumor testicular | 120/80 | No | No | Vómito, CC, TCG, amaurosis | ||
| somnolencia, agresividad | |||||||||
| 21 | 12 a 5 m | F | LLA | 174/100 | No | Sí | HC | CC, PC, somnolencia | |
| 22 | 7 a 5 m | M | PHS*h | 160/114 | Sí | MMF | Sí | PDN | Irritabilidad, desorientación |
Dx. base: diagnóstico de base; TA: tensión arterial; Uso IMN: uso de inmunosupresores; Tipo INM: tipo de inmunosupresores; Uso ES: uso de esteroides; Tipo ES: tipo de esteroides; HC: hallazgos clínicos.
*a síndrome hemolítico urémico; *b posoperado de trasplante renal; *c nefropatía lúpica; *d degeneración cavernomatosa de la Porta; *e púrpura trombocitopénica autoinmune; *f síndrome hemofagocítico; *g leucemia linfoblástica aguda; *h púrpura de Henoch-Schönlein; *i ciclosporina A; *j azatioprina; *k micofenolato de mofetilo; *l metilprednisolona; *m prednisona; *n dexametasona; *o hidrocortisona; *p crisis convulsiva tónico clónico generalizadas; *q crisis convulsiva parcial compleja.
El cuadro clínico más común fue el de las crisis convulsivas en 86.3%, seguido de alteraciones de la conciencia (45.5%), cefalea (22.7%), náuseas/vómito (13.6%), temblores (9%) y alteraciones visuales (4.5%) (tabla 1). Las crisis convulsivas generalizadas se presentaron en 10 pacientes, 9 de los cuales la presentaron de tipo focal. No hubo recurrencia de las crisis convulsivas en ningún paciente. La imagen hiperdensa en la secuencia de T2/FLAIR se observó con mayor frecuencia en los lóbulos parietales y occipitales (21 pacientes) de manera bilateral en 20 casos. Otras áreas afectadas fueron los lóbulos frontales y temporales en 14 y 8 pacientes, respectivamente. Los ganglios cerebrales, el cerebelo y el tallo cerebral estuvieron menos involucrados. La reversibilidad de la lesión solo se pudo evaluar en 11 pacientes (50%) ya que no a todos se les realizó la RM de control. Ocho presentaron reversibilidad de la lesión (edema vasogénico), aunque en 4 de ellos se observó algún tipo de secuela del parénquima cerebral; de los 3 pacientes en quienes no se confirmó reversibilidad del edema vasogénico en la RM de control, 2 ya tenían algún tipo de secuela en el parénquima, como necrosis laminar y encefalomalacia (tabla 2).
Hallazgos radiológicos en la resonancia magnética de los pacientes con síndrome de encefalopatía posterior reversible
| Caso | DTRMI | HRx.RMI | HRx.RMI | Grado de la lesión | DTRMC | Reversibilidad | Secuela |
|---|---|---|---|---|---|---|---|
| RMC* | RMC | ||||||
| 1 | 12 d*a | LP*b bilateral | LF*d bilateral | 3¿ | 90 d | Sí | Malacia |
| LO*c bilateral | LT*e unilateral | ||||||
| 2 | 20 d | LP bilateral | LF unilateral | 2¿ | 38 d | Sí | Sin secuela |
| LO bilateral | |||||||
| 3 | 1 d | LP bilateral | LF bilateral | 1¿ | Sin control | - | - |
| LO bilateral | |||||||
| 4 | 11 d | LP bilateral | LT bilateral | 3¿ | 24 d | Sí | Malacia |
| LO bilateral | Lesión GB*f | ||||||
| LF bilateral | Lesión TC*g | ||||||
| 5 | 2 d | LP bilateral | LT unilateral | 1¿ | 24 d | No | Sin secuela |
| LO bilateral | |||||||
| 6 | 3 d | LP bilateral | LT bilateral | 2¿ | 23 d | Sí | Sin secuela |
| LO bilateral | Lesión GB | ||||||
| LF bilateral | LC*h | ||||||
| 7 | 7 d | LP bilateral | LF bilateral | 2¿ | Sin control | - | - |
| LO bilateral | LT unilateral | ||||||
| 8 | 3 d | LP bilateral | 2¿ | Sin control | - | - | |
| LO bilateral | |||||||
| 9 | 2 d | LP bilateral | LF bilateral | 2¿ | Sin control | - | - |
| LO bilateral | |||||||
| 10 | 14 d | LP bilateral | 1¿ | Sin control | - | - | |
| LO bilateral | |||||||
| 11 | 4 d | LP bilateral | 1¿ | Sin control | - | - | |
| LO bilateral | |||||||
| 12 | 8 d | LP bilateral | LF unilateral | 1¿ | Sin control | - | - |
| LO bilateral | |||||||
| 13 | 2 d | LP bilateral | LF unilateral | 1¿ | 17 d | Sí | Gliosis |
| LO bilateral | LT bilateral | ||||||
| 14 | 2 d | LP bilateral | 1¿ | Sin control | - | - | |
| 15 | 0 d | LP bilateral | LF bilateral | 2¿ | 17 d | Sí | Sin secuela |
| LO bilateral | |||||||
| 16 | 1 d | LP bilateral | LF unilateral | 3¿ | 28 d | No | Necrosis laminar |
| LO bilateral | LT unilateral | ||||||
| 17 | 1 d | LP bilateral | LF bilateral | 2¿ | - | - | - |
| LO bilateral | |||||||
| 18 | 1 d | LP bilateral | LC bilateral | 1¿ | 21 d | - | - |
| LO bilateral | |||||||
| 19 | 0 d | LO bilateral | 2¿ | 121 d | Sí | Sin secuela | |
| LT unilateral | |||||||
| 20 | 12 d | LP bilateral | LC bilateral | 2¿ | 13 d | Sí | Necrosis laminar, hemorragias petequiales, gliosis |
| LO bilateral | |||||||
| 21 | 8 d | LP bilateral | LF unilateral | 2¿ | 22 d | No | Encefalomalacia |
| LO bilateral | |||||||
| 22 | 14 d | LP bilateral | LF unilateral | 2¿ | - | - | - |
| LO bilateral |
DTRMI: días transcurridos para la toma de RM inicial; HRx.RMI: hallazgos radiológicos de RM inicial; DTRMC: días transcurridos para la toma de RM de control; RMC*: RM de control; TC: tomografía computarizada.
*a días; *b lesión parietal; *c lesión occipital; *d lesión frontal; *e lesión temporal; *f lesión en ganglios basales; *g lesión en tallo cerebral; *h lesión cerebelo.
Ningún paciente tenía historia previa de HTA. De los 22 pacientes, 20 tuvieron presión arterial alta, de los cuales el 80% fueron clasificados con HTA severa (tabla 3). La mediana de la presión sistólica y diastólica fue: 132.5 y 88mmHg.
Factores predisponentes de síndrome de encefalopatía posterior reversible. Graduación de hipertensión arterial, cuadro clínico y radiológico
| Caso | TA | Gdo. HTA | INM | Esteroide | QMT | Gdo. CN | Gdo. NI |
|---|---|---|---|---|---|---|---|
| Mm/Hg | |||||||
| 1 | 140/100 | Sev* | - | - | - | Sev* | 3 |
| 2 | 135/85 | Sev | - | MPD*d | - | Sev | 2 |
| 3 | 166/95 | Sev | CSA*a/AZP*b | PDN*e | - | Sev | 1 |
| 4 | 147/92 | Sev | CSA | PDN | - | Sev | 3 |
| 5 | 142/86 | Sev | - | PDN | - | Sev | 1 |
| 6 | 194/129 | Sev | - | MPD | - | Sev | 2 |
| 7 | 112/63 | Leve | - | - | - | Sev | 2 |
| 8 | 130/100 | Sev | CSA | MPD | - | Sev | 2 |
| 9 | 120/70 | Leve | CSA/MMF*c | MPD | - | Sev | 2 |
| 10 | 195/140 | Sev | CSA | PDN | - | Sev | 1 |
| 11 | 100/90 | Sev | CSA | - | - | Sev | 1 |
| 12 | 129/85 | Sev | - | - | VCR*h/L-asp*i | Sev | 1 |
| 13 | 120/90 | Sev | - | - | - | Sev | 1 |
| 14 | 113/85 | Leve | - | - | MTX*j | Sev | 1 |
| 15 | 130/80 | Leve | - | DXM*f/PDN | - | Sev | 2 |
| 16 | 130/70 | Sev | - | HC*g | - | Sev | 3 |
| 17 | 110/70 | - | - | - | - | Sev | 2 |
| 18 | 159/100 | Sev | - | - | MTX | Sev | 1 |
| 19 | 140/79 | Sev | - | - | VCR/CDDP*k | Sev | 2 |
| 20 | 120/80 | - | - | - | IFX*l/CDDP/VP-16*m | Sev | 2 |
| 21 | 174/100 | Sev | - | HC | - | Sev | 2 |
| 22 | 160/114 | Sev | MMF | PDN | - | Sev | 2 |
TA: tensión arterial, Gdo. HTA: grado de hipertensión arterial, INM: inmunosupresor, QMT: quimioterapia, Gdo. CN: grado de cuadro neurológico, Gdo. NI: grado de neuroimagen. * Severo;*a ciclosporina, *b azatioprina; *c micofenolato de mofetilo; *d metilprednisolona; *e prednisona; *f dexametasona; *g hidrocortisona; *h vincristina; *i L-aspart; *j metotrexato; *k cisplatino; *l ifosfamida; *m etoposido.
Seis pacientes (27.2%) recibían inhibidores de calcineurina (ciclosporina) en el momento de presentar el PRES, 2 de ellos en combinación con otro inmunosupresor, azatioprina y micofenolato, respectivamente. Doce pacientes (54.5%) recibían esteroides cuando presentaron el síndrome, 4 de ellos con metilprednisolona en forma de pulsos; el resto recibió prednisona, dexametasona o hidrocortisona a razón de 1mg/kg/día. Cinco pacientes (22.7%) recibieron quimioterapia antes de presentar el síndrome de PRES, 2 con metotrexato, uno con vincristina/L-aspart, otro con vincristina/cisplatino y el último con etoposido/cisplatino/ifosfamida. Todos fueron clasificados con cuadro clínico severo debido a que tenían algún tipo de alteración de la conciencia. El grado de la lesión en la RM de 11 pacientes se catalogó como grado 2 (50%); 8 (36.3%) como grado 1 y 3 como grado 3 (13.6%).
No hubo asociación estadísticamente significativa entre las variables de edad y sexo con el grado de la lesión en la RM, así como con el grado de lesión con secuelas. Tampoco se observó alguna asociación del grado de la lesión o las secuelas con el número de factores de riesgo de los pacientes para desarrollar PRES.
DiscusiónEl PRES es raro. No se conoce su incidencia o prevalencia en la población pediátrica ni de adultos. Debido a que el cuadro clínico es variado, agudo o subagudo, con signos y síntomas desde sutiles hasta severos, es posible que se esté infradiagnosticando, ya que en casos con características clínicas como cefalea o náuseas como únicos síntomas, probablemente no se les practique una RM de rutina5,14.
En 1897, Vazquez y Nobecourt hicieron la primera descripción de alteraciones neurológicas asociadas al embarazo, pero no fue hasta 1928 cuando se describió la encefalopatía hipertensiva por Oppenheimer y Fishberg15,16. Posteriormente, Tamaki et al.15-17 describieron la disminución del flujo cerebral, precedida por disfunción de la barrera hematoencefálica y el consecuente edema cerebral, como ocurre en el PRES. Durante los últimos años, ha habido controversia en cuanto a la utilización del nombre de encefalopatía hipertensiva o síndrome de leucoencefalopatía posterior reversible para este cuadro de alteraciones neurológicas, ya que el cuadro clínico y radiológico es similar; sin embargo, a partir de que Hinchey et al. describieron otras causas que pueden desarrollar este cuadro clínico-radiológico, como las enfermedades renales, oncológicas, hematológicas, inmunológicas, uso de inmunosupresores, los esteroides, principalmente en dosis altas, el tratamiento con quimioterapia, así como la HTA, que aunque en la mayoría de los casos es de tipo severa, esta puede ocurrir hasta en el 20% de los casos sin hipertensión o con hipertensión leve; por eso, Hinchey et al. decidieron nombrar esta patología como leucoencefalopatía posterior reversible y no como encefalopatía hipertensiva1,2. Casey et al. propusieron modificar dicha nomenclatura en el 2000 por encefalopatía posterior reversible (PRES) debido a que encontraron que no solo se podía presentar en la materia blanca, sino también en la materia gris3. En vista de lo descrito anteriormente, en este estudio los pacientes tenían enfermedades renales, oncológicas, inmunológicas o hematológicas en su mayoría (solo uno correspondía al área de gastroenterología por degeneración cavernomatosa de la vena porta). Se propusieron diferentes hipótesis de mecanismos fisiopatológicos para este síndrome: la primera se relacionó con la HTA. Actualmente, lo más aceptado es que este síndrome se manifieste como edema vasogénico más que ante un citotóxico, o bien que, en algunos casos pudieran coexistir ambos problemas. En esta hipótesis se propone que el mecanismo fisiopatológico se produce debido a una pérdida de la autorregulación cerebral que conduce a una vasodilatación arteriolar y disfunción endotelial con alteración de la barrera hematoencefálica y trasudado capilar. Se acumulan plasma y células en el espacio extracelular, principalmente en la sustancia blanca4,10,12,18-23. Por otro lado, el mecanismo fisiopatológico del PRES relacionado con el uso de inmunosupresores, principalmente calcineurínicos como la ciclosporina, los citotóxicos o ambos, es aún más incierto. Sin embargo, se ha pensado que estos fármacos pueden tener un efecto tóxico directo sobre el endotelio vascular y originar vasoespasmo, reducción de la perfusión tisular, activación de la cascada de la coagulación y a su vez extravasación de líquido4,5,7,10,19.
Yamada et al.13 investigaron la asociación de la severidad del cuadro clínico de PRES y sus secuelas con la edad y el sexo del paciente. Observaron que los más jóvenes tuvieron mayor recurrencia de crisis convulsivas, y que los síntomas neurológicos fueron más severos en pacientes del sexo femenino; sin embargo, estos datos no fueron estadísticamente significativos ya que la muestra del estudio fue muy pequeña (11 casos). En nuestro estudio predominó el sexo masculino en un 59% y no hubo relación con la severidad del cuadro clínico, ya que todos los pacientes fueron clasificados con cuadro clínico severo. De los pacientes menores de 5 años, 3 tenían un grado 3 de la lesión en la RM, y algún tipo de secuela en la RM de control, lo que podría sugerir que en este grupo de edad pueden tener mayor edema cerebral, así como mayor riesgo de una secuela; sin embargo, otros 2 pacientes del mismo grupo de edad tuvieron grados 1 y 2 de la lesión, respectivamente y sin secuelas. No se encontró relación del grado de la lesión con secuelas, ya que de los 6 pacientes con secuela, 3 tenían edema grado 3. De los factores predisponentes, casi todos los pacientes tuvieron más de un factor para desarrollar PRES, y casi todos presentaron algún tipo de enfermedad que se ha relacionado a este síndrome. Por otro lado, el 90% de los casos tuvieron HTA, el 80% de los cuales fue de tipo severo. Otros factores fueron el uso de inmunosupresores en 8 pacientes, algún tipo de esteroide en 12 pacientes y antecedente de quimioterapia en 5. Solo un paciente tenía como único factor su enfermedad: leucemia linfoblástica aguda, que pudo estar relacionada con su alteración inmunológica. Con esto podemos confirmar que esta entidad es de origen multifactorial, por lo que la nomenclatura más correcta es PRES.
Entre los inmunosupresores más relacionados con el desarrollo del PRES destacan los inhibidores de la calcineurina, principalmente la ciclosporina, por su efecto tóxico sobre el endotelio; seis de nuestros 7 pacientes con inmunosupresores recibieron ciclosporina1,3,4,8,10. La presentación clínica más frecuente fue con crisis convulsivas, principalmente de tipo clónico generalizadas, o bien se inició como parcial compleja y evolucionó a generalizada, pudiendo estar relacionadas en su mayoría con HTA2,4,10,23. De los casos que tuvieron crisis convulsivas, 52% iniciaron como tónico-clónicas generalizadas y el resto como parcial compleja, aunque todas evolucionaron a tónico-clónicas generalizadas.
El edema vasogénico observado en el cráneo, sea a través de RM o tomografía axial computarizada, se observa con más frecuencia en la región posterior de los hemisferios cerebrales, principalmente parieto-occipital y de manera bilateral; no obstante, existen casos que lo presentan además en cerebelo, tallo cerebral, ganglios basales, entre otras áreas. También puede presentarse de manera asimétrica y se le llama PRES atípico3,7,12,15,19-22. De nuestros 22 pacientes, 18 tuvieron edema vasogénico más allá de la región occipito-parietal, en su mayoría bilateral; solo 4 tuvieron edema limitado a la región posterior como lo describe la literatura con mayor frecuencia. Aunque todos presentaron reversibilidad de los síntomas neurológicos de manera temprana, al revisar la RM de control a los 11 pacientes que contaban con ella, en 3 no se observó reversibilidad del edema vasogénico y 2 de ellos ya tenían secuelas como encefalomalacia y necrosis laminar, por lo que es importante realizar la RM de control para evaluar el daño parenquimatoso que pudiera quedar a pesar de considerarse que es un síndrome reversible en la mayoría de los casos. Asimismo, es importante que a los pacientes que hayan cursado con PRES se les realice una exploración neurológica completa, debido a lesiones que puedan quedar en el parénquima.
ConclusiónEl PRES no es una entidad diferente a lo que se conocía como encefalopatía hipertensiva, sino una entidad patológica de causa multifactorial y no solo por hipertensión. Una vez identificado este síndrome, es imprescindible iniciar un tratamiento oportuno: control de la tensión arterial, disminución o retiro de inmunosupresores o esteroides, uso de anticonvulsivantes, entre otros, para reducir el riesgo de daño irreversible.
Esta entidad puede o no ser similar a una encefalopatía hipertensiva, excepto que el PRES es multifactorial, ya que además de la hipertensión y los cambios neurológicos subyacentes a las crisis convulsivas, se relaciona con la administración de inmunosupresores en enfermedades que los requieren: tacrolimus o ciclosprina (calcineurínicos). Lo importante en esta entidad es realizar estudios de imagen para identificar eventos vasculares cerebrales; si no existen, es necesario ajustar el tratamiento o retirarlo y controlar la HTA.