Las guías de práctica clínica subrayan la importancia de valorar la morfología del flujo Doppler para estimar la severidad de la estenosis aórtica (EA). Nuestro objetivo fue evaluar el ratio tiempo de aceleración/tiempo de eyección (TA/TE) como valor pronóstico en esta entidad.
MétodosAquellos pacientes evaluados en nuestro laboratorio de ecocardiografía entre enero de 2013 y julio de 2016, con EA severa (área valvular <1cm2), fueron incluidos. Se analizó en la curva Doppler continuo del flujo aórtico el tiempo desde el inicio al punto de máxima velocidad (tiempo de aceleración) y el tiempo total de eyección, para posteriormente estimar el cociente TA/TE. El objetivo primario fue un end-point combinado de muerte cardiovascular o reemplazo valvular aórtico.
ResultadosSe incluyeron 197 pacientes con EA severa (55% mujeres, edad media de 76±8años). Se consiguió el seguimiento en 190 pacientes (96%): durante un seguimiento medio de 223±156días, 110 pacientes (58%) alcanzaron el objetivo primario; 70 pacientes (37%) fueron intervenidos quirúrgicamente, 8 pacientes (4%) por vía percutánea, y 33 pacientes (17%) fallecieron de causa cardiovascular. Los pacientes con TA/TE mayor de 0,35 tuvieron más eventos cardiovasculares (66% vs. 41%, p=0,008). Hubo una tendencia no significativa a menor supervivencia libre de eventos por la curva de Kaplan-Meier en pacientes con TA/TE mayor de 0,35 (284±25 vs. 350±32días, p=0,07). En el análisis multivariante por regresión de Cox solo el área valvular (p=0,03), la fibrilación auricular (p=0,02), la presencia de síntomas (p<0,001) y TA/TE (p=0,04) fueron factores predictores independientes del end-point combinado.
ConclusiónEl ratio TA/TE puede ayudar a identificar pacientes con mayor severidad de EA. Los valores mayores de TA/TE se asociaron a mayor incidencia de sustitución valvular aórtica y/o mortalidad cardiovascular.
Guidelines underline the importance of assessment of aortic flow waveform morphology to estimate aortic stenosis (AS) severity. Our aim was to evaluate acceleration time/ejection time ratio (AT/ET) as prognostic value in this disease.
MethodsBetween January 2013 and July 2016, patients with severe AS (aortic valve area <1cm2) who came to our echocardiography laboratory were included. We analyzed in the aortic flow in continuos Doppler wave the time between the onset and the peak velocity (acceleration time), and total ejection time, and then acceleration time/ejection time ratio was calculated. The primary end-point was a combined one of cardiovascular death or aortic valve replacement.
ResultsOne hundred and ninety-seven patients with severe AS were included (55% women, mean age 76±8years). Complete follow-up was achieved in 190 patients (96%): during a mean follow-up of 223±156days, 110 patients (58%) reached the primary endpoint; 70 patients (37%) were surgically operated, 8 patients (4%) percutaneous replacement, 33 patients (17%) suffered from cardiovascular death. Patients with AT/ET higher than 0.35 had more cardiovascular events (66% vs. 41%, P=.008). There was a non-significant trend to lower free-events survival by Kaplan-Meier method in patients with AT/ET higher than 0.35 (284±25 vs. 350±32days, P=.07). In multivariate analysis by Cox regression, only aortic valve area (P=.03), atrial fibrillation (P=.02), symptomatic status (P<.001) and AT/ET (P=.04) were independent predictors of combined end-point.
ConclusionAT/ET ratio could help to identify patients with more severe AS. Higher values of AT/ET ratio were associated with higher incidence of aortic valve replacement and/or cardiovascular death.
La estenosis aórtica (EA) es la valvulopatía más prevalente en países desarrollados1,2. El ecocardiograma es considerado la piedra angular del diagnóstico en las valvulopatías3. El área valvular (AVA) estimada por ecuación de continuidad es un parámetro estándar en la evaluación ecocardiográfica de la EA4, ya que se ha validado en estudios clínicos y experimentales5,6.
Sin embargo, las discordancias entre la severidad estimada por el AVA por ecuación de continuidad y los gradientes transvalvulares se han detectado en entre un 24 y un 38% de los pacientes con EA7-10. Las guías de práctica clínica recomiendan la evaluación de la morfología de la curva Doppler, si bien no establecen un parámetro objetivo11.
Nuestro objetivo fue evaluar el valor pronóstico del ratio tiempo de aceleración/tiempo de eyección (TA/TE) medido en la curva Doppler continuo del flujo aórtico, en pacientes con EA severa.
MétodosIncluimos de manera prospectiva 197 pacientes entre enero de 2013 y julio de 2016 con estenosis valvular aórtica nativa severa (AVA <1cm2). Se establecieron como criterios de exclusión: edad <18años, ventana acústica subóptima, insuficiencia aórtica moderada o severa, enfermedad valvular mitral o tricuspídea moderada o severa concomitante, EA subvalvular o supravalvular (definida como velocidad máxima >1,5m/s), cardiopatías congénitas (a excepción de válvula aórtica bicúspide) y un diámetro de aorta ascendente menor de 25mm.
El protocolo del estudio fue aprobado por el comité ético de nuestro centro y los participantes dieron su consentimiento verbal a la participación en el mismo.
Datos clínicosLos datos demográficos, factores de riesgo y analíticos se obtuvieron de la historia clínica de los pacientes. También se realizó una entrevista clínica en el momento del examen ecocardiográfico para obtener información sobre el estado clínico de los pacientes. Aquellos que manifestaran angina, síncope, insuficiencia cardiaca congestiva o disnea de esfuerzo ≥II de la NYHA se consideró que tenían síntomas atribuibles a la EA.
Examen ecocardiográficoEl ecocardiograma transtorácico bidimensional y Doppler fueron llevados a cabo mediante sonógrafos equipados con transductores de 2,5-3,5MHz (iE33; Phillips Medical Systems, Best, Países Bajos) por dos cardiólogos (S.G.C y E.D.R.) acreditados en la realización de ecocardiografía transtorácica por la European Society of Cardiology.
Las medidas de los volúmenes ventriculares y la fracción de eyección se realizaron de acuerdo con las recomendaciones de la American Society of Echocardiography11. El plano paraesternal eje largo con zoom se usó para la estimación del diámetro del anillo aórtico en protosístole. Se empleó el Doppler pulsado a 1cm por debajo del plano valvular para la estimación de la integral tiempo-velocidad (ITV) del tracto de salida del ventrículo izquierdo. Se empleó el Doppler continuo tanto en el plano apical de 5 cámaras como en el paraesternal derecho para estimar los mayores gradientes a través de la válvula aórtica. El AVA fue posteriormente calculada usando la ecuación de continuidad. Se estimó el AVA indexada como el cociente AVA/superficie corporal. El gradiente transvalvular medio se obtuvo con el uso de la ecuación modificada de Bernoulli. El ratio ITV, una simplificación de la ecuación de continuidad, se calculó mediante la ITV del tracto de salida ventricular izquierdo/ITV aórtico.
Se tomó la presión arterial de todos los pacientes en el momento del examen ecocardiográfico. Así, se calculó posteriormente la pérdida de trabajo sistólico como (100*gradiente medio)/(gradiente medio+presión arterial sistólica)12.
Un ecocardiograma de estrés con dobutamina se realizó en casos de AVA<1cm2, gradiente medio <40mmHg y FEVI <50%4. Una infusión intravenosa de dobutamina a baja dosis se llevó a cabo tras el estudio basal, desde 5μg/kg de peso hasta 20μg/kg, incrementándose progresivamente 5μg/kg cada 5 min13. Se suspendió el tratamiento con β-bloqueantes 24h antes del examen ecocardiográfico. Se estimaban los gradientes, el AVA, el ratio ITV y la presión arterial del paciente en cada estadio del protocolo. Se consideró EA severa en caso de velocidad máxima aórtica >4m/s o gradiente medio >40mmHg, y con un AVA menor de 1cm2 durante el ecocardiograma de estrés4.
Todas las medidas representan una media de al menos 3 ciclos cardiacos si el paciente se encuentra en ritmo sinusal, o 5 si el ritmo es diferente.
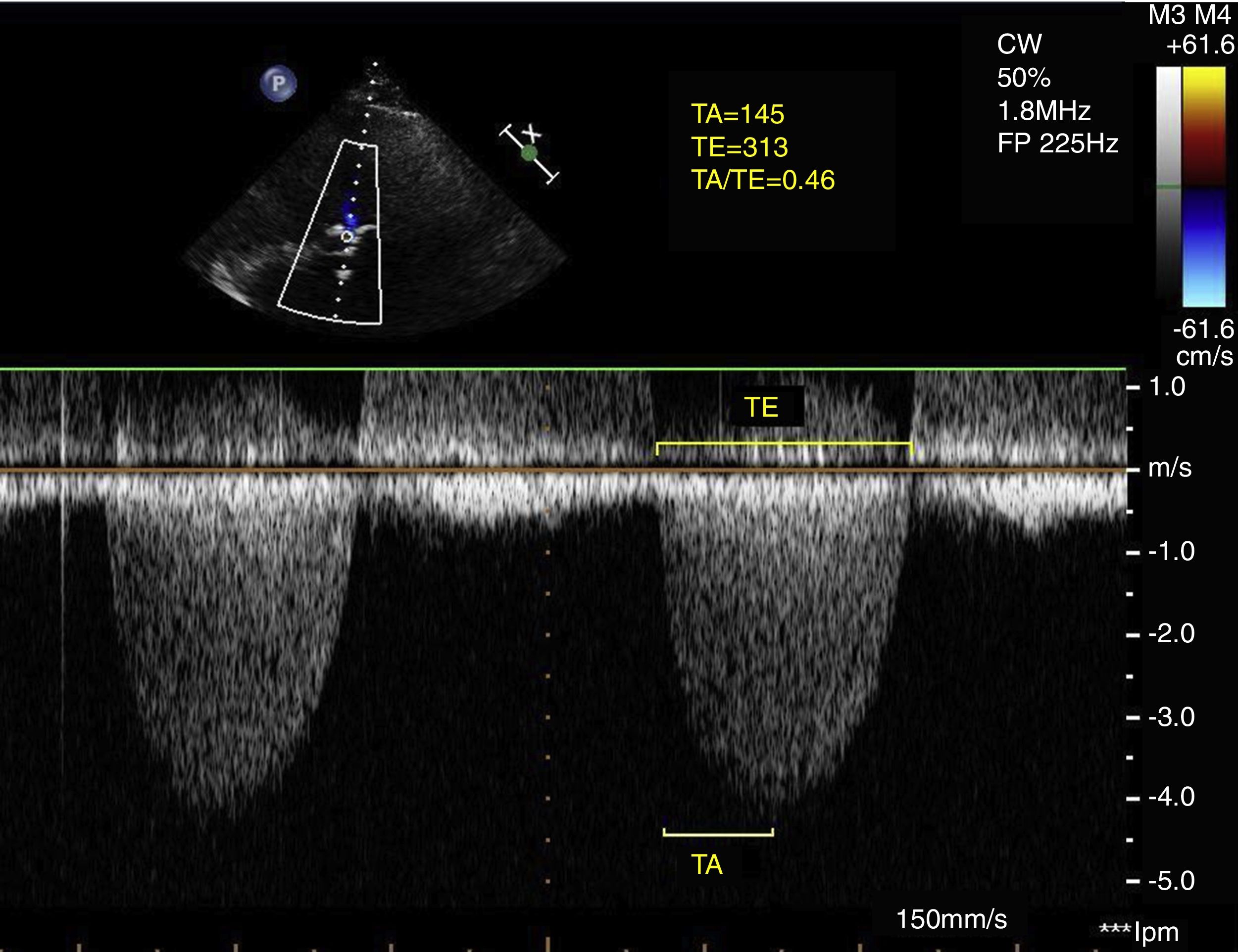
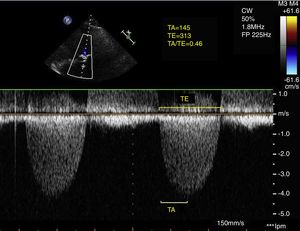
Parámetros de hemodinámica del flujo aórticoSe empleó la curva de velocidad obtenida mediante Doppler continuo a través de la válvula aórtica en plano apical de 5 cámaras para el cálculo de los parámetros hemodinámicos de flujo. Para ello se aumentó la velocidad de barrido a 150mm/s.
Se definió el tiempo de aceleración (TA) como el periodo desde el inicio del flujo aórtico hasta el punto de mayor velocidad del flujo aórtico; el tiempo de eyección (TE) se definió como el tiempo total de duración de la sístole (fig. 1). Posteriormente, se calculó el cociente TA/TE.
PronósticoLa decisión de sustitución valvular aórtica de un paciente quedó a cargo de su cardiólogo de referencia, y el tipo de intervención se decidía en cada paciente en reuniones con el Heart Team, según los criterios clínicos y ecocardiográficos evidenciados en las guías de práctica clínica3.
Se definió el evento primario como un end-point combinado de muerte de causa cardiovascular o reemplazo valvular aórtico. También se registró el reemplazo valvular quirúrgico o percutáneo y la mortalidad global. Definimos la muerte cardiovascular como aquella que resulta de una muerte súbita cardiaca, insuficiencia cardiaca, ictus, endocarditis infecciosa o aquella muerte que resulta del procedimiento de reemplazo valvular. El seguimiento clínico se llevó a cabo a través de la base de datos hospitalaria, certificados de defunción o llamada telefónica.
Análisis estadísticoLas variables continuas se expresaron mediante la media±desviación estándar. Las variables cualitativas se expresaron como frecuencias en porcentajes.
La comparación entre variables cuantitativas independientes se realizó mediante el test de la t de Student, en caso de normalidad estimada por el método Kolmogorov-Smirnov. Para comparar las variables cualitativas empleamos el test de la Chi-cuadrado, o en caso de no cumplir los criterios necesarios para usarlo, se empleó el test exacto de Fisher. Se dividió a los pacientes en dos grupos en función del valor de TA/TE, estableciendo el punto de corte en 0,35 basándonos en estudios previos13.
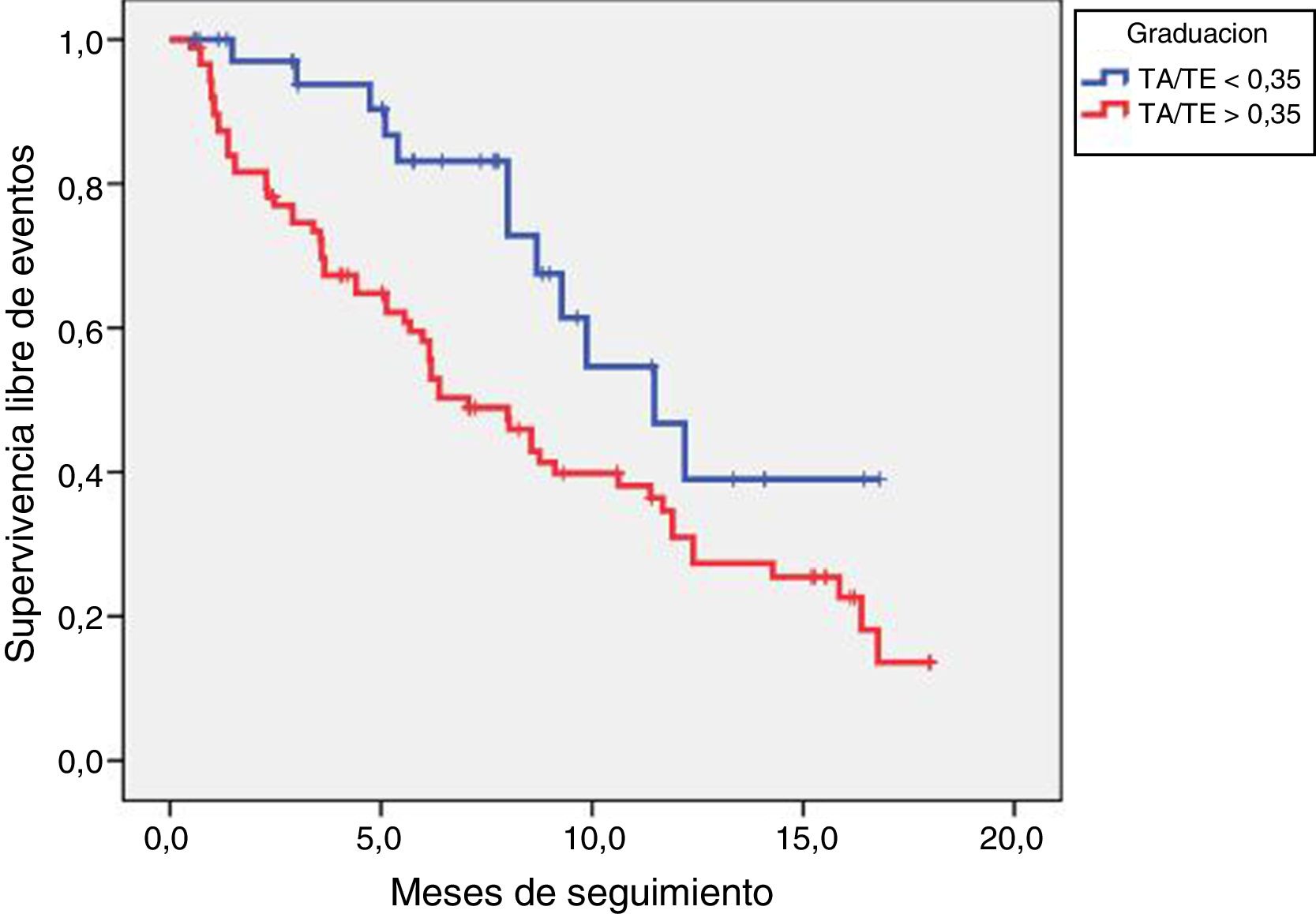
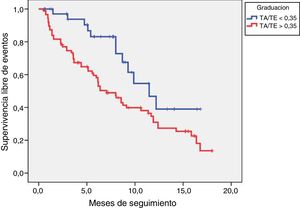
La diferencia en la supervivencia libre del objetivo primario entre los dos grupos (TA/TE≥0,35 y TA/TE<0,35) se realizó mediante el método de Kaplan-Meier, comparándose las distintas curvas de supervivencia por la prueba de log-rank.
Se calcularon modelos de regresión de Cox incluyendo las variables edad, FEVI, AVA, velocidad máxima, gradiente medio, TA/TE, presencia de fibrilación auricular y sintomatología para estimar el hazard ratio (HR) para la supervivencia libre del evento primario.
Se consideró diferencia significativa un valor de p inferior a 0,05.
El análisis estadístico se realizó mediante el paquete SPSS versión 17.0 (SPSS Inc., Chicago, Illinois, EE.UU.).
ResultadosSe incluyeron 197 pacientes con EA severa (55% mujeres, edad media de 76±8años). La etiología predominante fue la degenerativa (95%), de los cuales 169 (86%) presentaban síntomas. Un 16% tenían disfunción ventricular (FEVI <50%), y 14 pacientes (7%) presentaban disfunción ventricular severa (FEVI ≤35%). Se practicó en 14 pacientes el ecocardiograma de estrés con dobutamina, de los que 3 pacientes no fueron incluidos en el estudio por presentar EA «pseudosevera».
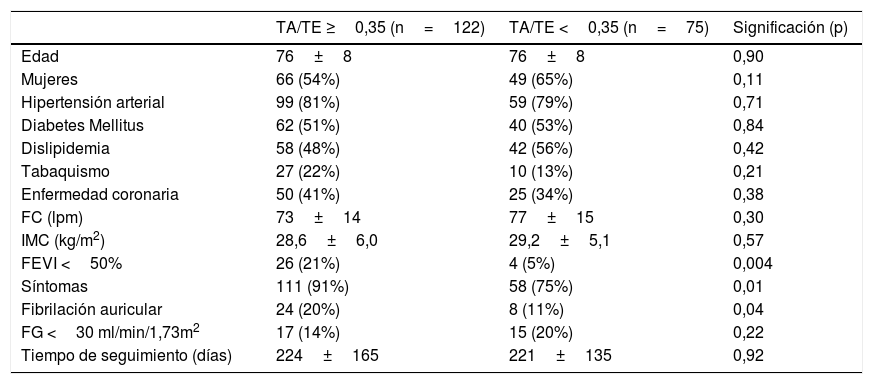
De nuestra cohorte, 122 pacientes (62%) tenían un ratio TA/TE ≥0,35 y 75 pacientes (38%) un TA/TE <0,35. Las características basales de ambos grupos fueron similares (tabla 1), a excepción de la presencia de síntomas, la función ventricular o la fibrilación auricular.
Características basales de los pacientes
| TA/TE ≥0,35 (n=122) | TA/TE <0,35 (n=75) | Significación (p) | |
|---|---|---|---|
| Edad | 76±8 | 76±8 | 0,90 |
| Mujeres | 66 (54%) | 49 (65%) | 0,11 |
| Hipertensión arterial | 99 (81%) | 59 (79%) | 0,71 |
| Diabetes Mellitus | 62 (51%) | 40 (53%) | 0,84 |
| Dislipidemia | 58 (48%) | 42 (56%) | 0,42 |
| Tabaquismo | 27 (22%) | 10 (13%) | 0,21 |
| Enfermedad coronaria | 50 (41%) | 25 (34%) | 0,38 |
| FC (lpm) | 73±14 | 77±15 | 0,30 |
| IMC (kg/m2) | 28,6±6,0 | 29,2±5,1 | 0,57 |
| FEVI <50% | 26 (21%) | 4 (5%) | 0,004 |
| Síntomas | 111 (91%) | 58 (75%) | 0,01 |
| Fibrilación auricular | 24 (20%) | 8 (11%) | 0,04 |
| FG <30 ml/min/1,73m2 | 17 (14%) | 15 (20%) | 0,22 |
| Tiempo de seguimiento (días) | 224±165 | 221±135 | 0,92 |
FC: frecuencia cardiaca; FEVI: fracción de eyección de ventrículo izquierdo; FG: filtrado glomerular; IMC: índice de masa corporal; lpm: latidos por minuto; TA/TE: ratio tiempo de aceleración/tiempo de eyección.
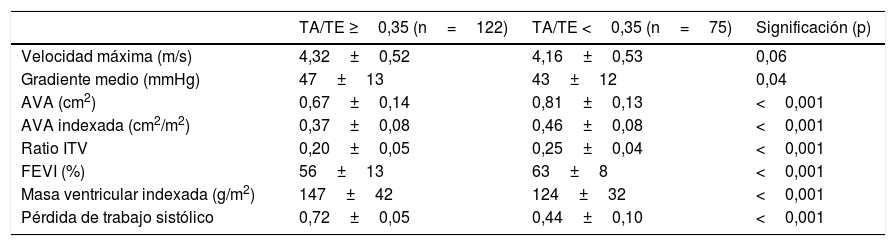
Los distintos valores de los parámetros ecocardiográficos en pacientes con TA/TE mayor y menor de 0,35 se reflejan en la tabla 2. Los pacientes con mayores valores de TA/TE tuvieron mayor severidad en otros parámetros ecocardiográficos.
Características ecocardiográficas de los pacientes en función del valor de TA/TE
| TA/TE ≥0,35 (n=122) | TA/TE <0,35 (n=75) | Significación (p) | |
|---|---|---|---|
| Velocidad máxima (m/s) | 4,32±0,52 | 4,16±0,53 | 0,06 |
| Gradiente medio (mmHg) | 47±13 | 43±12 | 0,04 |
| AVA (cm2) | 0,67±0,14 | 0,81±0,13 | <0,001 |
| AVA indexada (cm2/m2) | 0,37±0,08 | 0,46±0,08 | <0,001 |
| Ratio ITV | 0,20±0,05 | 0,25±0,04 | <0,001 |
| FEVI (%) | 56±13 | 63±8 | <0,001 |
| Masa ventricular indexada (g/m2) | 147±42 | 124±32 | <0,001 |
| Pérdida de trabajo sistólico | 0,72±0,05 | 0,44±0,10 | <0,001 |
AVA: área valvular aórtica; FEVI: fracción de eyección ventricular izquierda; ITV: integral tiempo-velocidad; TA/TE: ratio tiempo de aceleración/tiempo de eyección.
Se logró el seguimiento completo de 190 pacientes (96%) con un periodo de seguimiento medio de 223±156días, durante el cual 110 pacientes (58%) alcanzaron el objetivo primario: 70 pacientes (36%) fueron intervenidos quirúrgicamente, 8 pacientes (4%) por vía percutánea, y 33 pacientes (17%) fallecieron de causa cardiovascular.
Los pacientes con TA/TE ≥0,35 tuvieron más eventos cardiovasculares (66% vs. 41%, p=0,008), sin que hubiese diferencias en el seguimiento medio. Los eventos de ambos grupos se resumen en la tabla 3. La curva de Kaplan-Meier muestra una tendencia no significativa a una mejor supervivencia al evento combinado en los pacientes con TA/TE <0,35 (284±25 vs. 350±32días, p=0,07), tal como se refleja en la figura 2.
Eventos durante el seguimiento de ambos grupos
| TA/TE ≥0,35 (n=122) | TA/TE <0,35 (n=75) | Significación (p) | |
|---|---|---|---|
| Eventos cardiovasculares | 80 (66%) | 30 (41%) | 0,008 |
| Muerte cardiovascular | 27 (22%) | 6 (8%) | 0,06 |
| Mortalidad global | 29 (24%) | 11 (15%) | 0,20 |
| Cirugía cardiaca | 46 (38%) | 24 (33%) | 0,78 |
| TAVI | 8 (6%) | 0 (0%) | 0,05 |
| Supervivencia libre de evento combinadoa (días) | 284±25 | 350±32 | 0,07 |
TAVI: implante percutáneo de válvula aórtica; TA/TE: ratio tiempo de aceleración/tiempo de eyección.
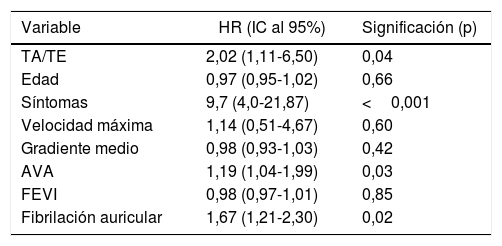
Tras el análisis multivariante, solo la presencia de síntomas, la fibrilación auricular, el AVA y el ratio TA/TE mostraron un valor pronóstico independiente en la predicción del evento cardiovascular (tabla 4).
Modelo de regresión de Cox para predecir el end-point primario
| Variable | HR (IC al 95%) | Significación (p) |
|---|---|---|
| TA/TE | 2,02 (1,11-6,50) | 0,04 |
| Edad | 0,97 (0,95-1,02) | 0,66 |
| Síntomas | 9,7 (4,0-21,87) | <0,001 |
| Velocidad máxima | 1,14 (0,51-4,67) | 0,60 |
| Gradiente medio | 0,98 (0,93-1,03) | 0,42 |
| AVA | 1,19 (1,04-1,99) | 0,03 |
| FEVI | 0,98 (0,97-1,01) | 0,85 |
| Fibrilación auricular | 1,67 (1,21-2,30) | 0,02 |
AVA: área valvular aórtica; FEVI: fracción de eyección ventricular izquierda; HR: hazard ratio; IC: intervalo de confianza; TA/TE: ratio tiempo de aceleración/tiempo de eyección.
El principal hallazgo del presente estudio fue que los pacientes con un TA/TE superior a 0,35 presentaron más eventos cardiovasculares, siendo este ratio un factor pronóstico independiente. Hasta la fecha, ningún estudio había determinado el valor pronóstico de esta variable en la EA severa.
En nuestra opinión, el peor pronóstico de los pacientes con un TA/TE ≥0,35 refleja una mayor severidad de estos pacientes, y aunque en parte podría ser explicado por la asociación a la severidad de otros parámetros ecocardiográficos, como puede observarse en la tabla 2, nuestros datos confirman que se trata de un factor pronóstico independiente en EA.
Está bien documentado que la presencia de síntomas supone una disminución de la supervivencia en la historia natural de la EA14,15, por lo que está indicada la sustitución valvular en los pacientes sintomáticos3, si bien el manejo de los pacientes asintomáticos continúa siendo controvertido16,17.
Por otro lado, debido al envejecimiento de la población, la etiología degenerativa es la causa más frecuente de EA en nuestro medio18, y determinar el estado sintomático puede ser especialmente complicado en pacientes ancianos19. La avanzada edad de nuestra muestra, la alta comorbilidad y la dificultad de valorar si los síntomas son consecuencia de la EA podrían motivar la baja incidencia de sustitución valvular aórtica en nuestro estudio.
Varias técnicas han mostrado una peor supervivencia de los pacientes con EA, y podrían ayudar a valorar el pronóstico de los pacientes con EA severa asintomática: el score de calcio valvular medido por TAC20, la fibrosis intersticial estimada por resonancia magnética21, o los péptidos natriuréticos22,23.
Los parámetros de la dinámica de la eyección se han estudiado previamente por ecocardiografía: Chambers et al.24 describieron un ratio de gradiente de presión de pico al medio con capacidad para discernir la severidad de la EA; Ben Zekry et al.25 correlacionaron el tiempo de aceleración aórtica con la disfunción valvular protésica.
Nuestro grupo ya ha demostrado la correlación del ratio TA/TE con el estado sintomático de los pacientes y con el valor de los péptidos natriuréticos26. Además, un punto de corte más elevado de TA/TE se correlacionó con una mayor severidad de la EA27, con una aceptable sensibilidad y especificidad para establecer EA severa con un TA/TE ≥0,35.
Este índice presenta una serie de ventajas: se trata de un parámetro que es independiente de flujo, sencillo, con una buena correlación inter e intraobservador27, por lo que su empleo rutinario puede añadir un valor pronóstico a los parámetros convencionales.
LimitacionesPodría argumentarse que la sustitución valvular no es un end-point «duro» y que puede determinarse de manera arbitraria a lo largo de la historia natural de la entidad. Sin embargo, consideramos complicado un end-point exclusivo de mortalidad en una enfermedad cuyo tratamiento modifica la historia natural de la EA3; y por otro lado, hay que reseñar que los médicos de referencia de los pacientes desconocían el valor del TA/TE, decidiendo el momento de la intervención en función de parámetros ecocardiográficos convencionales y del estado sintomático de los pacientes.
El pequeño tamaño muestral es una de nuestras principales limitaciones, ya que reduce la capacidad de incrementar la potencia estadística para poder encontrar diferencias significativas en otros end-points estudiados.
Además, solo una pequeña proporción de pacientes se encontraba asintomática, lo que puede limitar la aplicabilidad de este ratio en este subgrupo de pacientes.
Como conclusión, nuestro estudio demuestra que un valor mayor de 0,35 supone una mayor incidencia de eventos cardiovasculares en una muestra de EA severa, por lo que este índice podría ayudar a establecer un pronóstico en este grupo de pacientes.
Conflicto de interesesSin conflicto de intereses.