Las cardiopatías congénitas engloban aquellas alteraciones del corazón y grandes vasos que se originan antes del nacimiento. Se estima que se presentan entre 8 y 10 casos por cada 1.000 nacimientos, y representan la mayor causa de mortalidad durante el primer año de vida.
El cardiólogo que solicita un estudio de resonancia magnética cardiaca (RMC) debe conocer varios aspectos fundamentales: los principios físicos más elementales en los que se basa la RMC, las contraindicaciones, limitaciones, las principales indicaciones y finalmente algunos conocimientos sobre las secuencias básicas.
¿Cuáles son los principios físicos elementales de la resonancia magnética cardiaca?La fuente principal de la que se obtiene la señal necesaria para realizar un estudio de RMC proviene de los protones de hidrógeno que se encuentran en las moléculas de agua y grasa de nuestro cuerpo. Mediante la utilización de potentes campos magnéticos (aproximadamente 30.000 veces la intensidad del campo magnético terrestre en equipos de 1,5 teslas) y pulsos de radiofrecuencia se pueden estimular dichos protones. Al cesar el pulso de radiofrecuencia los protones se relajan y emiten energía, la cual puede ser captada, cuantificada y localizada en el espacio. De esta forma se puede generar un mapa de la cantidad de protones (intensidad) y su localización en el cuerpo humano. Para simplificar, mediante un imán, un emisor de ondas de radio y el propio contraste que aportan las moléculas de agua de nuestro organismo se obtienen las imágenes de RMC. Evidentemente el proceso es mucho más complejo, por lo que para una mayor profundización en los principios físicos de la resonancia magnética se recomiendan lecturas adicionales1.
¿Cuáles son las contraindicaciones de la resonancia magnética cardiaca?La RMC es una técnica segura siempre y cuando se tengan presentes algunas precauciones. La exposición al campo magnético no ha demostrado producir efectos biológicos nocivos. El riesgo se produce por la presencia de objetos metálicos bien implantados, bien presentes en la sala de exploración. La mayoría de implantes como stents, coils y válvulas cardiacas no contraindican su utilización, tan solo artefactarán la imagen en ciertas secuencias. En cuanto a los marcapasos y desfibriladores no son contraindicación absoluta, porque ya existen dispositivos compatibles.
Mención especial requiere el uso de contrastes basados en el gadolinio. Su administración por vía venosa en pacientes con insuficiencia renal se ha asociado al desarrollo de fibrosis sistémica nefrogénica, un desorden fatal multisistémico que afecta a la piel. Es por ello que el uso de estos agentes de contraste está contraindicado en pacientes con insuficiencia renal.
¿Cuáles son limitaciones de la resonancia magnética cardiaca?Una de las mayores desventajas de la RMC es su escasa versatilidad para realizar estudios a pie de cama, y sobre todo la necesidad de utilizar anestesia general en pacientes pediátricos.
Otra gran limitación es la existencia de los artefactos producidos por el movimiento. A diferencia de la resonancia magnética cerebral, o de otros órganos estáticos, en el caso de la RMC existen 2 grandes inconvenientes, el movimiento del propio latido cardiaco más el movimiento del diafragma producido por la respiración. Para compensar el movimiento cardiaco se utilizan varias estrategias; la más frecuente es sincronizar la adquisición de la imagen con el ciclo cardiaco utilizando el electrocardiograma. La adecuada colocación de los electrodos antes de iniciar el estudio es uno de los pasos más importantes que no solo mejora la imagen, sino que también ahorra mucho tiempo de estudio. Los artefactos por el movimiento respiratorio son fáciles de compensar en adolescentes y adultos mediante la realización de apneas. Sin embargo, es un inconveniente en pacientes pediátricos. Para ello existen varias alternativas como los cinturones de sensado de respiración, uso de eco navegadores, utilización de adquisiciones múltiples durante la respiración libre o el uso controlado de apneas en pacientes intubados bajo anestesia general.
¿Cuáles son las ventajas de la resonancia magnética cardiaca?Las ventajas de la RMC son su capacidad para evaluar la anatomía cardiovascular en 3 dimensiones (3D), la no emisión de radiación ionizante y que es una técnica no invasiva. En el diagnóstico de cardiopatías congénitas es fundamental conocer las relaciones anatómicas espaciales de los distintos segmentos cardiacos: venas, aurículas, ventrículos y grandes vasos. La adquisición de un volumen 3D permite al examinador seleccionar el plano que mejor detalle estas relaciones espaciales sin existir limitación de ventanas acústicas, como en la ecocardiografía. Además, no solo permite evaluar la anatomía espacial en 3D, sino que también permite evaluar sus cambios en el tiempo a lo largo del ciclo cardiaco. Esto permite la cuantificación precisa y reproducible de los volúmenes, masa y función cardiaca, tanto para el ventrículo derecho como para el izquierdo2. El no emitir radiación ionizante la sitúa en una posición de elección frente a la tomografía axial computarizada, particularmente en niños donde el riesgo de desarrollar tumores sólidos por radiación ionizante se multiplica respecto a la población adulta. Finalmente también permite evaluar parámetros hemodinámicos como el gasto cardiaco y determinar el flujo sanguíneo en los grandes vasos sin necesidad de utilizar procedimientos invasivos como el cateterismo cardiaco.
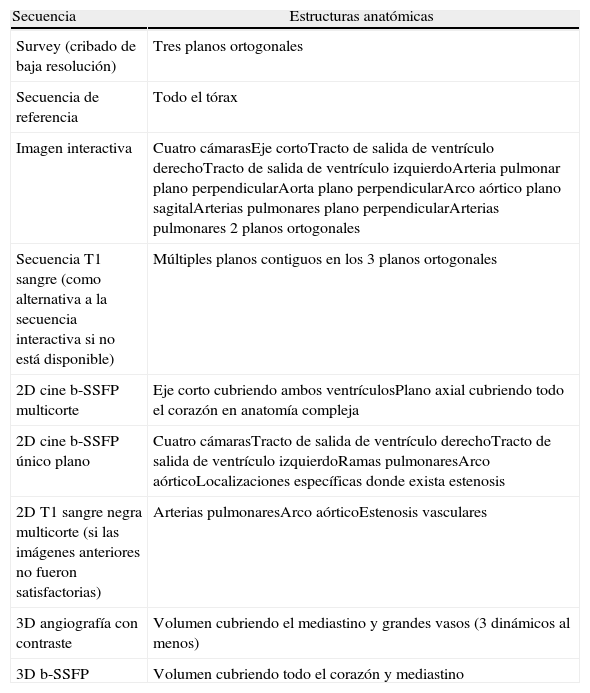
¿Cuales son las aplicaciones clínicas de la resonancia magnética cardiaca?De acuerdo a las guías de práctica clínica, la RMC se considera indicación de clase i para la evaluación de pacientes con cardiopatías congénitas3. El estudio de RMC se compone de distintas secuencias de imagen, y estas se construyen a partir de 2 tipos de pulsos fundamentales: spin-echo (sangre negra) y gradient-echo (sangre blanca). En la tabla 1 se resume una sugerencia de protocolo estándar para realizar en pacientes con cardiopatías congénitas.
Protocolo estándar en cardiopatías congénitas
| Secuencia | Estructuras anatómicas |
| Survey (cribado de baja resolución) | Tres planos ortogonales |
| Secuencia de referencia | Todo el tórax |
| Imagen interactiva | Cuatro cámarasEje cortoTracto de salida de ventrículo derechoTracto de salida de ventrículo izquierdoArteria pulmonar plano perpendicularAorta plano perpendicularArco aórtico plano sagitalArterias pulmonares plano perpendicularArterias pulmonares 2 planos ortogonales |
| Secuencia T1 sangre (como alternativa a la secuencia interactiva si no está disponible) | Múltiples planos contiguos en los 3 planos ortogonales |
| 2D cine b-SSFP multicorte | Eje corto cubriendo ambos ventrículosPlano axial cubriendo todo el corazón en anatomía compleja |
| 2D cine b-SSFP único plano | Cuatro cámarasTracto de salida de ventrículo derechoTracto de salida de ventrículo izquierdoRamas pulmonaresArco aórticoLocalizaciones específicas donde exista estenosis |
| 2D T1 sangre negra multicorte (si las imágenes anteriores no fueron satisfactorias) | Arterias pulmonaresArco aórticoEstenosis vasculares |
| 3D angiografía con contraste | Volumen cubriendo el mediastino y grandes vasos (3 dinámicos al menos) |
| 3D b-SSFP | Volumen cubriendo todo el corazón y mediastino |
Protocolo convencional sugerido para el estudio de pacientes con cardiopatías congénitas.
Adaptada con permiso de Attili et al.2.
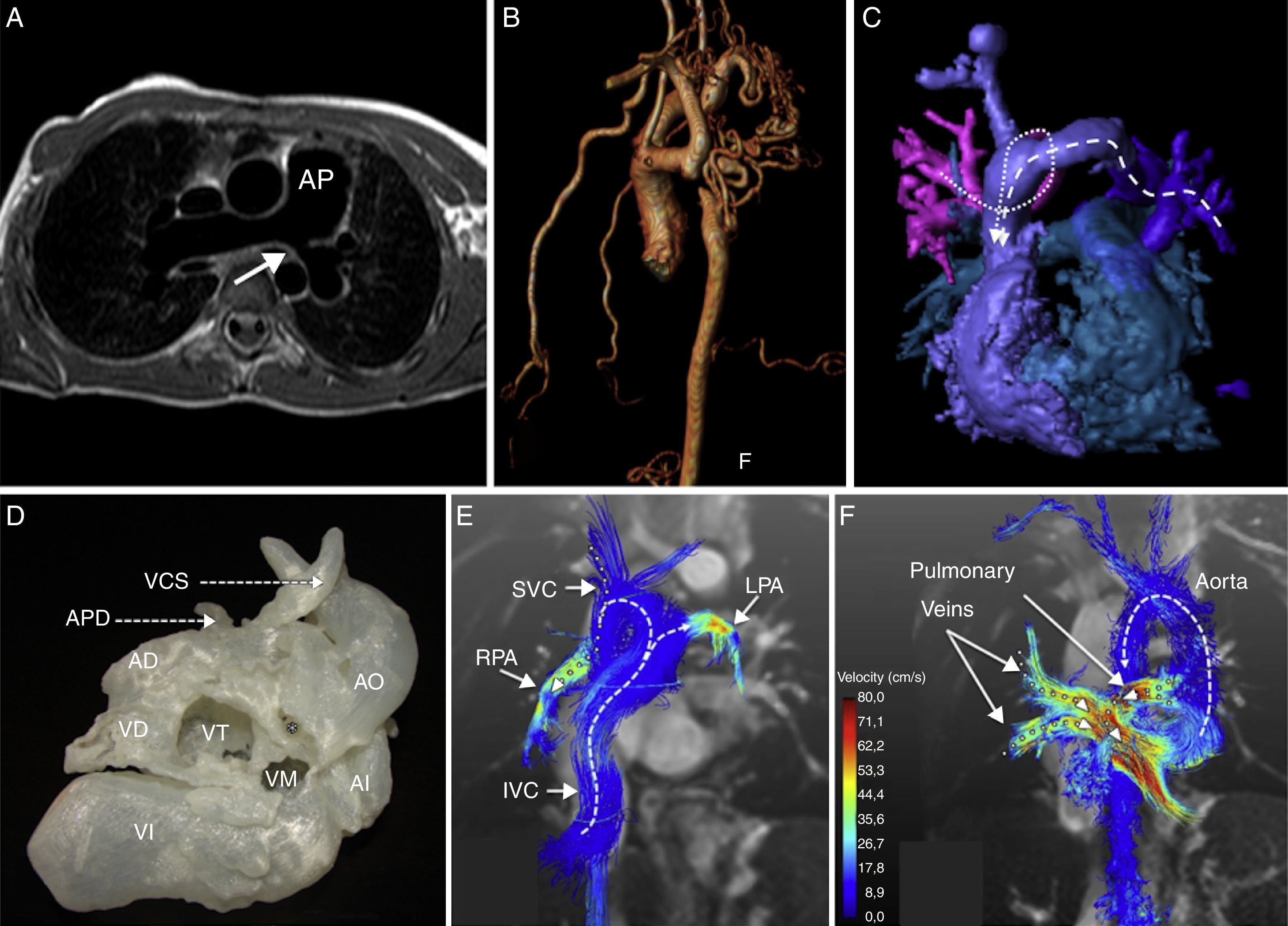
La mayor parte de estudios de RMC en cardiopatías congénitas se realizan para el seguimiento de la tetralogía de Fallot (fig. 1A), coartación de aorta (fig. 1B), D-transposición de grandes arterias, cirugía paliativa de corazón univentricular y cuantificación de cortocircuitos, como el caso de los drenajes venosos pulmonares anómalos (fig. 1C).
A. Secuencia T1 sangre negra, plano axial. Paciente con tetralogía de Fallot corregida, dilatación de la arteria pulmonar (AP) y estenosis en el origen de la rama pulmonar izquierda (flecha). B. Secuencia realce con gadolinio, reconstrucción 3D. Paciente con coartación de aorta severa y colaterales múltiples. C. Secuencia realce con gadolinio, reconstrucción 3D. Paciente con drenaje venoso anómalo parcial de venas pulmonares superiores izquierdas a vena innominada (línea discontinua) y de venas pulmonares superiores derechas a vena cava superior (línea de puntos). D. Modelo 3D de paciente de 8 años diagnosticado de situs solitus con dextrocardia y dextroápex, ventrículo derecho (VD) de doble salida con ventrículos en doble piso, estenosis pulmonar severa (*), CIV subaórtica amplia y vasos en L malposición. AD: aurícula derecha; AI: aurícula izquierda; APD: arteria pulmonar derecha; VCS: vena cava superior, VD: ventrículo derecho; VI: ventrículo izquierdo; VM: válvula mitral, VT: válvula tricúspide.). E. Secuencia 4D-flow en un paciente de 22 años con cirugía paliativa de conexión cavopulmonar total. Representación del flujo de partículas en la circulación de Fontan, demostrando la división del flujo de la vena cava inferior (IVC) hacia la arteria pulmonar derecha (RPA) y arteria pulmonar izquierda (LPA), así como el flujo preferencial de la vena cava superior (SVC) a la arteria pulmonar derecha. F. Reconstrucción en 3D del flujo de partículas de las venas pulmonares y del flujo aórtico.Reproducida con permiso de Bächler et al.5.
La tetralogía de Fallot es la cardiopatía cianosante más frecuente, representando casi el 10% de todas las cardiopatías congénitas. La RMC desempeña un papel fundamental en el seguimiento posquirúrgico de estos pacientes, con el fin de detectar precozmente y evaluar en el tiempo los efectos deletéreos de las lesiones residuales como la regurgitación valvular pulmonar, la dilatación progresiva del ventrículo derecho, la disminución de la función sistólica del ventrículo derecho, el desarrollo de aneurismas en el tracto de salida del ventrículo derecho o la existencia de estenosis residuales en las ramas pulmonares que puedan contribuir al desarrollo de hipertrofia del ventrículo derecho.
La RMC permite evaluar la morfología y severidad en los casos de coartación de aorta, pero también permite evaluar alteraciones a nivel de la pared y detectar de forma precoz el desarrollo de disecciones o aneurismas. De igual forma, es importante evaluar la repercusión hemodinámica que produce, tal y como el desarrollo de circulación colateral e hipertrofia de ventrículo izquierdo.
¿Cuáles son las nuevas líneas de investigación en resonancia magnética cardiaca?La RMC es una técnica en constante desarrollo y reinvención. Los nuevos avances no se centran solo en mejorar la calidad de la imagen, sino que exploran nuevas áreas del conocimiento imposibles de imaginar hasta hace poco. Estas nuevas líneas de investigación cubren desde la evaluación integral del flujo cardiaco, la cuantificación de las fuerzas de estrés que se producen a nivel del endotelio, la evaluación microscópica de las relaciones geométricas que se forman entren las fibras miocárdicas, la cuantificación de la contractilidad en cada uno de los componentes del espacio hasta la generación de copias específicas de la anatomía del paciente mediante impresión 3D. Cada una de estas áreas de investigación están ayudándonos a comprender mucho mejor la fisiología cardiovascular de forma espectacular. Algunos de estos ejemplos los detallaremos a continuación.
Impresión 3D de modelos cardiovascularesLos modelos cardiovasculares 3D son copias exactas de la anatomía cardiovascular específica de cada paciente fabricadas a partir de las imágenes médicas como la RMC. Utilizando tecnologías de diseño asistido por ordenador, las imágenes de RMC se transforman en geometrías en 3D, y mediante impresión 3D se crean los modelos físicos (fig. 1D)4. El potencial, a nuestro entender, es ilimitado y las aplicaciones médicas van desde la simulación de procedimientos percutáneos de cateterismo y planificación quirúrgica de cirugía complejas hasta la docencia y comunicación con pacientes y familiares. Ver y tocar directamente las estructuras anatómicas permite simular las maniobras quirúrgicas a realizar con gran precisión en el modelo antes de en el paciente y comprobar el resultado. No sería de extrañar que en un futuro no muy lejano las imágenes de RM no se impriman en papel convencional para su visualización, sino que se envíen directamente a una impresora 3D para poder tocar y mostrar a los profesionales médicos la anatomía del paciente en tamaño real.
Evaluación de la hemodinámica cardiovascular: 4D-flowLos patrones del flujo están estrechamente relacionados con la función y morfología del sistema cardiovascular. Estos patrones reflejan la excepcional adaptabilidad del sistema cardiaco para mantener una circulación normal incluso en situaciones patológicas como estenosis e insuficiencia valvular. Poder analizar y mostrar dichos patrones de flujo ha sido tradicionalmente un reto, dada la dificultad técnica para poder capturar los campos de velocidad en el corazón y los grandes vasos con suficiente resolución espacial y temporal.
Utilizando la técnica de contraste de fase las velocidades del flujo cardiovascular se pueden medir en cualquier dirección del espacio sin necesidad de contraste. Gracias a complejos algoritmos de adquisición retrospectiva y navegadores para el control de la respiración se pueden obtener los campos de velocidad en un volumen suficiente que cubre el mediastino y el corazón. Esta técnica se conoce como time-resolved 3D phase-contrast flow o 4D-flow. Su aplicabilidad ya se ha trasladado a la práctica clínica permitiendo la cuantificación de flujo en cualquiera de los grandes vasos y el análisis de cortocircuitos a varios niveles.
Pero su mayor potencial tal vez esté en mejorar nuestro conocimiento de la hemodinámica cardiovascular y añadir nuevos parámetros de medida a la práctica clínica. Poder analizar cómo las fuerzas de fricción del flujo interaccionan con el endotelio, cuantificar la pérdida de energía en geometrías alteradas como en la fisiología de Fontan5 (figs. 1E y F) o los patrones turbulentos de flujo en las estenosis.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónParte de esta investigación ha sido financiada por el Instituto de Salud Carlos III, del Ministerio de Ciencia e Innovación, Proyecto de investigación en salud FIS número PI13/02319.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.