En los últimos años se ha incorporado al arsenal de técnicas diagnósticas que disponemos en el laboratorio de hemodinámica la tomografía de coherencia óptica (OCT). Se trata de una técnica de diagnóstico intravascular que utiliza ondas de luz que se reflejan en la estructura interna de los tejidos biológicos y que, en función de sus propiedades ópticas, produce una dispersión y absorción de la luz que permite obtener imágenes tomográficas del tejido analizado con una resolución axial de 10-15μm y lateral de 20-40μm. Esta mayor resolución permite discriminar estructuras no visibles con el eco intracoronario, si bien su capacidad de penetración (1-2,5mm) es menor que la de los ultrasonidos. Antes del tratamiento, nos permite una caracterización de la placa y una medición precisa de la luz del vaso y de los segmentos de referencia, permitiendo tomar decisiones antes de su tratamiento. Además es una excelente herramienta para monitorizar el implante del stent y para su seguimiento. En el presente artículo revisaremos los distintos escenarios en los que se está utilizando esta técnica.
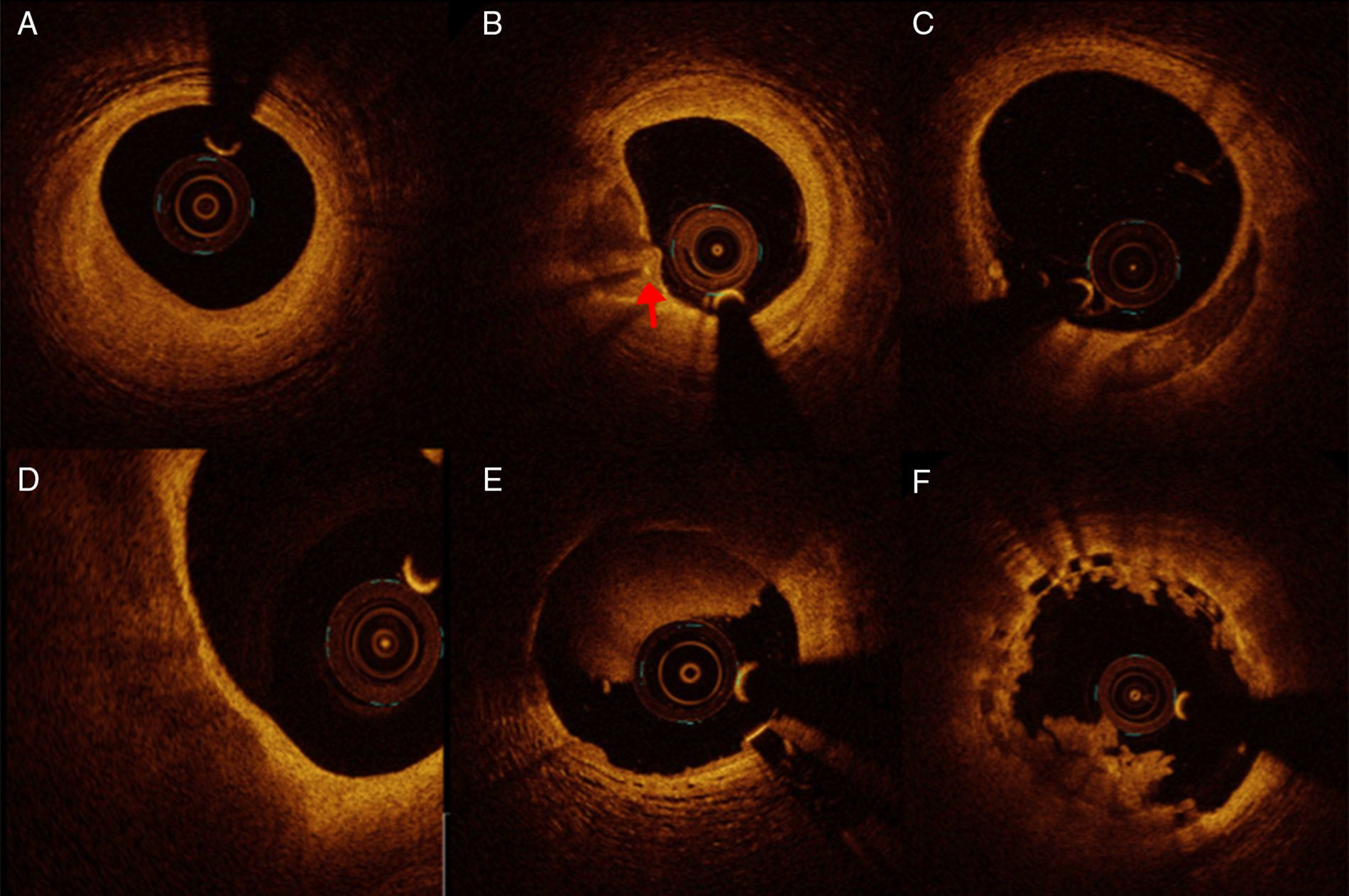
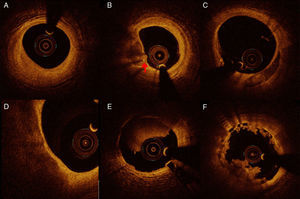
Caracterización de la placaEstudios ex vivo con OCT de arterias arterioescleróticas procedente de cadáveres han mostrado una alta correlación con la histología en la detección de placas de ateroma, estableciéndose a partir de estos estudios los criterios que definen estas placas como fibróticas, fibrocálcicas o con alto contenido lipídico1. También se han establecido, a partir de estos estudios, los criterios diagnósticos para identificar microestructuras como macrófagos, cristales de colesterol o neovasos.
Placa fibrótica: se visualiza como una imagen homogénea intensa con poca atenuación, y representa la presencia de células musculares lisas y colágeno (fig. 1A).
Caracterización de tejido. A) Placa fibrótica. B) Placa mixta con calcificación y cápsula adelgazada. Nótese la presencia de macrófagos (flecha). C) Placa cálcica de 3 a 6. D) Placa vulnerable: placa con alto contenido lipídico (alta atenuación) con cápsula adelgazada. E) Trombo rojo. F) Trombo blanco.
Placa fibrocálcica: el calcio se identifica por la presencia de una señal heterogénea, de bordes bien definidos y con poca atenuación posterior, a diferencia de lo que ocurre con los ultrasonidos, en los que el calcio deja sombra acústica, impidiendo ver lo que hay detrás del mismo (fig. 1B y C).
Placa con alto contenido lipídico: se caracterizan por una señal en la superficie de alta intensidad (cápsula fibrótica) y la presencia de lípidos extracelulares que producen una alta atenuación posterior sin bordes bien definidos (fig. 1D). Cuando la placa lipídica (core necrótico) ocupa más de 90° de circunferencia y el grosor de la capa fibrosa es ≤ 65μm, se considera que es una placa vulnerable con alto riesgo de rotura (thin cap fibroatheroma). Adicionalmente, en relación con la placa vulnerable, se pueden identificar macrófagos (patrón granular de puntos confluentes de alta intensidad con atenuación posterior heterogénea) y cristales de colesterol (señal de alta intensidad que no deja atenuación posterior). La acumulación de macrófagos se piensa que debilita la capa fibrótica y que podría contribuir a la rotura de la placa. Por otro lado, la neovascularización de la placa, que se considera que es un factor desestabilizador, también se visualizan con la coherencia óptica (estructuras vesiculares dentro de la placa menores de 200μm).
Trombos: los trombos se visualizan como masas irregulares. En la fase inicial, el trombo rojo (fig. 1E) presenta una señal de alta intensidad, con gran atenuación posterior (predominio de glóbulos rojos). Por el contrario, el trombo blanco, que es rico en plaquetas, es de menor intensidad y con menos atenuación posterior (fig. 1F).
Evaluación de lesiones intermediasLa OCT tiene la capacidad de cuantificar el área luminal mínima de una lesión con alta precisión. Basados en este parámetro, se han realizado estudios para correlacionar el área luminal mínima de lesiones intermedias con valores de FFR patológicos2, obteniendo puntos de corte que oscilan entre 1,62 y 2,05 mm2 en función del estudio, con elevada sensibilidad y especificidad. En este sentido, la OCT ha demostrado tener una capacidad diagnóstica para detectar lesiones con FFR menor de 0,8 similares al eco intracoronario. Más allá de puntos de corte cuantitativos, con la OCT se pueden objetivar parámetros cualitativos que nos puedan orientar a tomar la decisión de tratar o no una lesión, como la presencia de una placa rota con trombo adherido, una placa erosionada o presencia de nódulos de calcio.
Monitorización del tratamiento con stents metálicosUno de los campos donde más se ha expandido el uso de esta técnica intracoronaria es la evaluación inmediata del implante de los stents, siendo más sensible que el eco intracoronario para detectar complicaciones mecánicas tras el implante del stent, como disección de los bordes, protrusión de tejido o aposición incompleta. Recientemente se han publicado estudios en los que muestran que aquellos pacientes en los que se monitorizó el procedimiento con OCT tuvieron menos eventos adversos que aquellos en los que el procedimiento se guió solo por angiografía3. Los parámetros han tener en cuenta para evitar un implante subóptimo son los siguientes.
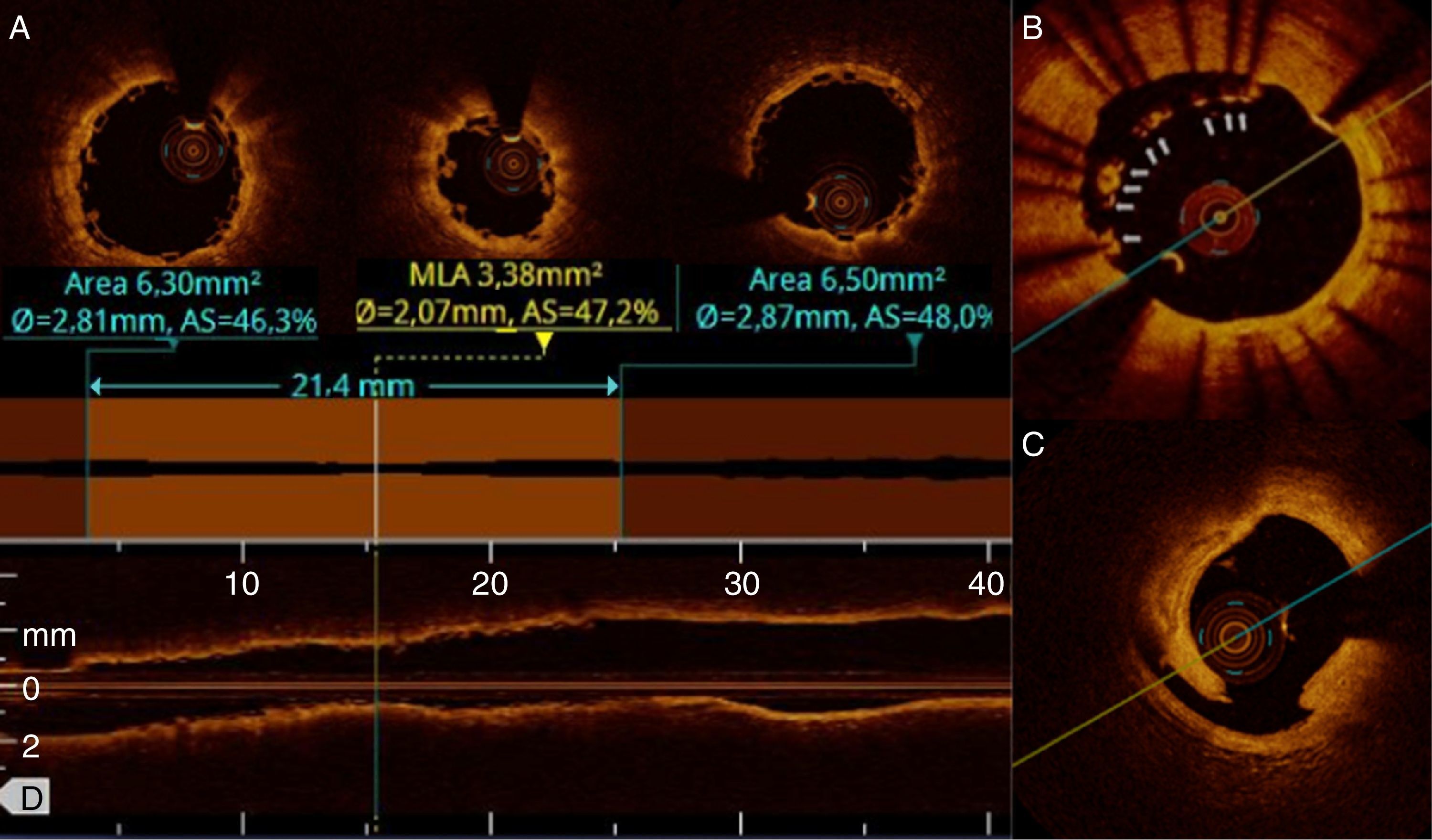
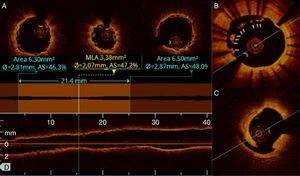
Expansión incompleta del stent: la OCT permite detectar con precisión y rapidez el punto de mínima expansión y compararlo con los segmentos de referencia (fig. 2A). Se considera expansión incompleta cuando el área mínima luminal del stent es inferior al 90% del segmento de referencia media o si el área es ≤ 4,5 mm2.
Implante subóptimo del stent. A) Stent bioabsorbible con falta de expansión a nivel central. En los cortes axiales se observa el stent proximal y distal, y el segmento de menor expansión que identifica el software de forma automática. En la parte inferior la reconstrucción longitudinal con el corte a nivel del área mínima del stent. B) Falta de aposición del stent de 8 a 12. C) Disección del borde del stent.
Área reducida del segmento de referencia: placa residual adyacente al stent con un área ≤ 4,5 mm2.
Mala aposición: la alta resolución de la OCT permite identificar mínimas faltas de aposición de los struts no evidenciadas con el eco intracoronario (fig. 2C). La distancia strut-pared del vaso, el número de struts no apuestos y el número de fotogramas en los que se objetiva esta mala aposición determinarán la necesidad de maniobras de posdilatación o no. Actualmente se considera una falta de aposición significativa y que sería subsidiaria de corrección aquellas que tenga una distancia strut-pared superior a 200μm en 3 fotogramas consecutivos. Se ha indicado que una mala aposición significativa podría generar un flujo que favorezca depósitos de fibrina y plaquetas, que pudieran constituir un nicho para la formación de trombos.
Disección de los bordes: tras el implante del stent, se puede dañar la pared vascular, induciéndose una disección en la transición entre los bordes del stent y la pared del vaso (fig. 2B), habiéndose asociado también a la aparición de eventos adversos. La mayor resolución de la OCT permite objetivar disecciones no identificadas con angiografía o eco intracoronario. Chamié et al.4 demostraron que la frecuencia de disecciones tras el implante de un stent metálico era del 38%, de las que solo el 16% se visualizaba por angiografía. La presencia en los bordes de placas fibrocálcicas y de thin cap fibroateroma se asoció a la inducción de disecciones tras implantar el stent. En el seguimiento, las disecciones silentes angiográficamente que no se trataron tuvieron un curso benigno, similar a las lesiones que no tuvieron disección.
Protrusión de placa/trombo: tejido que prolapsa entre los struts del stent con un grosor superior a 500μ (fig. 1F).
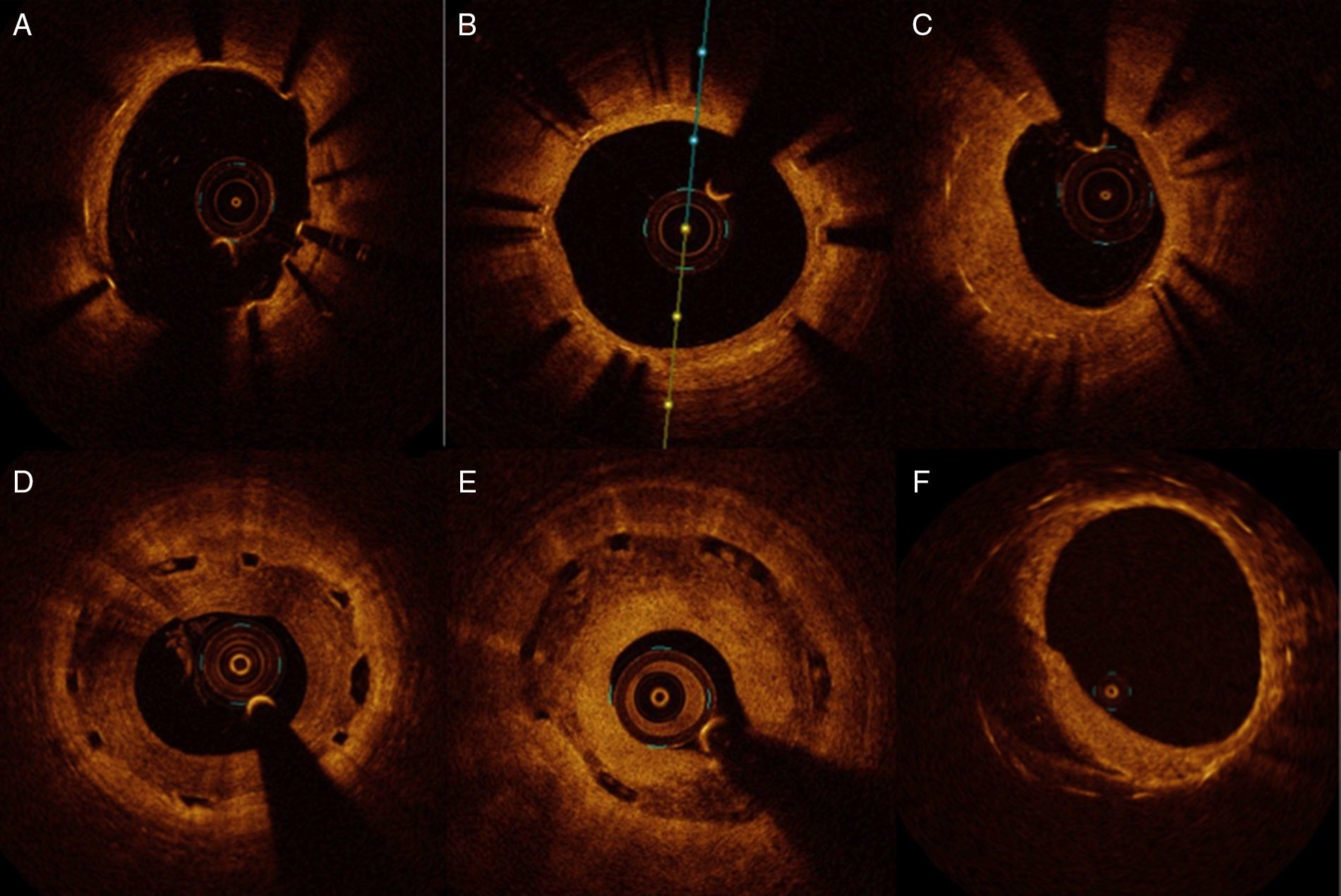
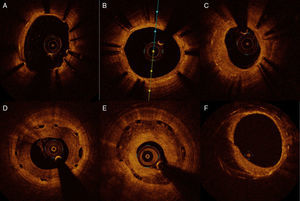
Seguimiento del stent implantadoLa OCT es capaz de detectar mínimos grados de endotelización de los struts. Una adecuada aposición y cubrimiento endotelial del stent (fig. 3B) se asocia a una buena evolución del mismo; sin embargo, en los estudios de seguimiento realizados con OCT muestran como hallazgo ocasional la presencia de trombo en struts no cubiertos y/o no apuestos, que podrían suponer un sustrato para las trombosis tardías o muy tardías de los stents. Los stents farmacoactivos de primera generación han demostrado tener menor grado de cubrimiento que los de segunda y tercera generación. En un estudio realizado por nuestro grupo, observamos que, pasado un año del implante, el porcentaje de struts no cubiertos y no apuestos del stent Cypher (11%/1,8%) y Taxus (7%/3,5%) era muy superior al observado en el Xience (1,9%/0,1%, p < 0,05)5.
Seguimiento del stent implantado. A) Struts no endotelizados al seguimiento (de 1 a 7). B) Stent con endotelización completa de todos los struts. C) Hiperplasia neointimal con patrón homogéneo. D) Stent bioabsorbible con patrón de hiperplasia intimal heterogéneo. E) Stent bioabsorbible con patrón de hiperplasia en capas. F) Stent metálico con patrón de neoarterioesclerosis (placa lipídica con calcio) de 6 a 12.
La OCT ha sido utilizada para evaluar las características del tejido de la hiperplasia neointimal, además de la extensión y la cantidad de neoíntima. En función de las características de la hiperplasia por OCT se han definido 3 patrones predominantes, el homogéneo, el heterogéneo y en capas6 (fig. 3). El patrón homogéneo representa el tejido rico en células del músculo liso, con poca cantidad de elastina y colágeno, y es el patrón más habitual en las reestenosis de los stents convencionales, mientras que el patrón heterogéneo o en capas podría representar componentes de la matriz extracelular, tales como proteoglucanos. Otro patrón que se ha descrito en estudios anatomopatológicos y en los que se ha profundizado con la OCT es la neoarterioesclerosis (cambios ateromatosos en el tejido neointimal). Este fenómeno es más frecuente en los stents farmacoactivos. Se ha postulado que la rotura de estas placas de ateroma podrían explicar las trombosis tardías y muy tardías. Los criterios de neoarterioesclerosis son la presencia en la neoíntima de contenido lipídico, de calcificaciones o the thin cap fibroatheroma (fig. 3F).
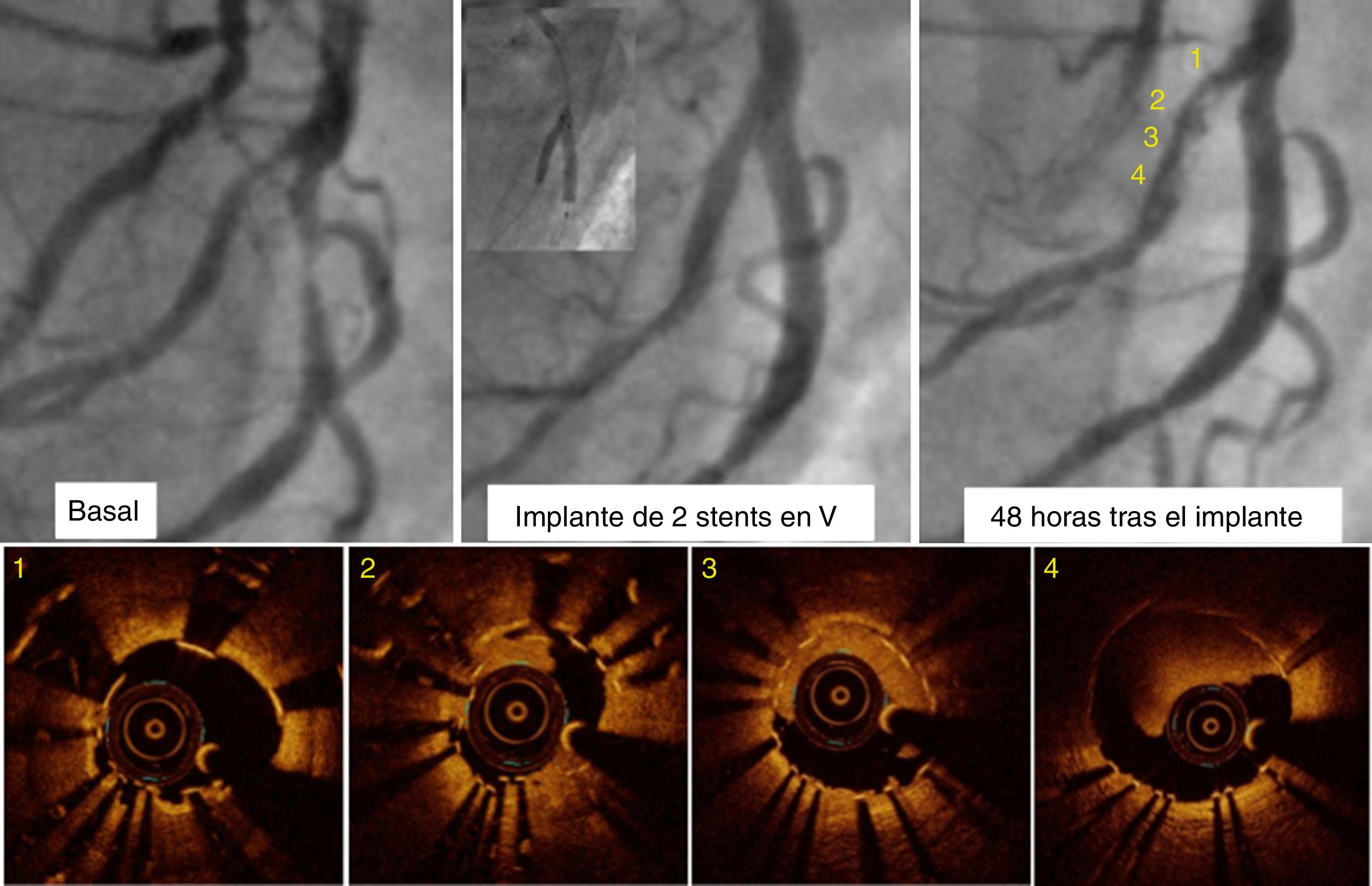
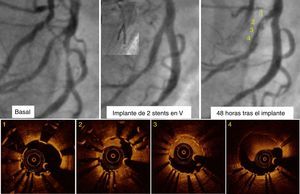
Identificación de la causa de trombosisLa OCT proporciona información que ayuda a entender los mecanismos y el tratamiento ideal cuando se trombosa un stent7. Las trombosis agudas y subagudas se suelen relacionar con problemas derivados del procedimiento: no aposición del stent, disección de los bordes o falta de expansión del stent (fig. 4). En los casos de no aposición y de falta de expansión, una posdilatación con balón de alta presión puede ser suficiente tratamiento, mientras que en los casos con disección que comprometa el flujo se suele precisar un stent adicional. En el caso de las trombosis tardías y muy tardías, la presencia de struts no cubiertos ha demostrado ser un factor predictor independiente para el desarrollo de trombosis. Otros factores asociados a trombosis tardía son la presencia de neoarterioesclerosis, las fracturas tardías de los stents o las malas aposiciones adquiridas, que se asocian a un remodelado positivo del vaso.
Trombosis subaguda del stent. Bifurcación 0, 1, 1 tratada mediante implante de 2 stents farmacoactivos en V. A las 48 h, dolor torácico y cambios eléctricos, por lo que se revalúa. La OCT muestra infraexpansión del stent en su porción proximal (1-3) y presencia de trombo rojo (4) y blanco (2 y 3).
Recientemente se ha incorporado al arsenal terapéutico el andamiaje bioabsorbible, con un armazón de polímero que mantiene la fuerza radial durante 6 meses para posteriormente iniciar un proceso de reabsorción que finaliza a los 3-4 años del implante. Los struts poliméricos permiten el paso de la luz, visualizándose nítidamente el lado abluminal y adluminal del strut. Por ello la OCT es una herramienta excelente para monitorizar el proceso de degradación de la plataforma hasta su completa desaparición. Por otro lado, esta plataforma, al tener mayor grosor de strut y menor fuerza radial, exige mayor preparación previa de la lesión y un implante óptimo para evitar trombosis de la plataforma. Por ello la OCT adquiere un papel relevante en este escenario, ya que permite la selección adecuada del dispositivo para asegurar una correcta aposición sin sobrepasar límites de expansión e identifica con claridad zonas de inexpansión, no aposición y presencia de disecciones. En cuanto a su indicación, cada vez se está expandiendo a escenarios clínicos y anatómicos más complejos. Recientemente se ha publicado un estudio aleatorizado frente al stent Xience (TROFY II) en el contexto de angioplastia primaria en el que el objetivo primario del estudio era el healing score a los 6 meses, analizando por OCT el grado de cubrimiento neointimal y el análisis de struts mal apuestos, sin haber encontrado diferencias entre las 2 plataformas. Otro escenario particular para esta plataforma son las bifurcaciones coronarias, ya que el dispositivo es fracturable cuando se posdilata la rama lateral a través de sus celdillas. La OCT es capaz de identificar criterios de rotura8, como son la presencia de superposición de struts, la protrusión de struts en la luz del vaso o identificar struts que pierden la perpendicularidad con la fuente de luz.
LimitacionesLa sangre es una barrera para la luz, por lo que se precisa rellenar la arteria con contraste durante la adquisición, lo que puede suponer una limitación en pacientes con insuficiencia renal. Por otro lado, su pobre capacidad de penetración impide valorar el remodelado del vaso o la carga de placa.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.