Los episodios de obstrucción bronquial a temprana edad constituyen un problema frecuente en pediatría. El objetivo de este estudio, además de conocer la prevalencia de sibilancias recurrentes en lactantes de Buenos Aires, fue identificar los factores asociados.
MétodosEstudio de tipo transversal realizado durante 2011 y 2012, en el Hospital de Niños Ricardo Gutiérrez, Buenos Aires, como parte del Estudio Internacional de Sibilancias en Lactantes, mediante una encuesta validada para padres de lactantes de 12 a 15 meses. Se evaluó la prevalencia de sibilancias, fundamentalmente de tipo recurrentes (tres o más episodios) y los posibles factores asociados. El análisis estadístico se realizó por prueba de χ2, prueba de Fisher y análisis de regresión logística univariada y multivariada. El nivel de significación fue de 0.05.
ResultadosDe 1063 lactantes, el 58.9% (intervalo de confianza (IC) 95% 55.9-61.9) presentaron al menos un episodio de sibilancia y el 26.3% (IC 95% 23.8-29.9), tres o más episodios (sibilancias recurrentes). Los factores vinculados a padecer al menos un episodio de sibilancia fueron el sexo masculino (p=0.001), seis o más resfríos en el primer año (p <0.0001), edad del primer resfrío <4 meses (p <0.0001), neumonía (p <0.0001), tabaquismo durante el embarazo (p=0.01). Los factores relacionados con sibilancias recurrentes fueron seis o más resfríos en el primer año de vida (p <0.0001), tener el primer episodio de sibilancia antes del cuarto mes de vida (p <0.0001) y sibilancias nocturnas (p <0.0001).
ConclusionesLa prevalencia de sibilancias recurrentes en Buenos Aires es alta (26.3%). Algunos de los factores asociados serían prevenibles.
The episodes of bronchial obstruction at early age constitute a frequent problem in Pediatrics. The aim of this study was to evaluate the prevalence of recurrent wheezing in infants in Buenos Aires City, as well as to identify any associated factors.
MethodsCross-sectional study performed from 2011 to 2012 in the Children Hospital Ricardo Gutiérrez, Buenos Aires City, as part of the International Study of Wheezing in Infants. A validated questionnaire was applied to parents of infants aged between 12 and 15 months. The prevalence of wheezing, mostly the recurrent episodes (three or more), and their probable associated factors were evaluated. Data were statistically analyzed with χ2, Fisher's test, binary and logistics multiple regression analysis. The significance level was 0.05.
ResultsOver 1063 infants, 58.9% (confidence interval (CI) 95% 55.9-61.9) presented at least one episode of wheezing and 26.3% (CI95% 23.8-29.9) three or more episodes (recurrent wheezing). Risk factors associated to wheezing were male gender (p=0.001), six or more episodes of cold during the first year of life (p <0.0001), age at first cold <4 months (p <0.0001); pneumonia (p <0.0001) and smoking during pregnancy (tobacco) (p=0.01). For recurrent wheezing, risk factors we considered as six or more episodes of cold during the first year of life (p <0.0001), early (< 4 month of age) onset wheezing (p <0.0001) and nocturnal wheezing (p <0.0001).
ConclusionsThe prevalence of recurrent wheezing among infants in Buenos Aires Ciy was high (26.3%). Some identified associated factors can be preventable.
Las manifestaciones clínicas por enfermedades respiratorias en la infancia son el motivo más frecuente de consulta médica, resultando en una alta demanda de prestaciones de salud en todos los niveles de atención1,2.
En el Estudio Internacional de Sibilancias en Lactantes (EISL)1 en Latinoamérica, la prevalencia de lactantes que presentaron sibilancias al menos una vez en su primer año de vida osciló entre 22.4% y 58.9%, con una amplia variabilidad entre los distintos centros participantes.
Según datos publicados en los Estados Unidos, aproximadamente 800,000 lactantes (20% de la cohorte nacida en un año) reciben atención médica ambulatoria en los primeros 12 meses de vida por infecciones respiratorias de tipo viral3. El principal agente involucrado es el virus sincicial respiratorio (VSR) que infecta al 90% de los pacientes menores de 24 meses4, de los cuales el 40% desarrolla bronquiolitis5.
La patología bronquial obstructiva, cuyo síntoma principal es la presencia de sibilancias, continúa siendo un problema frecuente en pediatría, especialmente en el primer año de vida, dado que no todos los pacientes que presentan sibilancias recurrentes desarrollarán asma6.
El desarrollo de sibilancias recurrentes se presenta en una amplia proporción de lactantes, y se ha relacionado con las infecciones virales respiratorias, principalmente con el VSR y el rinovirus, entre otros7.
Por otro lado, la epidemiología del asma es bien conocida en niños en edad escolar, adolescentes y adultos. Sin embargo, entre los lactantes, la prevalencia de sibilancias recurrentes y los factores asociados con su desarrollo son aún objeto de estudio. Se ha reportado un incremento en la prevalencia de sibilancias en infantes con historia de infección viral respiratoria a temprana edad; esta asociación se ha descrito incluso hasta la adultez en estudios de seguimiento a largo plazo8–10.
Por lo tanto, decidir cuándo un episodio de sibilancia se debe a una infección respiratoria o cuándo es el inicio de la presentación clínica de asma a esta edad, resulta un desafío11.
El objetivo del presente estudio, además de evaluar la prevalencia de sibilancias recurrentes en el primer año de vida en lactantes de Buenos Aires, fue identificar factores asociados con estos episodios.
2MétodosEste trabajo, que forma parte del EISL, fue un estudio de tipo observacional, analítico, transversal, que utilizó una encuesta escrita, estandarizada y validada (prueba k de concordancia: 0.98)12 dirigida a padres de lactantes sanos de 12 a 15 meses que concurrieron a sus controles de salud y/o a vacunarse. El cuestionario se refirió a lo acontecido durante los primeros 12 meses de vida. Este estudio se realizó desde marzo del 2011 hasta octubre del 2012 en el Consultorio de Niño Sano y en el Centro de Vacunación del Hospital de Niños Ricardo Gutiérrez de Buenos Aires (HNRG).
Se realizaron 1063 entrevistas. No obstante, para el estudio EISL, se calculó que el tamaño muestral en cada centro participante debería incluir al menos 984 lactantes, considerando una prevalencia de sibilancias de entre el 25% y el 30%, con una potencia del 80% y nivel de significación de 0.05.
El cuestionario comprendió 50 preguntas acerca de lo acontecido en el primer año de vida de los lactantes; incluyó características demográficas (sexo, edad, número de hermanos, número de convivientes); ambientales (combustible usado para cocinar, convivientes fumadores, presencia o no de aire acondicionado, alfombra, mascota, celular); educacionales (nivel educativo materno); lactancia materna y duración de la misma; tabaquismo durante el embarazo; antecedentes familiares (madre, padre y hermanos) de asma, rinitis y dermatitis alérgica. Para los lactantes, se consideraron síntomas respiratorios (edad de inicio, recurrencia de episodios de sibilancias, resfríos, neumonías, presencia de tos, sibilancias nocturnas); medicación recibida (broncodilatadores inhalados, corticoides sistémicos, corticoides inhalados, antileucotrienos, antibióticos, paracetamol); consultas médicas a guardia y hospitalizaciones por síntomas respiratorios.
Previo al inicio de la encuesta se le explicó claramente al entrevistado el concepto médico de una sibilancia y una bronquitis obstructiva. En el presente estudio, la variable dependiente “sibilancia” fue definida como una respuesta positiva de los padres a la pregunta “¿Ha tenido su bebé uno o más episodios de sibilancias en el primer año de vida?” y categorizada como “ocasional” (hasta dos episodios) o “recurrente” (tres o más episodios).
Los datos fueron registrados en una planilla tipo Excel y analizados empleando el paquete estadístico SPSS versión 16 (SPSS. Inc,1989-2007). Para todas las variables se estableció la distribución de frecuencias y porcentajes en relación con el total de casos. Para las medidas en escala ordinal o superior se computaron las siguientes estadísticas: número de casos, valor mínimo, valor máximo, media aritmética, desviación estándar y cualquier otra que hubiera sido aplicable a partir de la distribución de frecuencia.
Se analizaron estadísticamente los datos cualitativos empleando la prueba χ2 o la prueba de Fisher y el análisis de regresión logística univariada y multivariada. Para el nivel de significación se utilizó una p ≤ 0.05.
El estudio fue aprobado por el Comité de Docencia e Investigación y por el Comité de Ética del HNRG de Buenos Aires y se obtuvo consentimiento informado por escrito en todos los casos.
3ResultadosAl momento de realizar el control de salud y/o la vacunación de sus hijos, 1147 padres de lactantes fueron contactados, de los cuales el 92.7% aceptó ser entrevistado (1063). Cada uno completó el consentimiento informado por escrito; el 96.6% eran madres y el 3.4%, padres.
Al realizar la encuesta, la edad promedio de los lactantes fue de 13.28 meses (desviación estándar (DE) 1.28 meses). De los 1063 lactantes, 626 (58.9%; intervalo de confianza (IC)95% 55.9-61.9%) presentaron al menos un episodio de sibilancia en el primer año de vida. De los 626 pacientes que presentaron sibilancias, 280 (44.7%; IC 95% 40.8-48.7%) tuvieron sibilancias recurrentes (SR). La edad media del primer episodio de sibilancia (ocacionales y recurrentes) fue de 4.39 meses (DE 2.81 meses).
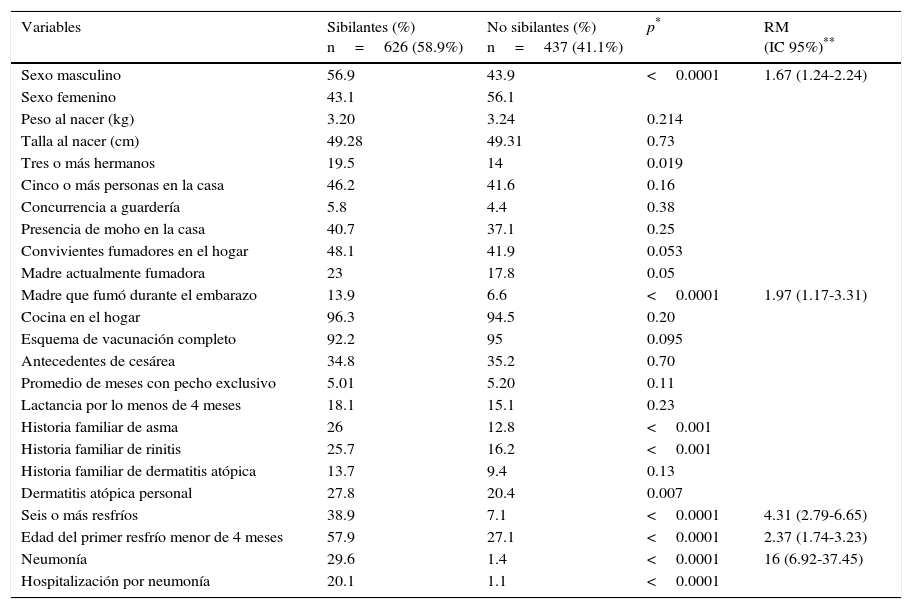
El análisis comparativo entre sibilantes y no sibilantes en el primer año de vida, de acuerdo con las características demográficas, familiares y clínicas, se muestra en la tabla 1 (análisis univariado seguido por análisis multivariado ajustado a las siguientes variables: asma familiar, rinitis familiar, presencia de tres o más hermanos, tabaquismo materno actual, tabaquismo en conviviente, hospitalización por neumonía, dermatitis atópica personal).
Análisis comparativo entre sibilantes y no sibilantes en el primer año de vida de acuerdo a características demográficas, familiares y clínicas
| Variables | Sibilantes (%) n=626 (58.9%) | No sibilantes (%) n=437 (41.1%) | p* | RM (IC 95%)** |
|---|---|---|---|---|
| Sexo masculino | 56.9 | 43.9 | <0.0001 | 1.67 (1.24-2.24) |
| Sexo femenino | 43.1 | 56.1 | ||
| Peso al nacer (kg) | 3.20 | 3.24 | 0.214 | |
| Talla al nacer (cm) | 49.28 | 49.31 | 0.73 | |
| Tres o más hermanos | 19.5 | 14 | 0.019 | |
| Cinco o más personas en la casa | 46.2 | 41.6 | 0.16 | |
| Concurrencia a guardería | 5.8 | 4.4 | 0.38 | |
| Presencia de moho en la casa | 40.7 | 37.1 | 0.25 | |
| Convivientes fumadores en el hogar | 48.1 | 41.9 | 0.053 | |
| Madre actualmente fumadora | 23 | 17.8 | 0.05 | |
| Madre que fumó durante el embarazo | 13.9 | 6.6 | <0.0001 | 1.97 (1.17-3.31) |
| Cocina en el hogar | 96.3 | 94.5 | 0.20 | |
| Esquema de vacunación completo | 92.2 | 95 | 0.095 | |
| Antecedentes de cesárea | 34.8 | 35.2 | 0.70 | |
| Promedio de meses con pecho exclusivo | 5.01 | 5.20 | 0.11 | |
| Lactancia por lo menos de 4 meses | 18.1 | 15.1 | 0.23 | |
| Historia familiar de asma | 26 | 12.8 | <0.001 | |
| Historia familiar de rinitis | 25.7 | 16.2 | <0.001 | |
| Historia familiar de dermatitis atópica | 13.7 | 9.4 | 0.13 | |
| Dermatitis atópica personal | 27.8 | 20.4 | 0.007 | |
| Seis o más resfríos | 38.9 | 7.1 | <0.0001 | 4.31 (2.79-6.65) |
| Edad del primer resfrío menor de 4 meses | 57.9 | 27.1 | <0.0001 | 2.37 (1.74-3.23) |
| Neumonía | 29.6 | 1.4 | <0.0001 | 16 (6.92-37.45) |
| Hospitalización por neumonía | 20.1 | 1.1 | <0.0001 |
RM: razón de momios; IC 95%: intervalo de confianza 95%.
RM (IC 95%): intervalo de confianza de las variables que permanecen significativas en el análisis multivariado (modelo ajustado para las siguientes variables: asma familiar, rinitis familiar, presencia de tres o más hermanos, tabaquismo materno actual, tabaquismo en conviviente, hospitalización por neumonía, dermatitis atópica personal).
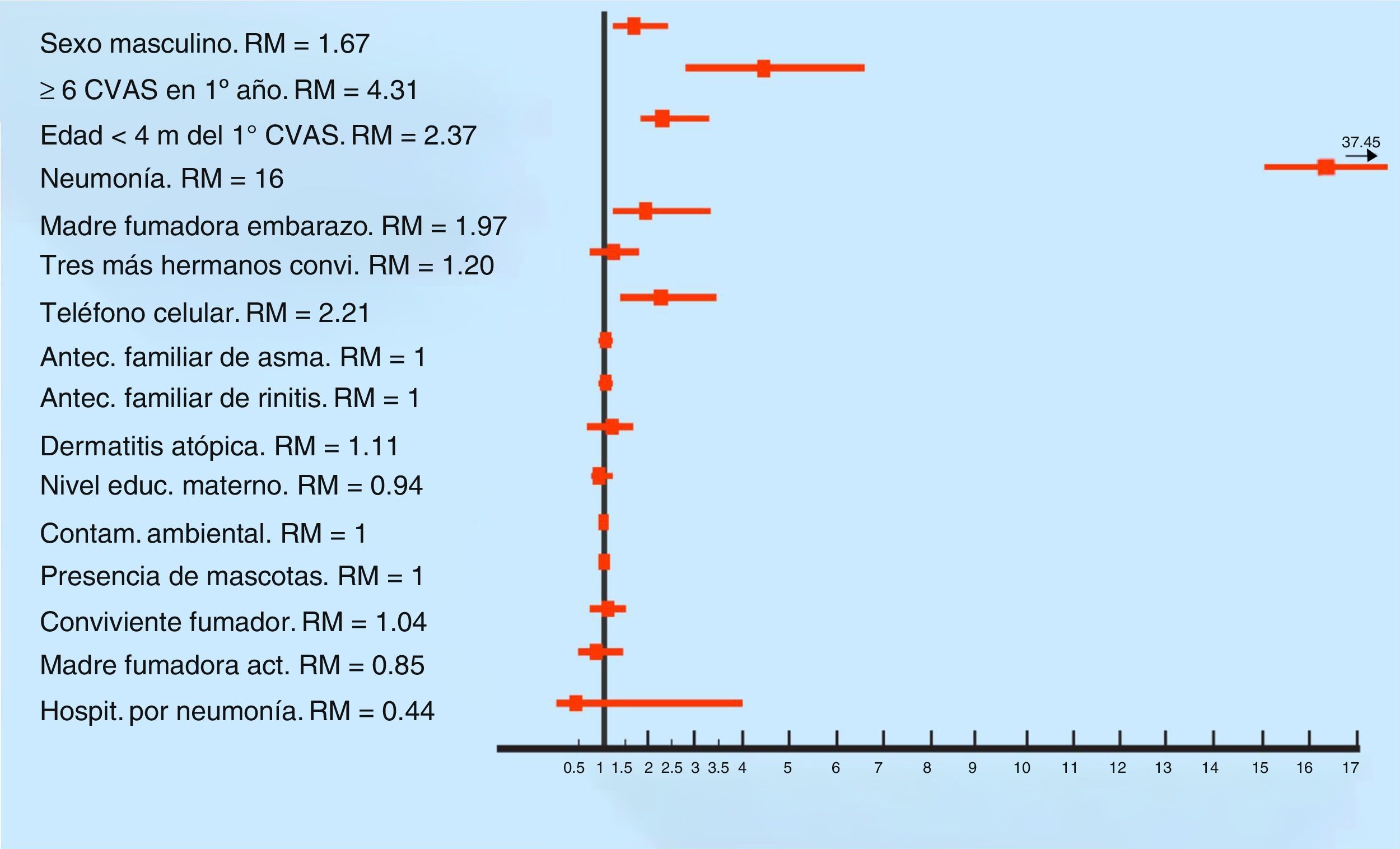
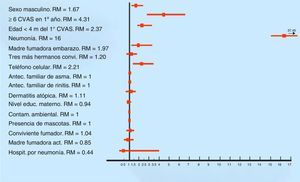
Los factores vinculados al menos a un episodio de sibilancia (n=626) fueron los siguientes (por análisis multivariado): sexo masculino (p=0.001) (Razón de momios (RM) 1.67; IC 95% 1.24-2.24); seis o más resfríos en el primer año de vida (p <0.0001) (RM 4.31; IC 95% 2.79-6.65); edad del primer resfrío <4 meses (p <0.0001) (RM 2.37; IC 95% 1.74-3.23); neumonía (p <0.0001) (RM 16; IC 95% 6.92-37.45); tabaquismo durante el embarazo (p=0.01) (RM 1.97; IC 95% 1.17-3.31) (Figura 1).
Factores de riesgo asociados a los 626 lactantes con sibilancias en el primer año de vida (análisis multivariado). RM: razón de momios; CVAS: catarro de vía aérea superior; convi: convivientes; antec: antecedente; educ: educacional; contam: contaminación; act: actualmente; hospit: hospitalización.
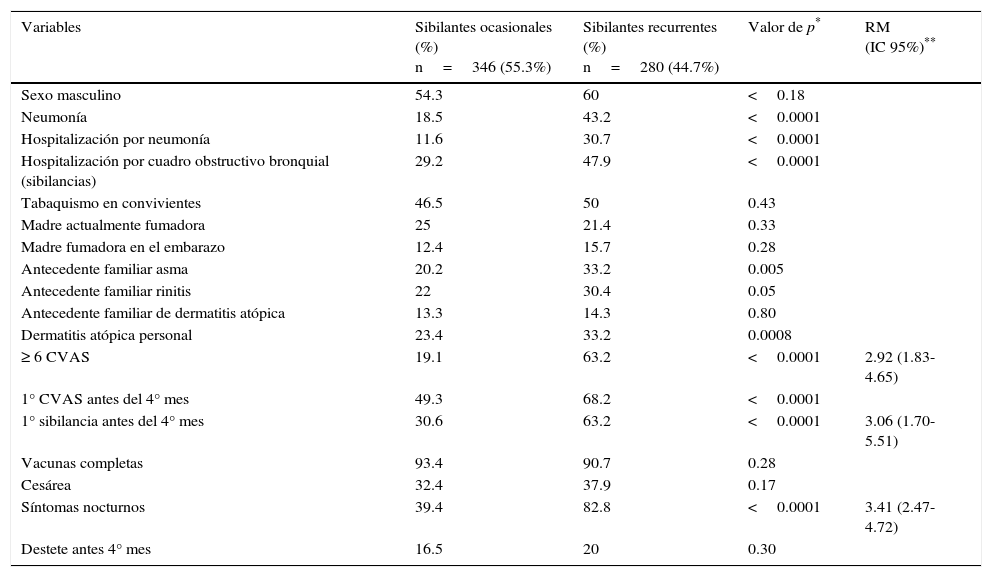
En la tabla 2 se muestra el análisis comparativo entre sibilantes ocasionales y sibilantes recurrentes en el primer año de vida, de acuerdo con las características demográficas, familiares y clínicas (análisis univariado seguido de análisis multivariado, ajustado para las siguientes variables: asma familiar, rinitis familiar, dermatitis atópica personal, primer resfrío antes del cuarto mes, neumonía, hospitalización por neumonía, hospitalización por cuadro obstructivo bronquial).
Análisis comparativo entre sibilantes ocasionales y sibilantes recurrentes en el primer año de vida de acuerdo a características demográficas, familiares y clínicas
| Variables | Sibilantes ocasionales (%) n=346 (55.3%) | Sibilantes recurrentes (%) n=280 (44.7%) | Valor de p* | RM (IC 95%)** |
|---|---|---|---|---|
| Sexo masculino | 54.3 | 60 | <0.18 | |
| Neumonía | 18.5 | 43.2 | <0.0001 | |
| Hospitalización por neumonía | 11.6 | 30.7 | <0.0001 | |
| Hospitalización por cuadro obstructivo bronquial (sibilancias) | 29.2 | 47.9 | <0.0001 | |
| Tabaquismo en convivientes | 46.5 | 50 | 0.43 | |
| Madre actualmente fumadora | 25 | 21.4 | 0.33 | |
| Madre fumadora en el embarazo | 12.4 | 15.7 | 0.28 | |
| Antecedente familiar asma | 20.2 | 33.2 | 0.005 | |
| Antecedente familiar rinitis | 22 | 30.4 | 0.05 | |
| Antecedente familiar de dermatitis atópica | 13.3 | 14.3 | 0.80 | |
| Dermatitis atópica personal | 23.4 | 33.2 | 0.0008 | |
| ≥ 6 CVAS | 19.1 | 63.2 | <0.0001 | 2.92 (1.83-4.65) |
| 1° CVAS antes del 4° mes | 49.3 | 68.2 | <0.0001 | |
| 1° sibilancia antes del 4° mes | 30.6 | 63.2 | <0.0001 | 3.06 (1.70-5.51) |
| Vacunas completas | 93.4 | 90.7 | 0.28 | |
| Cesárea | 32.4 | 37.9 | 0.17 | |
| Síntomas nocturnos | 39.4 | 82.8 | <0.0001 | 3.41 (2.47-4.72) |
| Destete antes 4° mes | 16.5 | 20 | 0.30 |
RM: razón de momios; IC 95%: intervalo de confianza 95%; CVAS: catarro de vías aéreas superiores.
RM (IC 95%) de las variables que permanecen significativas en el análisis multivariado (modelo ajustado para las siguientes variables: asma familiar, rinitis familiar, dermatitis atópica personal, primer resfrío antes del cuarto mes, neumonía, hospitalización por neumonía, hospitalización por cuadro obstructivo bronquial).
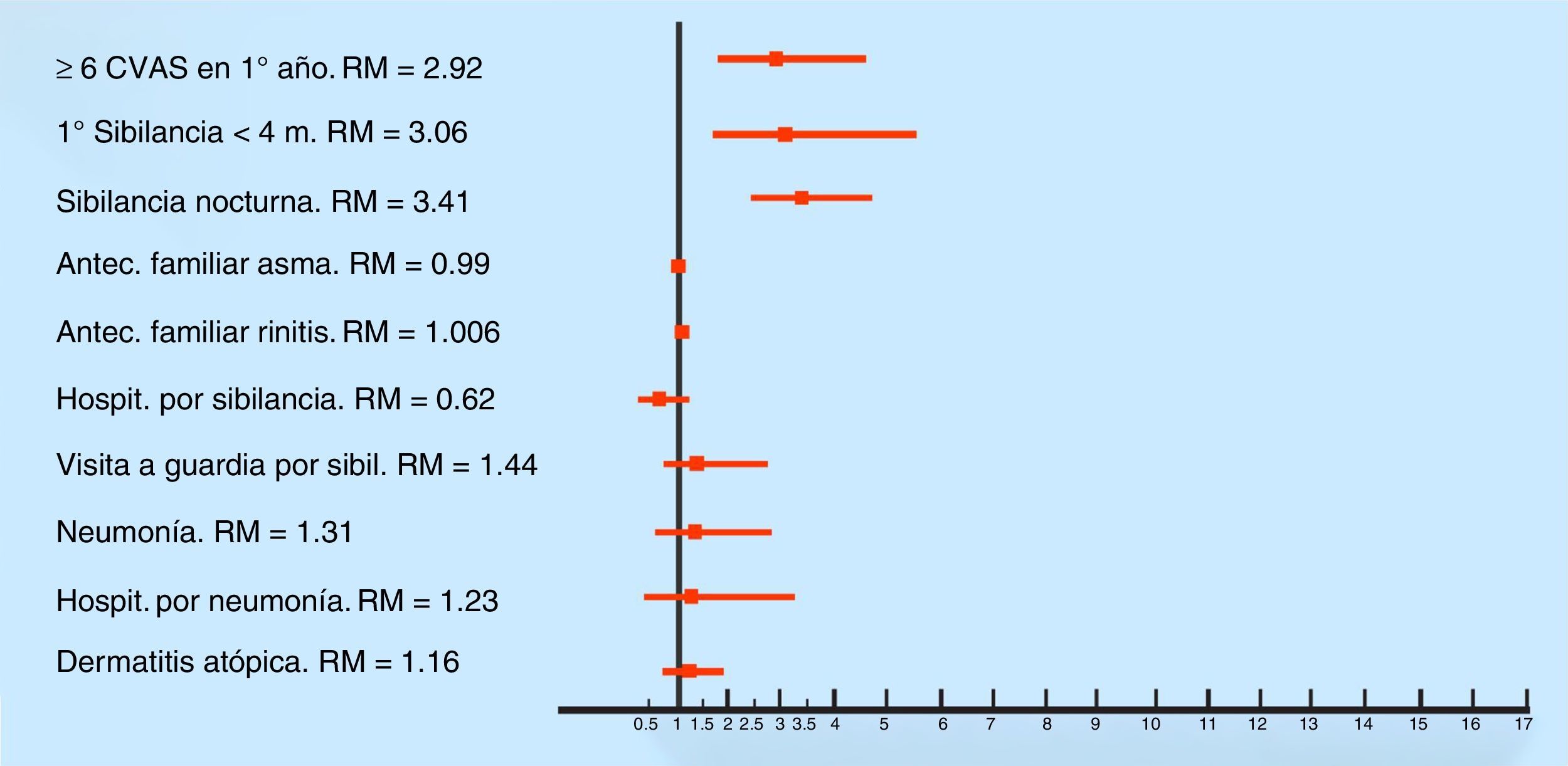
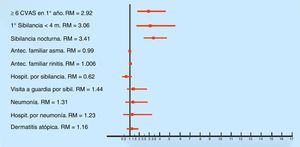
Los factores asociados con SR (por análisis multivariado) fueron los siguientes: haber tenido seis o más resfríos en el primer año de vida (p <0.0001) (RM 2.92; IC 95% 1.83-4.65); tener el primer episodio de sibilancia antes del cuarto mes de vida (p <0.0001) (RM 3.06; IC 95% 1.70-5.51) y presentar sibilancias nocturnas (p <0.0001) (RM 3.41; IC 95% 2.47-4.72) (Figura 2).
4DiscusiónEn este trabajo, la prevalencia de lactantes que sibilaron una o más veces en su primer año de vida fue del 58.9%, similar a la cifra reportada en Montevideo (54.5%), siendo las más altas de la región comparadas con otros centros participantes del EISL (Bucaramanga (22.4%), Cuiabá (27.1%) y Uruguaiana (28.4%))1.
La prevalencia de lactantes con SR fue del 26.3%, similar a la reportada por Montevideo (26.4%) y mayor a la reportada en Uruguaiana (14%), Lima (16.6%) y San Pablo (21.7)1.
La mayor prevalencia de sibilancias en el primer año de vida, así como de SR observadas en Buenos Aires y Montevideo, podrían deberse a factores climáticos semejantes, dada su cercanía geográfica.
La severidad de los episodios entre los pacientes con SR en nuestro centro fue la más alta de la región. Esta severidad se determinó con base en las consultas a guardia por obstrucción bronquial (91.8%), hospitalización por sibilancias (47.9%), diagnóstico médico de neumonía (43.2%) y hospitalización por neumonía (30.7%)1. Asimismo, se observó que la presencia de seis o más infecciones respiratorias virales en el primer año de vida y la edad menor a 4 meses de la primer infección viral respiratoria constituyeron factores asociados para presentar al menos un episodio de sibilancia, así como SR, concordando con estudios previos13–20.
Diversas investigaciones demostraron una clara asociación entre infecciones respiratorias virales a temprana edad y el desarrollo de sibilancias21–25. Otros estudios concluyeron que la infección viral respiratoria en lactantes, tanto leve (resfrío común) como severa (bronquiolitis), sería un factor predisponente para el desarrollo de sensibilización alérgica posterior en la niñez y adolescencia13.
En Finlandia, los pacientes hospitalizados por rinovirus con bronquiolitis presentaron mayor riesgo de padecer asma; esta relación se mantuvo hasta los 10 años de edad14,15.
En España, en un estudio publicado recientemente, se evaluaron las infecciones virales respiratorias en una cohorte de recién nacidos mediante PCR. Se detectó que el rinovirus fue el agente más frecuentemente involucrado. Los autores demostraron que los lactantes que requirieron hospitalización por su primer infección viral, presentaron un riesgo incrementado de desarrollar sibilancias recurrentes, en comparación con aquellos lactantes cuya primer infección viral fue leve o asintomática26.
Asimismo, Bønnelykke y colaboradores16 evaluaron la asociación entre las infecciones respiratorias virales (VSR, rinovirus, entre otros) y bacterianas en lactantes y el desarrollo de asma en la niñez. Concluyeron que el número total de infecciones respiratorias padecido a temprana edad fue un factor de riesgo para desarrollar asma, independientemente del agente causal específico.
Uno de los factores asociados al desarrollo de al menos un episodio de sibilancia fue el sexo masculino, coincidiendo con publicaciones previas27–29. Se ha descrito que los lactantes varones normalmente presentan valores de Vmax FRC (flujo espiratorio máximo a nivel de capacidad residual funcional) menores con respecto a las niñas30, lo que podría explicar el desarrollo de sibilancias en los pacientes varones en este grupo etario.
Los pacientes que padecieron al menos un episodio de sibilancia presentaron una probabilidad 16 veces mayor de padecer neumonía con respecto a los que nunca presentaron sibilancia. En trabajos de seguimiento a largo plazo se demostró que, en niños menores de 2 años que habían padecido bronquiolitis o neumonía, se incrementó la prevalencia de sibilancias, aun en la adultez31–33.
La prevalencia de madres que fumaron durante el embarazo fue del 10.9% (IC 95% 9.13-12.9%); en los Estados Unidos, la prevalencia oscila del 10% al 20%34,35. El presente estudio también demostró que el tabaquismo durante el embarazo constituye un factor asociado a padecer al menos un episodio de sibilancia durante el primer año de vida. Hallazgos similares se informaron en el resto de Latinoamérica y Europa1,2,28. En las madres que fuman durante el embarazo, y aun en las que están expuestas al humo del tabaco ajeno, se produce una alteración en la respuesta inmunitaria fetal, con disminución en los linfocitos T cooperadores (CD4+) e incremento del riesgo alérgico, favoreciendo los episodios obstructivos bronquiales36–39, lo cual podría explicar, en parte, los resultados observados es este estudio. La exposición prenatal al tabaquismo materno disminuye aún más la distensibilidad pulmonar, reduciendo la elastina en el intersticio pulmonar, con lo cual las vías aéreas pequeñas permanecerán con menor calibre.
La prevalencia de la exposición al humo del tabaco de los convivientes fue del 45.5% en este trabajo. No obstante no constituyó un factor asociado para el desarrollo de sibilancias. Otros autores comprobaron que la exposición al humo del tabaquismo ajeno incrementa la hiperreactividad bronquial en forma proporcional al número de cigarrillos fumados dentro del hogar; incluso, se ha demostrado que aumenta la incidencia de asma en niños y adolescentes por lo menos en el 20%38.
La lactancia materna entre los lactantes de este trabajo no constituyó un factor de protección para presentar episodios de sibilancias. Sin embargo, fue un claro factor de protección en el EISL de toda Latinoamérica1. Estas diferencias podrían deberse al número de pacientes encuestados.
En este estudio, los lactantes con SR tuvieron 3.4 veces más probabilidad de presentar sibilancias nocturnas con respecto a los pacientes con sibilancias ocasionales. En la última norma del Global Initiative for Asthma (GINA)11, se describió que los lactantes con episodios recurrentes de sibilancias, que incluyen aquellas durante el sueño, orientan al diagnóstico de asma. Asimismo, en un trabajo donde se evaluaron niños de 6 a 20 meses de edad que padecieron SR y presentaban factores de riesgo para desarrollar asma (antecedentes familiares de asma u otro hallazgo de atopia en uno o ambos padres), se constató la disminución de su Vmax FRC en la función pulmonar40.
Pareciera que la clave para el desarrollo de sibilancias se encuentra en la interacción inmunogenética y ambiental, tanto en el periodo fetal como en los primeros meses de vida.
La alta prevalencia de sibilancias recurrentes y su severidad expresada en las cifras de hospitalizaciones y consultas a urgencia por cuadros obstructivos bronquiales constituye un factor de carga laboral y económica muy importante para los centros de salud y para los padres.
Una limitación de este trabajo fue que, al ser un estudio transversal, se dificulta reconocer sin duda el predictor del resultado, lo que no ocurriría en un estudio longitudinal de cohorte. Por ello, algunos de los factores identificados asociados con el padecimiento de sibilancias tanto ocasionales como recurrentes podrían prevenirse si se confirmara su causalidad en un estudio de cohorte longitudinal.
La implementación de acciones de salud pública destinadas a disminuir las infecciones respiratorias virales tempranas y el tabaquismo materno en el embarazo podrían resultar en una disminución de la prevalencia y la severidad de episodios de sibilancias en el primer año de vida.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoNinguno.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Dario Rajmilovich, Jana Cao y al Dr. Vicente Castiglia.