Recién nacida pretérmino con defecto de pared abdominal que ingresó al Hospital Infantil de México Federico Gómez (HIMFG) a las 24h de vida extrauterina. La madre, de 16 años de edad, había recibido atención prenatal desde el primer trimestre del embarazo, ácido fólico y multivitamínicos. Se le habían realizado tres ultrasonidos obstétricos. En el último se observó oligohidramnios severo y un defecto en la pared abdominal.
Nació en un hospital general mediante cesárea a las 36 semanas de gestación (SDG). Su peso al nacer fue de 2,200g y talla de 42cm. Obtuvo una calificación de Apgar de 7/9. Tenía un defecto de la pared abdominal con exposición de asas de intestino y estómago, los cuales fueron envueltos en gasas y cubiertos con una bolsa estéril. Se inició ventilación mecánica a través de tubo endotraqueal. Se mantuvo en ayuno con soluciones intravenosas y cobertura antimicrobiana con cefotaxima y amikacina. Con este manejo fue trasladada al HIMFG.
A su ingreso al HIMFG se registraron los siguientes datos: peso 2,620g, frecuencia cardiaca 160/min, frecuencia respiratoria 50/min, presión arterial 53/37mmHg, temperatura 36°C, llenado capilar de 2 s. A la exploración física se encontró con piel pálida, bien hidratada, inconsciente por sedación, soplo continuo en segundo espacio intercostal izquierdo y abdomen con defecto de pared de 4cm de diámetro a la derecha de cordón umbilical, con asas intestinales expuestas, de coloración rosa/rojiza, edematizadas, cubiertas con bolsa y fijadas con venda. El resto de la exploración, sin alteraciones.
En la unidad de cuidados intensivos neonatales permaneció en ayuno, con líquidos intravenosos y cobertura antibiótica con ampicilina, amikacina y metronidazol. En los estudios de laboratorio realizados al ingreso se encontró con alteración en las pruebas de función hepática: bilirrubinas totales 2.66mg/dl, bilirrubina directa 2.56mg/dl, aspartato aminotransferasa 269 U/l, alanino aminotransferasa 82 U/l, albúmina 0.8g/dl, globulinas 1.6g/dl, proteínas totales 2.4g/dl.
En el ecocardiograma se identificó conducto arterioso permeable de 2mm de diámetro con gradiente de presión de 21mmHg. La presión sistólica de ventrículo derecho (PSVD) era de 48mmHg.
A la exploración quirúrgica no se encontraron perforaciones ni datos de isquemia intestinal. Se colocó un silo suturado a la aponeurosis de manera tal que las asas intestinales se retrajeran hacia la cavidad abdominal por efecto de la gravedad.
Después de a la cirugía se mantuvo con nutrición parenteral. El manejo ventilatorio fue complicado y requirió aumento de parámetros hasta que al final de la primera semana postquirúrgica se inició ventilación de alta frecuencia y administración de óxido nítrico. Debido a la presencia de infiltrado basal derecho en la radiografía simple de tórax y a un aumento en los leucocitos y las bandas, se cambió el esquema antibiótico a cefepime y amikacina.
La segunda semana postquirúrgica cursó con inestabilidad hemodinámica por lo que se inició apoyo aminérgico y milrinona. Continuó con estrategias de reclutamiento alveolar, óxido nítrico y ventilación de alta frecuencia con altas concentraciones de oxígeno. Se escaló el esquema antibiótico a meropenem y vancomicina.
En la tercera semana postquirúrgica mejoró el estado hemodinámico, lo que permitió la disminución del apoyo aminérgico y ventilatorio. Las asas intestinales lucían rosa pálido con líquido cetrino. Un ultrasonido transfontanelar identificó hemorragia intraventricular grado II. El ecocardiograma en esta semana encontró PSVD 24mmHg, fracción de eyección de 79%, fracción de acortamiento de 45% y conducto arterioso casi cerrado.
En la cuarta semana de estancia, se inició infusión de albúmina al 25% a 0.5mg/kg por persisitir con albúmina por debajo de 1.5g/dl. Las asas intestinales continuaban con buena coloración y descenso paulatino a la cavidad abdominal. Sin embargo, presentó deterioro ventilatorio y hemodinámico y un reporte de antígeno de manano de 190pg/ml, por lo que se inició administración de anfotericina B y se escaló apoyo aminérgico y ventilatorio hasta que a los 24 días de vida extrauterina presentó paro cardiorrespiratorio que no respondió a maniobras de reanimación.
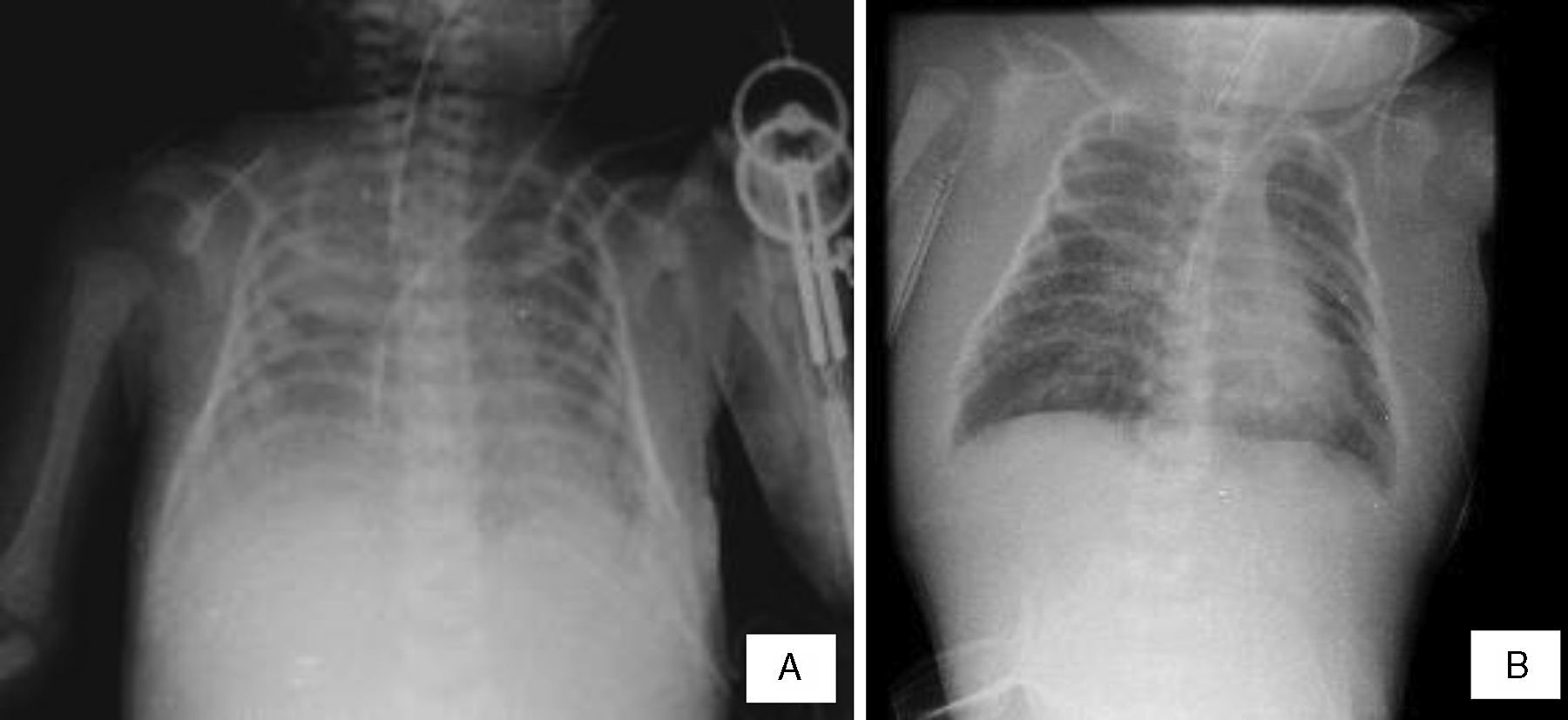
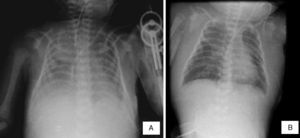
2Imagenología (Dra. María Teresa Valadez)En las últimas radiografías se observó borramiento de los ángulos costodiafragmáticos, opacidad en pulmón izquierdo y engrosamiento de los tejidos blandos (Figura 1A). No se puede descartar zona de consolidación. Se puede observar el edema de tejidos blandos de manera difusa hasta cuello y un infiltrado pulmonar sugerente de edema pulmonar agudo (Figura 1B).
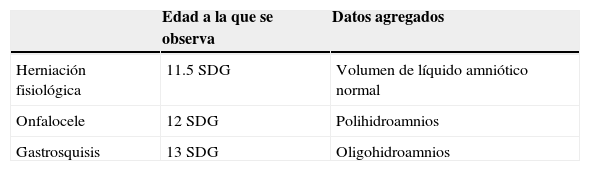
En nuestro medio, el diagnóstico prenatal de gastrosquisis no se establece con la frecuencia que debería. Una posible explicación es que la mayoría de los ultrasonidos obstétricos son realizados por médicos ginecobstetras y neonatólogos que no siempre cuentan con experiencia en la interpretación de este método de imagen. Por ello, se presenta un resumen de los hallazgos ultrasonográficos útiles (Tabla 1). Se han descrito otros hallazgos asociados con la severidad de daño en gastrosquisis, como la presencia de un asa fija dilatada mayor de 2.5cm.
3Presentación del caso (Dra. Ma. Guadalupe Vega González)El abordaje de un recién nacido con defecto de pared abdominal debe iniciar desde el periodo prenatal. El cierre fisiológico de la pared abdominal ocurre entre la décima y la decimotercera SDG. El diagnóstico de gastrosquisis es posible al final del primer trimestre mediante ultrasonido con una sensibilidad del 60-75% y una especificidad del 95%. Se debe hacer diagnóstico diferencial con onfalocele, en el cual, a diferencia de la gastrosquisis, se encuentra una membrana cubriendo las asas. Con el ultrasonido también se puede medir el grosor y la dilatación de las asas intraabdominales, y con esto estimar el riesgo de atresia intestinal y mal pronóstico1.
El ser hijo de madre adolescente y producto de la primera gesta son factores de riesgo para malformaciones congénitas como la gastrosquisis. La restricción del crecimiento intrauterino es un factor asociado, ya que se encuentra del 20 al 60% de los casos. El antecedente de oligohidramnios severo debió alertar al personal de salud, ya que dicho hallazgo se asocia con alta mortalidad del producto e indica la necesidad de referir a un centro especializado que cuente con obstetra perinatólogo, cirujano pediatra y neonatólogo2.
El manejo debe comenzar con la protección de la vía aérea y reanimación hídrica de acuerdo con los requerimientos de cada paciente. Posteriormente, se debe colocar sonda orogástrica para disminuir la presión de los vasos mesentéricos. Para proteger las estructuras evisceradas se recomienda cubrirlas con una bolsa estéril, de preferencia de silastic, para evitar la pérdida de proteínas, líquidos y calor a través de las asas intestinales3. Es importante que el personal que recibe a recién nacidos con gastrosquisis sepa que debe cubrir las asas intestinales con bolsas estériles inmediatamente después de la reanimación para evitar la contaminación y daño a la serosa del intestino. Si el cirujano pediatra está presente para realizar la reducción de las asas intestinales en un corto tiempo, se puede mantener cubierto el intestino con esponjas húmedas que permitan la hidratación continua4.
Desde enero de 2014, en la unidad de cuidados intensivos neonatales del HIMFG se lleva a cabo un protocolo de manejo de pacientes con gastrosquisis que consiste en lo siguiente:
- 1)
Referencia y traslado seguro del paciente, con asesoría directa, asas cubiertas con bolsa plástica y sin uso de gasas húmedas.
- 2)
Manejo quirúrgico que incluye uso de silo prearmado o cierre de pared sin sutura, dependiendo de las condiciones clínicas del paciente.
- 3)
Uso de analgesia gentil para evitar la necesidad de intubación.
- 4)
Manejo médico con inicio temprano de alimentación parenteral y enteral y cobertura antimicrobiana. Con este protocolo de manejo se ha logrado disminuir la mortalidad a 2.5% (E. Bracho-Blanchet, comunicación personal).
Gracias a la fácil colocación de los silos preformados en la cama del paciente sin necesidad de anestesia general, se ha facilitado la reintroducción a la cavidad abdominal de las asas intestinales en pacientes con defectos de pared abdominal tipo gastrosquisis. Estas bolsas de silo son dispositivos prearmados, económicos y eficientes para la reducción progresiva de la gastrosquisis grave, con un anillo cuyo diámetro interno se adapta al defecto de la cavidad peritoneal. La colocación del silo disminuye el riesgo de hipertensión intraabdominal y de síndrome compartamental asociados con el cierre primario del defecto.
Los pacientes con hipoalbuminemia grave, esto es, menor de 1.5g/dl, tienen alta mortalidad y alta frecuencia de falla intestinal; es decir, fracaso para tolerar la alimentación enteral, y requieren nutrición parenteral prolongada con una media de 28 días después al cierre de la pared abdominal. Estos niveles bajos de albúmina se deben a la pérdida de proteínas durante el periodo fetal a través del intestino expuesto. Se puede considerar la infusión de albúmina, aunque su uso es controvertido en neonatología debido a los efectos adversos que se han descrito5.
Desde el punto de vista de Infectología, en este caso se estableció un diagnóstico presuntivo de candidiasis invasiva, la cual es una infección nosocomial que se presenta en el 0.5-1.2% de los pacientes de la unidad de cuidados intensivos neonatales, y cuya mortalidad es de hasta el 75% según el peso del paciente y la especie de cándida involucrada6. Entre los factores de riesgo para candidiasis invasiva nosocomial se encuentran la hospitalización prolongada, la administración prolongada de antibióticos de amplio espectro y la colocación de sondas y catéteres. El diagnóstico de certeza se realiza mediante cultivo; sin embargo, la sensibilidad de este es muy baja, por lo que frecuentemente se inicia tratamiento de forma empírica.
Los diagnósticos finales son los que se mencionan a continuación:
- 1.
Recién nacido pretérmino tardío de 36 SDG
- 2.
Restricción del crecimiento intrauterino simétrico
- 3.
Defecto de pared abdominal tipo gastrosquisis
- 4.
Peritonitis secundaria
- 5.
Hipoalbuminemia
- 6.
Persistencia de conducto arterioso en vías de cierre
- 7.
Hipertensión arterial pulmonar persistente
- 8.
Neumonía nosocomial
- 9.
Insuficiencia respiratoria hipóxica
- 10.
Hemorragia intraventricular gado II
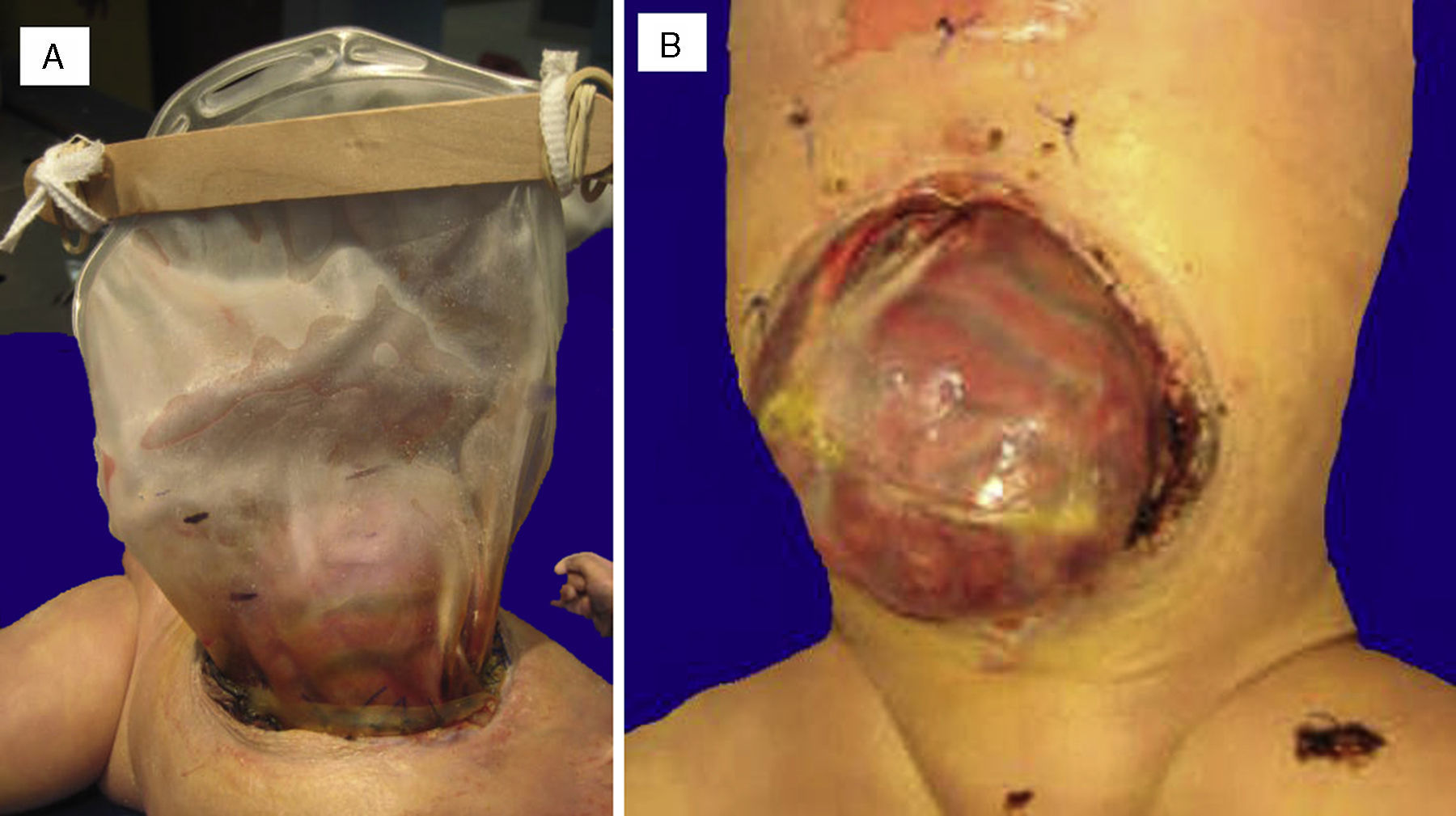
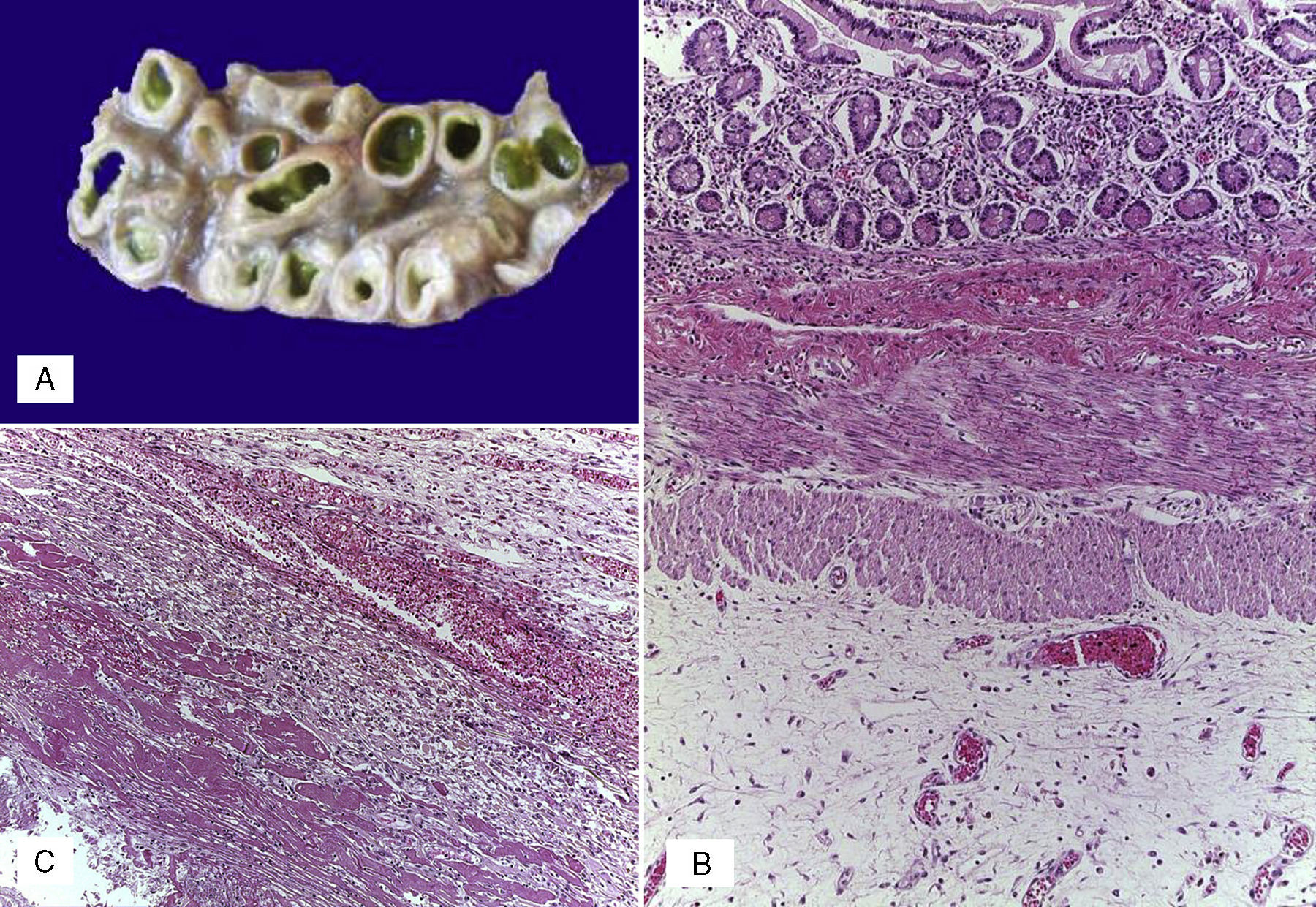
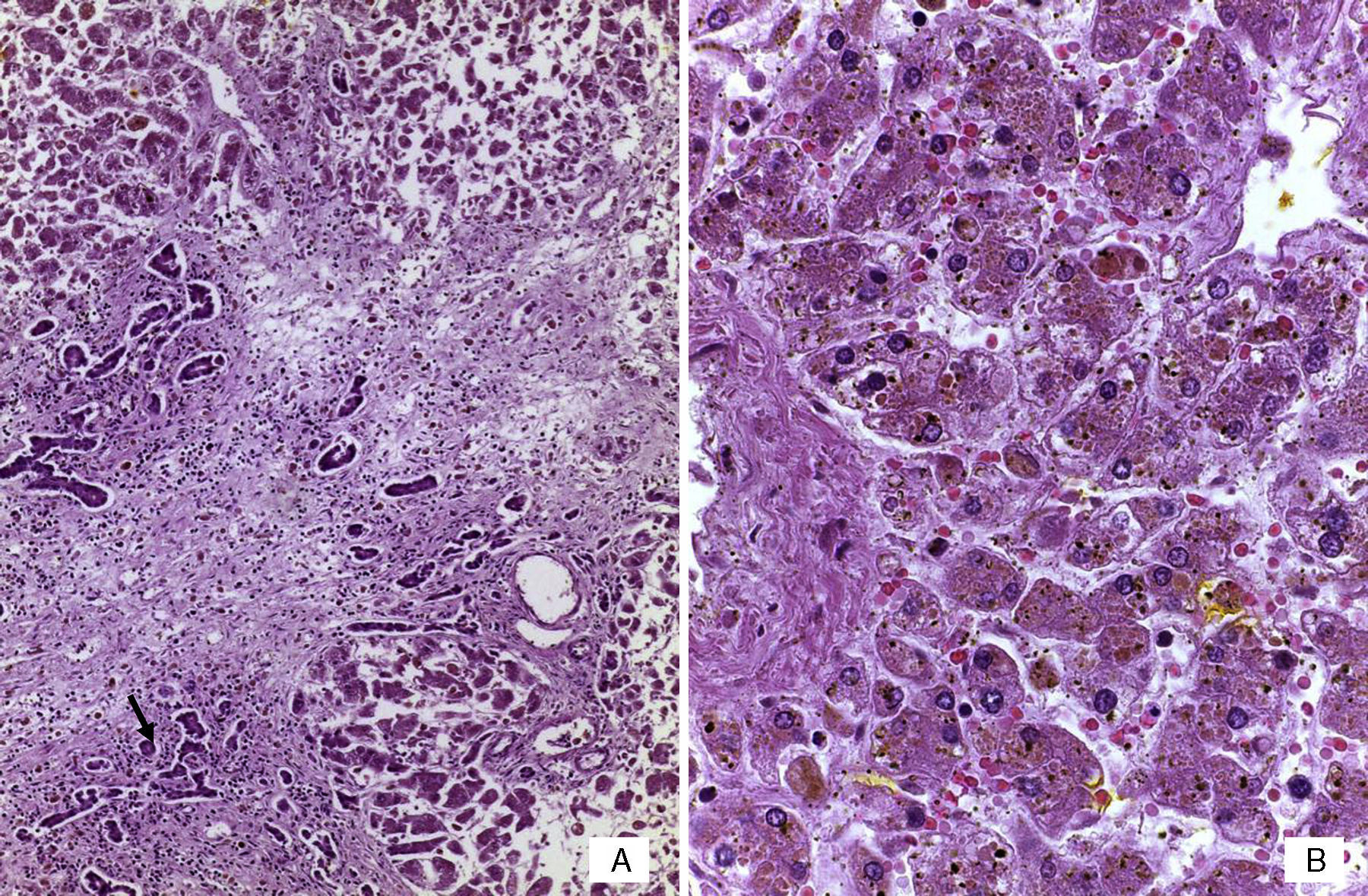
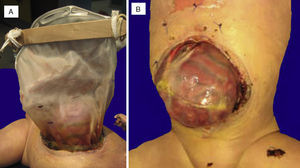
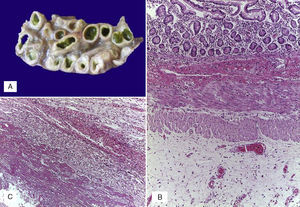
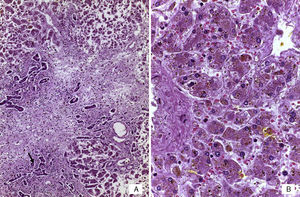
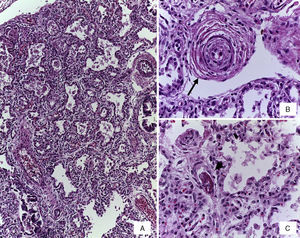
Se realizó la autopsia de una recién nacida que presentó en el aspecto exterior edema de piel y tejidos blandos, además de un defecto en la pared abdominal de 12cm de diámetro cubierto por silo de plástico con suturas íntegras (Figura 2). Cuando se retiró el silo se observó que las asas de intestino delgado se encontraban fuera de la cavidad abdominal por desproporción víscero-abdominal, estaban cubiertas por depósito de fibrina blanquecina, tenían aspecto edematoso y se encontraban unidas por adherencias. El estudio histopatólgico del aparato digestivo mostró edema de la submucosa en estómago y serosa del intestino, peritonitis crónica fibroadhesiva y aguda extensa (Figura 3). El hígado estaba aumentado de tamaño, de consistencia blanda y el parénquima de color café-amarillo. Microscópicamente se observó necrosis reciente panlobular del parénquima, en puente, con proliferación de neocolangiolos y colapso, así como colestasis hepatocelular y canalicular (Figura 4). No se identificaron inclusiones virales ni microorganismos por lo que se consideró que la necrosis fue secundaria a choque. Desde su ingreso la paciente presentaba hipoalbuminemia grave la cual se ha asociado con un pronóstico desfavorable. Se ha referido que la causa de la hipoalbuminemia es por la pérdida de líquidos de la cavidad amniótica secundaria al defecto abdominal y exposición de asas intestinales. Sin embargo, la necrosis hepática que la paciente desarrolló al final también contribuyó a agravar esta hipoalbuminemia por falta de síntesis7,8.
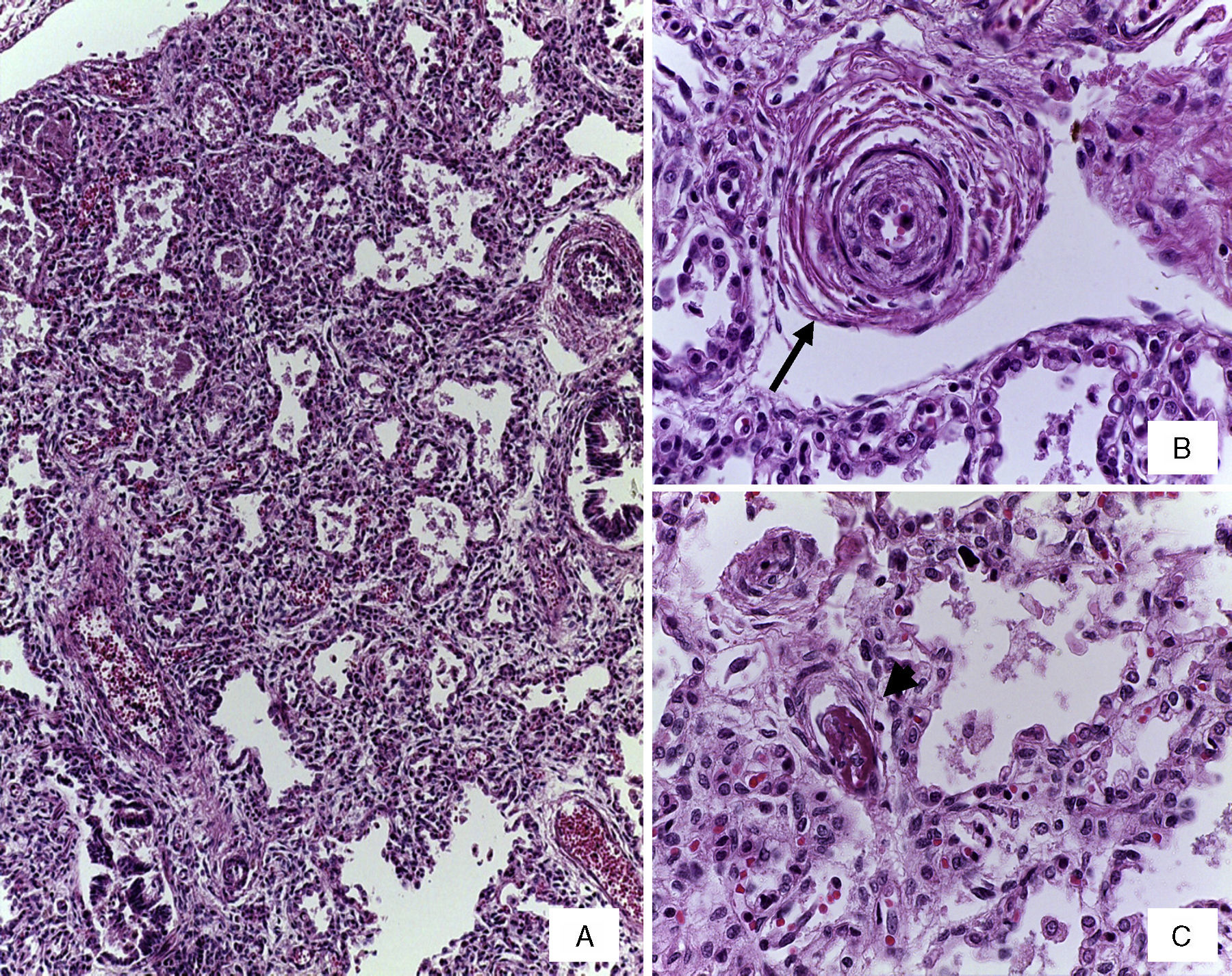
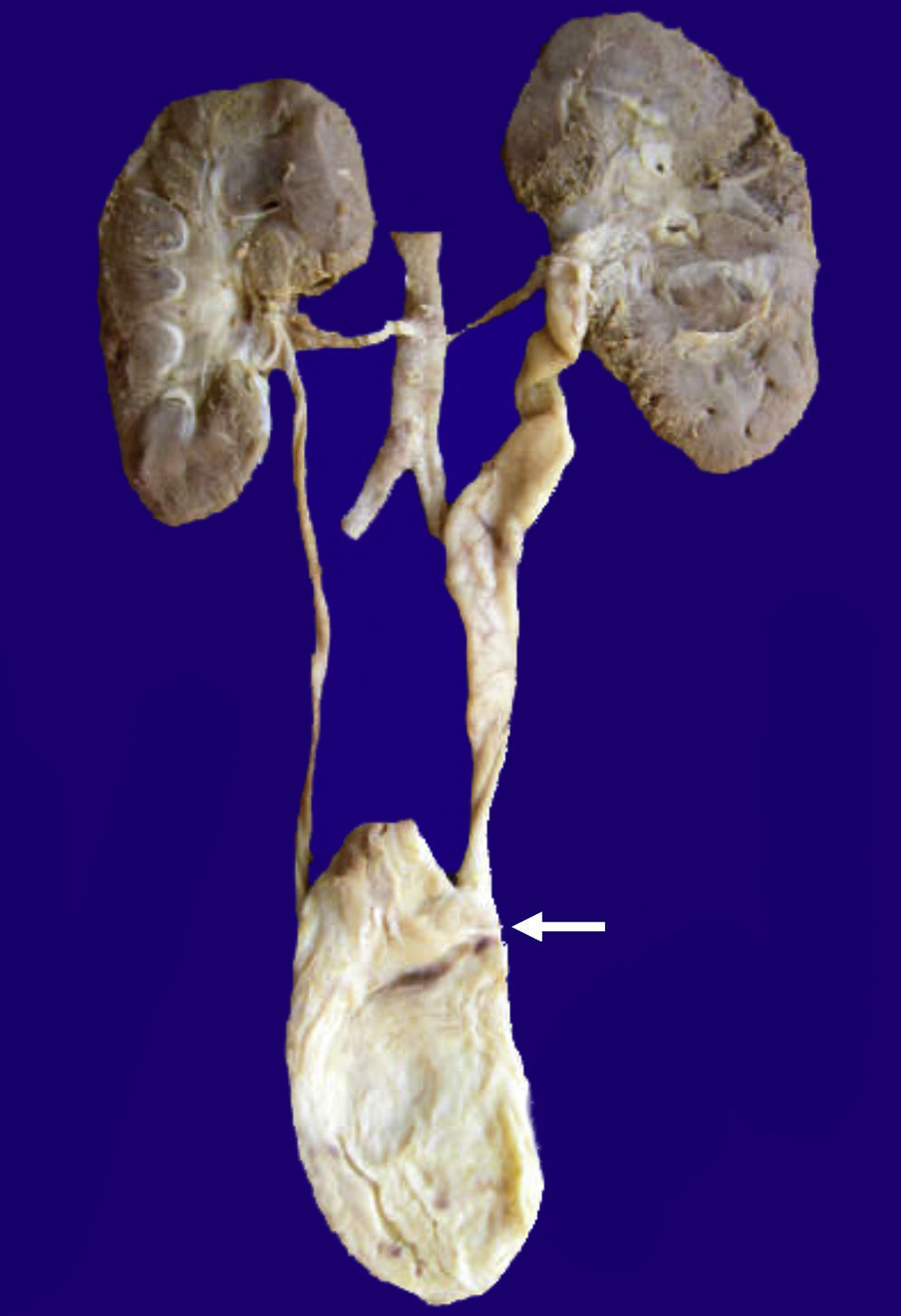
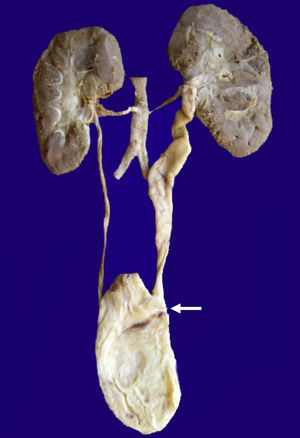
En la vasculatura pulmonar arterial se observaron alteraciones que corresponden a datos morfológicos de hipertensión vascular grado B y engrosamientos de los tabiques por infiltrado linfocitario por neumonitis (Figura 5). En ninguno de los cortes ni en las tinciones especiales se observaron hongos, bacterias ni inclusiones virales. Como malformación asociada se encontró una implantación anómala del uréter en la vejiga que ocasionaba dilatación de la luz y tortuosidad del mismo (Figura 6). El cerebro presentaba datos de encefalopatía hipóxica y no se encontró hemorragia intravaentricular.
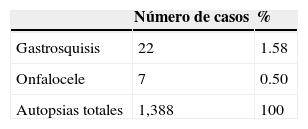
Esta paciente con gastrosquisis fue la última a la que se le realizó un estudio post mórtem en el HIMFG. En el Departamento de Patología de este instituto se realizaron 1,388 autopsias durante el periodo de 1997 a 2011, de las cuales 29 han correspondido a defectos de la pared abdominal. De estas, 22 han sido gastrosquisis (Tabla 2). Se ha informado un aumento en la frecuencia de gastrosquisis en los productos de madres jóvenes en Europa, por lo que se espera que el número de casos que lleguen a los hospitales de tercer nivel sea mayor9.
Gastrosquisis con exposición de intestino delgado y estómago.
4.2Alteraciones concomitantes- •
Desproporción víscero-abdominal
- •
Peritonitis aguda y crónica con adherencias
- •
Status post colocación de silo
- •
Hipoalbuminemia grave
- •
Anasarca
- •
Edema de tejidos blandos
- •
Edema submucoso en estómago y de serosa de intestino
- •
Enfermedad vascular pulmonar grado B
- •
Necrosis hepática submasiva
- •
Hepatomegalia (300g vs 127g)
- •
Colestasis hepática mixta, grave
- •
Encefalopatía hipóxico-isquémica
- •
Hidronefrosis e hidrouréter izquierdo secundarios a implantación anómala
La causa inmediata de la muerte se atribuyó a la hipoalbuminemia y sepsis. Los cultivos post mórtem fueron positivos para Staphylococcus epidermidis en el hemocultivo, pulmón derecho, bazo e hígado.
5Comentarios finales5.1Departamento de Cirugía (Dr. Eduardo Bracho Blanchet)A partir de 2014 se ha implementado en el Instituto un nuevo protocolo de manejo para los pacientes con Gastrosquisis. Este consiste en los siguientes pasos:
- 1)
Referencia temprana y traslado seguro.
- 2)
Manejo quirúrgico con silo prearmado o cierre primario en la cama del paciente en UCIN.
- 3)
Manejo médico multidisciplinario.
- 4)
Alimentación parenteral y enteral temprana, con esquema ya estandarizado para todos los pacientes.
Con dicha estrategia, la mortalidad ha disminuido. El presente caso fue el último que falleció en el HIMFG por gastrosquisis antes del 2014. Del 2014 al 2015 se han tratado 35 pacientes con gastrosquisis mediante cierre del defecto sin el uso de suturas. Desde entonces solamente ha fallecido un paciente, pero no se realizó autopsia.
5.2Departamento de Gastroenterología (Dr. Salvador Villalpando Carrión)El manejo actual de los pacientes con gastrosquisis se basa en el tratamiento siguiente:
- 1)
Nutrición parenteral temprana y de duración corta.
- 2)
Manejo de la colestasis.
- 3)
Introducción de nuevos lípidos.
- 4)
Nutrición enteral temprana (5 días).
- 5)
Glutamina parenteral.
Se ilustra un caso de defecto de pared tipo gastrosquisis con un factor de mal pronóstico poco frecuente que es la hipoalbuminemia grave.
El paciente que nos ocupa falleció en 2012 y es el último paciente con esta enfermedad al que se le realizó un estudio post mórtem, ya que a partir de 2014 se ha implementado un nuevo protocolo de manejo con muy buenos resultados. Se debe enfatizar la importancia de la referencia temprana y el traslado seguro de estos pacientes a un hospital de tercer nivel de atención para un manejo multidisciplinario avanzado.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación nose han realizado experimentos en seres humanos ni enanimales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datosde pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datosde pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.