El autismo, hoy en día definido como trastornos del espectro autista, fue descrito inicialmente en 1943. Se caracteriza por alteraciones en la comunicación, la interacción social y un espectro restringido de intereses del paciente. Generalmente se identifica en etapas tempranas del desarrollo a partir de los 18 meses de edad. Actualmente el autismo se considera un desorden neurológico con un espectro que abarca diferentes grados que se asocian con factores genéticos, no genéticos y del medio ambiente. Dentro de los factores genéticos se han referido diversos síndromes relacionados con este trastorno. Asimismo, el autismo se ha estudiado a nivel genético, neurofisiológico, neuroquímico y neuropatológico. Las técnicas de neuroimagen han mostrado múltiples anormalidades estructurales en estos pacientes. También se han observado alteraciones relacionadas en los sistemas serotoninérgico, GABAérgico, catecolaminérgico y colinérgico. En este trabajo se presenta una actualización de la información de los aspectos genéticos y neuroendocrinos del trastorno del espectro autista.
The autism spectrum disorder (ASD) was described in 1943 and is defined as a developmental disorder that affects social interaction and communication. It is usually identified in early stages of development from 18 months of age. Currently, autism is considered a neurological disorder with a spectrum covering cases of different degrees, which is associated with genetic factors, not genetic and environmental. Among the genetic factors, various syndromes have been described that are associated with this disorder. Also, the neurobiology of autism has been studied at the genetic, neurophysiological, neurochemical and neuropathological levels. Neuroimaging techniques have shown multiple structural abnormalities in these patients. There have also been changes in the serotonergic, GABAergic, catecholaminergic and cholinergic systems related to this disorder. This paper presents an update of the information presented in the genetic and neuroendocrine aspects of autism spectrum disorder.
El autismo, hoy en día definido como trastornos del espectro autista (TEA), fue descrito inicialmente por el doctor Leo Kanner en 1943. Está caracterizado por alteraciones en la interacción social, la comunicación y un espectro restringido de intereses de los pacientes. El diagnóstico se realiza en etapas infantiles. Los pacientes se describen como niños retraídos, que tienen una forma inusual de relacionarse, con escaso lenguaje o poca comunicación, apegados a rutinas, que presentan comportamientos repetitivos extraños, formas inusuales de juego y falta de reciprocidad emocional hacia las personas1. Actualmente, el autismo se considera un desorden neurológico de amplio espectro que abarca casos de diferentes grados asociados con factores genéticos y del medio ambiente, cuya manifestación es variable. Generalmente se identifica en etapas tempranas, a partir de los 18 meses de edad. Más aún, se ha propuesto que las alteraciones en múltiples genes en combinación con la presencia de factores no genéticos constituyen la causa para el desarrollo del fenotipo correspondiente al autismo, el cual representa, en sí, un conjunto de alteraciones genéticas atípicas que generan un mismo fenotipo2.
2DiagnósticoEl diagnóstico del autismo, o bien de los TEA (en inglés ASD, por las siglas para Autism Spectrum Disorders), tiene como base el estudio clínico. Hasta el momento no se ha identificado un marcador biológico totalmente confiable3. Sin embargo, y con base en los diversos síntomas indicativos de los TEA, diferentes especialistas han sugerido una estrategia comprensible, estructurada y sistemática, tanto para el diagnóstico como para el tratamiento, con el fin de identificar las diversas capacidades y limitantes específicas en cada paciente con TEA4. Algunos de los síntomas presentes en pacientes autistas también se presentan en niños con discapacidad mental sin autismo. Por ejemplo, los pacientes con autismo pueden mostrar diferentes grados de déficit cognitivo y, a su vez, los pacientes con discapacidad intelectual pueden desarrollar estereotipias y dificultades en la comunicación características de los pacientes con TEA.
Sin embargo, lo anterior representa un problema para el diagnóstico preciso del autismo5. Por esto se requieren diversas pruebas para el diagnóstico oportuno de este conjunto de patologías. Para ello, los especialistas médicos, así como los investigadores en el campo, han diseñado varios cuestionarios. Además, se encuentran los criterios establecidos por la Asociación Americana de Psiquiatría en el Manual Diagnóstico y Estadístico de Trastornos Mentales o DSM-V-TR, publicado recientemente, en el cual se han mejorado los criterios diagnósticos al consensuarlos y simplificarlos. Asimismo, se integran a este manual los últimos hallazgos derivados de estudios genéticos y de neuroimagen, específicos para cada uno de los TEA. De igual forma, se reconocen y detallan los síntomas que se presentan y que abarcan varias categorías de diagnóstico, ampliando así la perspectiva clínica. Los criterios específicos han sido consolidados e incluyen el trastorno autista, el síndrome de Asperger y el trastorno generalizado del desarrollo en el espectro autista. Por último, se ha optimizado la clasificación de otros trastornos, como la bipolaridad y la depresión. Todo ello con la finalidad de coadyuvar de forma coherente con el diagnóstico en la práctica clínica6.
Los criterios específicos para el diagnóstico de los TEA se derivan de tres dominios.
Afectación de la interacción social: a) impedimento del uso de comunicación no-verbal como contacto visual, expresión facial y postura corporal; b) incapacidad para desarrollar relaciones con pares en edad; c) carencia para compartir o comunicar afecto e intereses con otras personas; d) interés o noción limitada sobre las reacciones y emociones de otros.
Alteraciones cualitativas en las habilidades de comunicación: a) retraso o falta de adquisición del lenguaje; b) incapacidad de iniciar o mantener una conversación; c) empleo del lenguaje de forma estereotipada o repetitiva, o bien empleo de lenguaje idiosincrásico; d) inexistente desarrollo de juegos de imitación o pretensión apropiados para la edad.
Presencia de patrones restrictivos o repetitivos en el comportamiento: a) preocupación exacerbada por un número restricto de intereses inusuales; b) adherencia inflexible a ciertos hábitos o rutinas; c) estereotipias motoras; d) preocupación o apego exagerado a partes de objetos.
El diagnóstico de autismo se confirma cuando el individuo evidencia un total de seis o más comportamientos de los tres dominios mencionados, incluyendo por lo menos dos del primer dominio. Una vez realizado el diagnóstico, es importante la confirmación y severidad de los síntomas presentes. Para esto, generalmente se aplica un segundo cuestionario, como el CARS (Childhood Autism Rating Scale) que consta de 15 preguntas, cada una con siete respuestas posibles5.
Estudios de tipo longitudinal en niños con alto riesgo de desarrollar TEA por tener un hermano mayor afectado así como el análisis retrospectivo de videos de niños de un año con este padecimiento confirman que en algunos de estos pacientes los síntomas característicos se pueden identificar a partir de los 6 y hasta los 12 meses de edad7, siendo dichos síntomas más evidentes a partir de los 18 meses8. Es importante mencionar que aun cuando en la literatura se mencionan como síntomas iniciales a las diversas alteraciones en el lenguaje y la comunicación, los estudios longitudinales arriba mencionados han demostrado que otros síntomas no tan característicos pueden identificarse antes de los 6 meses, como irritabilidad, hipo o hiperreactividad al medio, hipo o hiperactividad, así como un déficit en el desarrollo de movimientos gruesos9. Por lo anterior, es importante que los médicos de primer nivel estén conscientes de los signos de alerta dentro del espectro sintomático que puede presentar un niño con TEA, a fin de que se lleven a cabo, en primera instancia, las pruebas de tamiz pertinentes, y posteriormente la confirmación del diagnóstico lo más temprano posible.
3PrevalenciaEstudios epidemiológicos en el mundo han identificado pacientes con TEA en los países incluidos, con índices similares de prevalencia10. El desorden autista se estima en 2/1,000 individuos4. Actualmente, alrededor de uno de cada 175 niños de todo el mundo nace con este trastorno, aunque la frecuencia varía en cada país. En los Estados Unidos, datos basados en el reporte comunitario de la red para el monitoreo del autismo y las discapacidades en el desarrollo (Community Report from the Autism and Developmental Disabilities Monitoring Network) del Centro de Control de Enfermedades indican que uno de cada 68 niños es diagnosticado con autismo. Los varones tienen cinco veces mayor riesgo de desarrollar TEA que las niñas. De igual forma, los datos de este reporte indican que la mayoría de los diagnósticos se realiza después de los 4 años de vida, y la prevalencia es mayor en niños caucásicos que en afroamericanos o hispanos11. Para el 2013, el estimado de la prevalencia para el autismo en México era de uno de cada 300 niños. Como pronóstico se puede hablar de cuando menos 115 mil niños con autismo en México, con un riesgo de 6,200 nuevos casos por año12.
4Genética del TEAEl autismo considera las alteraciones genéticas, que suelen ser heterogéneas, entre sus causas principales. Estas alteraciones se presentan en los distintos niveles de organización del material genético. El material genético, durante la división celular, se organiza en superestructuras denominadas cromosomas, las cuales evidencian las llamadas alteraciones cromosómicas en las que pueden ocurrir macro o micro deleciones, duplicaciones, inserciones e inversiones del material genético. Se debe señalar que, incluso a nivel molecular, pueden existir mutaciones puntuales de novo en la secuencia del ADN que alteran genes o promotores y afectan la expresión génica. Muchos de ellos se relacionan con el desarrollo del sistema nervioso. Los principales síndromes relacionados con el autismo se mencionan a continuación.
4.1Síndrome de Prader-Willi (SPW)El síndrome es consecuencia de una deleción del cromosoma 15, región q11-q13, ya sea por mutación del gen paterno o por la disomía uniparental de origen materno, es decir cuando no se expresa el alelo paterno o existe una alteración en el patrón de metilación. Este síndrome se presenta del 1-4% de los casos de autismo, y sus síntomas son hipotonía, discapacidad intelectual, obesidad, avidez por la comida, trastorno obsesivo compulsivo, baja sociabilidad; son individuos que hablan en exceso y que tienen altos niveles de oxitocina13.
4.2Síndrome de AngelmanEste síndrome se observa del 2-4% de los autistas y se encuentra afectada la misma región que el SPW, aunque la alteración proviene del lado materno. Puede presentarse como una inversión, duplicación o la mutación del gen UBE3A/E6AP. Este gen codifica para una ubiquitina E3 ligasa que participa en la vía de degradación de proteínas en las neuronas. Los individuos portadores de esta alteración presentan hiperactividad, aleteo de manos, convulsiones, discapacidad intelectual, epilepsia, estrabismo y muy baja habilidad lingüística; también puede haber criptorquidia o microcefalia14,15.
4.3Síndrome del X frágilCon una incidencia del 4-8% en pacientes con diagnóstico de autismo, este síndrome se caracteriza por discapacidad intelectual, macrorquidia, lenguaje perseverante y repetitivo, pobre contacto visual y dismorfias faciales características. La alteración del gen FMR1 (fragile X mental retardation 1) localizado en el cromosoma X, usualmente proviene de un estado desmetilado del lado materno, por lo que las afectaciones se aprecian principalmente en varones. En este gen se encuentra una serie de trinucleótidos (CGG) repetidos (5 a 45 veces) en el extremo 5’ del ARN mensajero, el cual regula la traducción de dicho gen. Sin embargo, las duplicaciones de esta región pueden aumentar a más de 200 repeticiones de trinucleótidos, produciendo el síndrome. Este aumento de trinucleótidos en el ARN mensajero del gen impide su traducción, y dado que la proteína de unión a ARN que codifica regula negativamente los mensajeros de genes que modulan la plasticidad sináptica, se altera seriamente el desarrollo intelectual16.
4.4Síndrome de TimothyEn este síndrome se han detectado mutaciones espontáneas en el gen CACNA1C, las cuales interfieren con el funcionamiento de los canales de calcio. Este gen se localiza en el cromosoma 12, región p13.3. Además del fenotipo autista se presentan arritmias letales, cardiopatía congénita, déficit inmunitario, hipoglucemias y alteraciones cognitivas17.
4.5Síndrome de RettEl síndrome de Rett afecta principalmente a las mujeres, y en el caso de los varones heterocigotos resulta letal. En este síndrome se encuentra mutado el gen MeCP2, en el brazo largo del cromosoma X. Este gen se relaciona con el desarrollo del cerebro. Este síndrome se caracteriza por un fenotipo autista severo, regresión sicomotora, movimientos estereotipados, marcha atáxica y falta de interacción social. La proteína MeCP2 se encarga de “silenciar” la cromatina metilada en las citosinas de los pares CpG18.
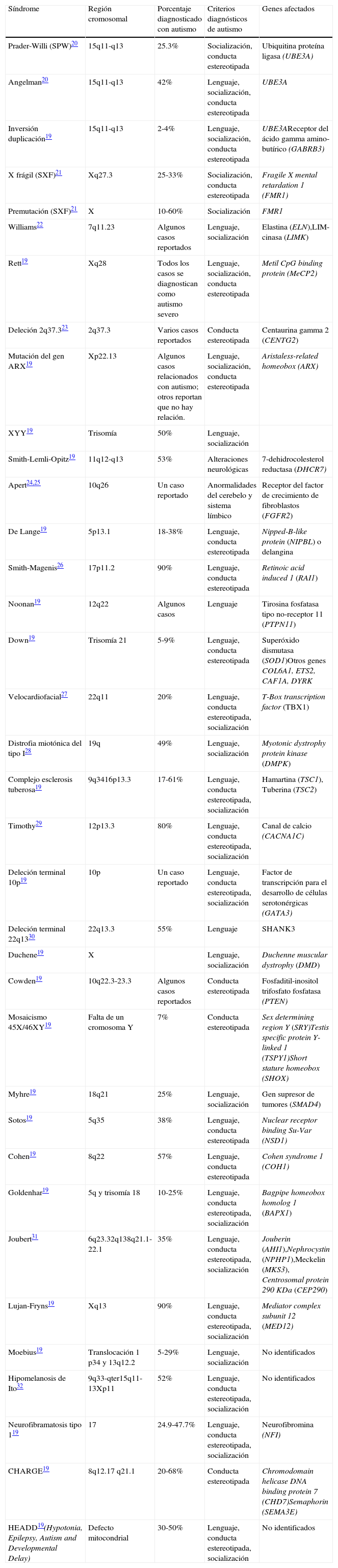
4.6Otras alteraciones genéticasEn general, el autismo se asocia con varios síndromes en los que se presentan alteraciones en la conducta, desarrollo del lenguaje o socialización, por lo que el diagnóstico genético sirve para detectar si el individuo padece alguno de estos síndromes (Tabla 1)19–32. Además de la sintomatología propia del síndrome, un porcentaje de casos se diagnostica con autismo si los criterios de diagnóstico prevalecen33.
Síndromes asociados con los trastornos del espectro autista
| Síndrome | Región cromosomal | Porcentaje diagnosticado con autismo | Criterios diagnósticos de autismo | Genes afectados |
| Prader-Willi (SPW)20 | 15q11-q13 | 25.3% | Socialización, conducta estereotipada | Ubiquitina proteína ligasa (UBE3A) |
| Angelman20 | 15q11-q13 | 42% | Lenguaje, socialización, conducta estereotipada | UBE3A |
| Inversión duplicación19 | 15q11-q13 | 2-4% | Lenguaje, socialización, conducta estereotipada | UBE3AReceptor del ácido gamma amino-butírico (GABRB3) |
| X frágil (SXF)21 | Xq27.3 | 25-33% | Socialización, conducta estereotipada | Fragile X mental retardation 1 (FMR1) |
| Premutación (SXF)21 | X | 10-60% | Socialización | FMR1 |
| Williams22 | 7q11.23 | Algunos casos reportados | Lenguaje, socialización | Elastina (ELN),LIM-cinasa (LIMK) |
| Rett19 | Xq28 | Todos los casos se diagnostican como autismo severo | Lenguaje, socialización, conducta estereotipada | Metil CpG binding protein (MeCP2) |
| Deleción 2q37.323 | 2q37.3 | Varios casos reportados | Conducta estereotipada | Centaurina gamma 2 (CENTG2) |
| Mutación del gen ARX19 | Xp22.13 | Algunos casos relacionados con autismo; otros reportan que no hay relación. | Lenguaje, socialización, conducta estereotipada | Aristaless-related homeobox (ARX) |
| XYY19 | Trisomía | 50% | Lenguaje, socialización | |
| Smith-Lemli-Opitz19 | 11q12-q13 | 53% | Alteraciones neurológicas | 7-dehidrocolesterol reductasa (DHCR7) |
| Apert24,25 | 10q26 | Un caso reportado | Anormalidades del cerebelo y sistema límbico | Receptor del factor de crecimiento de fibroblastos (FGFR2) |
| De Lange19 | 5p13.1 | 18-38% | Lenguaje, conducta estereotipada | Nipped-B-like protein (NIPBL) o delangina |
| Smith-Magenis26 | 17p11.2 | 90% | Lenguaje, conducta estereotipada | Retinoic acid induced 1 (RAI1) |
| Noonan19 | 12q22 | Algunos casos | Lenguaje | Tirosina fosfatasa tipo no-receptor 11 (PTPN11) |
| Down19 | Trisomía 21 | 5-9% | Lenguaje, conducta estereotipada | Superóxido dismutasa (SOD1)Otros genes COL6A1, ETS2, CAF1A, DYRK |
| Velocardiofacial27 | 22q11 | 20% | Lenguaje, conducta estereotipada, socialización | T-Box transcription factor (TBX1) |
| Distrofia miotónica del tipo I28 | 19q | 49% | Lenguaje, socialización | Myotonic dystrophy protein kinase (DMPK) |
| Complejo esclerosis tuberosa19 | 9q3416p13.3 | 17-61% | Lenguaje, conducta estereotipada, socialización | Hamartina (TSC1), Tuberina (TSC2) |
| Timothy29 | 12p13.3 | 80% | Lenguaje, conducta estereotipada, socialización | Canal de calcio (CACNA1C) |
| Deleción terminal 10p19 | 10p | Un caso reportado | Lenguaje, conducta estereotipada, socialización | Factor de transcripción para el desarrollo de células serotonérgicas (GATA3) |
| Deleción terminal 22q1330 | 22q13.3 | 55% | Lenguaje | SHANK3 |
| Duchene19 | X | Lenguaje, socialización | Duchenne muscular dystrophy (DMD) | |
| Cowden19 | 10q22.3-23.3 | Algunos casos reportados | Conducta estereotipada | Fosfaditil-inositol trifosfato fosfatasa (PTEN) |
| Mosaicismo 45X/46XY19 | Falta de un cromosoma Y | 7% | Conducta estereotipada | Sex determining region Y (SRY)Testis specific protein Y-linked 1 (TSPY1)Short stature homeobox (SHOX) |
| Myhre19 | 18q21 | 25% | Lenguaje, socialización | Gen supresor de tumores (SMAD4) |
| Sotos19 | 5q35 | 38% | Lenguaje, conducta estereotipada | Nuclear receptor binding Su-Var (NSD1) |
| Cohen19 | 8q22 | 57% | Lenguaje, conducta estereotipada | Cohen syndrome 1 (COH1) |
| Goldenhar19 | 5q y trisomía 18 | 10-25% | Lenguaje, conducta estereotipada, socialización | Bagpipe homeobox homolog 1 (BAPX1) |
| Joubert31 | 6q23.32q138q21.1-22.1 | 35% | Lenguaje, conducta estereotipada, socialización | Jouberin (AHI1),Nephrocystin (NPHP1),Meckelin (MKS3), Centrosomal protein 290 KDa (CEP290) |
| Lujan-Fryns19 | Xq13 | 90% | Lenguaje, conducta estereotipada, socialización | Mediator complex subunit 12 (MED12) |
| Moebius19 | Translocación 1 p34 y 13q12.2 | 5-29% | Lenguaje, socialización | No identificados |
| Hipomelanosis de Ito32 | 9q33-qter15q11-13Xp11 | 52% | Lenguaje, conducta estereotipada, socialización | No identificados |
| Neurofibramatosis tipo 119 | 17 | 24.9-47.7% | Lenguaje, conducta estereotipada, socialización | Neurofibromina (NFI) |
| CHARGE19 | 8q12.17 q21.1 | 20-68% | Conducta estereotipada | Chromodomain helicase DNA binding protein 7 (CHD7)Semaphorin (SEMA3E) |
| HEADD19(Hypotonia, Epilepsy, Autism and Developmental Delay) | Defecto mitocondrial | 30-50% | Lenguaje, conducta estereotipada, socialización | No identificados |
Varios de estos síndromes, además, tienen componentes como retardo mental, epilepsia y alteraciones cardiacas, entre otros. A este respecto, el autismo también tiene un alto porcentaje de retardo mental (75%) y un componente de epilepsia en un menor porcentaje (42%). La mayoría de las mutaciones relacionadas con autismo corresponden a genes que participan en el desarrollo neuronal y la sinaptogénesis.
En cuanto a la asociación del autismo con epilepsia se han identificado mutaciones en genes que participan en el sistema excitador (glutamato) e inhibidor (GABA) neuronal. El gen del receptor de glutamato tipo 6 (mGluR6) se encuentra en desequilibrio de ligamiento en algunos individuos con autismo; es decir, no segregan de forma independiente y tienen baja recombinación debido a que los dos loci implicados suelen estar en el mismo cromosoma. Por otra parte, se ha detectado la disminución de enzimas del sistema GABAérgico y de la disponibilidad de GABA en autistas. Además, las alteraciones en la región 15q11-13 incluyen los genes de los receptores GABAA. Por otro lado, la familia de las neuroliginas (NLGN1, NLGN2, NLGN3, NLGN4X y NLGN5, genes distribuidos en los cromosomas 3, 7, X y Y) también juegan un papel relevante en la sinaptogénesis y el desequilibrio entre la inhibición e excitación neuronal. Los estudios de asociación de polimorfismos en los genes NLGN3 y NGLN4 con el autismo no han encontrado una relación clara. Sin embargo, se han encontrado isoformas de estos genes relacionadas con el autismo34. Genes descritos en algunos síndromes también son factores que desencadenan la epilepsia en autistas, como los genes CDK5, FMR1, ARX (aristaless-related homeobox, implicado en el desarrollo del cerebro, proliferación de neuroblastos y la migración de interneuronas GABAérgicas), y el gen MeCP2, que a su vez regula a DLX5. Además, otros genes con mutaciones que codifican para subunidades del canal de sodio neuronal dependiente de voltaje SCN1A (alfa 1) y SCN2A (alfa 2) desencadenan las crisis convulsivas en los autistas35.
El complejo de esclerosis tuberosa es producido por mutaciones en los genes TSC1 y TSC2. En este se presentan síntomas como epilepsia, trastornos neurocognitivos y autismo. Las proteínas TSC1y TSC2 modulan el crecimiento celular mediado por la vía de señalización de mTOR, que también modula la sinaptogénesis36.
El desarrollo lingüístico es uno de los componentes críticos del autismo. Varios genes relacionados con el lenguaje se encuentran alterados. Las alteraciones descritas se han localizado en los loci AUTS e incluyen genes implicados en el desarrollo del cerebro. El locus AUTS3, localizado en la región 13q13.2-14.1, contiene los genes para la migración neuronal y el desarrollo (NBEA, MAB21L1, DCAMKL1 y SMAD9). El locus AUTS1B (7q31) contiene, al menos, dos genes que se asocian con el autismo. Entre los genes candidatos que afectan el desarrollo del sistema nervioso central se estudian WNT2 (7q31-33), que se expresa en tálamo, y FOXP2, que regula genes para el desarrollo del lenguaje y el habla. En este mismo locus se encuentran los genes MET, cuyo promotor alterno reduce en la mitad su expresión en el autismo, lo que afecta la maduración y crecimiento de la neocórtex (“corteza nueva” o la “corteza más reciente”).
En 7q35 se encuentra otro gen crucial para el desarrollo del lenguaje, el CNTNAP2 de la proteína asociada a la contactina, de la familia de las neuroxinas. En ratones que no expresan este gen se observó que manifiestan síntomas de autismo; de la misma manera, la expresión disminuida de este gen debido a variaciones en su región promotora o pérdida de sitios de metilación se presenta en algunos individuos autistas. Sin embargo, alteraciones en este gen se relacionan con una gran cantidad de desórdenes del desarrollo neuronal37.
El locus AUTS1A (7q36) contiene el gen EN2, cuya mutación implica la reducción de células de Purkinje e hipoplasia cerebelar. El brazo largo del cromosoma 2 contiene al locus AUTS5, que se liga al retraso para la construcción de frases y del cual aún no se ha identificado algún gen responsable, pero sí se ha asociado con polimorfismos del gen RAPGEF4 en 2q31-32. La región 15q11-13 con el locus AUTS4 contiene a los genes UBE3A, ATP10A, GABRB3, GABRA5, GABRG3; además, está sujeta a afectaciones en su patrón de metilación (impronta genómica) que conllevan a una disfunción lingüística38.
La genética del autismo revela la participación de genes implicados en el desarrollo del sistema nervioso y las implicaciones para el desarrollo del lenguaje, la socialización, la conducta, e incluso alteraciones neuronales. Las nuevas herramientas moleculares, como la identificación en la variación del número de copias, las mutaciones de novo, los microarreglos de expresión génica, la secuenciación de genomas y la secuenciación masiva permitirán explorar la gran mayoría de casos de autismo idiopático39. La identificación de genes relacionados con el desarrollo del lenguaje, socialización y la conducta permitirá establecer las interacciones entre ellos y plantear los mecanismos moleculares que participan en el autismo40,41.
5Aspectos neuroendocrinos de los TEALos TEA son desórdenes en el neurodesarrollo caracterizados por alteraciones en la interacción social, comunicación y conducta repetitiva. Afectan al 1% de la población y su prevalencia es mayor en varones. Por ello, la mayoría de los estudios se han realizado en el sexo masculino. La neurobiología del autismo se ha estudiado a nivel genético, neurofisiológico, neuroquímico y neuropatológico. Las técnicas de neuroimagen han mostrado múltiples anormalidades estructurales, pero poco consistentes. Se han encontrado alteraciones en los sistemas serotoninérgico, GABAérgico, catecolaminérgico, colinérgico, entre otros, aunque sin especificidad o valor diagnóstico42. Bauman y Kemper, en 1985, mostraron los hallazgos neuropatológicos de un hombre de 29 años43. En 1998 completaron una serie de nueve casos de los cuales cuatro padecían epilepsia y cinco, discapacidad intelectual, sin malformaciones evidentes y mielinización normal. En comparación con sujetos no autistas, estos mostraron reducción del tamaño neuronal y aumento en la densidad celular en el sistema límbico y cerebelo. Además, observaron la disminución en la extensión de las ramificaciones dendríticas en neuronas piramidales CA1 y CA4 del hipocampo44.
Estudios recientes han establecido que la circunferencia de la cabeza en neonatos autistas es normal al nacimiento, pero a los 2 años de edad se presenta un alargamiento de la cabeza, y de los 3-4 años se incrementa alrededor del 5-10%45,46. Este aumento de la circunferencia de la cabeza se ha asociado con una disminución en las capas corticales y en la maduración de la corteza. Otra teoría propone que hay una respuesta secundaria a eventos de remodelación neuronal que induce el sobrecrecimiento46. Asimismo, existe una disfunción en áreas corticales, incluyendo lóbulo frontal, temporal y corteza cingulada, afectando y promoviendo problemas de atención y de la función ejecutiva encargada de la planificación y organización, lo cual provoca la falta de autonomía y de toma de decisiones, además de la dependencia de los autistas47. Otros autores relacionan la disfunción del hipocampo y amígdala (estructuras del lóbulo temporal medial), lo que afecta la memoria de trabajo o de reconocimiento y la codificación verbal, dependiendo de la severidad del autismo48.
Por otra parte, estudios realizados por Lai y colaboradores en el Centro de Investigación del Autismo en la Universidad de Cambridge han sugerido que el autismo afecta diferentes partes del cerebro en las mujeres y en los hombres. Con imágenes de resonancia magnética encontraron que la anatomía del cerebro de una persona con autismo difiere dependiendo de su sexo49. Esto puede implicar mecanismos fisiológicos que conducen a un dimorfismo sexual, como las hormonas sexuales prenatales y los mecanismos genéticos ligados al sexo. Debido a que la frecuencia de autismo en las mujeres es menor que en los varones, esta diferencia es un ejemplo importante de la diversidad dentro del “espectro”50.
Se ha demostrado la importancia de algunos neurotransmisores, como la serotonina, en los trastornos de conducta. En niños hipercinéticos que presentan bajos niveles de serotonina plasmática se ha comprobado que su mejoría clínica depende del aumento de serotonina. Asimismo, Schain y Freedman51 relacionaron una alta concentración de serotonina (26%) en los autistas examinados; estos niveles de serotonina disminuyeron al restringir el contenido de triptófano (aminoácido precursor) en la dieta. Con base en lo anterior, un fenómeno común observado en sujetos con TEA es la hiperserotoninemia52. Sin embargo, el tratamiento con inhibidores selectivos de la recaptura de serotonina (SSRI), como fluoxetina, paroxetina, fluvoxamina y venlafaxina, mostró efectos positivos en el estereotipo de conductas repetitivas, déficit social y en los problemas de comunicación53.
Por otra parte, el sistema de dopamina se ha relacionado con funciones de análisis, planeación y de ejecución; además, con conductas de actividad motora, social y de percepción. Barthelemy y colaboradores analizaron los niveles urinarios de catecolaminas en autistas, y encontraron niveles bajos de dopamina y altos de noradrenalina, que inducen conductas pasivas como se observa en los autistas54. En el cerebro, los menores con autismo mostraban conexiones débiles en áreas que liberan dopamina en respuesta a recompensas, comparados con niños sin autismo. En el lóbulo izquierdo del cerebro, los niños autistas mostraron conexiones débiles con el núcleo accumbens y el área tegmental ventral. Y en el lado derecho, había una conexión débil con la amígdala, que procesa las señales emocionales.
En sujetos con TEA con tratamiento de antagonistas de dopamina como haloperidol y risperidona, los cuales son medicamentos antipsicóticos, se ha observado una mejora en conductas de irritabilidad e hiperactividad55.
Por otra parte, en tejido post mórtem de autistas se ha encontrado una disminución de conexiones GABAérgicas en células de Purkinje en cerebelo43. Estudios recientes mostraron una disminución de receptores (GABAA y GABAB) y proteínas en cerebelo y áreas corticales, sugiriendo una desregulación del sistema inhibitorio de GABA en el autismo, lo que afecta la regulación de circuitos y de la conducta56,57.
6Errores en el metabolismo en el TEALas principales alteraciones metabólicas que presenta un fenotipo autista son la fenilcetonuria, alteraciones en el ciclo de la urea, alteraciones en el metabolismo de las purinas y deficiencias de la enzima succinato semialdehído deshidrogenasa. Algunos autores han encontrado hiperuricemia en pacientes con discapacidad intelectual y con trastornos de la personalidad, además de otros defectos bioquímicos que pueden ocasionarse no solo por la ingestión insuficiente de sus precursores, sino también por una absorción defectuosa, como puede observarse en la enfermedad celiaca que se caracteriza por intolerancia a las grasas y al gluten. Dicha intolerancia al gluten produce daños en el epitelio intestinal, provocando heces voluminosas por las grasas y otras sustancias no absorbidas (esteatorrea), a la vez que se aprecia un trastorno en el crecimiento en autistas que padecen enfermedad celiaca. Cuando dichos niños fueron sometidos a una dieta sin gluten, la sintomatología de la enfermedad autista disminuyó. La presencia de dos enfermedades en un mismo paciente no significa necesariamente que una sea consecuencia de la otra, sino que pueden tener las mismas bases genéticas y por dicha razón se presenten juntas.
Por último, los neurotóxicos que atraviesan la barrera placentaria son peligrosos. Roberts y colaboradores reportaron que si la madre durante la gestación está expuesta a pesticidas, como en las zonas de agricultura, se incrementa seis veces el riesgo de que el feto desarrolle autismo58.
7Tratamiento7.1. Tratamiento farmacológicoHasta ahora no existe ningún tratamiento específico o curativo para el autismo. Los tratamientos existentes pueden dividirse en farmacológicos y psicopedagógicos. Todos los tratamientos farmacológicos son sintomáticos. Muchos fármacos se han utilizado en el manejo de esta condición,59–61 pero no existe alguno aceptado de forma unánime o que sea útil para todos los pacientes. El haloperidol puede ser útil para disminuir la impulsividad y agresividad,59,61 así como las estereotipias y la labilidad emocional, pero es importante estar atento ante sus posibles efectos colaterales tempranos y tardíos (disquinesias, sedación excesiva, etcétera). Se aconseja utilizarlo por periodos cortos o de manera intermitente. Otros reportes han mostrado igual eficacia de la risperidona, aunque con menos efectos secundarios, por lo cual es el fármaco más utilizado actualmente62.
Existen reportes que señalan una elevada actividad de opioides endógenos en el sistema nervioso central de autistas63,64, y esto ha motivado el uso del antagonista opiáceo naltrexona65,66. Sin embargo, los resultados han sido pobres y actualmente casi no se utiliza. De igual manera se afirma que existen alteraciones en el metabolismo serotoninérgico, con elevación significativa de la concentración de serotonina67. Esto ha dado lugar al uso de inhibidores de la recaptura de serotonina, como fluvoxamina y sertralina,68,69 con buenos resultados en la disminución de pensamientos repetitivos y conducta ritualista, así como disminución en la agresividad, además de la mejoría en el uso del lenguaje y la conducta social, aunque se señala que el efecto benéfico puede ser solo transitorio.
No existe medicación que actúe sobre las manifestaciones básicas del autismo. A veces se deben tratar algunos de los problemas asociados. La epilepsia se trata siguiendo los principios epileptológicos, sin ningún aspecto particular. Como la mayoría de las crisis son focales complejas, la carbamacepina es uno de los fármacos indicados. Cuando existe un trastorno de la actividad con déficit atencional, se puede usar ritalina (tres dosis diarias de 0.4-1mg/kg). Para la ansiedad puede utilizarse la buspirona (5mg, tres veces al día). Para la agresión se ha utilizado la naltrexona (0.5mg/kg/d). En los últimos años se han practicado estudios con risperidona, un antipsicótico atípico que bloquea los receptores postsinápticos de la serotonina; esta puede ser desplazada más fácilmente por la dopamina endógena, lo cual disminuye el riesgo de los efectos neurológicos colaterales. La dosis empleada es de 0.01-0.03mg/kg de peso en dos dosis diarias durante períodos de 8 semanas. Su efecto favorable sobre la auto y heteroagresividad, las estereotipias, los movimientos anormales, la inatención y la hiperactividad es bastante notorio. Los efectos colaterales son la moderada somnolencia y decaimiento, sobre todo al comienzo. Un problema que a veces obliga a suspender la medicación es el aumento del apetito y un aumento marcado de peso. En las niñas puede presentarse amenorrea, otra indicación para suspender el medicamento. Cuando se utilizan dosis superiores a 3.5mg/d y durante períodos prolongados, pueden aparecer discinesias y temblores70.
7.2. Tratamiento psicopedagógicoLa terapia psicopedagógica juega un papel central en el tratamiento de los autistas. El manejo más aceptado actualmente es el inicio temprano del tratamiento, intensivo y de tipo multimodal: terapia de lenguaje, programas de socialización, estimulación sensorial múltiple (auditiva, visual, somestésica), terapia recreativa, etcétera. Desgraciadamente, en esta área han surgido diversos métodos revestidos de bases pseudocientíficas, que solamente aportan confusión y falsas expectativas en los familiares de estos pacientes (delfinoterapia, equinoterapia, uso de otras mascotas, aromaterapia, musicoterapia, entre otras)59–61,71. Algunos tratamientos utilizados con los autistas son los programas educativos y de comportamiento, que se centran en el desarrollo de las habilidades sociales, para el habla, el lenguaje, el cuidado personal y las capacidades laborales. Los profesionales de salud mental brindan asesoramiento, capacitación y tratamientos basados en las necesidades de cada niño, pues no se puede generalizar ya que cada caso tiene características y necesidades particulares.
El tratamiento específico será determinado por el médico con base en los siguientes criterios:
- •
La edad del niño, estado general salud y antecedentes médicos
- •
El grado del trastorno
- •
Los síntomas del niño
- •
La tolerancia a determinados medicamentos o terapias
- •
Expectativas para la evolución del trastorno
- •
La opinión o preferencia de los padres
Es importante tener en cuenta que el tratamiento de este trastorno del desarrollo se centrará en los síntomas particulares, con el fin de mejorar los aspectos deficientes en los niños. Sin embargo, esto no significa que el tratamiento eliminará el trastorno o cambiará la conducta de niño71.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.