ácido acetilsalicílico;
Action to Control Cardiovascular Risk in Diabetes;
American Diabetes Association;
Action in Diabetes and Vascular Disease-Preterax and Diamicron Modified Release Controlled Evaluation;
automonitorización de la glucemia;
Diabetes Control and Complications Trial;
diabetes mellitus;
diabetes tipo 2;
European Association for the Study of Diabetes;
filtrado glomerular;
hemoglobina glucosilada;
International Diabetes Federation;
United Kingdom Prospective Diabetes Study;
Veterans Affairs Diabetes Trial.
Para enfocar el tratamiento hipoglucemiante de cualquier paciente con diabetes mellitus (DM) se considera prioritario marcar un objetivo de control glucémico según las características de cada paciente en particular. En nuestro caso, se trata de un varón de 81 años con buena calidad de vida pero muy mal control glucémico (hemoglobina glucosilada [HbA1c] de 9,6%), a pesar de estar ya con una dosis de insulina de acción lenta (glargina) y dos fármacos potentes (metformina y glimepirida) en dosis casi plenas.
Una HbA1c de 9,6% se correlaciona con un promedio glucémico de ~230mg/dL1, cifra elevada y que al paciente le supondrá un deterioro progresivo de las complicaciones crónicas de la DM. Diversos estudios ponen de manifiesto la mayor tasa de mortalidad2 o el aumento del riesgo relativo de enfermedad coronaria, ictus isquémico y muerte por cualquier causa secundarios a niveles elevados de HbA1c3. Los datos del United Kingdom Prospective Diabetes Study (UKPDS) demostraron que, con cada disminución de un 1% de la HbA1c, se conseguía reducir un 21% las muertes por diabetes, un 14% los infartos de miocardio, un 37% las complicaciones microvasculares y un 43% la vasculopatía periférica4. Este estudio, realizado en pacientes con diabetes tipo 2 (DM2), y el Diabetes Control and Complications Trial (DCCT), efectuado en pacientes con diabetes tipo 15, establecieron que, consiguiendo una HbA1c <7%, se reducía significativamente el riesgo de padecer complicaciones microvasculares y neuropáticas a corto plazo (10 años). La evaluación a largo plazo de ambos estudios6,7 evidenció que esta estrategia logra disminuir el riesgo cardiovascular a largo plazo (~17-20 años). Por tanto, el objetivo de HbA1c en general para adultos debe ser <7%1.
Pero hay excepciones a la recomendación general de un objetivo de HbA1c <7%. Ésta está basada en datos de ensayos controlados y aleatorizados como el ACCORD (Action to Control Cardiovascular Risk in Diabetes), el ADVANCE (Action in Diabetes and Vascular Disease-Preterax and Diamicron Modified Release Controlled Evaluation) y el VADT (Veterans Affairs Diabetes Trial), realizados en pacientes con DM2 de más de 10 años de evolución que perseguían la«casi-normoglucemia»con la intención de conseguir disminuir las complicaciones macrovasculares8. De los resultados de esos ensayos se desprende que pueden resultar apropiados objetivos menos estrictos de HbA1c para pacientes con antecedentes de hipoglucemia grave, expectativa de vida limitada, complicaciones micro y macrovasculares avanzadas e importantes situaciones de comorbilidad, y para aquellos con diabetes de larga evolución, en quienes el objetivo comentado sea difícil de conseguir1,8.
Nuestro paciente posiblemente entraría en estos supuestos, pues al tener 81 años su expectativa de vida no es ya muy larga, y además presenta una DM muy mal controlada y de 22 años de evolución. Así pues, el objetivo de control glucémico que me marcaría con este paciente sería alcanzar unas cifras de HbA1c de entre el 7 y el 8%, evitando en lo posible la presencia de hipoglucemias. La American Diabetes Association recomienda reevaluar todos los regímenes terapéuticos en los que el valor de HbA1c sea superior al 8%1. Por encima de esta cifra, la propia glucotoxicidad dispara la incidencia de todas las complicaciones crónicas de la diabetes. De hecho, ya se observaban en nuestro paciente una nefropatía incipiente y datos clínicos de polineuropatía.
Así pues, creo que nuestro paciente tiene ya unas cifras de HbA1c tan elevadas que ha agotado cualquier posibilidad de añadir más fármacos orales a su tratamiento y sólo cabe proponerle una terapia intensiva de insulina, suspendiendo la sulfonilurea y planteándonos si mantener o no metformina.
Pero ¿qué pauta de insulinización completa es la más adecuada en un paciente de 81 años, con una HbA1c de 9,6%, buena situación mental, que sólo se realiza tres glucemias preprandiales a la semana y que sigue un plan de comidas básico con horarios de ingesta y cantidades de hidratos de carbono bastante regulares? Si siguiéramos las recomendaciones de la ADA/EASD (American Diabetes Association/European Association for the Study of Diabetes)9, le pasaríamos a una pauta bolo-basal, donde se le irían añadiendo insulinas de acción rápida antes de cada ingesta hasta alcanzar los objetivos glucémicos de control (figura 1). Pero el paciente tendría que realizar al menos cuatro controles de glucemia capilar diarios (tres preprandiales y uno a las 2h de la cena), además de ir modificándose las dosis en función de los resultados que se obtuvieran.
Pautas de insulinización en la diabetes tipo 2 según la ADA/EASD9
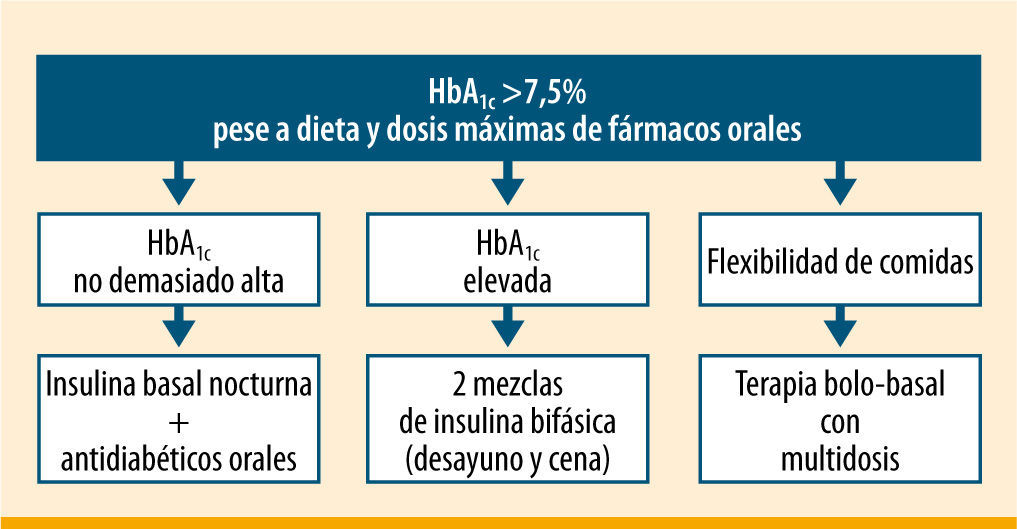
Otra posibilidad es pautar insulinas premezcladas en multidosis, generalmente antes del desayuno y antes de la cena10,11. Esta forma de insulinización puede ser más fácil de entender y de realizar por un número relevante de pacientes con DM2, consiguiéndose un buen control en más de la mitad de los casos12, sin diferencias en cuanto al número de hipoglucemias ni de otros efectos adversos. Además, la pauta con insulinas premezcladas puede proporcionar una mejor calidad de vida que la pauta bolo basal13. A tenor de varios ensayos clínicos, cuando la HbA1c está por encima del 8,5% las mezclas de insulina pueden alcanzar mucho antes los objetivos de control14-16; de ahí que haya bastante consenso entre la comunidad médica en considerar la insulinización con mezclas en pacientes con HbA1c >8,5%11. La International Diabetes Federation (IDF)17 recomienda pasar a dos dosis de insulinas premezcladas cuando la HbA1c está por encima de 7,5%, realizar controles posprandiales desde el inicio de la insulinización, y pautar una tercera dosis de insulina si fuese necesario (figura 2). Lasserson et al.18 llevaron a cabo un metaanálisis en el que comprobaron que se obtenían mejores resultados en la HbA1c con las mezclas de insulina que con la insulina basal (−0,45%; IC del 95%: 0,19-0,70; p=0,0006), aunque con menor reducción de la glucemia basal (+16,74mg/dL; IC del 95%: 3,78-29,7; p=0,01) y mayor aumento del peso (no significativo). No se encontraron diferencias en los episodios hipoglucémicos graves, aunque sí en los leves a favor de las insulinas lentas frente a las bifásicas.
Pautas de insulinización en la diabetes tipo 2 según la IDF17
Barnett et al.19 recomiendan la insulinización con mezclas de insulina cuando se dan estos supuestos: a) hay una preferencia por un menor número de inyecciones diarias; b) no se desea la automonitorización intensiva; c) existe un apoyo familiar y/o médico escaso; d) hay capacidad limitada por la presencia de un deterioro cognitivo o visual o bien falta de destreza y/o habilidad del paciente, y e) existe un patrón fijo de ingestas en cuanto a horarios y cantidades de hidratos de carbono. Nuestro paciente, por su edad y tipo de vida muy regular, no necesita flexibilizar las comidas ni el tipo de éstas, tampoco se beneficiará de un tratamiento intensivo (HbA1c <7%) y probablemente no quiera acogerse a realizar un número importante de controles glucémicos diarios.
Creo que, a este paciente en concreto, pasar de una pauta basal a una pauta basal plus y de ésta a una pauta bolo-basal le comportaría una pérdida de tiempo innecesaria y, posiblemente, le complicaría la vida al tener que realizarse muchos más controles glucémicos de los que hacía con anterioridad. Por lo tanto, en su tratamiento yo optaría por pautar dos dosis de una insulina premezclada.
¿Cómo cambiamos de una inyección de insulina basal a dos inyecciones de mezcla? Las dosis iniciales para comenzar una terapia con mezclas de insulina deben individualizarse en función de los requerimientos previos y de los objetivos glucémicos marcados para el paciente, pero sobre todo por el resultado del perfil glucémico de seis puntos, atendiendo especialmente a los niveles de glucemias posprandiales11. Al inicio de una insulinización, si se utilizan dos dosis de mezclas, se suele recomendar 0,3 UI/kg (0,15 UI/kg en el desayuno y la cena, respectivamente)20. Pero si la insulinización es completa (como en nuestro caso), ya se recomiendan 0,5-0,6 UI/kg, repartidas en dos dosis (~0,25-0,30 UI/kg en el desayuno y la cena, respectivamente) o en tres dosis (0,15-0,20 UI/kg en el desayuno, 0,20-0,25 UI/kg en la comida y 0,15-0,20 UI/kg en la cena)21. Las pautas anglosajonas que promueven 2/3 de la dosis total establecida en el desayuno y 1/3 en la cena22 no deben aplicarse a nuestros pacientes de manera sistemática, porque las costumbres de ingesta española son muy diferentes. Por otra parte, es preferible comenzar con mezclas de insulina que lleven menos cantidad de insulinas rápidas (Humalog® Mix 25 KwikPen™ o NovoMix 30 FlexPen®), y si los perfiles del paciente así lo sugieren, añadir una tercera dosis (a razón de 0,15-0,2 UI/kg) o pautar una mezcla con más cantidad de insulina rápida en el momento del día que se requiera (Humalog® Mix 50 KwikPen™, NovoMix 50 FlexPen® o NovoMix 70 FlexPen®).
Por tanto, a nuestro paciente, que pesa 79kg, le pautaríamos 0,5-0,6 UI/kg de una mezcla de insulina con análogos rápidos, repartida en principio en dos dosis (~20-0-22 UI), e iríamos ajustando esas dosis en función de los perfiles glucémicos. Y, como ya hemos comentado, le suspenderíamos la sulfonilurea y le mantendríamos metformina.
¿Qué número de controles glucémicos le parecería idóneo que se realizara nuestro paciente?Para alcanzar los objetivos de control de nuestro paciente (HbA1c 7-8%) intentaremos conseguir glucemias preprandiales de entre 90 y 150mg/dL y posprandiales menores de 180–200mg/dL.
En los pacientes con diabetes tipo 2 en tratamiento insulínico la monitorización frecuente de la glucemia capilar se correlaciona con una mejora del control metabólico23,24, y por ello las diferentes guías terapéuticas recomiendan su práctica1,9,17,21. Sin embargo, el número óptimo de determinaciones que deben realizarse los pacientes no está bien definido, porque las evidencias sobre el impacto en el control metabólico son claramente deficitarias25. Por tanto, la frecuencia de la automonitorización glucémica (AMG) debe establecerse considerando aspectos relacionados con la propia diabetes (tipo, pauta de insulina y situación metabólica) y con las habilidades del paciente.
Para nuestro paciente en particular parecería muy razonable la recomendación de AMG sistemática mediante un perfil de seis puntos semanales (preprandiales y posprandiales en las tres comidas principales), con la indicación de que se realice controles de manera puntual si presenta síntomas de hipoglucemia o tras comidas de alto índice glucémico. Ese perfil glucémico de seis puntos debe realizarlo 3 días consecutivos antes de acudir a la consulta médica. De esa manera, el clínico tendrá un apoyo importante para modificarle la pauta de insulina26.
¿Cree conveniente el tratamiento con antiagregantes?Se ha demostrado que el ácido acetilsalicílico (AAS) es eficaz para disminuir la morbimortalidad cardiovascular en pacientes de alto riesgo con infartos e ictus previos, es decir, en prevención secundaria1. Pero su beneficio neto en prevención primaria es más polémico. Recientemente se ha publicado un metaanálisis de seis ensayos clínicos de AAS en prevención primaria con más de 95.000 participantes, de los cuales 4.000 presentaban diabetes27. El efecto del AAS sobre los episodios vasculares fue similar para pacientes con DM o sin ella, y en total se determinó que el AAS disminuía el riesgo de episodios vasculares un 12% (RR 0,88; IC del 95%: 0,82-0,94). El efecto neto sobre el ictus total reflejó una reducción relativa en el riesgo de ictus isquémico (−14%) y un riesgo relativamente mayor de ictus hemorrágico (+32%).
Así pues, tiene un nivel de evidencia sólo de C el hecho de considerar el tratamiento con AAS (75–162mg/día) en pacientes con DM2 y alto riesgo cardiovascular (riesgo a 10 años >10%). Esto incluye a la mayoría de los hombres mayores de 50 años y a las mujeres mayores de 60 que presentan al menos un factor de riesgo (antecedentes familiares de enfermedad cardiovascular, hipertensión, tabaquismo, dislipemia o albuminuria)1. Nuestro paciente entraría de lleno en este supuesto y, por tanto, en él sí estaría indicado el tratamiento con AAS como prevención primaria.
¿Le realizaría alguna otra prueba complementaria?Sería conveniente completar el estudio de su función renal con la determinación del filtrado glomerular (FG), ya que la creatinina sérica es necesaria pero insuficiente para detectar una insuficiencia renal oculta. Una creatinina sérica de 1,3mg/dL es diferente con un FG>o<de 60mL/min. Por ello, en pacientes con hipertensión y DM, en los que es importante estratificar el riesgo cardiovascular, también lo es conocer el FG para el uso adecuado de varios fármacos, entre ellos metformina.
Por otra parte, sería conveniente disponer de un registro electrocardiográfico y de un fondo de ojo. La realización de un electromiograma de las extremidades inferiores nos permitiría cuantificar el grado de neuropatía y monitorizar su evolución. Por último, un estudio de la presión arterial mediante monitorización ambulatoria nos ayudaría a ajustar el tratamiento hipotensor.
Declaración de potenciales conflictos de intereses
La autora declara no tener ningún conflicto de intereses en cuanto a todo lo relacionado con este artículo.



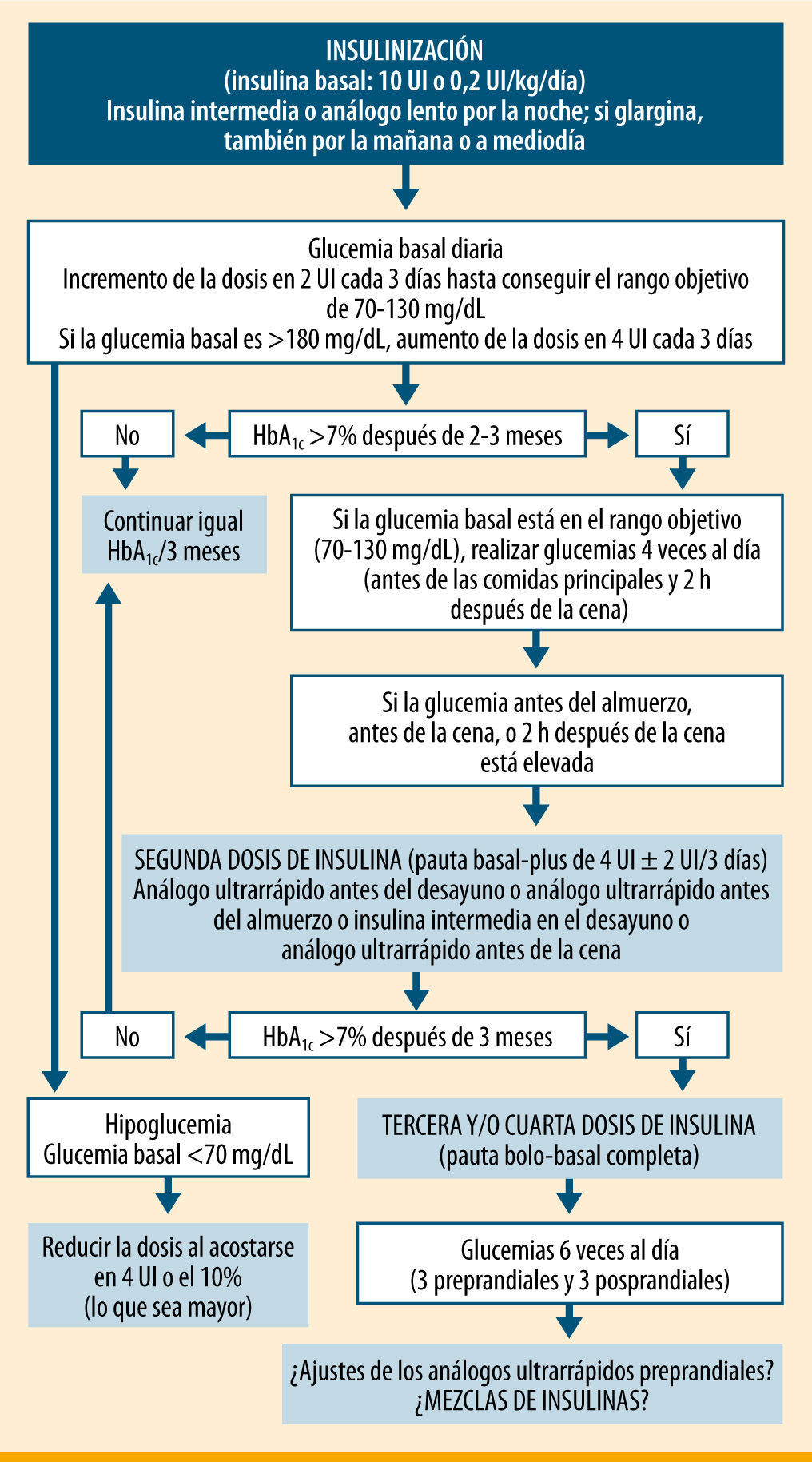
 ADA/EASD9' title='Pautas de insulinización en la diabetes tipo 2 según la
ADA/EASD9' title='Pautas de insulinización en la diabetes tipo 2 según la  IDF17' title='Pautas de insulinización en la diabetes tipo 2 según la
IDF17' title='Pautas de insulinización en la diabetes tipo 2 según la 
