American Diabetes Association
diabetes mellitus tipo 2
dipeptidilpeptidasa IV
European Association for the Study of Diabetes
factores de riesgo cardiovascular
glucagon-like peptide 1
hemoglobina glucosilada
índice de masa corporal
modificación del estilo de vida
Ministerio de Sanidad y Consumo
National Institute for Clinical Excellence
insulina protamina neutra de Hagedorn
tomografía axial computarizada
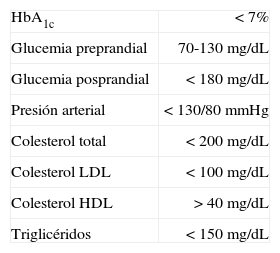
La paciente presenta una diabetes mellitus tipo 2 (DM2) de larga evolución (9 años), con un mal control metabólico reciente (hemoglobina glucosilada [HbA1c] >7%, glucemia basal 168mg/dL) y sobrepeso (índice de masa corporal [IMC] 27,3kg/m2) a pesar del tratamiento combinado con metformina y vildagliptina en dosis submáximas. Los objetivos de control metabólico que debemos perseguir en nuestra paciente, y que vienen recogidos en las recomendaciones de la American Diabetes Association (ADA) y de la European Association for the Study of Diabetes (EASD) (tabla 1)1, incluyen una HbA1c inferior al 7%, y para ello se deben mantener glucemias preprandiales de 70 a 130mg/dL, mientras que las posprandiales no deben superar los 180mg/dL.
Objetivos de control de la ADA-EASD 20091
| HbA1c | <7% |
| Glucemia preprandial | 70-130mg/dL |
| Glucemia posprandial | <180mg/dL |
| Presión arterial | <130/80mmHg |
| Colesterol total | <200mg/dL |
| Colesterol LDL | <100mg/dL |
| Colesterol HDL | >40mg/dL |
| Triglicéridos | <150mg/dL |
ADA: American Diabetes Association; EASD: European Association for the Study of Diabetes.
La DM2 es una enfermedad progresiva. Con el paso del tiempo la HbA1c va incrementándose, por lo que se requiere la intensificación del tratamiento con varios fármacos orales o la combinación de éstos con insulina. La justificación de la terapia combinada se basa no sólo en el fracaso de la monoterapia a largo plazo, sino también en el aprovechamiento del efecto sinérgico de los diferentes mecanismos de acción de los medicamentos. Esta opción terapéutica permite utilizar dosis menores, reduciendo la frecuencia y gravedad de los efectos adversos de los fármacos con una efectividad superior.
La asociación de una sulfonilurea y metformina es la combinación con mayor experiencia y tiene una gran efectividad, y la recomiendan la mayor parte de las guías terapéuticas1, 2. Otras asociaciones (metformina más inhibidor de la dipeptidilpeptidasa IV [DPP-IV], metformina más un análogo del GLP-1 [glucagon-like peptide 1] o metformina más una glitazona) constituyen una alternativa cuando hay una contraindicación o intolerancia a la asociación anterior (como pudiera ser el riesgo de hipoglucemia asociado a la sulfonilurea)2. Probablemente, ésta es la razón que determinó la elección de la combinación de metformina y vildagliptina en nuestra paciente, máxime si tenemos en cuenta que una hipoglucemia podría determinar un mayor riesgo de caída y, secundariamente, una fractura en una paciente con osteoporosis.
Tomando como base las recomendaciones de la guía del National Institute for Clinical Excellence (NICE) 20092 y de la reciente guía de práctica clínica del Ministerio de Sanidad y Consumo3 (MSC), se aconseja que los cambios se hagan rápidamente para mantener una HbA1c dentro del objetivo terapéutico (<7%) y llegar a la insulinización precoz, a fin de preservar la función de la célula beta y prevenir las complicaciones crónicas.
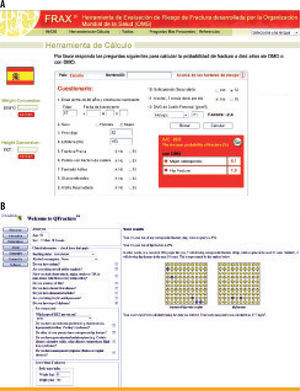
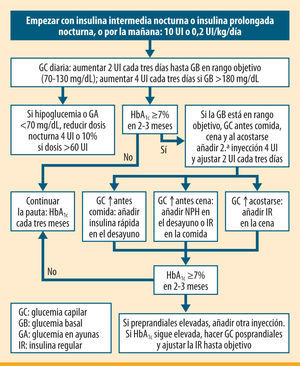
La primera opción cuando se produce un fallo secundario de los fármacos orales es añadir una dosis basal nocturna de insulina intermedia NPH o NPL, o de análogo lento (detemir o glargina), a cualquier hora del día si se trata de este último1-4. La dosis nocturna de insulina frena la producción hepática de glucosa en estado de ayunas y disminuye la hiperglucemia basal. El aumento de peso y las hipoglucemias son menores que con la insulinización en monoterapia. En los pacientes tratados con dos o más fármacos se recomienda mantener metformina y suspender el resto, aunque no hay suficientes evidencias para recomendar la suspensión o continuación de los otros fármacos orales. La dosis inicial recomendada es de 10 unidades o de 0,2 UI/kg/día, según el algoritmo propuesto por la ADA/EASD (figura 2). La elección de un análogo de insulina de acción prolongada frente a la insulina protamina neutra de Hagedorn (NPH) se fundamenta en un perfil de acción más predecible y un menor riesgo de hipoglucemias, especialmente nocturnas5. El parámetro que utilizaremos para guiarnos en el ajuste es la glucemia en ayunas, y nuestro objetivo será reducirla por debajo de 130mg/dL.
Algoritmo de inicio y ajuste de insulina en el paciente con diabetes mellitus tipo 2 (ADA/EASD 2009)1
Otra posibilidad terapéutica contemplada por algunas guías1, 2, 6 sería la triple terapia oral. Ésta constituye una alternativa a la insulinización si el paciente es reticente y la HbA1c no está por encima del 8,5%6, pero su eficacia es menor, en parte debido a la disminución del cumplimiento terapéutico y por la mayor incidencia de efectos secundarios. La combinación triple más potente sería la de una glitazona, una sulfonilurea y metformina, aunque pueden emplearse otros fármacos en caso de intolerancia o contraindicación de alguno de los mencionados2, 6. En caso de considerarse necesario el uso de una glitazona, se ha sugerido seleccionar pioglitazona, por su perfil de seguridad cardiovascular presumiblemente más favorable1. Sin embargo, en el caso clínico que nos ocupa (mujer diabética con criterios densitométricos de osteoporosis), al añadir una glitazona al esquema terapéutico debemos valorar la evidencia que sugiere que las glitazonas disminuyen la densidad mineral ósea y aumentan el riesgo de fracturas, sobre todo en mujeres7.
¿Qué perfiles glucémicos deberían realizarse con el cambio de terapia que propone?Según las recomendaciones de la ADA8 y de la guía de práctica clínica del MSC3, se acepta que la automonitorización de la glucosa sanguínea es útil en los pacientes con DM2 en tratamiento con insulina. En nuestra paciente, dado que se encuentra en fase de ajuste por inicio de tratamiento con insulina en dosis única diaria, recomendaríamos la realización diaria de las glucemias en ayunas9, explicándole un esquema de autoajuste de la dosis que es simple y eficaz: incrementar 2 UI cada 3 días mientras las glucemias capilares superen el objetivo planteado de 130mg/dL, y disminuir 2 UI si la glucemia capilar media es inferior a 80mg/dL.
¿Qué exploraciones, analíticas y pruebas complementarias deberían realizarse?En primer lugar, y debido a las alteraciones en el sistemático de orina (bacteriuria, leucocituria y nitritos), repetiría la analítica incluyendo un urinocultivo para confirmar una posible infección urinaria que estuviera contribuyendo a empeorar su control metabólico.
En cuanto a la presencia de complicaciones microvasculares, resulta extraño el diagnóstico de neuropatía periférica por electromiografía en una paciente con exploración neuropática y vascular normal, y en ausencia de complicaciones más precoces y frecuentes en los diabéticos de larga evolución, como por ejemplo la retinopatía y la neuropatía. Por este motivo, creo que deberíamos replantearnos la indicación de gabapentina, más cuando no ha sido efectiva.
La presencia de astenia importante y la elevación del marcador tumoral CA 19.9 (valor normal en adultos <37 UI/mL) nos obliga a descartar diversas patologías. El CA 19.9 se eleva en el 20-40% de los carcinomas gástricos y de colon y en el 75-95% de los cánceres de páncreas. También puede elevarse en enfermedades no neoplásicas como la pancreatitis y la colitis ulcerosa, la patología biliar (20%), las hepatopatías, la tuberculosis y en la propia diabetes, aunque en concentraciones más bajas. En general, los marcadores tumorales tienen poco valor en el diagnóstico de neoplasia maligna, pues no son lo bastante específicos y resultan poco sensibles en los estadios iniciales de la enfermedad. Su utilidad radica en el seguimiento de los procesos tumorales. Por estas razones, podríamos plantearnos solicitar una ecografía abdominal y, si fuera preciso, una tomografía axial computarizada (TAC) abdominal.
Otra de las posibles causas de astenia y debilidad de miembros inferiores debemos buscarla en la yatrogenia. Esta paciente sigue tratamiento con dos fármacos, atorvastatina y risedronato, que tienen entre sus efectos secundarios la debilidad, los calambres y los dolores musculoesqueléticos. Por esta razón se podría pedir una analítica que incluyera CPK, e incluso retirar transitoriamente dichos tratamientos y valorar la respuesta, máxime si tenemos en cuenta que el colesterol LDL de esta paciente está controlado (65mg/dL con un objetivo <100mg/dL), y que el efecto de los bisfosfonatos se mantiene tras la retirada del fármaco.
¿Qué otros cambios realizaría en el resto de la terapia de esta paciente?Algunas guías recogen la posibilidad de añadir ácido acetilsalicílico en dosis bajas, de 75–162mg/día. La ADA8 lo recomienda en pacientes con aumento del riesgo cardiovascular (riesgo a 10 años >10%); esto incluye a la mayoría de los hombres de >50 años o a las mujeres >60 años que tienen al menos otro factor de riesgo cardiovascular (FRCV), como por ejemplo antecedentes familiares de enfermedades cardiovasculares, hipertensión, tabaquismo, dislipidemia o albuminuria. El NICE2 lo recomienda en todos los DM2 ≥50 años o en <50 años con presencia de FRCV.
En esta paciente, dicho tratamiento es más que discutible si consideramos el balance riesgo/beneficio. La estimación del riesgo cardiovascular de nuestra paciente, basado en el United Kingdom Prospective Diabetes Study (UKPDS)10, da como resultado un riesgo de episodios cardiacos del 12,3%, y de ictus del 8,8% a 10 años (riesgo bajo); además, debemos recordar el uso de antiinflamatorios (celecoxib), que incrementaría el riesgo de hemorragia gastrointestinal.
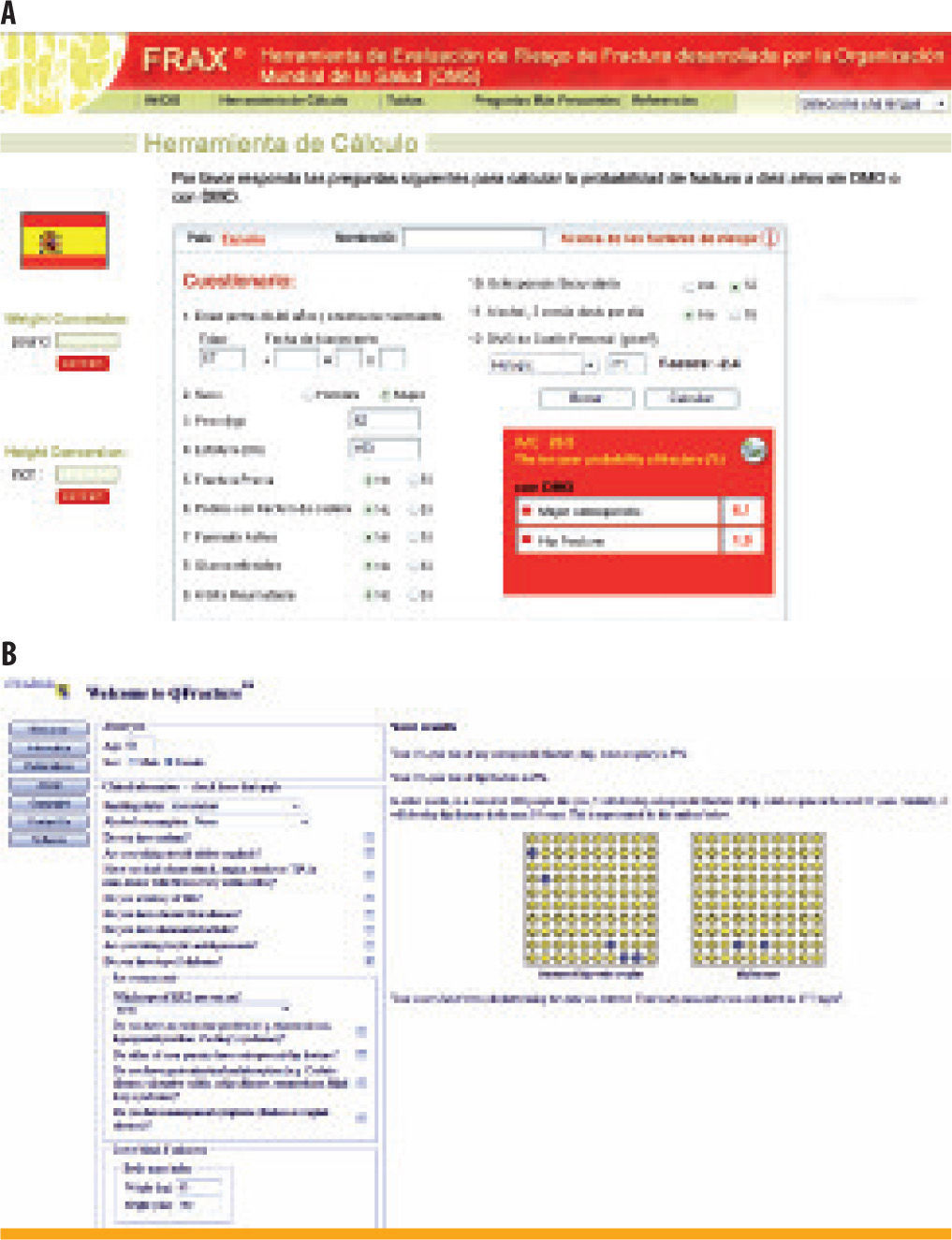
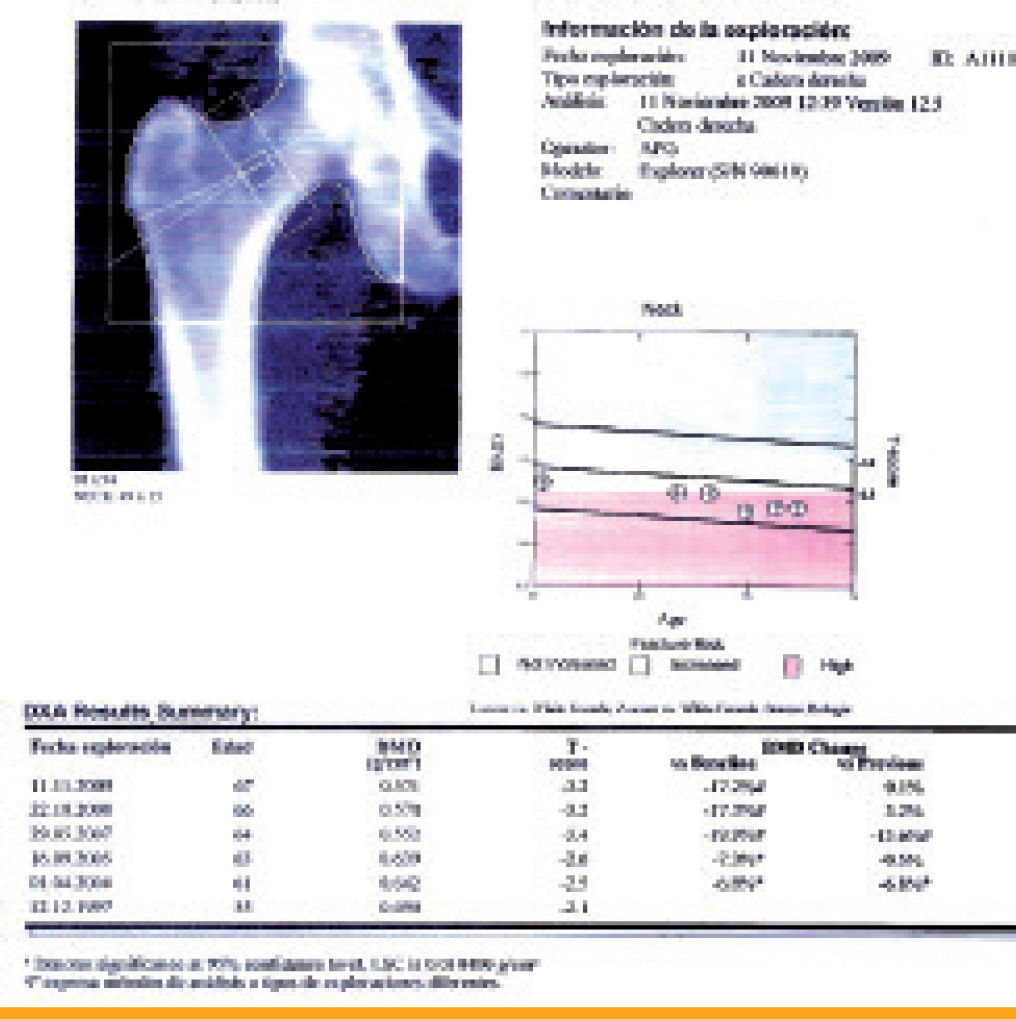
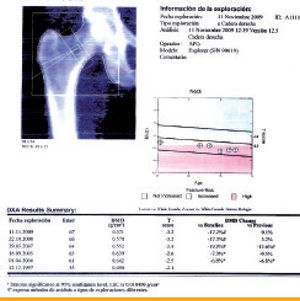
En cuanto al tratamiento de la osteoporosis, cabe recordar que los pacientes con mayor riesgo de fractura son los que más pueden beneficiarse del tratamiento farmacológico. Disponemos de algunas escalas de cálculo del riesgo absoluto de fractura, como el índice FRAX® (figura 3)11, que en la paciente que nos ocupa estima un riesgo de fractura medio del 9,5% para cualquier fractura osteoporótica mayor, y del 4,4% para la fractura de cadera. La respuesta terapéutica se considera aceptable si hay un aumento ≥5% en la zona lumbar y ≥8% en la zona femoral. En el caso de nuestra paciente, no hay cambios en la densidad mineral ósea desde 2007, razón que nos obliga a evaluar la adherencia y el cumplimiento terapéutico y a añadir suplementos de calcio (500–1.000mg/día) y vitamina D (800 UI/día)12, que habían sido suspendidos del esquema terapéutico sin una causa razonable, como por ejemplo presencia de efectos secundarios gastrointestinales. ¿
Herramienta FRAX® para el cálculo de riesgo absoluto de fractura en los siguientes 10 años11
Declaración de potenciales conflictos de intereses
Juan Carlos Obaya Rebollar declara no tener ningún conflicto de intereses en relación con el contenido de este manuscrito.



 EASD 2009)1' title='Algoritmo de inicio y ajuste de insulina en el paciente con diabetes mellitus tipo 2 (ADA/
EASD 2009)1' title='Algoritmo de inicio y ajuste de insulina en el paciente con diabetes mellitus tipo 2 (ADA/