La cirugía bariátrica es un tratamiento aceptado para pacientes con IMC superior o igual a 40kg/m2 y para pacientes con IMC 35-40kg/m2 que tengan comorbilidades como diabetes, hipertensión arterial, enfermedad cardiovascular, dislipidemia, SAOS y artrosis degenerativa1. Las técnicas quirúrgicas más frecuentemente utilizadas son la banda gástrica, el by-pass gástrico, la derivación biliopancreática, el cruce duodenal y la gastrectomía tubular. Los estudios muestran que la cirugía bariátrica comporta una pérdida de peso significativa y es más efectiva en la mejora de la diabetes a corto plazo (hasta 2 años) que las intervenciones convencionales como la dieta, el ejercicio y los cambios del estilo de vida. La mejoría de la DM se inicia rápidamente después de la cirugía, antes de la existencia de una pérdida de peso significativa. Se ha sugerido que los mecanismos de esta mejoría, aunque no del todo conocidos, pueden ser en parte independientes de la pérdida de peso y explicados por cambios en la secreción hormonal de péptidos intestinales implicados en la homeostasis de la glucosa y la regulación del balance energético (principalmente GLP-1 y ghrelina)2. Esto sugiere que la cirugía bariátrica puede mejorar comorbilidades metabólicas incluso en pacientes que no presenten obesidad mórbida, de manera que la cirugía bariátrica se ha planteado como opción terapéutica para el tratamiento de la diabetes y otras condiciones metabólicas en pacientes con menor IMC (entre 30-35kg/m2). Esta cirugía dirigida al tratamiento de las alteraciones metabólicas y no a la reducción de peso ha recibido el nombre de cirugía metabólica.
Sin embargo, el papel de la cirugía bariátrica como terapia primaria para la DM2 dependerá de si los beneficios exceden las complicaciones quirúrgicas y nutricionales, y esto puede solo ser determinado por estudios controlados aleatorizados a largo plazo que comparen sus resultados con los de un tratamiento médico optimizado.
¿Qué hemos aprendido de los efectos de la cirugía sobre la diabetes mellitus tipo 2 en las indicaciones clásicamente aceptadas?Desde que Pories en el año 19953 describiera la remisión de la DM2 tras el by-pass gástrico en pacientes con obesidad mórbida, otros grupos han verificado los beneficios de las técnicas bariátricas sobre la DM2. Sin embargo, la mayoría de la literatura publicada que apoya la remisión de la diabetes tras cirugía bariátrica tiene un seguimiento a corto y medio plazo. El metaanálisis más importante a este respecto, el metaanálisis de Buchwald de 621 estudios (la mayoría serie de casos retrospectivos) incluyendo by-pass gástrico, derivación biliopancreática/cruce duodenal, estimó que un 78,1% de los pacientes diabéticos sometidos a estas técnicas experimentaban remisión de la diabetes4. Sin embargo, de los estudios incluidos en este metaanálisis pocos tenían una buena calidad, la mayoría carecían de información del paciente preoperatoria, no estaba descrito el tiempo de seguimiento y estaban basados en datos clínicos en lugar de en parámetros bioquímicos específicos, como las concentraciones de HbA1c o glucemia plasmática en ayunas.
En el estudio SOS con 641 pacientes intervenidos (banda gástrica, gastroplastia vertical anillada y by-pass gástrico), un 72% de los operados experimentaron remisión de la DM2 a los 2 años5. Resultados similares han sido descritos en varios estudios realizados con gastrectomía tubular con un seguimiento no superior a 3 años6–8.
Debemos tener en cuenta que los criterios utilizados para definir remisión de la DM han sido muy variables en función de los estudios. De este modo, los puntos de corte para la HbA1c han sido heterogéneos, y no fue hasta el año 2009 que un comité de expertos estableció los criterios de remisión9. Estos nuevos criterios utilizan puntos de corte de glucemia/HbA1c más estrictos (HbA1c<6%, glucemia plasmática en ayunas <100mg/dl durante al menos un año sin tratamiento farmacológico) y por tanto, las tasas de remisión comunicadas más recientemente son más bajas que las descritas previamente en la literatura, estimándose actualmente que un 60% de los pacientes alcanzan remisión de su diabetes en los primeros años tras la cirugía.
Factores implicados en la remisión de la diabetes mellitus tipo 2Varios factores han sido propuestos como predictores de remisión de la diabetes tras cirugía bariátrica, como son una diabetes en un estadio precoz, no tratada con insulina y con buen control metabólico, pérdida significativa del porcentaje del exceso de peso tras la cirugía y edad joven. Por el contrario se ha descrito una disminución de las probabilidades de remisión a mayor duración de la DM2 (entre 5-10 años), HbA1c>8%, tratamiento con insulina y pérdida del exceso de peso<50%. Respecto a la reserva pancreática, concentraciones de péptido c<1ng/ml son predictoras de no remisión. Aunque no existe un consenso respecto a los valores de corte del péptido c basal, una menor reserva pancreática es un factor de peor respuesta a la cirugía. Una edad mayor se ha asociado también a no remisión, probablemente por el deterioro de las células beta y la progresión de la enfermedad10,11. Recientemente se han descrito varios algoritmos para calcular las probabilidades de remisión de la DM2. Entre ellos destaca el DiaRem score system, que utiliza las variables preoperatorias (edad, HbA1c, tipo de antidiabéticos orales, tratamiento con insulina) con una puntuación del 0 al 22 con mayor probabilidad a mayor puntuación. De todas las variables el tratamiento con insulina es la de mayor peso12.
De lo anterior se concluye que aquellos pacientes con una DM de más larga evolución, menor reserva pancreática, peor control metabólico y tratamiento con insulina, que son los que más preocupan al endocrinólogo, son los que menos se beneficiarán de la cirugía.
Evidencias de la reaparición de diabetes mellitus tipo 2 tras remisiónSi bien inicialmente un 50-60% de los pacientes con DM2 alcanzan remisión de su diabetes tras la cirugía bariátrica, un 20-40% de estos experimentan reaparición de la misma a largo plazo. Se conocen poco los factores asociados, aunque se ha sugerido que una edad más avanzada, la mayor duración de la DM, la utilización preoperatoria de insulina, una escasa pérdida ponderal inicial y la recuperación de peso tras la cirugía son predictores significativos de reaparición de la DM.
Un estudio recientemente publicado por Shauer, con 217 pacientes (n=162 by-pass gástrico, n=32 banda gástrica, n=32 gastrectomía tubular), mostró una remisión completa en un 24% de los pacientes, sin embargo en el seguimiento a 5 años se observó recurrencia en un 19% de los mismos. Analizando por tipo de intervención un 52% de los pacientes con by-pass gástrico alcanzó remisión completa con una recurrencia a 5 años del 17%, y en gastrectomía tubular la remisión fue alcanzada en un 26% de los sujetos con recurrencia en un 38% de los mismos. En este estudio una duración de la diabetes >5 años previa a la cirugía fue el factor más importante para predecir la reaparición de DM13. En el estudio prospectivo de Adams el seguimiento de 418 pacientes sometidos a by-pass gástrico mostró remisión de la diabetes en el 75% a 2 años, y del 62% a los 6 años respectivamente14. En el estudio retrospectivo de Arterburn, con 4.434 adultos sometidos a by-pass gástrico, un 68,2% experimentó una remisión completa de su diabetes en los primeros 5 años tras la intervención. De estos un 35,1% volvió a desarrollar DM, siendo la duración media de remisión de 8,3 años15. En el estudio SOS solo un 36% permanecía sin diabetes a los 10 años de seguimiento5. Recientemente, en el congreso EASD de Barcelona 2013, Sjostrom mostró que en el seguimiento a 20 años esta cifra descendía a menos del 20%.
De manera que de los estudios anteriores se concluye que si bien el by-pass gástrico se asocia a una remisión inicial en la mayoría de los diabéticos con obesidad mórbida, en aproximadamente un tercio de los casos la diabetes reaparece a los 5 años de la remisión inicial. Aunque todavía existen pocos datos, la gastrectomía tubular presenta unas cifras similares de remisión en los primeros años, pero a largo plazo el porcentaje de recidiva parece ser superior con esta técnica.
Reducción de las complicaciones macrovascularesEl objetivo final del tratamiento de la DM es reducir las complicaciones micro y macrovasculares. A los 10 años de la cirugía bariátrica el estudio SOS mostró una reducción de todas las causas de mortalidad, muertes cardiovasculares y primeros eventos fatales y no-fatales cardiovasculares (IAM y AVC)16. La incidencia de eventos cardiovasculares fue inferior en los pacientes inicialmente diabéticos en el grupo quirúrgico comparado con el control (13,4 vs 19,9/1.000 personas/año). Sin embargo, el efecto beneficioso del tratamiento quirúrgico respecto a los eventos cardiovasculares se asoció no a la presencia de diabetes, sino a las concentraciones basales de insulina, siendo el beneficio superior en participantes con las concentraciones más altas.
Complicaciones microvascularesDatos de los estudios UKPDS, DCCT/EDIC han mostrado que un periodo de control glucémico optimizado con tratamiento farmacológico y dieta puede inducir una memoria metabólica y reducir los eventos microvasculares. Sin embargo, los efectos de la cirugía bariátrica sobre las complicaciones microvasculares permanecen sin explorar a pesar de más de 40 años de cirugía en pacientes con DM2. Además existe la preocupación de que una rápida mejoría de la glucemia pueda paradójicamente causar o exacerbar las complicaciones microvasculares.
De los pocos datos al respecto, en 84 pacientes con DM2 sometidos a cirugía bariátrica (by-pass gástrico, banda gástrica, gastrectomía tubular), Miras et al. analizaron la evolución de la retinopatía a 12-18 meses y de la excreción urinaria de albúmina. De los 67 pacientes con datos oftalmológicos 7,5% mostraron mejoría de la retinopatía (RTP), 1,5% deterioro y el 91% no mostraron cambios. De los 28 pacientes con RTP 17,8% mejoraron, 3,6% mostraron deterioro y 78,6% no mostraron cambios, ninguno normalizó tras la cirugía. De los 32 pacientes con albuminuria preoperatoriamente, su ratio albúmina/creatinina mejoró de 7,6 a 2,2mg/mmol. Estos cambios no se correlacionaron con reducciones de peso, glucemia o presión arterial17. Brethauer estudió la evolución de la albuminuria en un grupo de 59 pacientes intervenidos de by-pass gástrico y seguidos durante 6 años. De los 40 pacientes con normoalbuminuria previa a la cirugía el 5% desarrolló albuminuria, de los 19 pacientes con albuminuria (2 con macroalbuminuria), la nefropatía diabética remitió en un 53% y en el resto permaneció estable. De los 2 pacientes macroalbuminúricos uno volvió a microalbuminuria y otro normalizó la excreción urinaria de albúmina13. De los datos previos se deduce que aunque algunos estudios iniciales han mostrado mejoría en retinopatía y nefropatía diabética el impacto de la cirugía bariátrica sobre las complicaciones microvasculares todavía no es bien conocido.
Remisión de la diabetes mellitus tipo 2 tras cirugía en índice de masa corporal<35kg/m2. Evidencias de los estudios controlados aleatorizadosHasta la publicación recientemente de los primeros estudios controlados y aleatorizados en cirugía metabólica disponíamos únicamente de la evidencia de diferentes series de casos, con un bajo número de pacientes y seguimiento a muy corto plazo, sin que constara en la mayoría de ellos información sobre el tiempo de evolución de la diabetes, tratamientos recibidos, reserva pancreática, etc. En estos se analizaba la evolución de la DM2 en pacientes con IMC<35kg/m2 tras diferentes procedimientos quirúrgicos, modificaciones sobre técnicas ya utilizadas en cirugía bariátrica (by-pass metabólico, by-pass duodeno-yeyunal, by-pass duodeno-yeyunal asociado a gastrectomía tubular, interposición ileal con o sin gastrectomía tubular), con resultados dispares.
Existen en la actualidad 4 estudios de alta calidad metodológica (controlados aleatorizados) que han analizado el papel de la cirugía metabólica comparado con el tratamiento médico en la mejoría de la DM2. Estos estudios han incluido un número pequeño de pacientes, son de corta duración (la mayoría de un año de duración) y han mostrado superioridad en el control glucémico de la cirugía comparado con el tratamiento médico, pero a expensas de complicaciones quirúrgicas y alteraciones nutricionales en muchos casos no bien detalladas. Así mismo se debe tener en cuenta que estos trabajos han incluido pacientes con IMC>30, siendo el porcentaje de sujetos con IMC 30-35 un 34-58% y estos no han sido analizados por separado.
Dixon et al. realizaron un estudio aleatorizado a 2 años comparando banda gástrica con tratamiento médico convencional en 60 pacientes con IMC 30-40kg/m2 (n=13, <35kg/m2) y DM2 de reciente diagnóstico (<2años de evolución), con control metabólico no deteriorado HbA1c 7,8%, únicamente un paciente basalmente recibía tratamiento con insulina. La remisión de la diabetes tuvo lugar en un 73% de los pacientes del grupo quirúrgico y en un 13% de la terapia convencional. La pérdida de peso fue del 20,7% vs 1,7%. Las complicaciones fueron 3% infección de la herida quirúrgica, 6% agrandamiento del reservorio y 3% retirada de banda por disfagia18.
Schauer et al., en la clínica Cleveland, realizaron un estudio aleatorizado comparando los efectos del tratamiento médico intensivo vs tratamiento médico intensivo más by-pass gástrico o gastrectomía tubular (estudio STAMPEDE)19. Los 150 pacientes aleatorizados (únicamente un 34% con IMC<35kg/m2), presentaban una diabetes de 8,2 años de duración, mal controlada HbA1c media de 9,3%, y recibían tratamiento con insulina un 46%. Al año un 12% de los pacientes con tratamiento médico tenían una HbA1c<6% comparado con un 42% en el grupo de by-pass y de 37% en el grupo de gastrectomía tubular. La HbA1c alcanzada fue de 7,5±1,8% en el grupo de tratamiento médico, 6,4±0,9% en el grupo de by-pass gástrico y de 6,6±1,0% en el de gastrectomía tubular. La pérdida de peso fue de 5,4kg en el grupo de tratamiento médico vs 29,4 y 25,1kg respectivamente. Comparado con el tratamiento médico se observó una reducción significativa de los niveles de triglicéridos en BPG pero no en GT. Las concentraciones de HDL se incrementaron de manera significativa en ambos grupos quirúrgicos comparado con el tratamiento médico. La utilización de tratamiento hipolipidemiante fue del 92% en el grupo de tratamiento médico vs 27% en BPG y 39% en GT. No se observaron diferencias en las cifras de tensión arterial, sin embargo el número de fármacos hipotensores se redujo de manera significativa en los pacientes con tratamiento quirúrgico. Las complicaciones fueron superiores en el grupo de by-pass comparado con gastrectomía tubular, siendo las más relevantes: 22 vs 8% re-hospitalizaciones, 6 vs 2% reintervenciones, 2 vs 2% transfusión, 2 vs 0% descenso en hemoglobina ≥5g/dl, 2 vs 0% infección de la herida quirúrgica, 4 vs 0% neumonía, 2 vs 0% hernia. En gastrectomía tubular 2% fístula, 2% arritmia y 2% derrame pleural. Recientemente han sido publicados los resultados a 3 años de un 91,3% de los pacientes inicialmente aleatorizados (n=137). Un 5% de los pacientes con tratamiento médico logra una HbA1c<6% vs 38% con by-pass y 24% con gastrectomía tubular20. La disminución del IMC y la duración de la diabetes<8 años fueron los predictores de alcanzar los objetivos primarios.
Mingrone et al. realizaron un estudio aleatorizado de 60 pacientes con DM2 aleatorizados a tratamiento médico convencional, by-pass gástrico o derivación biliopancreática. Los pacientes tenían una evolución de la DM de 6 años, un IMC 45kg/m2 (no se especifica cuántos por debajo de IMC 35kg/m2) y una HbA1c 8,5% (by-pass) y 8,8% (DBP). Se excluyeron de este estudio pacientes con complicaciones severas de la DM. A los 2 años la ratio de remisión (definida como glucosa plasmática en ayunas<100mg/dl, HbA1c<6,5% sin tratamiento médico), fue del 0% en el grupo de tratamiento médico, 75% en el de by-pass gástrico y 95% en DBP. La HbA1c fue de 7,69±0,57% vs 6,35±1,42, y 4,95±0,49, respectivamente. La pérdida de peso fue de 4,7kg en el grupo de tratamiento médico, 33,3kg y 33,8kg respectivamente. Las cifras de colesterol total se normalizaron en un 27,3% de los pacientes con tratamiento médico, 100% en BPG y DBP. Los triglicéridos se normalizaron en 0, 85,7 y 92,3% respectivamente y el HDL colesterol en un 11,1, 100 y 72,7%. El tratamiento antihipertensivo fue reducido o discontinuado en un 70% de los pacientes con tratamiento médico, 80% en BPG y 85% en DBP. Complicaciones en by-pass: 5% oclusión intestinal, 11% anemia; en DBP 5% hernia, 11% anemia, 5% osteopenia y 5% osteoporosis21.
Diabetes Surgery Study es un estudio a 12 meses aleatorizado que compara los efectos del tratamiento médico intensivo solo o combinado con by-pass para el control de DM2, la HTA y la hiperlipidemia22. Los 120 pacientes presentaban una DM de 9 años de evolución, una HbA1c de 9,6% (un 50% recibían insulina) y un 58% tenían IMC<35kg/m2. El objetivo primario (HbA1c<7%, LDL<100, TAS<130) fue alcanzado por un 49% de los pacientes con by-pass, 19% en la terapia médica. El grupo quirúrgico requirió 3 medicaciones menos para el control de la glucemia, dislipidemia e hipertensión. El porcentaje de pérdida de peso fue superior en el by-pass gástrico, 26,1 vs 7,9%. Los efectos adversos fueron superiores en el grupo de tratamiento quirúrgico, siendo los más relevantes: 2 fístulas, una infección y un hematoma de la herida quirúrgica, 2 estenosis, un sangrado de úlcera anastomótica, una gastritis y 2 obstrucciones intestino delgado. La complicación para un paciente con fístula incluyó sepsis, AVC, amputación de extremidades inferiores, fallo multiorgánico, coma y alteración de lacoagulación. Las alteraciones nutricionales asociadas al by-pass incluyeron déficit de hierro en 13 pacientes, en 4 hipoalbuminemia y en 11 déficit de vitamina B12.
De los estudios previos se concluye que tras un año de la cirugía, la reducción de peso y de la HbA1c es superior a la observada en estudios con dieta, ejercicio u otras intervenciones médicas. Se muestra también una mejoría de la hipertensión y del colesterol al año de la cirugía. Sin embargo, la cirugía resulta en complicaciones quirúrgicas no despreciables y alteraciones nutricionales y vitamínicas cuya prevalencia a largo plazo es desconocida. A destacar que únicamente en 2 estudios de los anteriores el grupo aleatorizado a tratamiento médico recibe un tratamiento médico intensificado con fármacos del que actualmente disponemos para el tratamiento del paciente diabético obeso y dieta seguida de manera estricta por dietistas.
Reducción de las complicaciones macrovascularesNo existen datos en la actualidad sobre morbimortalidad cardiovascular tras cirugía para individuos con IMC<35kg/m2. A este respecto Cohen analizó un grupo de 66 pacientes con IMC entre 30-35kg/m2 seguidos entre 1-6 años tras by-pass gástrico (duración DM 12,5 años, HbA1c 9,7%, 15% insulinizados), mostrando resolución de la DM2 en un 88% de los casos, de la hipertensión en 58%, de la dislipidemia en 64% y de la hipertrigliceridemia en 58%. El riesgo a 10 años de desarrollar enfermedad cardiovascular fue calculado utilizando el algoritmo del UKPDS RISK Engine. El riesgo de enfermedad coronaria se redujo en un 71%, en un 84% el de enfermedad cardiovascular fatal, en un 50% AVC y en un 57% AVC fatal. En este grupo no hubo mortalidad, pero en un 15% hubo morbilidad menor (8 hematomas en el puerto trócar, una úlcera anastomótica)23.
Complicaciones microvascularesNo existen en la actualidad estudios que hayan demostrado el impacto de la cirugía metabólica sobre las complicaciones microvasculares. Tampoco existen datos de estudios controlados aleatorizados que apoyen la utilización de la cirugía metabólica para comorbilidades que están frecuentemente asociadas con la obesidad, incluyendo la estatohepatitis no alcohólica, el SAOS, etc.
Limitaciones de los estudios en cirugía metabólicaExisten en la actualidad pocos estudios de calidad que hayan incluido un pequeño número de pacientes diabéticos con IMC 30-35kg/m2 y su seguimiento ha sido a corto plazo (<2 años). En la mayoría de estos estudios los pacientes diabéticos con comorbilidades severas y múltiples han sido excluidos. Estos estudios no han sido diseñados para evaluar los efectos adversos, de manera que las complicaciones reportadas pueden estar sesgadas y ser menores a las prevalencias experimentadas en la comunidad más amplia. Además se han llevado a cabo en centros académicos de excelencia, de manera que los efectos adversos descritos pueden infraestimar las cifras de centros menos especializados con población más amplia. Se desconoce además la efectividad de la cirugía metabólica en prevenir complicaciones crónicas de la DM. Los estudios realizados por el momento han tenido lugar en otros países, de manera que su aplicabilidad en nuestra población no está clara puesto que la dieta, el estilo de vida y cultura pueden diferir claramente de un país a otro. Es necesario todavía evaluar la calidad de vida y los resultados psicológicos tras esta cirugía.
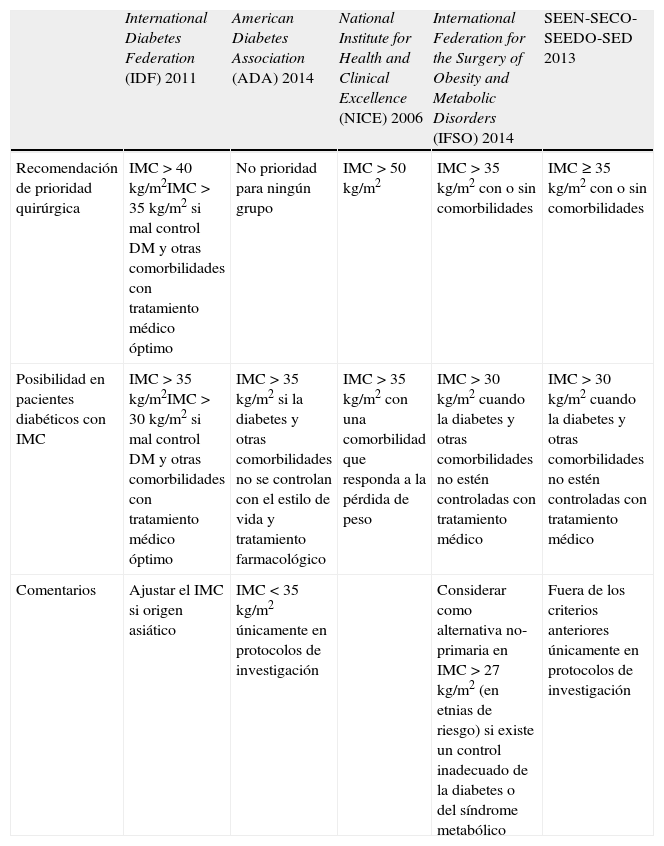
Consensos de las diversas sociedades respecto a la cirugíaen pacientes con índice de masa corporal 30-35kg/m2Las diferentes sociedades difieren en cuanto a su posicionamiento sobre la cirugía en diabéticos con IMC<35kg/m2 (tabla 1). La American Diabetes Association (ADA) muestra una actitud más conservadora restringiendo este tipo de cirugía al contexto de los ensayos clínicos, sin embargo para otras sociedades esta cirugía estaría indicada en aquellos pacientes con deficiente control metabólico con el tratamiento médico.
Guías sobre la indicación de cirugía bariátrica en adultos con diabetes
| International Diabetes Federation (IDF) 2011 | American Diabetes Association (ADA) 2014 | National Institute for Health and Clinical Excellence (NICE) 2006 | International Federation for the Surgery of Obesity and Metabolic Disorders (IFSO) 2014 | SEEN-SECO-SEEDO-SED 2013 | |
| Recomendación de prioridad quirúrgica | IMC>40kg/m2IMC>35kg/m2 si mal control DM y otras comorbilidades con tratamiento médico óptimo | No prioridad para ningún grupo | IMC >50kg/m2 | IMC>35kg/m2 con o sin comorbilidades | IMC≥35kg/m2 con o sin comorbilidades |
| Posibilidad en pacientes diabéticos con IMC | IMC>35kg/m2IMC>30kg/m2 si mal control DM y otras comorbilidades con tratamiento médico óptimo | IMC>35kg/m2 si la diabetes y otras comorbilidades no se controlan con el estilo de vida y tratamiento farmacológico | IMC>35kg/m2 con una comorbilidad que responda a la pérdida de peso | IMC>30kg/m2 cuando la diabetes y otras comorbilidades no estén controladas con tratamiento médico | IMC>30kg/m2 cuando la diabetes y otras comorbilidades no estén controladas con tratamiento médico |
| Comentarios | Ajustar el IMC si origen asiático | IMC<35kg/m2 únicamente en protocolos de investigación | Considerar como alternativa no-primaria en IMC >27kg/m2 (en etnias de riesgo) si existe un control inadecuado de la diabetes o del síndrome metabólico | Fuera de los criterios anteriores únicamente en protocolos de investigación |
En un paciente diabético con IMC>30 y <35kg/m2 la cirugía metabólica debería esperar hasta haberse confirmado una respuesta inapropiada a un tratamiento médico optimizado. Sin embargo, en la mayoría de los estudios, incluso en los de mayor calidad, como máximo un 46% de los pacientes recibían insulina y un porcentaje todavía menor análogos del GLP-1. Además solo en un estudio un programa intensivo de pérdida de peso fue ofrecido durante 4 meses previos a la intervención. Disponemos en la actualidad de datos sólidos que indican que las intervenciones sobre el estilo de vida mejoran el control de la DM2. En el estudio LOOK AHEAD los cambios del estilo de vida intensivos consiguieron unas diferencias en la pérdida de peso en el primer año (8,6% en el grupo de intervención vs 0,7% en el grupo control) que se mantuvo significativo a lo largo del estudio. El estudio observó una mayor tasa de remisión de la DM inicial del 11,5 y 7,3% a 4 años comparado con la educación estándar (2,0%)24. Además, las opciones farmacológicas han mejorado en los últimos años con la aparición de nuevas clases de medicamentos hipoglucemiantes como los análogos del GLP-1, que han supuesto un gran avance en el control de la enfermedad permitiendo reducciones de HbA1c de hasta 1,9% y pérdida promedio de 3,6kg de peso en valores absolutos. Otros fármacos como los inhibidores de la SGLT2 con menor potencia hipoglucemiante permiten alcanzar una reducción HbA1c de 0,5% y pérdida de hasta 4-5kg en estudios de extensión a expensas predominantemente de masa grasa. Por otro lado, aunque todavía no comercializados en nuestro país, existen nuevos medicamentos para la obesidad (lorcaserina, topiramato/fentermina) con ensayos que muestran una pérdida de peso de hasta el 3,6 y del 8,7%, respectivamente y una reducción de la HbA1c del 0,5%. De manera que un abordaje integral multimodal puede ser beneficioso y debería ser valorado antes del tratamiento quirúrgico25.
En opinión de la autora la cirugía metabólica siempre debe esperar en el caso de pacientes diabéticos con buen control metabólico con tratamiento médico y del resto de comorbilidades asociadas a la obesidad (hipertensión arterial, dislipidemia, SAOS). Sin embargo, una vez objetivada la falta de control metabólico con los cambios del estilo de vida y el tratamiento médico intensificado, puede plantearse la cirugía antes de que el paciente se encuentre en un estadio muy evolucionado de la enfermedad, con fracaso de la célula beta. Porque, como se ha comentado anteriormente, los pacientes con una diabetes de larga evolución (>8-10 años), con menor reserva pancreática (péptido c<1ng/ml), peor control metabólico (HbA1c>8%) y tratamiento con insulina, que son los que más dificultades de manejo suponen al endocrinólogo, son los que menos se beneficiarán de la cirugía. Es fundamental haber descartado previamente otras formas de diabetes (diabetes tipo 1, LADA, MODY). La cirugía será especialmente útil cuando coexistan otras comorbilidades mayores como dislipidemia, hipertensión arterial, apneas obstructivas del sueño no controladas con el tratamiento habitual. Esta opinión está en consonancia con el actual posicionamiento de la SEEN-SECO-SEEDO-SED.
El paciente en esos supuestos puede escoger la cirugía metabólica como opción terapéutica, siendo previamente informado de que la evidencia actual es escasa para llegar a una conclusión sobre la efectividad de la cirugía metabólica respecto a la pérdida de peso continuada o mantenimiento del peso perdido a largo plazo (más de 2 años), concentraciones de HbA1c a largo plazo (>2 años) y reducción de las complicaciones microvasculares y macrovasculares. Así mismo, la cirugía resulta en complicaciones quirúrgicas no despreciables y alteraciones nutricionales y vitamínicas que han sido poco descritas, y cuya prevalencia a largo plazo es desconocida. El paciente deberá aceptar adherirse a unas pautas nutricionales estrictas y a una suplementación vitamínica de por vida, de manera que en cierto modo sustituirá una medicación crónica por otra.
En relación con la técnica que se recomienda utilizar esta ha de basarse en procedimientos conocidos con modificaciones para adaptarse a las condiciones de peso del paciente y debe ser realizada por un cirujano experto dentro de un equipo multidisciplinar con estrecha colaboración, especialmente con endocrinólogos y dietistas.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.