La insulinoterapia basal-bolo administrada mediante infusores continuos de insulina (bombas de insulina) es la terapia más efectiva y segura actualmente para obtener un buen control metabólico en pacientes con diabetes mellitus tipo 1, sufriendo una dramática evolución en los últimos años con el lanzamiento de dispositivos cada vez más inteligentes, con programas de características específicas, como ayudantes para la administración de bolos, funciones de insulina activa, establecimiento de metas, entre otras. Es así como el mayor avance en tecnología de la terapia intensiva de diabetes ha sido el desarrollo de la monitorización continua de glucosa en tiempo real y su integración a las bombas de insulina. Se ha demostrado su impacto clínico, con una mayor reducción de la hemoglobina glucosilada, sin incrementar el riesgo de hipoglucemia, frente a la terapia con regímenes de múltiples dosis de insulina o a los sistemas de infusión continua subcutánea de insulina solos. Diferentes estudios clínicos controlados soportan la evidencia para la recomendación del uso de terapias con bomba de insulina integradas a la monitorización continua de glucosa, los cuales se revisarán desde una visión crítica en el presente artículo.
Baseline-bolus insulin therapy administered using continuous insulin infusions (insulin pumps) is currently the most effective and safe treatment to achieve good metabolic control in patients with type 1 diabetes mellitus, and is experiencing dramatic progress in the last few years with the launching of increasingly more intelligent devices, with programs with specific characteristics, including aids for the administration of a bolus, active insulin functions, establishing targets, etc. For these reasons, the greatest technological advance in intensive diabetes therapy has been the development of real-time continuous glucose monitoring and their integration with insulin pumps. Their clinical impact has been demonstrated, with a major reduction in the glycosylated haemoglobin, without increasing the risk of hypoglycaemia compared to treatment with multiple dose insulin regimes or subcutaneous insulin only infusion systems. Different clinical studies support the evidence for recommending the use of therapies with an insulin pump integrated with continuous glucose monitoring, and will be critically reviewed in the present article.
La insulinoterapia basal-bolo administrada mediante infusores continuos de insulina (bombas de insulina) es una terapia efectiva y segura para obtener un buen control metabólico en pacientes con diabetes mellitus tipo 1 (DM1), que ha tenido una gran evolución en los últimos años con el lanzamiento de dispositivos «inteligentes», con programas de características específicas, como ayudantes para la administración de bolos, funciones de insulina activa, establecimiento de objetivos terapéuticos, entre otras. Pero el mayor avance en tecnología de la terapia intensiva de diabetes ha sido el desarrollo de la monitorización continua de glucosa (MCG) en tiempo real y su integración a las bombas de insulina en los últimos 5 años. Estos sistemas dan al paciente la información correspondiente al valor y tendencias de la glucosa intersticial y permiten la programación de alertas, las cuales se activan una vez la glucosa se encuentra fuera de los rangos de normalidad, permitiendo al paciente tomar medidas pertinentes y así evitar tanto la hiperglucemia como la hipoglucemia. Algunos dispositivos van más allá y pueden suspender la infusión de insulina automáticamente al detectar niveles inferiores a los programados como seguros para el paciente. Las diferentes guías clínicas, sustentadas en múltiples estudios, han demostrado la necesidad de la intensificación del tratamiento en DM1 para alcanzar el buen control metabólico y reducir las complicaciones micro y macrovasculares a largo plazo1,2. El estudio Diabetes Control and Complications Trial (DCCT) demostró claramente el beneficio de tratar al paciente, buscando una meta de hemoglobina glucosilada (HbA1c) de 7% o menos, con una gran disminución de la morbilidad asociada, demorando el inicio o progresión de las complicaciones severas de la DM11,3. Dicho objetivo se logró a través de la reducción de los niveles de glucosa con esquemas de múltiples dosis de insulina (mínimo 3 al día) o el uso de infusión de insulina continua por bomba sumado a la automonitorización frecuente de los niveles de glucosa (al menos 4 veces al día) vs manejo convencional (1 o 2 inyecciones de insulina diariamente y pruebas de glucosa urinaria o sérica diarias)3. Sin embargo, el costo de la reducción de la HbA1c fue la presencia 3 veces mayor de hipoglucemia severa en el grupo de manejo intensivo, la cual tuvo una incidencia de 62 eventos por 100 pacientes año3. Es así como la hipoglucemia y el temor a esta son las principales barreras para lograr un buen control metabólico en pacientes con DM1, limitando las probabilidades de alcanzar una HbA1c menor del 7%2,4. La hipoglucemia se puede presentar en forma inadvertida hasta en un 57% de los pacientes, con valores menores de 70mg/dl en los periodos nocturnos, con una frecuencia de 2 episodios sintomáticos por semana, y de 1 a 1,7 episodios severos por año, con discapacidad temporal (por convulsiones o coma), alcanzando una prevalencia anual en los casos severos del 30 al 40%5,6. Desde la publicación del DCCT se han presentado innovaciones tecnológicas, siendo el avance más importante y relevante el desarrollo de los sistemas de monitorización continua de glucosa intersticial en tiempo real, así como su integración a la terapia con bomba de insulina desde el año 2006. Este proceso ha permitido aproximarse cada vez más al objetivo ideal de la terapia moderna de la diabetes: alcanzar una hemoglobina glucosilada más baja, sin incrementar el riesgo de hipoglucemia.
Aspectos técnicos en la monitorización continua de glucosaLa mayoría de los sistemas de monitorización continua de glucosa disponibles miden el contenido de glucosa intersticial usando un sensor enzimático electroquímico, llegando al fluido intersticial por una aguja-sensor insertada en forma subcutánea7,8 o por el implante del dispositivo completo en forma subcutánea9. Los dispositivos extraen el líquido intersticial a través de la piel usando un potencial eléctrico aplicado (iontoforesis), sobre el cual se realizan las determinaciones. Por contener una glucosa oxidasa, se presenta la conversión de glucosa del líquido intersticial en unión con oxígeno, en ácido glucónico y peróxido de hidrógeno (H2O2), el cual por su reactividad se disocia en hidrógeno y oxígeno, con liberación de energía (hasta 0,6 voltios). Esta descarga viaja a través de un electrodo al dispositivo, el cual interpreta la magnitud de la señal eléctrica como proporcional a la concentración de glucosa7. Las versiones iniciales de sensores otorgaban lecturas variables y con regular nivel de confiabilidad, los cuales han mejorado significativamente en el transcurso de la última década8,9. Los sistemas actuales de MCG utilizan algoritmos de calibración que incorporan los datos previos y futuros en los cálculos de cada valor de glucosa, por lo que son una aproximación al «tiempo real», empleando un modelo de promedio de regresión «suavizado», donde el sensor selecciona el valor reportado del acervo de datos obtenidos previamente que más se ajuste a la tendencia de las nuevas determinaciones de glucosa10. Una de las críticas realizadas a este tipo de dispositivos es que los sensores de líquido intersticial registran valores menores de glucosa comparados con la glucosa venosa plasmática, y presentan variaciones mayores cuando hay cambios rápidos en las concentraciones de glucosa plasmática11,12. En estudios iniciales, la MCG mostraba tendencia a una menor precisión en el rango inferior de glucemia (< 70mg/dl o 3,9 mmol/l), por lo que se discutió su validez para detectar hipoglucemia10. Sin embargo, los dispositivos actuales han demostrado una mejoría importante. La precisión se había definido previamente por la diferencia absoluta relativa (valor de diferencia absoluta entre la determinación capilar vs intersticial dividido por el valor de referencia, es decir la determinación capilar, expresado como porcentaje) o como media de diferencia absoluta relativa (la media aritmética de dichas diferencias). También se contaba con criterios de la organización para la estandarización (ISO) como una variación positiva o negativa de 15mg/dl cuando el valor de referencia es ≤ 75mg/dl (o de 20% cuando es ≥ 75mg/dl), valores que se equiparan a determinaciones realizadas en estudios en niños y adolescentes (19mg/dl para hipoglucemia), con 42% de los valores en el rango de 15mg/dl sugerido por la estandarización13. Sin embargo estos métodos numéricos se ven sesgados por el alto volumen de datos manejados. Por tanto, se han creado métodos para análisis por tendencias clínicas como la Gradilla de Error de Clarke. Esta categoriza los datos pareados (intersticial y capilar) en términos de las consecuencias de las decisiones terapéuticas tomadas. Se consideran 5 zonas de precisión clínica, la A, clínicamente correcta, la B de errores benignos, la C de errores de sobrecorrección, la D errores de detección (de hipoglucemia o hiperglucemia) y la E errores de tratamiento14. Se han realizado algunas modificaciones a este método, pero en general los dispositivos actuales alcanzan resultados en zonas A y B del 94 al 97%15,16, con excepción del rango entre 40 y 80mg/dl, donde a pesar de los nuevos algoritmos se alcanza hasta un 89,81% de valores en zonas A y B. Sin embargo, para la zona E los valores alcanzan solo 0,12 a 0,18%, disminuyendo el riesgo de intervenciones inadecuadas15. Pero, a pesar de todas estas aproximaciones aún existen grandes diferencias en la respuesta a la terapia, dadas por múltiples factores, como la variabilidad individual10. En la actualidad una compañía en particular ha desarrollado un nuevo algoritmo de calibración del sensor, el cual se ha probado con la realización de 7.193 descargas de registro por sensor por 3 días de uso, lo cual permitió comparar un total de 90.472 datos apareados (valores del sensor y de glucómetro), con 5.841 eventos de hipoglucemia y 15.851 de hiperglucemia detectados por la determinación capilar glucométrica. Con el nuevo algoritmo se logró una disminución de la media de la diferencia relativa absoluta de un 25%, en el dispositivo anterior, a 15,89% en el nuevo, aumentando la sensibilidad para hipoglucemia de un 54,9% a un 82,3%15. Adicionalmente, mediante el uso de alertas predictivas, las cuales informan al paciente de la tendencia a la baja de su comportamiento glucémico, se incrementa la sensibilidad hasta un 90,5%15. Es así como los nuevos mecanismos de calibración lograron una reducción del error en el rango de 40-120mg/dl (8,68 a 26,04 mmo/l), manteniendo su precisión a niveles de glucosa elevados15. Este incremento de la sensibilidad en hipoglucemia y la reducción en la diferencia relativa absoluta de la medición de la glucosa intersticial ha permitido que la integración del sistema de MCG a las bombas de insulina diera un paso más, adicionando la función de suspensión automática de la infusión de insulina en el caso de que el paciente sea incapaz de responder a las alarmas y alertas de los cambios de glucosa ante valores críticamente bajos de glucosa.
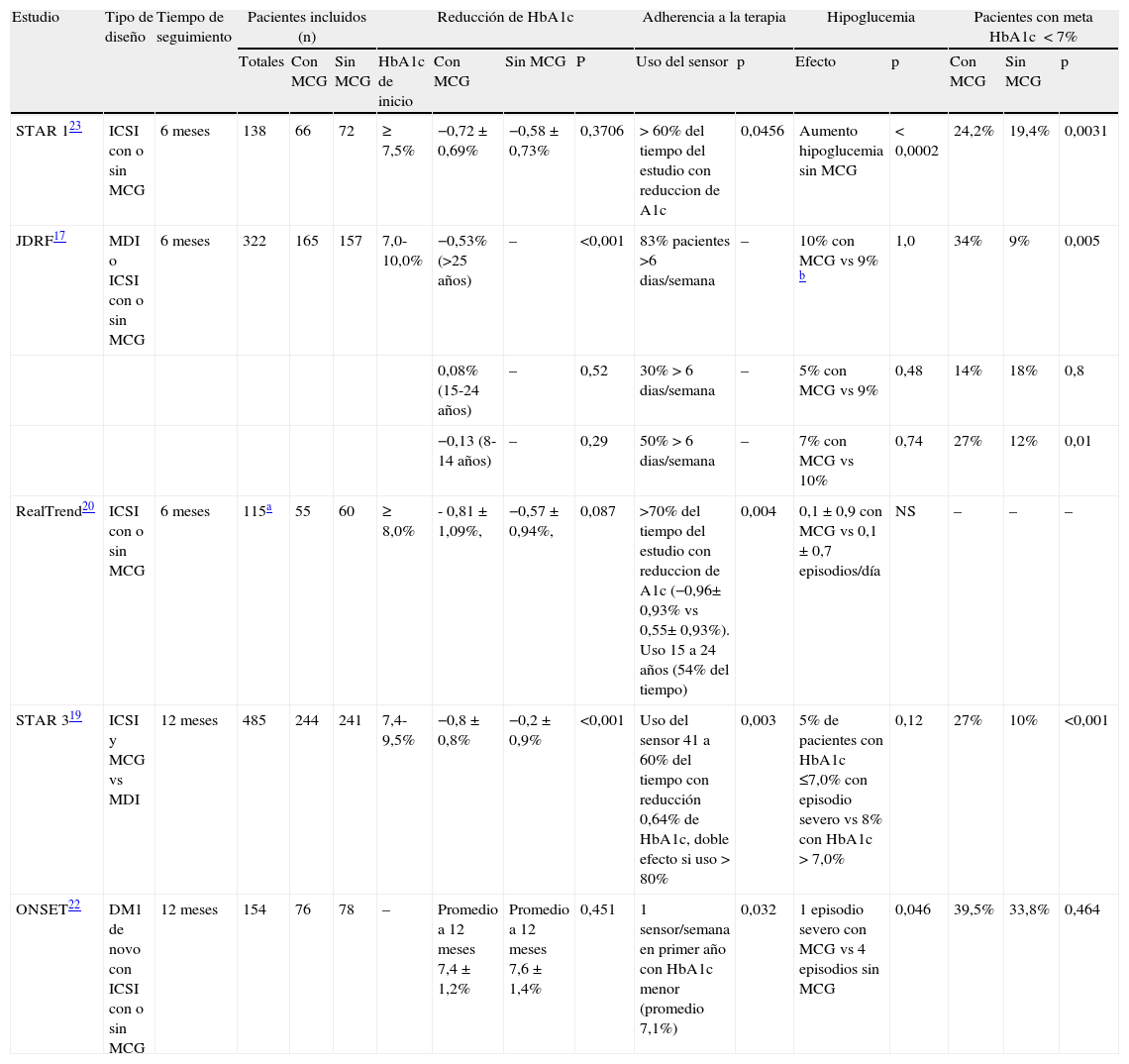
Evidencia clínica del uso de la monitorización continua de glucosaLa MCG en tiempo real ha revolucionado el cuidado y tratamiento de los individuos con DM1. Los estudios iniciales mostraron resultados muy prometedores en cuanto a la disminución de la HbA1c, y el creciente número de ensayos clínicos recientes ha generado evidencia que apoya esta y otras ventajas para considerar su utilización. Las características y hallazgos principales de los estudios más relevantes se resumen en la tabla 1. El beneficio en disminución de HbA1c fue demostrado inicialmente por un estudio clínico controlado, reportando la eficacia y superioridad de la MCG sobre el seguimiento de glucometría capilar convencional (mínimo 4 veces al día), en la reducción de la HbA1c en pacientes adultos y niños con DM1 mal controlada, posterior a un periodo de 3 meses de uso en forma continua7. Sin embargo, la mayor evidencia clínica en eficacia y seguridad proviene del estudio clínico controlado multicéntrico realizado por la Juvenile Diabetes Research Foundation (JDRF)17. En este, 322 pacientes, en manejo con bomba de insulina o un régimen de al menos 3 inyecciones de insulina diarias más glucometría capilar convencional, con HbA1c de 7 a 10%, tanto adultos como adolescentes y niños, fueron aleatorizados en 2 grupos con el fin de comparar la eficacia de la MCG. Se utilizaron diferentes dispositivos (DexCom Seven, MiniMed Paradigm Real-Time Insulin Pump and Continous Glucose Monitoring System FreeStyle Navigator) vs automonitorización capilar convencional. La diferencia en la reducción de la HbA1c, que constituyó el objetivo primario en el estudio, fue significativa en el grupo de adultos con una diferencia de -0,53% (IC 95% 0,71 -0,35%; p<0,001), favoreciendo al grupo con la MCG. El porcentaje de la reducción de la HbA1c fue dependiente del tiempo de uso del sensor. El promedio de uso durante 6 días o más por semana fue del 83% para los pacientes de 25 años de edad o mayores, vs 30% de los de 15 a 24 años de edad y 50% de los de 8 a 14 años17. El mejor control glucémico observado fue evidente en el grupo con MCG, tanto por la reducción de la HbA1c como por desenlaces secundarios, como el tiempo en normoglucemia, siendo mayor el número de pacientes que alcanzaron niveles menores del 7% en el grupo de manejo con MCG sin que aumentaran los eventos de hipoglucemia severa17. Estos resultados y los de otros estudios clínicos controlados son claros en cuanto al impacto en el control metabólico con el uso de la MCG y resaltan la importancia de lograr una buena adherencia en materia de continuidad en la utilidad del sensor de glucosa para alcanzar los objetivos de tratamiento7,17,18. Aunque en el estudio de la JDRF los adultos fueron los que presentaron una mayor adherencia a la terapia, un análisis de regresión logística del grupo de los pacientes aleatorizados al uso del MCG en dicho estudio, demostró que la aparente diferencia por la edad en el impacto de la MCG, para la reducción de la HbA1c, es totalmente dependiente de la frecuencia de uso del sensor. Al analizar el grupo de adolescentes y niños que utilizaron el sensor al menos 6 días por semana tuvieron una disminución en promedio de la HbA1c al menos de -0,5%, es decir, con la misma eficacia de la población adulta17. El integrar el sistema de MCG con todos su beneficios clínicos a una bomba de insulina confiere un beneficio adicional en el control de los pacientes con DM1, constituyendo el mayor avance en los últimos 5 años en la terapia intensiva, de nuevo mejorando el control metabólico sin incrementar la frecuencia de hipoglucemia, lo cual se ha demostrado en todos los grupos de edad. El primer estudio clínico controlado multicéntrico con inclusión de adultos y niños que brinda la mayor evidencia del uso de la terapia con bomba de insulina integrada al sistema de monitorización continuo de glucosa es el STAR 319. Este comparó la terapia con bomba de insulina aumentada con sensor vs un régimen de múltiples dosis de insulinas análogas más 4 glucometrías al día en pacientes con DM1 no controlada (con una HbA1c en promedio de 8,3%)19. El desenlace primario fue la diferencia en la reducción de la HbA1c de base, con una diferencia significativa de -0,64% (IC95% -0,7 a -0,4%; p<0,001), favoreciendo al grupo de terapia en bomba aumentada con sensor. De igual forma, la terapia combinada de infusor y monitorización permitió a un mayor porcentaje de pacientes lograr una meta de HbA1c menor de 7,0% (27 vs 10%, p=0,001), sin incrementar el riesgo de hipoglucemia19. Es importante resaltar que este estudio brindó una importante evidencia del uso de esta terapia en la población pediátrica de 7 a 18 años en donde se encontró una diferencia en la HbA1c de - 0,5% (95%IC 0,8 -0,2%; p<0,001). En este estudio el uso del sensor del 41 al 60% del tiempo estuvo asociado con la reducción de la HbA1c, y su uso mayor del 80% duplicó el efecto19. De nuevo se enfatiza la importancia para el éxito de la MCG del tiempo del uso del sensor para logar una mayor reducción de los niveles de HbA1c, evidenciándose un beneficio en la HbA1c con un menor tiempo de uso del que se observó en el JDRF16. La mayor limitación del estudio STAR 3 fue la falta de un tercer grupo de control con pacientes en terapia con bomba de insulina sin sensor para poder separar los beneficios de la MCG de los atribuibles a la bomba de insulina. Sin embargo, por la diferencia en los pacientes en cuanto al uso de la MCG, se podría considerar que el empleo de la MCG es más exitoso al utilizar en forma continua el sistema de monitorización integrado a una bomba de insulina, donde las acciones que se deben tomar por los valores de glucosa intersticial en tiempo real y sus tendencias son más fáciles de realizar al contar con una bomba más sofisticada e integrada a dicha monitorización. La metodología de este estudio demuestra que esta terapia, considerada por algunos como compleja, puede ser exitosamente iniciada con un entrenamiento específico del uso del sensor durante 2 sesiones en el transcurso de 5 semanas. Posteriormente se desarrolló un estudio clínico controlado que comparó la eficacia de la terapia con bomba de insulina asociada al sensor vs el uso de terapia en bomba de insulina no integrada a MCG, realizado con pacientes con DM1 en mal control metabólico (HbA1c>8%) y manejados con múltiples dosis de insulina (RealTrend)20. En el análisis por intención de tratar no se alcanzó una diferencia significativa de la HbA1c entre los 2 grupos a los 6 meses. Sin embargo, en el análisis por protocolo, incluyendo solamente a los pacientes que cumplieron el criterio de uso del sensor más del 70% del tiempo durante la terapia de bomba de insulina aumentada con sensor, se observó un beneficio clínico significativo, con una mayor reducción de la HbA1c de -0,41% (p<0,004) vs bomba de insulina sin monitorización20. El beneficio del uso de la MCG en pacientes bien motivados persistió a un año de la terapia, observándose con el transcurso del tiempo mayores reducciones de HbA1c (-0,4 ± 0,6%; p<0,001), con lo que se logróla meta de control metabólico. En aquellos pacientes que consiguieron una HbA1c menor del 7% se ha demostrado un mantenimiento del adecuado control metabólico, con un promedio de HbA1c de 6,4%, sin presentar un incremento de hipoglucemias severas. Este comportamiento se podría explicar por el uso de la monitorización continua en tiempo real, y el entrenamiento y educación para su utilización, así como por la reducción significativa de la desviación estándar (p=0,02) y de las excursiones glucémicas (p=0,03), indicando una reducción de la variabilidad de la glucosa21. Es así como la reducción significativa de la variabilidad glucémica con el uso de la MCG en tiempo real, en la terapia basal-bolo con múltiples dosis de insulina e integrada a las bomba de insulina es otra de las ventajas de los dispositivos combinados21,22. Esta podría ser una de las posibles estrategias para alcanzar una reducción significativa en las hipoglucemias severas en los pacientes con DM1 en manejo intensivo, con buen control metabólico20–23, y en el caso de los pacientes recién diagnosticados podría tener implicaciones en la preservación de la función de la célula beta, aunque esta afirmación requiere confirmación mayor por evidencia adicional. Como soporte se cuenta con un estudio que incluyó a 160 pacientes, con edades desde 1 hasta 16 años, recibiendo manejo con bomba de insulina con MCG o glucometría convencional. Aunque la HbA1c no varió significativamente entre los 2 grupos, los pacientes en el grupo con adherencia a la MCG alcanzaron un promedio de 7,1% (IC95% 6,8 a 7,4%) vs con bajo o no uso del sensor (promedio 7,6%, IC95% 7,3 a 7,9%; p=0,032) y el 51,4% de los pacientes con uso regular del sensor alcanzaron valores de HbA1c menores de 7,0% a 12 meses. No se presentaron episodios de hipoglucemia severa en el grupo con MCG vs 4 en el grupo sin sensor (p= 0,046). Aunque se observó una relación inversamente proporcional entre la HbA1c y la frecuencia de uso del sensor, esta no se prolongó en el tiempo (6 vs 26 y 52 semanas). Aun así la variabilidad glucémica fue menor en el grupo con bomba/sensor, por la determinación de amplitud promedio de excursiones 80,2 ± 26,2 vs 92 ± 33,7mg/dl; p=0,037), posiblemente asociada con una mayor eficacia en la aplicación de decisiones terapéuticas como el ajuste en las relaciones de insulina basal y bolos22. Uno de los aspectos más relevantes del estudio fue la demostración de aumento de la concentración basal de péptido C a 12 meses en el 39,2% de quienes usaron el sensor, aunque sin alcanzar una diferencia estadísticamente significativa (vs 34,2%; p=0,528). Al considerar solo a los pacientes con uso regular del sensor dicho aumento se presentó en el 45,9% a 12 meses, con una aparente relación entre la frecuencia de uso del sensor y las concentraciones del péptido C (0,16 ± 0,18 nmol/l en bomba y sensor vs 0,12 ± 0,11 nmol/l; p=0,151). Las mayores concentraciones se observaron en pacientes con sensor de 12 a 16 años de edad (0,25 ± 0,12 nmol/,) vs los tratados solo con bomba (0,19 ± 0,07 nmol/l; p=0,033)20. Es así como este estudio soporta lo planteado previamente, como un posible mecanismo de preservación de la secreción endógena de insulina, aunque el mecanismo no es claro, tendría aplicación más en el caso de los adolescentes, por su menor pérdida de función vs niños pequeños, y posiblemente por el aspecto educativo en el manejo de la diabetes. Se ha planteado que este fenómeno sería un complemento de intervenciones inmunológicas futuras, como el tratamiento con anticuerpos antiCD3 o vacunación GAD22.
Resumen de estudios aleatorizados de monitoriazión continua de glucosa
| Estudio | Tipo de diseño | Tiempo de seguimiento | Pacientes incluidos (n) | Reducción de HbA1c | Adherencia a la terapia | Hipoglucemia | Pacientes con meta HbA1c <7% | |||||||||
| Totales | Con MCG | Sin MCG | HbA1c de inicio | Con MCG | Sin MCG | P | Uso del sensor | p | Efecto | p | Con MCG | Sin MCG | p | |||
| STAR 123 | ICSI con o sin MCG | 6 meses | 138 | 66 | 72 | ≥ 7,5% | −0,72 ± 0,69% | −0,58 ± 0,73% | 0,3706 | > 60% del tiempo del estudio con reduccion de A1c | 0,0456 | Aumento hipoglucemia sin MCG | < 0,0002 | 24,2% | 19,4% | 0,0031 |
| JDRF17 | MDI o ICSI con o sin MCG | 6 meses | 322 | 165 | 157 | 7,0-10,0% | −0,53% (>25 años) | – | <0,001 | 83% pacientes >6 dias/semana | – | 10% con MCG vs 9% b | 1,0 | 34% | 9% | 0,005 |
| 0,08% (15-24 años) | – | 0,52 | 30% > 6 dias/semana | – | 5% con MCG vs 9% | 0,48 | 14% | 18% | 0,8 | |||||||
| −0,13 (8-14 años) | – | 0,29 | 50% > 6 dias/semana | – | 7% con MCG vs 10% | 0,74 | 27% | 12% | 0,01 | |||||||
| RealTrend20 | ICSI con o sin MCG | 6 meses | 115a | 55 | 60 | ≥ 8,0% | - 0,81 ± 1,09%, | −0,57 ± 0,94%, | 0,087 | >70% del tiempo del estudio con reduccion de A1c (−0,96± 0,93% vs 0,55± 0,93%). Uso 15 a 24 años (54% del tiempo) | 0,004 | 0,1 ± 0,9 con MCG vs 0,1 ± 0,7 episodios/día | NS | – | – | – |
| STAR 319 | ICSI y MCG vs MDI | 12 meses | 485 | 244 | 241 | 7,4-9,5% | −0,8 ± 0,8% | −0,2 ± 0,9% | <0,001 | Uso del sensor 41 a 60% del tiempo con reducción 0,64% de HbA1c, doble efecto si uso > 80% | 0,003 | 5% de pacientes con HbA1c ≤7,0% con episodio severo vs 8% con HbA1c > 7,0% | 0,12 | 27% | 10% | <0,001 |
| ONSET22 | DM1 de novo con ICSI con o sin MCG | 12 meses | 154 | 76 | 78 | – | Promedio a 12 meses 7,4 ± 1,2% | Promedio a 12 meses 7,6 ± 1,4% | 0,451 | 1 sensor/semana en primer año con HbA1c menor (promedio 7,1%) | 0,032 | 1 episodio severo con MCG vs 4 episodios sin MCG | 0,046 | 39,5% | 33,8% | 0,464 |
DM1: diabetes mellitus tipo 1; HbA1c: hemoglobina glucosilada; ICSI: infusión continua subcutánea de insulina; MCG: monitorización continua de glucosa; MDI: múltiples dosis de insulina,; NS No significativa.
Comparado con grupos > 25 años (74.9%) y 5 a 14 años (68.4%)
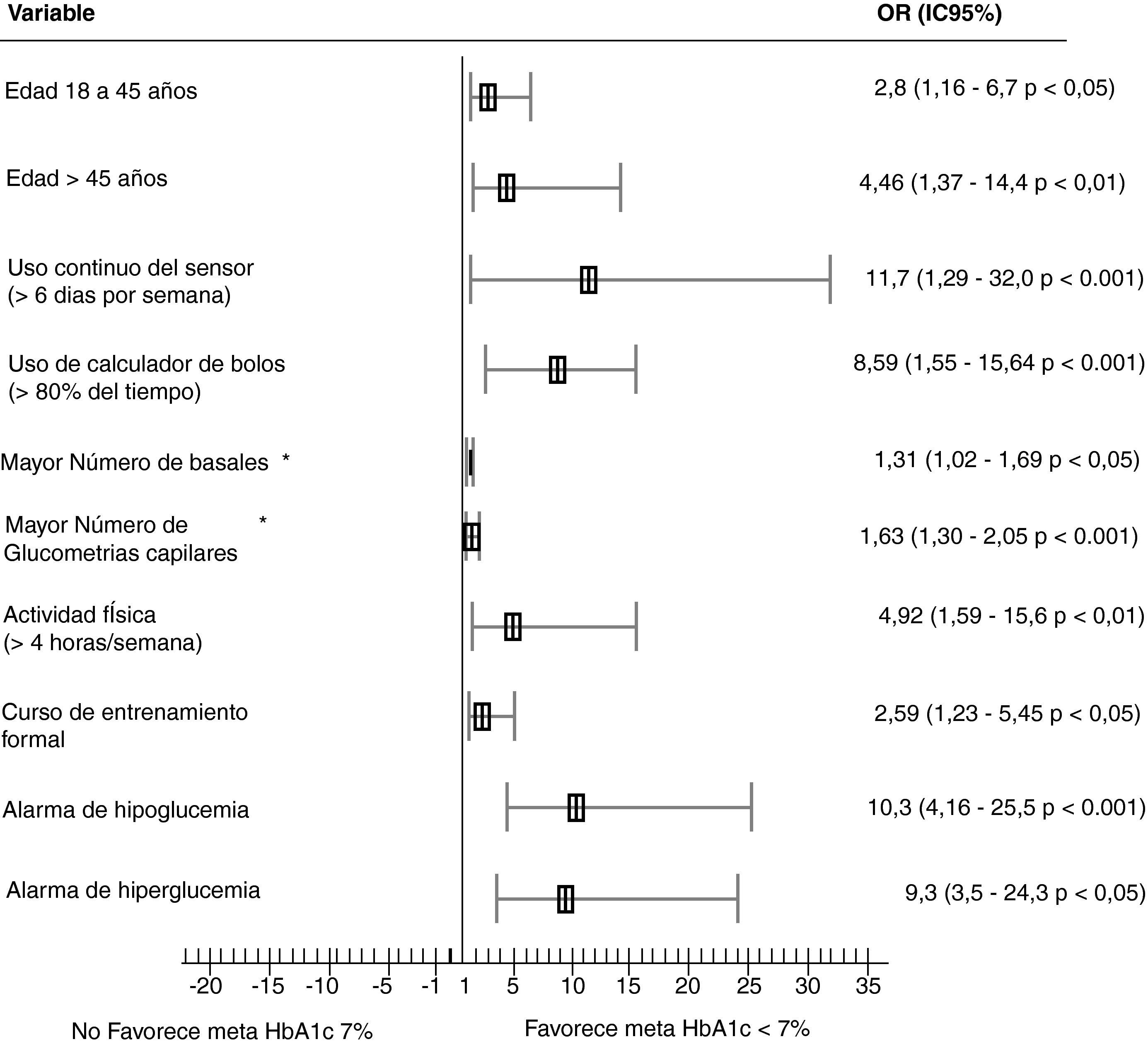
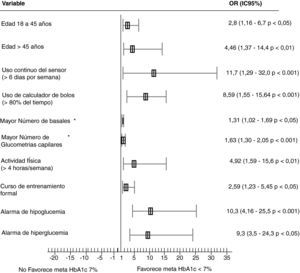
Nuestro Hospital es un centro de tercer nivel de atención, de remisión de pacientes para entrenamiento, inicio y seguimiento de terapia en bomba de insulina. Se realizó un estudio de cohorte descriptivo de esta población (para una próxima publicación) con el fin de establecer los factores asociados con buen control metabólico, definido por una HbA1c<7%. Se incluyeron 119 pacientes consecutivos en terapia con bombas de insulina integradas a MCG, modelos paradigma 722 y paradigma veo (con suspensión automática del infusor en hipoglucemia), con edad >12 años, con uso de bomba de insulina >3 meses, con inicio de la terapia por hipoglucemias severas, mal control metabólico o alta variabilidad glucémica24. El 48% eran hombres, el 91% con DM1 (con duración de la diabetes de 10 a 20 años en su mayoría) y el 68% de ellos en terapia con el dispositivo combinado desde hacía más de 1 año, todos ellos con entrenamiento formal para su uso y 56% con entrenamiento adicional en recuento de carbohidratos, ajuste en tasas basales y uso de datos. A pesar de contar con el dispositivo combinado, el 13% tenían uso irregular de la MCG. Se realizó un análisis univariado de las características y comportamiento de uso de la MCG en los pacientes con menores valores de HbA1c, los cuales se resumen en la figura 1. Según el análisis multivariado, los principales factores asociados con buen control son el uso del ayudante de bolos (OR 8,58; IC95% 3,37-21,9) y el uso continuo del sensor por más del 80% del tiempo, equivalente a 6 días a la semana (OR 7,2; IC95% 3,06-16,9)24. En cuanto a reducción de la HbA1c, se alcanzó una disminución significativa de -1,34% (p<0,001) en pacientes con manejo previo con múltiples dosis de análogos de insulina, con reducción importante de los episodios de hipoglucemia severa, de 2,56 a 0,28 eventos por 100 pacientes año, obteniéndose el mayor beneficio en los pacientes con indicación de terapia con bomba y monitorización por hipoglucemia severa (OR 4,16%; IC 1,64-10; p<0,001). Nuestros pacientes utilizan desde el inicio de la terapia con bomba el sistema de MCG, para lo cual reciben entrenamiento específico para el manejo e interpretación de alarmas y tendencias, integrando estas a su terapia, por lo cual conciben el manejo combinado como un solo dispositivo, alcanzándose una adherencia para uso del sensor mayor del 80% del tiempo en el 87% de los pacientes. Por esta experiencia clínica, así como lo reportado previamente en la literatura, el factor crítico para obtener beneficios con la terapia combinada es la adherencia al uso del sensor, así como el ayudante de bolos, y las herramientas de ayuda (alarmas, realización de ajustes de acuerdo a los niveles de glucosa, tendencias de los valores y la velocidad de cambio de glucosa) para tener una mayor probabilidad de un buen control metabólico, y de allí la importancia de contar con un programa y centro de entrenamiento con gran experiencia en esta tecnología.
ConclusionesLos beneficios del uso de la MCG en el paciente con DM1 en terapia basal-bolo son claros y, como hemos planteado, han sido demostrados en diferentes estudios clínicos. Su uso como parte integral de las bombas de insulina ofrece muchas ventajas, en cuanto a eficacia y seguridad, con una mayor reducción de HbA1c sin incrementar el riesgo de hipoglucemia. Esta terapia ha logrado llevar a un mayor número de pacientes a los objetivos de control metabólico, siendo superior a la terapia intensiva con múltiples dosis de insulinas análogas, y demostrando beneficios superiores a la terapia con bomba de insulina sola. Según la evidencia en la literatura, y nuestra propia experiencia, la mayor reducción en los niveles de HbA1c se alcanza con el uso del sensor durante el mayor tiempo posible, con un mínimo del 40 al 70% del tiempo, el cual se traduce en una reducción 7 veces mayor de HbA1c23, de allí que consideramos que es imprescindible el uso combinado de la MCG con la infusión continua de glucosa. Es así como esta asociación de tecnología brinda unos beneficios superiores en el control metabólico, supeditada a una adherencia adecuada al uso continuado del sensor, convirtiéndose en la terapia de elección para pacientes con DM1 e hipoglucemias severas, niños, adolescentes y pacientes con alta variabilidad glucémica. A pesar de sus beneficios también tiene limitaciones relevantes, como el alto costo de los sensores necesarios para la monitorización y la necesidad de calibración y confirmación de los valores intersticiales, mediante glucometría capilar, para definir conductas oportunamente. Sin embargo, con la disponibilidad de nuevos algoritmos de calibración y perfeccionamiento en la estructura de los sensores, lo que permite su uso durante tiempos más prolongados sin necesidad de cambio (hasta 6 días), estas limitaciones serán cada vez menores. Por tanto es clara la necesidad de estudios de costo efectividad que brinden evidencia para sopesar si su beneficio clínico supera el escollo del alto costo económico en su utilización a largo plazo.
Conflicto de interesesAna María Gómez Medina ha actuado como Speaker de NovoNordisk, Elli Lilly, MSD, Novartis y Medtronic y ha recibido apoyo financiero para investigación de Medtronic, Sanofi-Aventis y Abbott.
Alejandro Marín Sánchez declara no tener ningún conflicto de intereses.