La incidencia de diabetes de tipo 1 varía hasta 576 veces entre los distintos países del mundo y alcanza una relación de 2/1 entre comunidades autónomas españolas. En las 2 últimas décadas, se han publicado numerosos estudios con respecto a la incidencia, prevalencia, tendencias y características al comienzo de la diabetes de tipo 1: edad, sexo, raza, agrupación familiar y estacionalidad. Estos datos suponen las luces que la epidemiología aporta al estudio de la diabetes, ya que contribuyen a generar hipótesis sobre las que investigar posteriormente. Las sombras vienen representadas por las limitaciones en la recogida de los datos, la calidad de algunos Registros y la falta de resultados obtenidos hasta ahora en cuanto a eficacia, al seguir las pistas que la epidemiología nos ha proporcionado. Para mejorar las expectativas, es fundamental disponer de Registros amplios y fidedignos que proporcionen datos precisos y, posteriormente, buscar los factores ambientales implicados para poder combatirlos.
The incidence rate of type 1 diabetes varies by up to 576 times between different countries around the world. In Spain, the highest incidence rate is twice that of the lowest between Autonomous Communities. Many studies have been published in the last twenty years on the incidence, prevalence, trends, and characteristics at diagnosis of type 1 diabetes. The age at diagnosis, sex, racial group, familial clustering, and seasonal variation have been the characteristics analysed. These data are the lights that epidemiology provides us, in order to have a better understanding of diabetes aetiopathology. They allow us to create hypotheses to be investigated. The shades are the quality of some registries and the lack of success of trials conducted up until now. In order to improve these results, is necessary to develop more reliable registries to get accurate data in order to combat the environment risk factors.
La diabetes de tipo 1 aparece como resultado de diversas y complejas interacciones entre la predisposición genética, el sistema inmunológico y los factores ambientales. En este contexto, los estudios sobre epidemiología de la diabetes de tipo 1 son importantes, cuando menos, por 2 razones. En primer lugar, porque pueden ayudar a conocer la etiología y los factores desencadenantes de la enfermedad y, en segundo lugar, porque contribuyen a orientar adecuadamente los recursos sanitarios disponibles. Como toda esfera del conocimiento, como toda actividad humana, la epidemiología de la diabetes de tipo 1 presenta sus luces y sus sombras. Las luces son los datos que los diferentes grupos de investigación vienen aportando, sobre todo desde hace 2 décadas. Las sombras derivan de la calidad en la recogida de los datos y de la falta de respuestas que la epidemiología nos ha proporcionado hasta ahora.
En esta revisión, profundizaremos en las luces y sombras de la epidemiología de la diabetes de tipo 1 con el objetivo de atraer el interés de los clínicos hacia esta área del conocimiento de la diabetes.
LucesDatos de incidencia por paísesEn el presente año 2013, la IDF acaba de publicar la 6.a edición de su Atlas1, en el que aporta datos procedentes de 219 países repartidos por todo el mundo. La incidencia de diabetes de tipo 1 en niños de ≤ 14 años oscila desde 0,1/100.000 habitantes/año en Papúa Nueva Guinea y Venezuela hasta 57,6/100.000 habitantes/año en Finlandia. Para Europa, las cifras se sitúan entre 1,2 en Uzbekistán y los 57,6 de Finlandia. Previamente, el Grupo EURODIAB2, en agosto del 2012, proporcionó los datos del período 2004-2008 de 23 centros hospitalarios pertenecientes a 19 países europeos (entre los que, en esta publicación, no figuraba Finlandia). Las cifras por 100.000 habitantes y año oscilaron entre 5,8 de Macedonia y 36,6 de Suecia. Los resultados aportados representan una variación de 576 veces entre las poblaciones analizadas a nivel mundial y de 48 veces a nivel europeo. Esta variación en la incidencia de diabetes de tipo 1 podría reflejar la distribución de las diferentes etnias y, en este caso, demostraría un grado distinto de susceptibilidad genética a la diabetes, o bien ser debida a una exposición diferente a factores de riesgo ambientales.
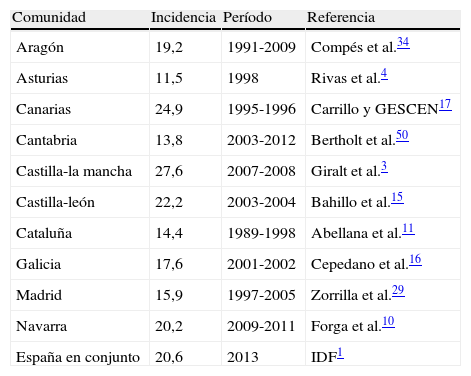
Para España, el Atlas de la IDF da una incidencia global de 20,6 en menores de 15 años. Además, se han publicado datos de casi todas las comunidades autónomas. Los más recientes se exponen en la tabla 1. La incidencia en la comunidad más afectada —Castilla-La Mancha (27,6)3— duplica a la de menor incidencia —Asturias (11,5)4—, aunque hay diferencias en el período de estudio que pueden ser determinantes. También se han publicado datos de incidencia por provincias o áreas de salud en el resto de comunidades autónomas, sin que las cifras aportadas escapen de los márgenes mencionados5-7.
Incidencia de diabetes de tipo 1 en menores 15 años. Datos más recientes por comunidades autónomas españolas
| Comunidad | Incidencia | Período | Referencia |
| Aragón | 19,2 | 1991-2009 | Compés et al.34 |
| Asturias | 11,5 | 1998 | Rivas et al.4 |
| Canarias | 24,9 | 1995-1996 | Carrillo y GESCEN17 |
| Cantabria | 13,8 | 2003-2012 | Bertholt et al.50 |
| Castilla-la mancha | 27,6 | 2007-2008 | Giralt et al.3 |
| Castilla-león | 22,2 | 2003-2004 | Bahillo et al.15 |
| Cataluña | 14,4 | 1989-1998 | Abellana et al.11 |
| Galicia | 17,6 | 2001-2002 | Cepedano et al.16 |
| Madrid | 15,9 | 1997-2005 | Zorrilla et al.29 |
| Navarra | 20,2 | 2009-2011 | Forga et al.10 |
| España en conjunto | 20,6 | 2013 | IDF1 |
A medida que se va ampliando el límite de edad al inicio, incluyendo a individuos adultos para el estudio de incidencia, las publicaciones van disminuyendo y son muy pocas las que proporcionan datos sin límite de edad. El estudio de Rochester, en Minnesota, aporta datos de incidencia entre 1960 y 1969 desde los 0 a los 70 años8. Los autores indican que la incidencia oscila entre 6,9 y 26,9 casos/100.000 habitantes y año, dependiendo del grupo de edad. También Landi-Olsson et al.9 aportaron, en 1990, datos de Malmö, con pacientes de todas las edades.
No hemos hallado estudios posteriores que analicen la incidencia de diabetes de tipo 1 desde el nacimiento hasta la vejez. Por ello, en Navarra, hemos estudiado recientemente la incidencia a lo largo de la vida. La cifra observada es de 8,7/100.000 habitantes-año (IC del 95%, 7,4-10,1)10.
Datos de incidencia por grupos de edadPor grupos de edad, generalmente, la mayor incidencia se da en el de 10-14 años, coincidiendo con la pubertad11,12. No obstante, en varios países13,14 y en diversas comunidades autónomas españolas, en menores de 15 años, el grupo de 5-9 años ha sido el que ha mostrado mayor incidencia3,15,16.
En adultos, se han publicado datos abarcando diferentes rangos de edad. El que corresponde a los pacientes entre 15 y 29 años es el más estudiado11,17,18. Otras publicaciones alcanzan hasta los 3419,20 y 39 años21. Todas ellas coinciden en que la incidencia en adultos es menor que en niños y que va disminuyendo a medida que aumenta la edad, hasta los 40 años22,23. A partir de aquí, algunos autores, en trabajos publicados hace 2 décadas, describen la aparición de nuevos picos de incidencia entre los 40 y 50 años en Dinamarca24, entre los 50 y los 70 años en Minnesota8 y entre los 60 y 80 años en Suecia9 y Dinamarca24. Dos estudios posteriores, en Suecia en 199825 y en Italia en 200526, no detectan picos y, en cambio, observan datos de incidencia claramente inferiores a los de los niños, en adultos de 40 a 75 años y de 30 a 49 años, respectivamente. Probablemente, estas diferencias se deben a aspectos metodológicos y de precisión diagnóstica.
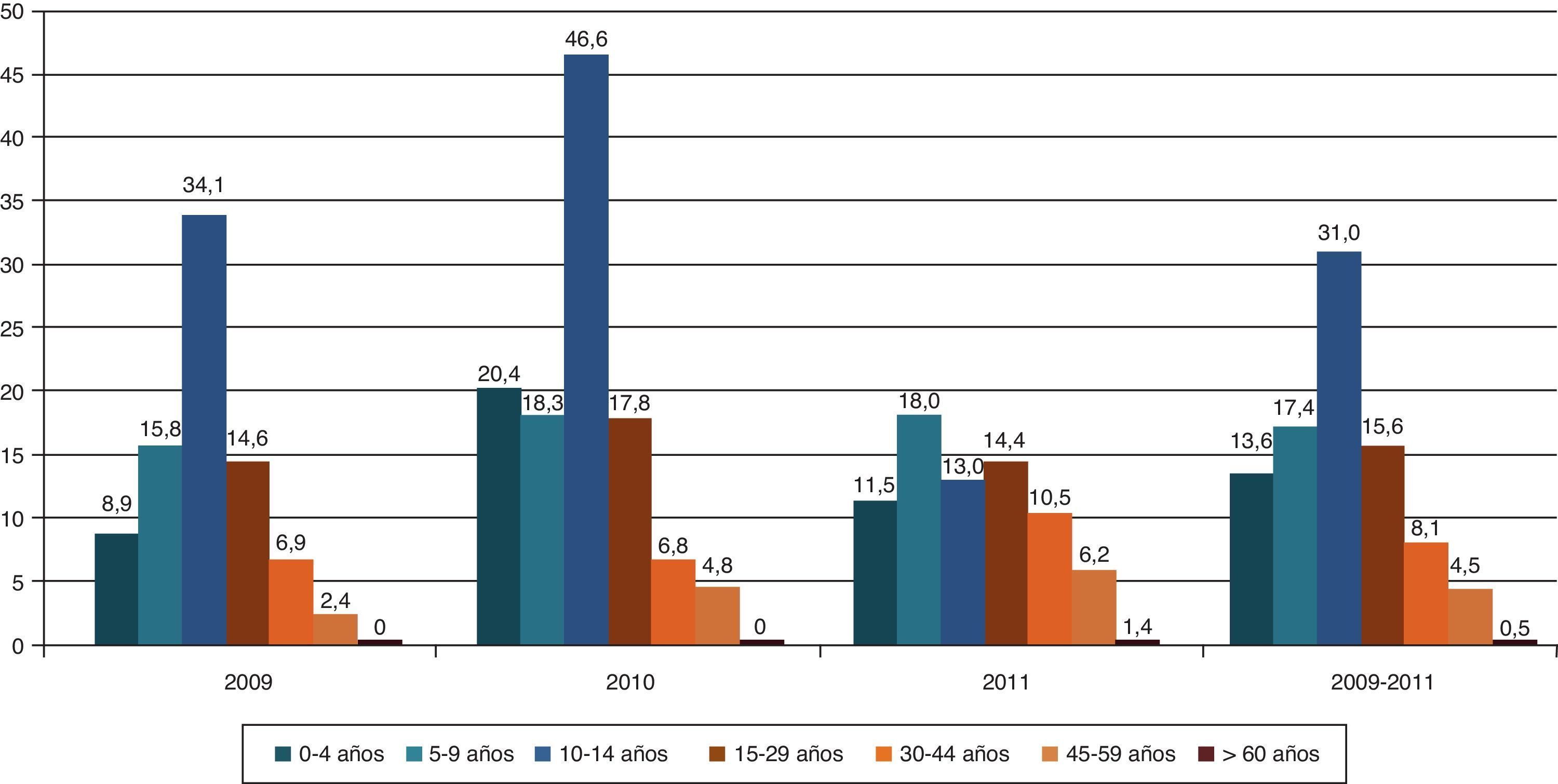
En Navarra, en el período 2009-2011, hemos hallado una distribución global en pico de la incidencia de diabetes de tipo 1 por grupos de edad, de tal manera que aumenta de los 0 a 14 años y disminuye posteriormente10 (fig. 1). Por otra parte, y también según nuestros datos, la edad al diagnóstico tiende a adelantarse en niños y se retrasa claramente en adultos27.
Datos de incidencia por sexosAunque la diabetes de tipo 1, como enfermedad autoinmune que es, cabría esperar que predominara en mujeres, lo cierto es que, en mayores de 15 años, presenta mayor incidencia en hombres11,17. En cambio, antes de los 15 años, los resultados son variables, dependiendo de si se trata de países con alta o baja incidencia de diabetes de tipo 114,21,23. El estudio SEARCH, en EE. UU., en menores de 20 años, describe una mayor presencia de diabetes de tipo 1 en mujeres que en hombres28.
Por otra parte, se ha descrito un aumento de la incidencia en niñas de 5 a 9 años y el pico de incidencia en niñas ocurre 3 años antes que en niños, lo que se ha relacionado con el hecho de que las niñas presentan la pubertad antes que los niños29,30.
En la mayoría de los estudios españoles, tampoco se describe diferencia en la incidencia por sexos en menores de 15 años considerados como grupo3,11,29, salvo en Canarias17, donde predominan los varones.
Datos de incidencia por razasLa incidencia de diabetes de tipo 1 varía entre las distintas razas, con un claro predominio de unas sobre otras, aunque, dentro de una misma raza, hay importantes diferencias regionales y temporales. En general, los individuos blancos no hispanos constituyen el grupo racial con la mayor incidencia de diabetes tipo 1, seguidos de los de raza negra, los blancos hispanos y, finalmente, los asiáticos12.
En España, los datos de incidencia proporcionados no distinguen por razas, probablemente porque, a pesar de la inmigración experimentada en los últimos años, no hay suficientes datos de cada etnia para poder pronunciarse al respecto. No obstante, en la publicación de Almería5, se distingue entre la incidencia en niños nacidos dentro o fuera de España, observándose mayor incidencia en los que nacieron fuera de nuestras fronteras.
En cuanto a las tendencias, en Filadelfia se ha reportado un mayor incremento en los niños de raza negra que en los hispanos o blancos no hispanos31.
EstacionalidadSe ha estudiado cuáles son las estaciones predominantes, tanto en el momento del diagnóstico como del nacimiento, de las personas afectas de diabetes de tipo 1. Se ha publicado que el verano es la estación menos frecuente en cuanto al comienzo de la diabetes de tipo 1 y los meses fríos muestran la mayor incidencia12,14,16,29. En cuanto al mes de nacimiento, en estudios realizados en países de distintos continentes, se ha indicado mayor frecuencia de diabetes de tipo 1 en los nacidos en primavera y menor en los nacidos en otoño. Los niveles de vitamina D relacionados con la cantidad de luz ultravioleta en la madre y los hijos podrían influir en la actividad del sistema inmunitario en períodos críticos del desarrollo. De modo opuesto, las infecciones virales relacionadas con el ambiente frío favorecerían la aparición de la diabetes. No obstante, en su conjunto, la literatura muestra resultados contradictorios o ausencia de diferencias significativas en este sentido. Es el caso del estudio de incidencia en Canarias, donde los autores relacionan la ausencia de estacionalidad con el clima estable a lo largo del año17.
Como curiosidad, en el Reino Unido, se ha descrito una mayor incidencia en otoño e invierno en niños, pero no en adultos32, mientras que en Bélgica, el predomino otoño-invierno se ha observado en varones mayores de 10 años y con un genotipo HLA-DQ determinado33.
Tendencias en la incidencia de diabetesLos Registros de diversos países proclaman el incremento mundial en la incidencia de diabetes de tipo 1, si bien de forma no lineal sino «en dientes de sierra» y desigual según edades y países34. En el estudio DIAMOND35, la incidencia de diabetes de tipo 1 en los 103 centros analizados, entre 1990 y 1999, fue aumentando a lo largo del tiempo, de tal modo que el incremento anual promedio fue del 2,8% (IC del 95%, 2,4-3,2%). El mayor aumento en la incidencia se vio en el grupo de 0 a 4 años. En su publicación de mayo del 2009, el Grupo EURODIAB describió un incremento de la diabetes de tipo 1 en menores de 15 años, entre 1989 y 2003, del 3,9% (IC del 95%, 3,6-4,2), con el mayor aumento también entre los 0 y 4 años de edad (5,4%, IC del 95%, 4,8-6,1) y en los países del centro y del este europeo36. Posteriormente, en el año 2012, el mismo EURODIAB2 comparó el incremento en la incidencia entre los períodos 1989-1998 y 1999-2008, observando aumentos muy similares (3,4%/año en la primera década y 3,3%/año en la segunda). Además, describió que el aumento no era uniforme entre los distintos países estudiados, lo que indica que la exposición temporal a los factores de riesgo varía entre ellos. Uno de estos factores de riesgo es el estado socioeconómico. El hecho de disponer de un estado socioeconómico mejor, más elevado, se ha asociado con un riesgo mayor de presentar diabetes de tipo 1 en el estudio SEARCH28. Además, otro estudio, en este caso europeo, demostró que la incidencia de diabetes de tipo 1 se correlaciona con los indicadores de prosperidad nacional, tales como el producto nacional bruto y la mortalidad infantil12. Por tanto, las diferencias en el incremento de la incidencia podrían deberse, al menos en parte, a las variaciones en la mejoría del nivel de vida.
Para otros grupos, y dado que el incremento predominante en la incidencia se ha detectado en los niños de 0 a 4 años, más que un auténtico incremento en la incidencia lo que se produciría es un desplazamiento del comienzo diabético hacia edades más tempranas20,21. No obstante, este comienzo precoz ha sido recientemente cuestionado por los datos del Registro sueco, que muestran, de nuevo, el mayor incremento relativo en el grupo de edad de 10 a 14 años en la última década37. Por tanto, siguen existiendo importantes dudas sobre el comportamiento en la incidencia de la diabetes de tipo 1 a lo largo del tiempo.
En España, distintas comunidades autónomas han aportado datos sobre la tendencia en la incidencia de diabetes tipo 1 en menores de 15 años. No han observado incremento en Madrid29, en Cataluña11 ni en Aragón34, en seguimientos que oscilan entre 8 y 20 años, pero sí en Málaga y en Navarra. En la provincia de Málaga, el incremento anual medio fue del 3,2% (2,0-4,3), desde 12,6/100.000 en el período 1982-1988 a 20,1/10.000 en 1996-20026. En Navarra, hemos detectado un claro aumento desde el 9,7/100.000 del período 1975-1991 (IC del 95%, 8,0-11,7)38 al 20,2/100.000 (IC del 95%, 15,1-25,5) del período 2009-201110.
PrevalenciaSe dispone de pocos estudios que hayan analizado la prevalencia de diabetes de tipo 1. La mayoría de ellos se basan en la incidencia acumulativa. Según esos datos, en 2011, unos 490.000 niños menores de 15 años, en todo el mundo, tenían diabetes de tipo 139. Las estimaciones de la OMS en el año 2000, para la población menor de 20 años, revelaban una prevalencia del 0,03% en todo el mundo y del 0,15% en los países desarrollados35. En los EE. UU., el estudio SEARCH estimaba la prevalencia en 1,5 casos/1.000 habitantes menores de 15 años y 2,2/1.000 menores de 20 años28. Se observaron diferencia por razas, pero no por sexos en la valoración global, aunque sí en determinados grupos étnicos, ya que en población de raza negra, de las islas asiáticas del Pacífico y de los indios americanos, la prevalencia es mayor en niñas. Otros datos de prevalencia proceden de: Sardinia (4,6/1.000), Manitoba en Canadá (1,2/1.000), Arabia Saudita (1,1/1.000), Alemania (0,8/1.000) y Estambul (0,6/1.000)12,40.
En España, los datos comunicados sobre prevalencia en menores de 15 años varían desde 0,9/1.000 habitantes en el área del Hospital de Mérida en Badajoz hasta 1,5/1.000 en Cantabria41. Entre medio se sitúan los de Castilla-León: 1,1/1.00015 y Castilla-La Mancha: 1,4/1.0003. La mayor prevalencia suele corresponder también al grupo de 10 a 14 años15 y, en menores de 15 años, hay predominio del sexo masculino en todos los grupos de edad3.
Agrupación por familiasLas personas con un familiar de primer grado afectado de diabetes de tipo 1 tienen, a lo largo de su vida, un riesgo de 1/20 de desarrollar ellos también diabetes de tipo 1, frente a 1/300 de la población general. Los hermanos de un paciente afectado de diabetes de tipo 1 tienen un riesgo del 3 al 6% de presentar la enfermedad. El mayor riesgo corresponde a los hermanos de niños diagnosticados antes de los 7 años de edad. Los hijos de padres diabéticos tienen un riesgo del 1-2% si la afectada es la madre y del 3 al 5% si es el padre12. En un gran estudio en gemelos llevado a cabo en Finlandia, la concordancia para diabetes de tipo 1 fue del 27,3% en gemelos monocigotos y del 3,8% en dicigotos. De nuevo el riesgo aumentaba cuanto menor fuera la edad de comienzo del gemelo índice42. Si el seguimiento es lo suficientemente prolongado, la concordancia en gemelos monocigotos puede llegar a ser del 60% y, en dicigotos, del 6-10%23.
SombrasCon respecto al diagnósticoEl diagnóstico de diabetes de tipo 1 frente a otras formas de diabetes resulta fácil en la mayoría de los casos. Las características clínicas (edad al diagnóstico, instauración rápida de los síntomas) y analíticas (cetosis/cetoacidosis y presencia de anticuerpos positivos frente a diversos antígenos de la célula beta pancreática) son determinantes. No obstante, otras veces es difícil distinguir entre diabetes de tipo 1 y LADA o tipo 2 con escasa reserva de insulina. Algunos autores han sido escrupulosos a la hora de clasificar a los pacientes como portadores de diabetes de tipo 1 y han validado sus criterios diagnósticos24. No obstante, en otros casos, se ha dado por bueno el criterio del médico informante sin más requisitos22; el diagnóstico se basa en datos clínicos y analíticos que no proporcionan una total certeza17,32 o se manejan conceptos generales del tipo: «criterios de la American Diabetes Association», de la OMS o «criterios internacionales»16,34. Ello supone, sin duda, imprecisiones en los datos que se minimizan en grandes Registros, pero que son importantes en los casos de comunidades con menos población o con baja incidencia de la enfermedad.
Con respecto a la calidad de los RegistrosLos Registros basados en la población general suponen los métodos más exhaustivos para obtener datos completos sobre la incidencia de la enfermedad y para monitorizar las tendencias a lo largo del tiempo. Los más conocidos sobre diabetes de tipo 1 se iniciaron en diversas áreas de Europa y EE. UU. en la segunda mitad del siglo xx y han aportado la mayoría de los datos en las últimas 2 décadas. No obstante, la fiabilidad de los mismos es variable, ya que los métodos de recogida de información son diversos y, a menudo, incompletos.
Para mejorarlos, se ha recomendado desarrollar un sistema de vigilancia nacional similar a los del cáncer, haciendo obligatoria la declaración de todos los casos de diabetes de tipo 1 y, posteriormente, buscar los factores ambientales implicados mediante una aproximación de colaboración a nivel mundial12. En nuestra comunidad, la Orden Foral 10/2010, del 21 de enero del 2010, creaba el Registro de diabetes de tipo 1 de Navarra, que cumplía, precisamente, con este requisito y que ha permitido realizar el estudio de incidencia de diabetes de tipo 1 sin límite de edad en la Comunidad Foral10.
En general, se emplea el método captura-recaptura para asegurar, en la medida de lo posible, la calidad de los datos. El método consiste en la estimación del número de sujetos que pertenecen a un grupo determinado utilizando para ello 2 fuentes de datos independientes obtenidos a partir de la población a estudiar. Se comparan estas muestras o listas, se determina el grado de solapamiento y se estima el número de casos. Para estimar este número de casos, se suele emplear el método propuesto por Chapman, que es una modificación del método captura-recaptura de Lincoln-Petersen. El número de casos estimados se calcula con IC del 95%. Cuando es > 80%, se considera que el grado de declaración es correcto. Las fuentes primarias suelen ser los hospitales públicos y privados de la comunidad o provincia objeto de estudio y las secundarias son múltiples: asociaciones de diabéticos, servicios de información de Atención Primaria, visados de recetas5, venta de glucómetros17, médicos con consultas privadas, compañías de seguros y/o campos de verano para personas con diabetes34. Las limitaciones son múltiples: en algunos casos, se basan en datos solo de pacientes ingresados en hospitales públicos16. En ocasiones, pueden existir dificultades añadidas debidas a la complejidad de los datos que se piden en el Registro. Cuantos más datos recojamos, más exhaustivo será el estudio, pero también serán más fáciles los errores y/o aumentará el número de datos incompletos.
Con respecto a las respuestas obtenidasDesde hace más de 40 años, sabemos que la diabetes de tipo 1 se asocia a los antígenos de leucocitos humanos (HLA) clase iiDR4 y DR3. La mayor susceptibilidad genética corresponde a la combinación de los 2 alelos DR3/DR4. Pero estas variantes de HLA explican solo el 50% de la susceptibilidad genética para diabetes de tipo 1. Hay más de 40 genes implicados en el 50% restante del riesgo genético. A pesar de ello, varios estudios han demostrado que la mayoría de los casos ocurren en niños con genotipos HLA de bajo riesgo, por lo que el impacto de factores ambientales es muy elevado y los estudios epidemiológicos para detectarlos son imprescindibles.
El análisis de estos factores ambientales ha dado lugar a la «hipótesis de la higiene», que relaciona el mayor riesgo para diabetes de tipo 1 con un mayor nivel socioeconómico y propone que la menor presencia de infecciones aumenta las enfermedades autoinmunes en los países industrializados43.
Otro elemento candidato a desencadenar la diabetes de tipo 1 es el que representan los virus, especialmente enterovirus44. Esta sospecha se basa en la (poco probada) variación estacional en la incidencia de la enfermedad. Pero lo cierto es que ni los enterovirus ni otros virus propuestos (rubéola, paperas, citomegalovirus, retrovirus) parecen estar realmente implicados.
Elementos de la dieta, como la albúmina sérica de la leche de vaca (elemento favorecedor de su aparición) o la vitamina D (elemento protector contra ella), también se han relacionado con la diabetes de tipo 1. A pesar de los resultados iniciales del estudio TRIGR45, el estudio DAISY parece descartar ambas posibilidades46,47. La lactancia materna, el gluten del trigo y la vitamina E son factores nutricionales que también se han valorado, sin resultados concluyentes23.
El factor materno, en forma de obesidad de la madre antes del embarazo, ganancia de peso durante el mismo (hipótesis de la sobrecarga) o estrés prenatal por factores psicológicos, también han sido considerados, sin éxito48.
Por último, la «teoría del acelerador»49 relaciona el aumento en la incidencia de la diabetes de tipo 1, así como el adelanto en su edad de aparición, con la obesidad y la resistencia insulínica a ella asociada. No obstante, esta teoría ha sido cuestionada por otros autores que la consideran ingeniosa, pero con fundamentos poco sólidos.
Por tanto, la genética desempeña un papel significativo, pero pequeño, en la aparición de la diabetes de tipo 1 y los factores ambientales estudiados no han proporcionado resultados clarificadores.
ConclusionesLa incidencia de diabetes de tipo 1 varía enormemente en los distintos países del mundo. Ha ido aumentando, de forma no lineal, a lo largo de las últimas décadas y, en algunos casos, se ha acompañado de un adelanto en la edad de aparición. La agrupación familiar y su asociación con los HLA señalan un fondo genético. Sin embargo, los factores ambientales desempeñan un papel fundamental en su aparición. Los estudios epidemiológicos son esenciales para detectar estos factores y así poder intentar influir en el desarrollo de la enfermedad. Los datos proporcionados por diferentes fuentes (Registros nacionales o internacionales preferentemente) permiten establecer hipótesis etiológicas sobre las que trabajar posteriormente. No obstante, la calidad de esos datos es, en ocasiones, cuestionable y, por desgracia, los estudios realizados sobre las hipótesis planteadas no han tenido éxito hasta el momento actual. Es preciso seguir investigando, con la mayor precisión posible, sobre estos elementos desencadenantes y así poder detener el avance de la diabetes de tipo 1. La epidemiología es una de las claves. Con sus luces y sus sombras.
FinanciaciónLos estudios correspondientes a la epidemiología de la diabetes tipo 1 en Navarra incluidos en esta revisión han sido financiados por 2 becas, una inicial del Departamento de Salud del Gobierno de Navarra (53/2008) y, otra posterior, del Instituto de Salud Carlos III (PI10/02715).
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés.