Se ha evidenciado en los últimos años no solo que la diabetes es un factor de riesgo para las enfermedades periodontales, sino que estas a su vez podrían afectar al control de la glucemia y las consecuencias de ello derivadas. El objetivo de este trabajo es revisar la evidencia existente sobre la influencia de las enfermedades periodontales en la diabetes, su control metabólico y sus complicaciones, así como tratar de analizar las implicaciones de esos hallazgos.
Las enfermedades periodontales son infecciones que inducen una respuesta inmunoinflamatoria en los tejidos periodontales, responsable en gran parte de la destrucción tisular asociada. Su prevalencia es alta en todo el mundo, lo que es confirmado por datos recientes tanto en España como en Portugal. Su importancia radica no solo en los efectos locales como la pérdida de dientes, sino también en sus efectos sistémicos.
Entre ellos, las enfermedades periodontales pueden afectar a la diabetes y a su control glucémico, debido a los efectos a nivel de la inflamación sistémica.
Diferentes estudios han señalado que la periodontitis se asocia a un nivel de hemoglobina glucosilada más elevado, tanto en pacientes con y sin diabetes. Incluso, se ha sugerido que la periodontitis puede asociarse a un riesgo aumentado de sufrir diabetes, además de un riesgo aumentado de sufrir ciertas complicaciones en pacientes diabéticos. Por otra parte, el tratamiento periodontal puede mejorar el control de la glucemia y, eventualmente, reducir la frecuencia de complicaciones.
Las implicaciones de estas evidencias son múltiples y afectan a dentistas, personal médico y a pacientes, entre otros.
In the last few years, various studies have shown that diabetes is not only a risk factor for periodontal diseases, but also that periodontal diseases may affect glycaemic control, with the well known consequences in terms of diabetes complications. The aim of the present paper was to review the existing evidence on the impact of periodontal diseases on diabetes, its metabolic control, and its complications, as well as the implications of these findings.
Periodontal diseases are infections, which trigger an immune inflammatory response in the periodontal tissues, responsible for a major proportion of the associated tissue destruction. The prevalence of periodontal diseases is high all over the world, which is confirmed in recent studies, both in Spain and Portugal. The importance of these diseases is based, not only on the local effects, such as tooth loss, but also on their systemic consequences. Among them, periodontal diseases have been shown to affect diabetes and its glycaemic control, due to (among other factors) the associated systemic inflammation.
Different studies have shown that periodontitis is associated with a higher level of glycosylated haemoglobin, both in subjects with and without diabetes. Moreover, it has been suggested that periodontitis may increase the risk of diabetes onset, as well as a higher risk of diabetic complications for diabetes patients. Conversely, periodontal therapy may improve glycaemic control in type 2 diabetic patients and, eventually, decrease diabetes complications.
The implications of these findings are numerous, affecting dentists, other health professionals and patients, among others.
En los pacientes afectados por enfermedades periodontales, la presencia de determinadas enfermedades sistémicas puede significar un reto para su manejo: puede ser necesario modificar los planes de tratamiento, se ha de consultar al médico que sigue al paciente y la prevención tiene que ser una parte al menos igual de relevante. En algunos casos, el enfoque periodontal tiene que ser menos agresivo. Igualmente la detección y el tratamiento de las enfermedades sistémicas pueden afectar el resultado de la terapia periodontal1.
De manera recíproca, en los últimos años, diversos estudios científicos han constatado que las enfermedades periodontales pueden afectar diferentes patologías sistémicas, incluidas las enfermedades cardiovasculares, las complicaciones del parto o la descompensación de la diabetes. Se ha pasado del concepto según el cual las enfermedades periodontales afectaban solo a los dientes y a sus tejidos de soporte (periodonto), a saber que pueden también tener efectos sistémicos, que pueden influir en la salud general de la población2.
Entre estas asociaciones, la observada entre diabetes y enfermedades periodontales es especialmente destacable, ya que ambas son enfermedades crónicas y de una gran relevancia desde el punto de vista de la salud pública. Además, se ha evidenciado que la relación entre ambas patologías es bidireccional: la doble vía de relación entre la diabetes y las enfermedades periodontales fue ya mencionada por Taylor3 en una hipótesis según la cual no solo la diabetes es un factor de riesgo para las enfermedades periodontales, sino que estas a su vez podrían afectar al control de la glucemia y las consecuencias de ello derivadas.
En otra revisión, paralela a esta, se han analizado los efectos de la diabetes sobre las enfermedades periodontales4. El objetivo de este trabajo es, pues, revisar la evidencia existente sobre la influencia de las enfermedades periodontales en la diabetes mellitus (DM), su control metabólico y sus complicaciones, así como tratar de analizar las implicaciones de esos hallazgos.
¿Qué son las enfermedades periodontales?Prevalencia en España y PortugalLos últimos estudios epidemiológicos han sugerido un incremento de la prevalencia de periodontitis en poblaciones adultas con acceso a cuidados bucodentales5. Esta prevalencia se sitúa en un 47% en una muestra de 3.742 adultos en EE. UU., con periodontitis moderada o avanzada en más de un 80% de los casos.
En Europa, los estudios epidemiológicos sugieren que alrededor del 30,5% de la población adulta presenta profundidades de sondaje superiores a 4-5mm (la profundidad de sondaje mide la bolsa periodontal, que es la lesión clínica asociada a la periodontitis), y hasta un 71,4% de la población de entre 65 y 74 años presenta pérdidas de inserción (la pérdida clínica de inserción da una estimación del tejido de soporte perdido) mayores o iguales a 6mm6.
Las encuestas sobre salud bucodental más relevantes en España se han realizado en 1993, 2000, 2005 y 2010. En la encuesta más completa, de 2005, los resultados mostraron que en adultos entre 35-44 años solo el 14,8% tendría las encías sanas; el 59,8% tendría gingivitis y el 25,4% periodontitis. En personas mayores, de 65-74 años, solo el 10,3% tendría las encías sanas; el resto tendría algún tipo de enfermedad periodontal: el 51,6% tendría gingivitis y el 38% periodontitis7. En España, la última encuesta de 2010 revela que más del 25% de los adultos jóvenes (35-44 años) presentan pérdidas de inserción de 4-5mm y más del 5% mayores o iguales a 6mm8.
El único estudio a nivel nacional disponible en Portugal fue realizado dentro de un programa para niños de 12 a 15 años, encontrando que más del 70% de los jóvenes presentaban sangrado al sondaje (que indica la presencia clínica de inflamación) y/o cálculo (presencia de depósitos bacterianos mineralizados). En este mismo estudio, se detectaron diferencias regionales, con las regiones del Algarve y Centro con mayor porcentaje de encías sanas, mientras que Alentejo y Norte mostraban mayor prevalencia de sangrado; Madeira y Azores presentaron cálculo en mayor porcentaje9. En un estudio realizado en 10 hospitales de la región norte de Portugal, se valoró el estado periodontal y de condiciones de higiene oral, mediante un examen clínico y un cuestionario, en 503 adultos con más de 60 años de edad. Los resultados indicaban que el 39,4% eran totalmente edéntulos (no tenían ningún diente) y que la mortalidad dentaria era del 70,2%. El índice de higiene oral (medido de 0 a 3; cuanto más alto indica un peor control de placa bacteriana por parte del paciente) fue de 2,1, lo que confirma la mala higiene oral de estos pacientes. La prevalencia de sangrado al sondaje fue del 95,6% y hubo presencia de cálculo en el 82,1%. La prevalencia de bolsas periodontales fue del 68,2% (4-5mm) y del 40,2% (>6mm)10.
Etiología y patogeniaLas enfermedades periodontales son patologías inflamatorias crónicas, causadas por las bacterias de los biofilms bacterianos dentales (antes llamado placa dental o bacteriana), que afectan a los tejidos periodontales. Específicamente en la periodontitis, el proceso infeccioso causa la destrucción de los tejidos de soporte del diente y puede llevar a movilidad y pérdida dentaria11. Aunque la periodontitis es considerada como una enfermedad de naturaleza infecciosa, se requiere también un huésped susceptible en el que se produzca la reacción inflamatoria crónica que origina la destrucción periodontal. Tras la realización de multitud de estudios epidemiológicos se ha sugerido que la gingivitis (inflamación superficial) no siempre progresa a periodontitis, y es necesario identificar a los individuos más susceptibles a padecerla, así como sus características12.
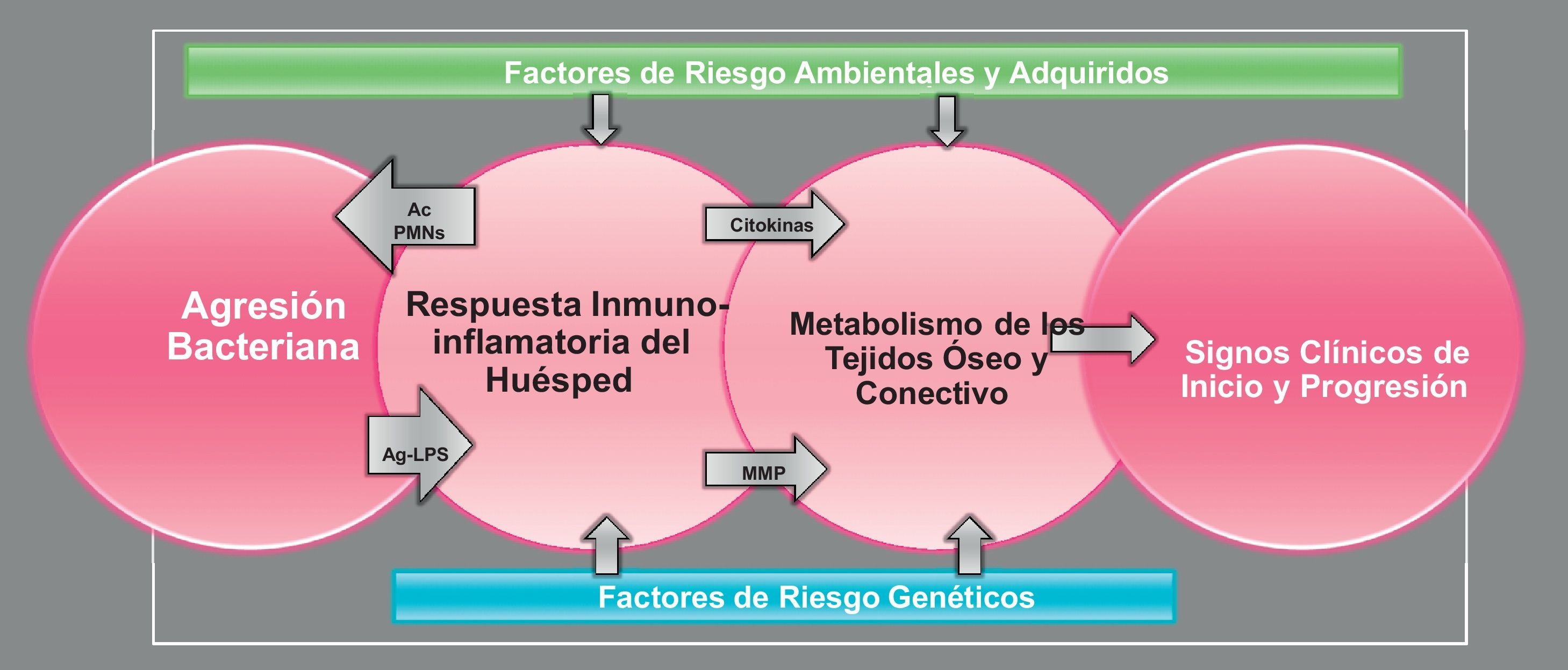
Por tanto, las enfermedades periodontales son enfermedades de etiología multifactorial (fig. 1). El agente causal que las desencadena es la agresión bacteriana y se ha demostrado que la presencia de ciertas bacterias, o grupos de bacterias, puede representar un factor de riesgo para la destrucción periodontal, destacando: Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis y Tannerella forsythia11. Estas especies bacterianas tienen diferentes factores de virulencia que les permiten colonizar el área subgingival y producir factores que dañen al huésped. Además, estas bacterias se organizan en forma de biofilms, lo que les confiere propiedades adicionales, aumentando su patogenicidad y su resistencia a los tratamientos13.
La presencia de bacterias a nivel subgingival induce en los tejidos periodontales la producción de citocinas y otros mediadores químicos proinflamatorios, generando una respuesta inflamatoria (gingivitis clínica). En la gingivitis predominan los leucocitos polimorfonucleares, que liberan numerosas enzimas con efectos deletéreos tanto para los tejidos del huésped como para los microorganismos. Si los leucocitos polimorfonucleares son capaces de controlar el crecimiento bacteriano, el proceso se mantiene bajo control14. Si no se controla adecuadamente la agresión bacteriana, se activa el sistema inmune adaptativo, con la presentación de antígenos bacterianos por las células de Langerhans y los macrófagos. Como resultado se produce la expansión clonal de los linfocitos B, que se transforman en células plasmáticas, y de linfocitos T. A lo largo de este proceso se producen diversos mediadores (prostaglandina E2, factor de necrosis tumoral-α, interleucina-1, interleucina-6…), que inducen la degradación del tejido conectivo a través de diversas enzimas (metaloproteinasas) y la reabsorción ósea debida a la inhibición de los osteoblastos y a la activación de los osteoclastos15. Todo este proceso genera la lesión clínica característica de las periodontitis, denominada bolsa periodontal, y que es una profundización patológica del surco gingival que rodea los dientes, causada por la inflamación de la encía y la destrucción de los tejidos de soporte (tejido óseo y ligamento periodontal)16.
Aunque el proceso explicado está desencadenado por la agresión bacteriana, en él influyen numerosos factores, considerados como factores de riesgo. Por una parte están los denominados determinantes del sujeto, que incluyen la edad, la raza y el sexo: la influencia de estos tres determinantes no se considera hoy en día muy relevante, dado que no se detectan diferencias claras entre sexos o entre grupos étnicos; solo el aumento de la edad muestra una mayor asociación, pero se debe principalmente a la acumulación de pérdida a lo largo de la vida. Entre los factores de riesgo genéticos se incluyen aquellos relacionados con alteraciones en los leucocitos polimorfonucleares, diferentes polimorfismos genéticos y anomalías congénitas o hereditarias asociadas a sobrecrecimiento gingival o a inmunodepresión. También se han evaluado factores de riesgo sociales y de comportamiento, destacando el tabaco y el estrés, y, en menor medida, la dieta (ya sea la falta de nutrientes fundamentales, o el exceso de ácidos grasos que favorezcan la formación de mediadores inflamatorios). Entre los factores de riesgo adquiridos destacan fundamentalmente la diabetes y otras patologías que cursen con inmunodepresión como la infección por VIH, o la ingesta de medicamentos asociados a sobrecrecimiento gingival (fenitoína, ciclosporina, grupo del nifedipino…)17.
También hay que tener en cuenta los factores de riesgo locales, tanto de tipo dentario (perlas y proyecciones del esmalte, malposición dentaria, discrepancias oclusales, proximidad radicular, contactos abiertos, anormalidades radiculares, afectación pulpar, fracturas dentarias y reabsorciones radiculares externas) como iatrogénico (restauraciones dentarias sobrecontorneadas o defectuosas, contactos abiertos, invasión de estructuras anatómicas, perforaciones radiculares)18.
Importancia de las enfermedades periodontalesLa importancia de las periodontitis no deriva exclusivamente de su prevalencia, sino de la morbilidad asociada. Por un lado, las periodontitis se asocian a la pérdida de dientes: en España, el promedio es de tres dientes ausentes en los adultos entre 35 y 44 años, y hasta 13,8 entre los 65 y 74 años7. Esta pérdida dentaria crea un importante deterioro estético y funcional6.
Por otro lado, cada vez cobra más relevancia la repercusión de las enfermedades periodontales sobre ciertas enfermedades sistémicas. Numerosas investigaciones implican a la infección periodontal como factor de riesgo para algunas condiciones sistémicas, como las enfermedades cardiovasculares, el parto prematuro, la descompensación de la diabetes o ciertas enfermedades pulmonares19.
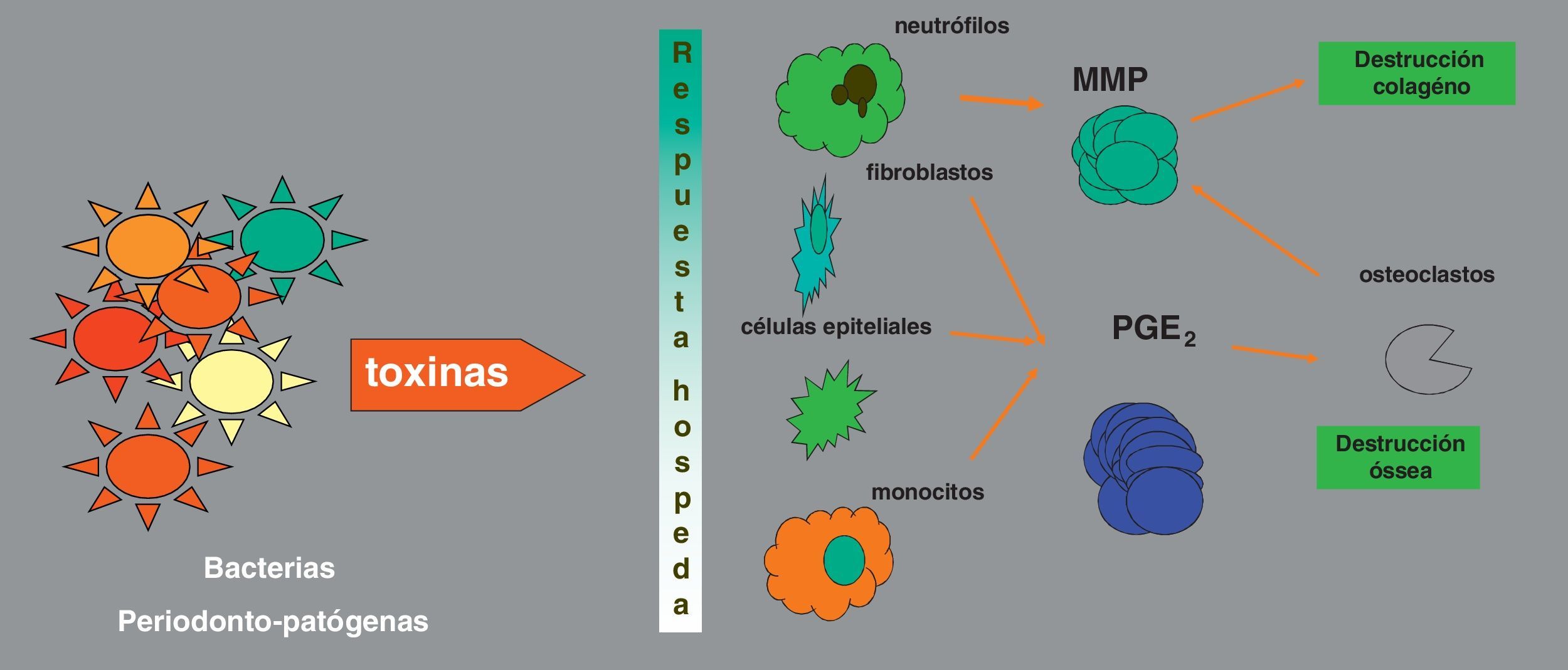
¿Afectan las enfermedades periodontales a la diabetes?Las enfermedades periodontales están causadas por bacterias, que inducen inflamación en los tejidos periodontales; esta respuesta inmunoinflamatoria, modulada por numerosos factores, es responsable en gran parte de la destrucción tisular (fig. 2). La evidencia científica actual sugiere que este proceso a nivel periodontal se asocia a una situación de inflamación sistémica (medida con el incremento de la proteína C-reactiva y otras proteínas de fase aguda o por marcadores de estrés oxidativo), que parece resultar del paso de bacterias periodontales y sus toxinas a la circulación general20. Esta inflamación crónica podría afectar el control de la DM, del mismo modo que podría influir en las función de las células β, generar resistencia a la insulina e incluso favorecer el desarrollo de DM tipo 2 (DM2)21.
Esquema de la patogénesis de las enfermedades periodontales, adaptado de75. MMP: metaloproteinasas de la matriz; PGE2: prostaglandina E2.
Respecto al primer paso en la hipótesis descrita más arriba, diversos estudios clínicos han demostrado que los pacientes con periodontitis tienen un nivel elevado de marcadores de inflamación sistémica, como la proteína C-reactiva, interleucina 6, haptoglobina o fibrinógeno, lo que lleva a pensar que la periodontitis contribuye de manera independiente a la inflamación sistémica22.
Esa inflamación sistémica, presente de manera crónica en pacientes con periodontitis, podría favorecer diferentes aspectos relacionados con la DM y el control de la glucemia:
- -
Aumento de la resistencia a la insulina, de manera similar a como lo hace la obesidad, dificultando el control de la glucemia1. En el estudio National Health and Nutrition Examination Survey (NHANES) 1999-2004, con 3.616 participantes, la inflamación periodontal, medida como profundidad de bolsa, se asociaba a la resistencia a la insulina, en pacientes sin diabetes23.
- -
Los pacientes con periodontitis podrían presentar intolerancia a la glucosa24.
- -
Cambios en la función inmune de las células, que podrían generar una mala regulación del metabolismo de los lípidos a través de mecanismos relacionados con las citocinas25. En un estudio con 120 pacientes con DM2, los niveles de peroxidación de lípidos se asociaban con el incremento en los niveles de inflamación periodontal26.
- -
Relación entre los niveles séricos de factor de necrosis tumoral-α, y otros biomarcadores, con la resistencia a la insulina en pacientes DM227–29.
El estudio NHANES III30 demostró que los pacientes con periodontitis presentaban una prevalencia del 12,5% (n=1.293) de DM, frente al 6,3% (n=12,178) en pacientes sin periodontitis. Por tanto, los pacientes con periodontitis tienen diabetes con el doble de probabilidad que los sujetos sin periodontitis. Un trabajo en 2009 sugirió que existe un aumento del riesgo para el desarrollo de diabetes en individuos con periodontitis, una vez ajustados los factores de confusión potenciales. En ese trabajo, la periodontitis severa se asoció con un aumento de la hemoglobina glucosilada (HbA1c) en individuos con y sin DM2. En personas sin diabetes, la progresión de la periodontitis durante 5-10 años se correlacionó con un aumento de la HbA1c y con intolerancia a la glucosa31.
En un artículo de revisión32, presentado en el Workshop conjunto de la Federación Europea de Periodoncia y de la Academia Americana de Periodontitis, se seleccionaron cuatro artículos24,33–35, que incluyeron en conjunto 22.230 sujetos, entre 25 y 74 años de edad, con un seguimiento entre uno y 22 años. Tres de los cuatro estudios24,33,35 encontraron un aumento significativo del desarrollo de diabetes en pacientes con periodontitis severa, definida por la profundidad de bolsa, tras el ajuste de los factores de confusión. Para la cuantificación de ese riesgo, uno de los estudios calculó que las personas con bolsas de 6mm o más en el inicio del estudio tenían 3,45 veces más riesgo de desarrollar diabetes que los pacientes sin periodontitis35.
Estos datos permiten concluir que diferentes estudios demuestran un aumento en el riesgo de desarrollar diabetes en personas con periodontitis severa, si se compara con salud periodontal o periodontitis inicial21.
¿Aumenta la periodontitis el nivel glucémico?Según el consenso de un reciente Workshop conjunto de la Federación Europea de Periodoncia y de la Academia Americana de Periodontitis21, la periodontitis severa se asocia con un aumento de la HbA1c en personas con y sin DM2; no se encontró evidencia en DM tipo 1 (DM1). En personas sin diabetes, la progresión de periodontitis en 5-10 años se asocia con un incremento en la HbA1c y alteraciones en la tolerancia a la glucosa. Esta conclusión estaba basada en cuatro estudios24,36–38. En el estudio de Demmer et al.36, los pacientes con periodontitis al principio del estudio y que mostraron progresión de la enfermedad mostraban un mayor aumento en la HbA1c (0,143%) frente a aquellos sin periodontitis, en el seguimiento a 5 años (0,005%).
Varios estudios epidemiológicos han coincidido en señalar que la periodontitis puede asociarse a una mayor dificultad en el control de la diabetes: en el estudio NHANES III, que trató de describir la prevalencia de caries y enfermedades periodontales en la población adulta de EE. UU., se concluyó que las enfermedades periodontales son un factor de riesgo para el control de la glucemia en pacientes con DM2, aunque se resaltaba la falta de datos en pacientes ancianos39; y en una revisión sobre los efectos adversos de la periodontitis sobre el control de la glucemia se encontraron dos estudios observacionales que apoyaban el efecto de la periodontitis severa, causando un peor control de los niveles de glucemia3.
¿Aumenta la periodontitis el riesgo de sufrir complicaciones de la diabetes?Como se ha visto, los estudios parecen indicar que los diabéticos con periodontitis tienen peor control metabólico y también podrían presentar mayores complicaciones sistémicas asociadas a la DM38,40–42.
Existen pruebas de una relación directa entre la severidad de la periodontitis y las complicaciones de la DM2; la periodontitis moderada y avanzada está asociada con un mayor riesgo de macroalbuminuria, enfermedad renal terminal, calcificación de las placas ateroscleróticas, aumento del grosor de la íntima-media de la carótida y mortalidad cardiorrenal43. Existe, en cambio, una evidencia limitada de la asociación entre enfermedades periodontales y complicaciones de la diabetes en adultos con una DM1 de larga duración21.
¿Afecta el tratamiento periodontal a la diabetes?Los objetivos generales del tratamiento periodontal son devolver y mantener la salud y la función de los tejidos periodontales44. El tratamiento periodontal tiene diferentes fases (control sistémico, fase higiénica, fase quirúrgica y fase de mantenimiento).
En la fase higiénica se debe intentar la eliminación de las causas locales de la enfermedad periodontal; es decir, se ha de eliminar la placa bacteriana y el cálculo dental, y todos aquellos factores que favorezcan su acumulación; el raspado y alisado radicular es el procedimiento más utilizado para la eliminación de cálculo y placa de la superficie del diente45. En la fase higiénica, el control de placa por parte del paciente resulta fundamental, al igual que durante el resto de las fases del tratamiento. En esta fase, se puede considerar además el uso de antimicrobianos46, tanto como antisépticos tópicos o como antibióticos locales47 o sistémicos48, aunque estos últimos se deben usar solo en casos concretos.
Una vez realizada la fase higiénica, se ha de realizar una reevaluación, que consiste en medir de nuevo los parámetros clínicos registrados en la evaluación inicial. Esto se ha de realizar entre 3 y 6 semanas tras terminar la primera fase. En función de los resultados obtenidos, se decide si se han conseguido los objetivos de control de la infección o no. Si no se han logrado, se debe considerar si la fase quirúrgica podría conseguirlos. La fase quirúrgica tiene como objetivos principales el acceso a zonas de difícil acceso y permitir la creación de una anatomía favorable para la higiene del paciente. Según el tipo de defectos periodontales, se pueden realizar técnicas de regeneración, con el objeto de recuperar parte de las estructuras de soporte del diente.
La última fase del tratamiento periodontal y, probablemente, una de las de mayor importancia, es la fase de mantenimiento49. La fase de mantenimiento está compuesta de visitas periódicas en las cuales se revisa la historia médica, se motiva al paciente en las técnicas de higiene oral y se valoran los niveles de inserción, de inflamación y sangrado gingival. Se deben eliminar todos los depósitos de cálculo y placa y tratar las zonas en las que la enfermedad periodontal haya recidivado. Esta fase será exitosa siempre que el paciente realice adecuadamente las medidas de higiene propuestas.
¿Reduce el tratamiento periodontal el riesgo de sufrir diabetes?Para esta pregunta, que es una hipótesis importante que se encuentra en la literatura, no hay todavía suficientes estudios para afirmarlo o rechazarlo50.
¿Reduce el tratamiento periodontal el nivel glucémico?Diversos estudios han evaluado esta hipótesis, dado que la disminución de la HbA1c es un resultado establecido para medir el éxito del tratamiento de la DM.
Entre los ensayos clínicos aleatorizado publicados, los resultados son variables y, a veces, contradictorios. En ellos varían tanto el tipo de tratamiento como el tipo de DM de los pacientes, aunque la mayoría evalúan DM2. De manera general, los resultados indican que el tratamiento periodontal, incluido raspado y alisado radicular, mejora el control de la glucemia en la DM251–53, aunque otros no reportan mejoría54. Cuando en el tratamiento se añade doxiciclina sistémica, algunos estudios observan mejor control metabólico55–57, mientras que otros no detectan diferencias58. Otros estudios añaden otras pautas coadyuvantes como tinidazol con ampicilina59,60, minociclina61 o azitromicina62, de manera sistémica; o antisépticos (como la clorhexidina)63 o antibióticos64, aplicados de manera tópica, con resultados positivos. En DM1, los resultados son contradictorios y hay menos estudios65,66.
También se han realizado revisiones sistemáticas con metaanálisis. Janket et al.67 trataron de cuantificar los efectos del tratamiento periodontal en los niveles de HbA1c en pacientes con DM1 y DM2. Los resultados indican que la reducción de los niveles de HbA1c era del 0,38%, siendo del 0,66% exclusivamente en pacientes con DM2 y del 0,71% cuando el tratamiento periodontal incluía antibióticos sistémicos. Simpson et al.68 estudiaron el efecto del tratamiento periodontal en el control glucémico de la diabetes, seleccionando siete ensayos clínicos aleatorizados, y concluyeron que existe una mejoría metabólica en el control de la diabetes del 0,40%, en HbA1c. Refieren además que existen pocos estudios y la mayoría con pocos pacientes. Salvi et al.69 concluyeron que la diabetes y la periodontitis tienen una influencia recíproca y señalaron que la periodontitis está asociada a un peor control glucémico y a otras complicaciones no orales. En una revisión más reciente se ha demostrado que el tratamiento periodontal resulta en una disminución de la HbA1c, con una media ponderada del 0,36% (intervalo de confianza del 95%: 0,19-0,54) a los 3 meses70. Estos resultados confirman los de otros metaanálisis previos. Pero parece evidente que los niveles de reducción de la HbA1c, tras tratamiento periodontal, medidos a corto plazo, podrían ser relevantes. Si esta reducción se pudiera mantener a largo plazo, esto podría contribuir a reducir la morbimortalidad asociada con la DM.
¿Reduce el tratamiento periodontal el riesgo de sufrir complicaciones de la diabetes?Según la hipótesis establecida en el apartado anterior, si la reducción en HbA1c se pudiera mantener a largo plazo esto podría reducir la morbimortalidad asociada con la diabetes, entre otras cosas, mediante la disminución de las complicaciones asociadas. No hay todavía datos suficientes para confirmar esta hipótesis de manera directa.
Otro aspecto importante de la relación enfermedades periodontales y DM es su impacto en la salud pública y en el coste de tratamiento de todas sus complicaciones. En un estudio retrospectivo a 2 años, de la base de datos de una empresa de seguros de salud en EE. UU., se observó una posible asociación entre el tratamiento periodontal y el costo de los gastos médicos por persona/por mes. Los resultados sugieren que el tratamiento periodontal (en pacientes con periodontitis) influye en el gasto por persona/por mes de tres enfermedades crónicas (DM, enfermedades coronarias y enfermedades cardiovasculares). Sin embargo, sugieren que son necesarios estudios para confirmar esta relación una vez se ajusten cofactores como el tabaquismo o el nivel socioeconómico71.
Implicaciones del efecto de las enfermedades periodontales sobre la diabetesImportancia del diagnóstico y tratamiento precoz de las enfermedades periodontales, especialmente en diabéticosLas personas con diabetes, tanto DM1 como DM2, y especialmente si la glucemia está mal controlada, deben ser consideradas como con riesgo de sufrir periodontitis, y es recomendable que se les recomiende la valoración de su estado periodontal43. Esto se justifica porque el diagnóstico precoz y la prevención tienen una importancia fundamental para evitar los daños irreversibles que puede provocar la periodontitis; pero también por la mejoría que el tratamiento periodontal puede aportar en el control de la glucemia21, ya que en pacientes diabéticos el tratamiento básico periodontal se asocia a una mejoría en el control de la glucemia (reducciones de HbA1c de aproximadamente un 0,40%), que puede ser clínicamente relevante en el manejo de la diabetes43. Por todo ello, se debe promover la salud bucodental en las personas con diabetes como parte integral del manejo global de su diabetes43.
La relación bidireccional entre las dos enfermedades justifica un manejo conjunto con el odontólogos y con otros profesionales sanitarios, con el objetivo de crear las condiciones adecuadas que favorezca el diagnóstico precoz y el tratamiento temprano y eficaz, de manera global.
Protocolos de tratamiento adaptados al paciente diabéticoA los pacientes diabéticos se les debería informar de que el riesgo de enfermedades periodontales aumenta con la diabetes, y esto también implica que se han de elaborar planes de tratamiento adaptados. Detalles como el horario de atención de los pacientes diabéticos, la duración de las citas o el tipo de tratamiento a realizar han de ser conocidos por el diabético y el equipo que le trata72,73.
Necesidad de información y acciones divulgativasLa relación bilateral entre la salud bucal y la salud sistémica es un reto para el tratamiento de pacientes con diabetes y enfermedad periodontal por parte de los equipos médicos1.
La educación con el objetivo de mejorar la higiene bucal debería formar parte del estilo de vida que ayude a disminuir los problemas de salud pública relacionados con la obesidad, las enfermedades cardiovasculares y la diabetes74.
Conflicto de interesesEste trabajo forma parte del IWorkshop Ibérico sobre diabetes y enfermedades periodontales, patrocinado por Colgate España.
Artículo preparado para el IWorkshop Ibérico sobre diabetes y enfermedades periodontales, patrocinado por Colgate España.