El perfil glucémico ambulatorio es un instrumento utilizado para detectar tendencias glucémicas a partir de datos de un paciente determinado, registrados mediante análisis de glucemia capilar o bien, de forma más habitual, mediante monitorización continua de glucosa. Este instrumento analiza las variaciones de las glucemias obtenidas a lo largo de un número determinado de días, y las expresa en función de la hora del día con ayuda de la mediana y los percentiles 10, 25, 75 y 90. Es de gran utilidad para identificar tendencias glucémicas en diferentes momentos del día, para cuantificar variabilidad glucémica y para estratificar el riesgo de hipoglucemias en función de las horas. Debe complementarse con el análisis del registro individual de glucemias, ingestas y ejercicio para de esta manera detectar posibles causas de variabilidad y corregirlas.
The ambulatory glucose profile is an instrument used to detect blood glucose patterns from patient results by recording blood glucose results or, more usually, by continuous glucose monitoring. This instrument analyzes the changes in glucose levels obtained over a number of days, and expresses the data, depending on the time of the day, using the median and the 10th, 25th, 75th and 90th percentiles. It is very useful for identifying glycemic patterns over the day, to quantify blood glucose variability, and to classify hypoglycemia risk according to time. This should be complemented with the analysis of individual blood glucose data, diet, and exercise, to detect potential causes of variability and correct them.
El control glucémico actual de la diabetes no alcanza los objetivos recomendados por las diferentes sociedades. En diabetes tipo 1 (DM1), datos del año 2012 de casi 26.000 pacientes con DM1 atendidos en 67 clínicas estadounidenses especializadas muestran que la hemoglobina glucosilada (HbA1c) media es de 8,3%, siendo aún más alta en pacientes entre 15 y 25 años1. En la mayoría de estudios, la HbA1c es la herramienta utilizada para definir la calidad del control glucémico. Es un excelente marcador de exposición glucémica que se correlaciona con la glucemia media2. Además, es un predictor de aparición futura de complicaciones microvasculares y macrovasculares, tanto en DM13 como en diabetes tipo 2 (DM2)4. No obstante, en el estudio DCCT, realizado en DM1, la HbA1c solo explica el 11% de la variación de riesgo en la aparición de complicaciones crónicas entre el grupo de tratamiento intensivo y el grupo de tratamiento convencional. De hecho, los pacientes del grupo de tratamiento intensivo con valores de HbA1c superiores a 9% presentaron una disminución del riesgo de retinopatía superior al 50% comparado con los pacientes del grupo convencional con similar HbA1c5. Estos datos indican que las diferencias en la aparición de complicaciones crónicas entre ambos grupos no solo se explican por una exposición glucémica inferior en el grupo de tratamiento intensivo. Se desconoce qué otros factores pueden explicar estas diferencias, dado que tampoco se han podido explicar por la variabilidad glucémica, al menos cuando esta se evalúa mediante perfiles de 7 puntos diarios de glucemia6.
La HbA1c no aporta información acerca de la dispersión de la glucemia y por tanto no informa acerca de la variabilidad glucémica. Tampoco se correlaciona con el número de hipoglucemias7, a diferencia de los datos obtenidos mediante monitorización continua de glucosa (MCG), que pueden predecir gran parte de las mismas8. Estas 2 características, hipoglucemias y variabilidad glucémica, van cobrando cada vez más relevancia en los objetivos de control de la diabetes, de manera que la definición actual de «óptimo control glucémico» consiste en una HbA1c dentro del objetivo (habitualmente inferior a 7%) sin hipoglucemias graves y con el máximo tiempo posible dentro del rango de normalidad (time in range o TIR), establecido como 70-180mg/dl.
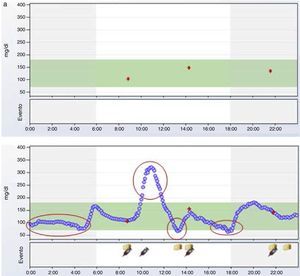
La automonitorización episódica de glucemia capilar (AGC) aporta valores puntuales de glucemia y por tanto completa la información proporcionada por la HbA1c, pudiendo calcularse a partir de estos datos diversas medidas de dispersión, como la desviación estándar5, y medidas de frecuencia de hipoglucemias9. La aparición en 1984 de los primeros glucómetros con memoria muestra que los diarios de glucemia con frecuencia presentan imprecisión en los registros. Actualmente los glucómetros disponen de sistemas electrónicos de volcado de datos, algunos con alarmas ante la detección de tendencias glucémicas10. Se define como tendencia glucémica una serie de mediciones de glucosa tomadas en el mismo momento del día que se encuentran fuera del rango deseable de un individuo (tendencia alta o tendencia baja). El inconveniente de la AGC es la escasa información que aporta acerca de una variable tan inestable en el paciente con diabetes como es la glucemia. Un dato aislado de glucemia es un valor puntual de una magnitud en constante cambio, que aporta la misma información que un fotograma en una película. Por otra parte, no debemos olvidar que la diabetes, principalmente la DM1, es una enfermedad crónica en la que la inmensa mayoría de las decisiones respecto al tratamiento, principalmente el ajuste de dosis de insulina, recaen sobre el propio paciente. La información que nos aporta un valor puntual de glucemia para tomar una decisión es limitada: interesa mucho más saber de dónde viene ese valor, pues la recomendación no será la misma si esta glucemia puntual viene de valores más elevados, de valores más bajos o incluso de una hipoglucemia. Esta limitación solo se soluciona muy parcialmente aumentando el número de glucemias capilares. Los estudios actuales de la mayoría de los fármacos antidiabéticos están realizados con perfiles diarios de 7 puntos de glucemia capilar. La figura 1 ilustra con 2 ejemplos las diferencias entre 3 o 5 puntos diarios, y 288 puntos diarios de glucemia (cada 5 min), que es la información que aportan los sensores actuales de MCG. La MCG es además la única forma de valorar el comportamiento nocturno de la glucemia. Por otra parte, las hipoglucemias se miden de forma diferente en distintos estudios, incluso muchas veces, y en ocasiones en estudios de gran trascendencia posterior en las guías clínicas, se cuantifican de forma imprecisa y subjetiva11. La forma más objetiva y precisa de medir las hipoglucemias es cuantificando su número exacto, duración y frecuencia mediante MCG.
Dado que, como se comentará posteriormente, la mejor forma de interpretar los resultados obtenidos mediante MCG es el perfil glucémico ambulatorio (PGA), en el presente artículo se revisarán de forma conjunta la utilidad de la MCG y del PGA.
Situación técnica actual de la monitorización continua de glucosaLa MCG se realiza por medio de sensores que miden la concentración de glucosa en líquido intersticial, adonde pasa por difusión desde el capilar y desde donde es captada por las células. Estos sensores generan una señal eléctrica de amplitud diferente en función de la concentración de glucosa, que es transmitida al receptor mediante un sistema de radiofrecuencia, donde puede permanecer almacenada hasta la descarga por el profesional (sistemas «ciegos» con lectura retrospectiva: iPro2®) o bien ser leída «a tiempo real» por el paciente (Guardian Real Time®, Dexcom G4 PLATINUM®, Freestyle Navigator II®). La calibración con glucemia capilar varias veces al día es necesaria en el momento actual para que el sensor traduzca de forma correcta la señal eléctrica en una concentración de glucosa. La precisión numérica actual de los sistemas actuales de MCG ronda el 88%, y la precisión clínica, obtenida mediante el sistema de análisis de error de cuadrículas de Clarke, el 79% (menor en hipoglucemia o durante cambios rápidos de glucemia)12. Por otra parte, estudios recientes de farmacocinética realizados en personas sanas inyectando por vía intravenosa trazadores de glucosa y analizando el tiempo que tardan en llegar al líquido intersticial han evidenciado que este tiempo, que inicialmente se pensaba que era de 10-15 min, es de 5-6 min13. La tabla 1 muestra la comparativa entre los 3 sistemas disponibles en la actualidad, aunque solo los 2 primeros (Guardian Real Time®, Dexcom G4 PLATINUM®) están comercializados en España.
Comparación de los 3 sistemas de MCG disponibles en la actualidad
| Guardian Real-Time® | Dexcom G4® PLATINUM | FreeStyle Navigator 2® | |
| Disponibilidad en España | Sí | Sí | No |
| Duración del sensor | 6 d | 7 d | 5 d |
| Frecuencia de medición | Cada 5min (288 / d) | Cada 5min (288 / d) | Cada 5min (288 / d) |
| Calibración | Cada 12 h | Cada 12 h | 1h, 2h, 10 h, 24 h, 72 h |
| Entrada de eventos (ejercicio, ingesta, insulina) | Sí | Sí | Sí |
| Opción de combinación con ISCI | Sí | Sí | No |
| Alarmas | Sí | Sí | Sí |
| PGA | p50 | p1, p25, p50, p75, p100 | p10, p25, p50, p75, p90 |
Se están realizando mejoras tecnológicas continuas en la MCG para aumentar la precisión. Obviamente, la precisión de estos sistemas, entendida como la reproducibilidad de sus mediciones y su aproximación al valor real, es un requisito fundamental para su utilidad y debe seguir mejorando14–16. Sin embargo, quizá la correlación de la glucosa intersticial con la glucemia capilar sea un aspecto menos relevante, dado que se ha demostrado en estudios animales que la concentración intraneuronal de glucosa es muy similar a la concentración de glucosa en líquido intersticial17. De hecho, el tiempo de recuperación de la clínica neuroglucopénica tras una hipoglucemia es más lento que la recuperación de los niveles plasmáticos, y más similar a la normalización de la glucosa en compartimento intersticial18. Si estos datos se confirman, es posible que en un futuro no muy lejano el lugar preferido para medir la glucosa sea el intersticio y no el plasma.
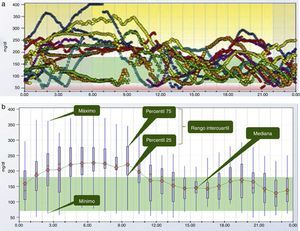
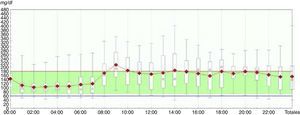
El perfil glucémico ambulatorioUno de los principales inconvenientes para utilizar los datos de MCG es su interpretación. Inicialmente, la duración de los sensores era de 3 días y la detección de tendencias superponiendo las gráficas de cada uno de los 3 días en una misma gráfica, representación llamada día modal, era relativamente sencilla. Sin embargo, al aumentar la duración del sensor a 5 días y posteriormente a 7 días, se ha vuelto inviable la extracción de conclusiones a partir de esta forma de representación de los datos (fig. 2a). Es en este momento cuando empieza a cobrar fuerza una propuesta lanzada en la década de los 80 por el Diabetes Research and Training Center19 para facilitar la identificación de tendencias a partir de los datos de glucemia, inicialmente obtenidos de forma episódica a partir de un medidor de glucemia capilar, y posteriormente de forma continua a partir de MCG. Esta propuesta consiste en «colapsar» los datos obtenidos para cada momento en diferentes días y obtener medidas de dispersión (percentiles), de manera que desaparecen los datos individuales y emergen tendencias. Esta representación de los datos mediante medidas de dispersión en función del momento se denomina «perfil glucémico ambulatorio» (PGA), traducción del inglés ambulatory glucose profile o AGP (fig. 2b y 2c).
Un extenso documento publicado por un panel de expertos internacionales el pasado año20 explica con detalle la propuesta. Al ser la glucemia una variable que no sigue una distribución normal, se recomienda para su caracterización el uso de percentiles en lugar de media y desviación estándar. Así, se propone utilizar la mediana (percentil 50) como medida de tendencia central, el percentil 25 y el percentil 75 como medidas de dispersión, y el rango intercuartil (magnitud situada entre percentiles 25 y 75) como medida de variabilidad glucémica. También se recomienda como medida de valores extremos el empleo de los percentiles 10 y 90, que dejan respectivamente por debajo y por encima el 10% de los datos. Todas estas medidas se pueden representar de forma numérica o de forma gráfica (fig. 2b y 2c). La evolución de la mediana a lo largo del día determina la estabilidad o inestabilidad de la glucemia (variaciones de glucemia a lo largo del día), mientras que la amplitud del rango intercuartil ilustra la variabilidad glucémica (variaciones de la glucemia en un mismo momento a lo largo de distintos días). Para analizar de forma correcta la variabilidad, se recomienda que mientras el paciente lleva el sensor, mantenga unos horarios de ingestas estables que permitan definir claramente cuál es el periodo posprandial.
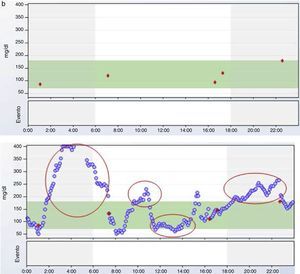
Un percentil 10 cercano al punto de corte de la hipoglucemia (habitualmente establecido por consenso en 70mg/dl) en un determinado momento del día marca un riesgo moderado de hipoglucemia en ese momento, pues en el 10% de las ocasiones el paciente presenta hipoglucemia a esa hora, mientras que si es el percentil 25 el que está en 70mg/dl, el riesgo de hipoglucemia a esa hora del día es elevado, ya que esta acontece en un 25% de los días. La figura 3 muestra un ejemplo de esta situación.
La representación visual del PGA permite analizar de un vistazo la variabilidad valorando la anchura del rango intercuartil. Si esta es elevada, se debe analizar y tratar este problema antes de intentar mejorar el control glucémico, para evitar que descienda el percentil 25 y aparezca un riesgo elevado de hipoglucemia. La variabilidad elevada se debe con frecuencia a aspectos corregibles mediante educación como errores en el conteo de hidratos o en el manejo del ejercicio, transgresiones dietéticas no cubiertas por bolos, sobrecorrección de hipoglucemias, etc.
Por desgracia, cada sistema de MCG muestra su propia representación de PGA. Como muestra la tabla 1, solo el sistema de descarga de datos del Freestyle Navigator 2® (no comercializado en España) muestra en su representación los percentiles 10, 25, 50, 75 y 90. Los 2 sistemas de descarga del Dexcom G4 PLATINUM® (Dexcom Studio® y Diasend®, este último acoplado a la ISCI Animas®) muestran los percentiles 25, 50 y 75, junto con el mínimo (percentil 1) y el máximo (percentil 100). El sistema de descarga de Guardian Real Time® solo proporciona el percentil 50 incorporado a la pantalla de día modal. Para interpretar el PGA, realmente no sería imprescindible que el sistema de MCG utilizado fuera a tiempo real, dado que la lectura y el análisis del conjunto de datos de varios días es siempre retrospectivo. No obstante, los 2 únicos MCG con capacidad de obtener registros gráficos relativamente completos de PGA (Freestyle Navigator 2® y Dexcom G4 PLATINUM®) son sistemas de lectura a tiempo real, por lo que al hablar de PGA se hace referencia a este tipo de sistemas.
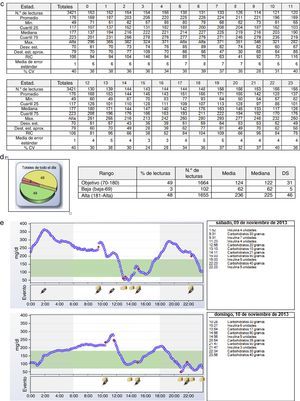
Otros datos que se pueden extraer de la MCG son la exposición glucémica durante el periodo de lectura, expresada como área debajo de la curva. Más que la exposición global, puede ser de interés el análisis de la exposición glucémica en determinados momentos del día, como el periodo posprandial o la noche. También es muy interesante conocer el TIR, que es el periodo de tiempo global o por franjas horarias en que las mediciones de glucosa se encuentran dentro de los objetivos prefijados individualizados de tratamiento (fig. 2d). El TIR habitualmente se establece por consenso entre 70 y 180mg/dl, dado que datos obtenidos mediante AGC muestran que si el 50% de los datos se encuentran en este rango, la HbA1c suele encontrarse en torno a 7%, aunque en diferentes poblaciones pueden ser más elevados (neuroglucopenia) o más bajos (gestantes). También se propone estratificar las hipoglucemias y las hiperglucemias en función de la cifra en 3 categorías para cada una: baja (60-70mg/dl), muy baja (50-60mg/dl) y peligrosamente baja (<50mg/dl); y alta (180-250mg/dl), muy alta (250-400mg/dl) y peligrosamente alta (>400mg/dl).
Para conceder el valor adecuado a la detección de una tendencia glucémica, debemos preguntarnos qué correlación existe entre la detección de una tendencia en un momento puntual y su aparición en el futuro inmediato. Para ello, debemos saber qué cantidad de días de MCG son suficientes para que el PGA pueda predecir con alta probabilidad los días sucesivos, y colocar el número de sensores que sean necesarios para cubrir este periodo (y no colocarlo el número de días que dure el sensor). Con este objetivo, se analizaron de forma retrospectiva los datos obtenidos por MCG de 185 pacientes con DM1 del estudio de la Juvenile Diabetes Research Foundation21, buscando correlaciones para los valores de determinadas medidas de tendencia (mediana de glucemia, TIR, porcentaje de hipoglucemias y porcentaje de hiperglucemias, retrospectivo), tomando un periodo previo de 3 días, 6 días, 9 días, 12 días, 15 días, y un periodo posterior de un mes, 2 meses, 3 meses. Las correlaciones más fuertes se obtuvieron con 15 días y un mes (r2=0,85-0,90), pero también con 15 días y 3 meses (r2=0,66-0,75). Por ello, se considera que 15 días es el periodo óptimo de tiempo para predecir las tendencias glucémicas de los 3 meses posteriores en pacientes con DM1, y por tanto esta debería ser la duración de MCG y de PGA. En pacientes con DM2, al ser una enfermedad menos variable, probablemente sean suficientes periodos más cortos.
Sistemática para interpretar un perfil glucémico ambulatorioEl primer paso es comprobar que la cantidad recogida de datos ha sido suficiente (máximo de 288 diarios). Lo habitual es obtener entre el 70 y el 80% de mediciones para considerar el registro de datos como suficiente. Tras esto, se recomienda seguir un orden estructurado para la interpretación del PGA20:
Análisis de la mediana, de la estabilidad o inestabilidad de la misma a lo largo del día y de su comportamiento en distintos momentos (día, noche, periodo posprandial).
Análisis del rango intercuartil y de la variabilidad glucémica, global y en distintos momentos del día (noche, periodo posprandial)Análisis del TIR
Análisis de las hipoglucemias (percentil 25, percentil 10, mínimo)
Una vez analizado el PGA, siempre debemos completar esta información mediante el análisis de los perfiles de días individuales para buscar causas potenciales de variabilidad (glucemias, ingesta, ejercicio, etc.).
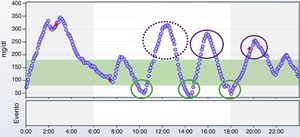
Limitaciones del perfil glucémico ambulatorioNo debemos olvidar que el PGA es la manera más sencilla e intuitiva de identificar tendencias, pero para poder corregirlas, se debe analizar la causa de las mismas mediante el análisis individual de los datos, que no aparecen en el PGA (fig. 2e). Para ello, hay que analizar de forma meticulosa el registro de glucemias del paciente, junto con el registro de ingesta, ejercicio, sueño, días de descanso y cualquier otra actividad que pueda influir en la glucemia. Para poder hacerlo, será fundamental que el paciente haya registrado de la forma más precisa posible estas actividades durante el tiempo que haya durado la monitorización. Este registro puede ser manual o electrónico, incorporando la información al receptor de MCG. Solo de esta forma podremos encontrar potenciales causas de variabilidad glucémica como ingestas mal cubiertas por bolos de insulina, respuestas inadecuadas al ejercicio, excesiva corrección de hipoglucemias, etc. El análisis del día a día de forma conjunta con el paciente es una forma única de presentarle los efectos, positivos o no, de determinadas conductas o tratamientos, y la evidencia visual del efecto deletéreo o beneficioso de las mismas sobre la glucemia resulta de gran utilidad para lograr su modificación o implementación. La figura 4 muestra un ejemplo de sobrecorrección de hipoglucemias que se detecta en el análisis del registro del día a día de la MCG.
Utilidad clínica del perfil glucémico ambulatorio y de la monitorización continua de glucosaEl estudio de la Juvenile Diabetes Research Foundation (JDRF) publicado en el año 200822 comparó el control glucémico de 322 pacientes adultos y adolescentes con DM1 en tratamiento intensivo con múltiples dosis de insulina (MDI) o infusión subcutánea continua de insulina (ISCI) y con una HbA1c inicial de 7,6%, aleatorizados a AGC o a cualquiera de los 3 sistemas de MCG durante 26 semanas. Sus resultados mostraron que el uso de MCG en mayores de 25 años se asociaba a una reducción media significativa de HbA1c de 0,53%. Los autores atribuyen la falta de diferencias en pacientes menores de 25 años al hecho de que esta población utilizaba la MCG menos del 80% del tiempo. No se encontraron diferencias en el número de hipoglucemias entre ambos grupos. Desde la publicación de este ensayo, la Asociación Americana de Diabetes (ADA) recomienda la utilización de MCG en tiempo real en pacientes con DM1 en tratamiento intensivo seleccionados con un nivel de evidencia A (edad superior o igual a 25 años) o C (niños, adolescentes o adultos menores de 25 años) para mejorar la HbA1c, y con un nivel de evidencia E para hipoglucemias desapercibidas o frecuentes23. Las recomendaciones de la Sociedad Española de Diabetes son similares y vienen recogidas en su documento de posicionamiento24. Los estudios que incluyen a pacientes adultos y niños con DM1 en tratamiento con MDI y ISCI han mostrado un efecto beneficioso de la MCG a tiempo real con reducciones de HbA1c de 0,3-0,6% sin aumento de hipoglucemias o con ligera reducción de las mismas25,26, excepto en niños menores de 10 años, en los que los beneficios no son concluyentes27,28. Los estudios que han añadido MCG a terapia previa con ISCI en niños y adultos29 o exclusivamente en adultos30 también han mostrado mejoría en hipoglucemias y en HbA1c. Las mejorías clínicamente más relevantes se han obtenido al pasar de tratamiento con MDI y AGC a tratamiento con ISCI y MCG31. De forma consistente y similar al estudio JDFR, la utilización de la MCG mayor al 60-70% del tiempo se asocia a mayores beneficios sobre la HbA1c. El estudio SWITCH32 analizó el control glucémico en 153 pacientes adultos y niños de 6 años o más en tratamiento con ISCI, antes y después de MCG durante 6 meses. Al ser un estudio cruzado, a diferencia del JDRF, elimina el posible efecto de la educación diabetológica como factor de confusión. El uso de MCG se asoció en este estudio a un descenso significativo de HbA1c de 0,43% acompañado de una reducción significativa del tiempo diario en hipoglucemia (19 versus 31min), a una reducción de la variabilidad glucémica medida mediante desviación estándar y a un aumento en los autoajustes de insulina por parte del paciente. A diferencia del estudio JDRF, la reducción de HbA1c se observó tanto en adultos como en niños. Un metaanálisis33 y una revisión de la Cochrane Database recientes34 concluyen que, en pacientes con DM1, la MCG a tiempo real logra reducciones de HbA1c 0,20-0,26% mayores que la AGC sin diferencias en el número de hipoglucemias graves. Algunos trabajos aislados comienzan a mostrar igualmente beneficios de la MCG a tiempo real en el control metabólico en pacientes con DM235.
El PGA se ha utilizado en investigación para conocer el comportamiento de la glucemia en los individuos sin alteraciones del metabolismo hidrocarbonado36, en pacientes con DM1, DM237 y en el embarazo sano y complicado con diabetes38, fundamentalmente por el grupo del International Diabetes Center.
Pese a estos datos que apoyan el uso de MCG en pacientes con DM1 en tratamiento intensivo, la utilización actual en el mercado de dichos sistemas es solo del 6% de los pacientes con DM1 en Estados Unidos1, y probablemente muy inferior en Europa. Esto se debe a una serie de barreras asociadas a su uso. Algunas de estas barreras, las tecnológicas, se están resolviendo rápidamente por parte de la industria farmacéutica: la precisión de los sensores mejora de forma constante39, la duración del sensor se prolonga cada vez más, y se espera que la próxima generación de sensores en un futuro cercano no precise calibración40, que constituye una fuente frecuente de imprecisión. Más importantes son las barreras administrativas. El coste de estos sistemas es elevado y su financiación por los sistemas públicos de salud difiere mucho según los países. En Estados Unidos, es reembolsable en pacientes con DM1 que padezcan hipoglucemias graves frecuentes y mal control pese a AGC. En España, la situación varía en función de la comunidad autónoma, pero por lo general la financiación de estos sistemas no está contemplada en ningún caso o bien en casos muy puntuales, aunque muchas unidades de diabetes están dotadas de sensores de MCG para su uso profesional. Aparte del coste del material fungible, también hay que tener en consideración el tiempo requerido por el equipo sanitario para la colocación, descarga de datos y, sobre todo, lectura y análisis adecuado de los mismos. Otra barrera importante para la implementación de estos sistemas es la inercia clínica de médicos, enfermería y también de pacientes, a la hora de familiarizarse con estos sistemas. El análisis de 288 datos de glucosa diarios (2.016 datos en el caso de llevar el sensor durante 7 días) no es tarea fácil. En este sentido, la falta de estandarización actual de los datos registrados por el MCG, con un volcado de datos diferente para cada sistema, dificulta que los clínicos, y también los pacientes, se familiaricen con ellos. Es llamativa la escasez de ensayos clínicos y publicaciones de los fármacos recientemente comercializados o de próxima comercialización que utilizan datos obtenidos mediante MCG, pese a que las ventajas que ofrecen los mismos no son un mejor control de la HbA1c, sino que consisten en beneficios sobre el control de la glucemia posprandial o en la disminución del número de hipoglucemias, beneficios mucho más cuantificables mediante MCG que mediante AGC. Algunos trabajos puntuales han utilizado la MCG durante 3 días, por ejemplo para cuantificar las diferencias en hipoglucemias nocturnas, excursiones posprandiales y TIR con insulina degludec sola41 o en combinación con insulina aspártica42.
ConclusionesEl PGA obtenido mediante análisis de los datos de MCG ofrece una visión precisa, detallada y consistente de las tendencias glucémicas a lo largo del día, evidenciando los detalles que la HbA1c no muestra. Es la mejor forma para conocer el comportamiento de la glucosa a lo largo del día y de la noche, y es la forma más objetiva y precisa de cuantificar las hipoglucemias. Además, ofrece al clínico y, sobre todo, al paciente, evidencia acerca del efecto de una determinada conducta o tratamiento.
Su uso puede ser muy útil siempre que se seleccione al candidato apropiado, de forma similar a lo que ocurre con la terapia con ISCI. Los sistemas de MCG no son un fin en sí mismos, sino un medio que ofrece amplias posibilidades para conocer el comportamiento de la glucosa en un paciente determinado y hacer los pertinentes cambios en su tratamiento dietético o farmacológico, así como para valorar la eficacia de estos cambios. Para que esta intervención sea rentable, al igual que ocurre con el tratamiento con ISCI, es crucial seleccionar al candidato idóneo, que esté motivado en mejorar el control de su enfermedad y preparado para analizar la información y sacar conclusiones de ella.
Sería deseable que aumentara el uso de MCG y de PGA tanto en la práctica clínica habitual como en investigación, y para ello es crucial que los médicos y enfermeros que manejan pacientes con diabetes se familiaricen con su lectura.
Conflictos de interesesLa autora declara no tener ningún potencial conflicto de interés relativo a esta revisión.