La diabetes mellitus tipo 1 es una enfermedad crónica que resulta de la destrucción autoinmune de las células beta pancreáticas. Aunque la terapia sustitutiva con insulina permite a los pacientes llevar una vida activa, no impide la aparición de complicaciones secundarias graves cuando el control de la glucemia es insuficiente, y está asociada al riesgo de padecer episodios de hipoglucemia. Por tanto, es necesario disponer de terapias más efectivas y seguras. La terapia génica se puede considerar una nueva aproximación o herramienta prometedora en la búsqueda de una curación para la diabetes. Los avances en el campo de la terapia génica nos permiten disponer de vectores más seguros y eficaces para transferir los genes de interés a las diferentes células/tejidos del organismo. En esta revisión se presentan, por un lado, los elementos que es preciso tener en cuenta a la hora de diseñar una estrategia de terapia génica para la diabetes y, por otro, las diferentes aproximaciones actuales para la diabetes tipo 1. Por último, se discuten los resultados más relevantes descritos en este campo.
Type 1 diabetes mellitus is a chronic disease characterized by autoimmune destruction of insulin-producing beta-cells. Current insulin replacement therapies offer many patient benefits, but do not prevent secondary complications when glycemic control is insufficient and are associated with the risk of hypoglycemia. Therefore, more efficient and safer therapies are still required. Gene therapy is considered a new approach/tool to treat diabetes. Important advances in the field of gene therapy have made vectors both more efficient and safer in delivering genes to most tissues and cell types. In this review, we first analyze the key issues that should be considered for designing a new gene therapy approach for diabetes and second, we discuss main approaches currently under investigation for this disease. Finally, most relevant results in the field are presented.
vectores adenoasociados
vectores adenovirales
glucocinasa
péptido similar al glucagón tipo 1
factor de crecimiento similar a la insulina tipo 1
kilobase
vectores lentivirales
factor de transcripción de unión al elemento C1 del gen de la insulina
factor de diferenciación neurogénico
neurogenina 3
diabético no obeso
factor de transcripción homeobox pancreático duodenal 1
vectores retrovirales.
La diabetes tipo 1 resulta de una destrucción autoinmune de las células beta pancreáticas que lleva al déficit en la producción de insulina y al desarrollo de hiperglucemia. En la diabetes tipo 1, la terapia sustitutiva con insulina, a pesar de que permite a los pacientes llevar una vida activa, no es perfecta, debido a la dificultad para mantener la normoglucemia. Esta terapia está asociada al riesgo de aparición de episodios de hipoglucemia aguda y, además, no previene el desarrollo de complicaciones secundarias muy severas como la retinopatía, la nefropatía o la neuropatía. Por ello, es necesario desarrollar terapias más efectivas que permitan mantener la normoglucemia. El diseño de nuevas terapias para la diabetes tipo 1 requiere en primer lugar avanzar en el conocimiento de los mecanismos moleculares que llevan al desarrollo de la enfermedad. Ello, junto con los avances en el campo de la terapia génica, contribuirá muy probablemente en un futuro a desarrollar aproximaciones que llevarán a la curación de la enfermedad.
La terapia génica se centra en la transferencia de material genético a células o tejidos para prevenir o curar una determinada enfermedad humana. De entre los muchos avances en medicina, la utilización de genes con fines terapéuticos puede tener un papel clave en la búsqueda de la curación de aquellas enfermedades que las terapias con fármacos convencionales no pueden solucionar.
En un principio se consideró la terapia génica una herramienta básica para el tratamiento de enfermedades hereditarias monogénicas (cuyo origen es el defecto en un único gen) con la intención de devolver a la célula la capacidad de producir la proteína funcional mediante la introducción de una copia correcta del gen mutado. Sin embargo, actualmente la mayoría de las aplicaciones de terapia génica se están desarrollando para enfermedades de alta prevalencia, ya sean poligénicas o no hereditarias, como por ejemplo el cáncer o el SIDA. Por tanto, la diabetes mellitus tanto tipo 1 como tipo 2 puede considerarse una buena candidata para ser tratada con estrategias de terapia génica.
Se debe tener en cuenta que la terapia génica es una terapia somática. Es decir, se pretende tratar únicamente a un individuo y no a su descendencia. Podemos distinguir dos tipos de aproximaciones de terapia génica: 1) la denominada terapia génica in vivo, en la cual el gen curativo se introduce en un vector y a continuación este vector se transfiere directamente al paciente, y 2) la denominada terapia génica ex vivo, que se basa en introducir el gen curativo en un vector, transfiriendo este vector a células en cultivo (que pueden ser del propio paciente); más tarde, estas células manipuladas genéticamente se trasplantarán al paciente.
Elementos clave en el diseño de estrategias de terapia génicaPara el desarrollo de una nueva estrategia de terapia génica para la diabetes existen diferentes factores que es preciso tener en cuenta. En primer lugar, se debe seleccionar el gen terapéutico, que se utilizará en función de si se pretende, por ejemplo, regenerar el páncreas, mantener la normoglucemia o bloquear la neovascularización de la retina. Por tanto, dependerá en gran parte del conocimiento que tengamos de la enfermedad y en particular del mecanismo sobre el que queramos actuar. Otro elemento clave es el vector que vamos a usar para transferir el gen de interés a la célula diana. Existe una gran variedad de vectores virales y no virales. La elección de uno u otro dependerá principalmente de la duración de la expresión del gen terapéutico que se necesite y, también, del tejido que se pretenda manipular. El campo de la vectorología es seguramente el más activo dentro de la terapia génica, con el objetivo último de mejorar la eficiencia de los diferentes vectores, su selectividad y especificidad celular, así como evitar posibles efectos secundarios.
La selección del tipo celular que queremos manipular para expresar nuestro gen terapéutico variará en función de la estrategia. En el caso de la diabetes puede ser de interés manipular, entre otras, las células musculares, los hepatocitos, las células beta, o incluso células de la retina para contrarrestar la retinopatía. Para conseguir expresar el gen terapéutico en los tipos celulares seleccionados, la vía de administración del vector puede resultar clave y depende de la accesibilidad del tejido. Así, mientras que el músculo esquelético es de fácil acceso, otros órganos internos, como el páncreas, son difíciles de manipular. Finalmente, la selección de un buen modelo animal es fundamental para verificar la eficiencia de un tratamiento de terapia génica, y además de utilizar modelos roedores es necesario validar las nuevas estrategias en un modelo animal grande, ya sean perros o primates no humanos. En el caso de la diabetes, existen varios modelos que están siendo muy útiles, como animales tratados con estreptozotocina o bien genéticamente susceptibles de desarrollar la enfermedad, como los ratones NOD, ob/ob y db/db, y también diferentes animales transgénicos.
Vectores para terapia génicaExisten dos grandes grupos de vectores: los virales y los no virales. No se puede afirmar cuál es el vector ideal para el tratamiento de la diabetes, ya que su selección dependerá en cada caso de la estrategia que se quiera desarrollar, del tejido al cual se deba acceder, del tiempo que deba durar la expresión del gen curativo, y de si se trata de una aproximación in vivo o ex vivo (terapia celular).
Vectores viralesLos vectores virales aprovechan la habilidad natural de los virus para infectar un cierto tipo celular y transferir el material genético al núcleo de la célula. En los vectores virales se han eliminado los genes responsables de la replicación viral, permitiendo así la introducción en su lugar de genes de interés y anulando de esta manera la patogenicidad del virus1. Actualmente existe una larga colección de vectores virales y una forma de clasificarlos en función de si: a) tienen capacidad para insertar el gen de interés en el genoma (vectores integrativos), lo que permite una expresión del gen terapéutico a largo plazo y que, además, cuando una célula se replique lo transmita a las células hijas; o bien b) el material genético se mantiene de forma episomal en la célula (vectores no integrativos) y, por tanto, la expresión a largo plazo depende mayoritariamente de la tasa de replicación del tipo celular transducido1.
Entre los vectores integrativos, los más empleados inicialmente fueron los vectores retrovirales (RV), derivados de oncorretrovirus murinos, si bien sólo pueden infectar células en división2. Los RV están siendo desplazados por los vectores lentivirales (LV), que son retrovirus derivados del virus de la inmunodeficiencia humana (VIH), pero a diferencia de los RV son capaces de infectar tanto células en división como quiescentes3. Estos vectores pueden ser utilizados en terapia génica ex vivo e in vivo.
Entre los vectores no integrativos, los más usados son los vectores adenovirales (Ad)4 y los vectores adenoasociados (AAV)5, que pueden infectar células en división y células que no se dividen. Los Ad de primera generación permiten expresar niveles elevados de genes exógenos in vivo. Sin embargo, dicha expresión es transitoria, ya que son muy inmunogénicos debido a que también expresan proteínas virales6. Por contra, la última generación de vectores adenovirales, los denominados «gut-less», carecen completamente de genes virales y, por tanto, son poco inmunogénicos y permiten que se pueda mantener la expresión de los genes de interés durante varios meses7.
Los vectores AAV permiten expresar genes exógenos durante largos periodos (años) cuando se manipulan tejidos con baja tasa de replicación, como el hígado o el músculo esquelético8,9. Actualmente, se han obtenido varios serotipos de AAV (AAV1, AAV2, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, etc.) que presentan diferente tropismo celular y que pueden seleccionarse según el tipo celular en el que se quiera expresar el gen terapéutico10. Así, se han descrito gran número de trabajos en los que se han utilizado AAV para transferir genes a músculo esquelético, hígado, corazón, etc., tanto de ratones y ratas como de perros, primates e incluso pacientes humanos11–15. No obstante, la gran limitación de estos vectores es su reducida capacidad de empaquetamiento para albergar el gen terapéutico, ya que provienen de virus pequeños (20 nm). Los AAV únicamente pueden contener genes de hasta 4,5 kb, mientras que los RV y los LV pueden albergar hasta 8 kb. Finalmente, los Ad de última generación ven aumentada esta capacidad hasta las 37 kb (tabla 1).
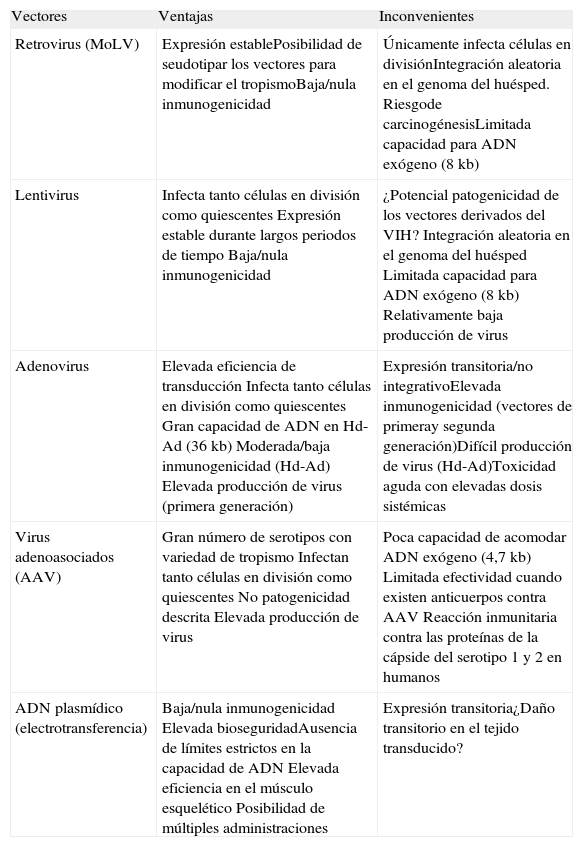
Ventajas e inconvenientes de los principales vectores utilizados para terapia génica
| Vectores | Ventajas | Inconvenientes |
| Retrovirus (MoLV) | Expresión establePosibilidad de seudotipar los vectores para modificar el tropismoBaja/nula inmunogenicidad | Únicamente infecta células en divisiónIntegración aleatoria en el genoma del huésped. Riesgode carcinogénesisLimitada capacidad para ADN exógeno (8 kb) |
| Lentivirus | Infecta tanto células en división como quiescentes Expresión estable durante largos periodos de tiempo Baja/nula inmunogenicidad | ¿Potencial patogenicidad de los vectores derivados del VIH? Integración aleatoria en el genoma del huésped Limitada capacidad para ADN exógeno (8 kb) Relativamente baja producción de virus |
| Adenovirus | Elevada eficiencia de transducción Infecta tanto células en división como quiescentes Gran capacidad de ADN en Hd-Ad (36 kb) Moderada/baja inmunogenicidad (Hd-Ad) Elevada producción de virus (primera generación) | Expresión transitoria/no integrativoElevada inmunogenicidad (vectores de primeray segunda generación)Difícil producción de virus (Hd-Ad)Toxicidad aguda con elevadas dosis sistémicas |
| Virus adenoasociados (AAV) | Gran número de serotipos con variedad de tropismo Infectan tanto células en división como quiescentes No patogenicidad descrita Elevada producción de virus | Poca capacidad de acomodar ADN exógeno (4,7 kb) Limitada efectividad cuando existen anticuerpos contra AAV Reacción inmunitaria contra las proteínas de la cápside del serotipo 1 y 2 en humanos |
| ADN plasmídico (electrotransferencia) | Baja/nula inmunogenicidad Elevada bioseguridadAusencia de límites estrictos en la capacidad de ADN Elevada eficiencia en el músculo esquelético Posibilidad de múltiples administraciones | Expresión transitoria¿Daño transitorio en el tejido transducido? |
Los vectores no virales, como los plásmidos, pueden utilizarse para introducir genes de interés en diferentes tipos celulares, pero su aplicación in vivo no ha dado muy buenos resultados, dado que la eficiencia de la entrada del plásmido dentro de la célula es muy baja16. En la actualidad se han desarrollado distintos métodos físicos (aplicación de campos eléctricos, ultrasonidos, etc.) y químicos (formación de complejos entre el plásmido y liposomas o polímeros catiónicos) que permiten incrementar la entrada del ácido nucleico en la célula (transfección). Así, la aplicación de pulsos eléctricos después de la inyección intratisular de un plásmido, conocida como electrotransferencia, es una técnica muy prometedora. Estos pulsos eléctricos desestabilizan la membrana celular permitiendo una mayor entrada del plásmido a la célula, y los genes que se encuentran en el vector pueden expresarse durante varios meses17. La naturaleza posmitótica y la longevidad de las fibras musculares permiten la expresión estable de los genes transferidos, si bien el ADN exógeno no se integra en los cromosomas (tabla 1)18,19. De entre las técnicas de transferencia de genes no virales, este método es simple, barato y seguro.
Las principales ventajas de la terapia génica no viral respecto a la viral son que permite transferir genes de gran tamaño y que prácticamente no desencadena ningún tipo de respuesta inmunitaria. Sin embargo, los protocolos aprobados para aplicación clínica utilizan mayoritariamente vectores virales, ya que, in vivo, los vectores no virales no consiguen niveles muy elevados de transferencia génica.
Estrategias actuales de terapia génica para la diabetes tipo 1La terapia celular no es el objetivo de esta revisión. No obstante, cabe destacar que en muchos casos dicha terapia puede combinarse con la terapia génica en la denominada terapia génica ex vivo para la diabetes. Así, por ejemplo, en el trasplante de islotes pancreáticos, para mejorar la supervivencia y reducir la respuesta inmunitaria contra éstos, existen varias aproximaciones de terapia génica centradas en la transferencia de genes antiapoptóticos, proangiogénicos o inmunomoduladores mediante la utilización de vectores virales o no virales20–25.
Las aproximaciones actuales de terapia génica in vivo para la diabetes se centran en la transferencia de genes exógenos a un tipo celular determinado del organismo. Las diferentes estrategias terapéuticas se pueden agrupar en cuatro grandes áreas que incluyen aspectos que van desde la prevención a la curación definitiva de la enfermedad (tabla 2):
Estrategias actuales de terapia génica para la diabetes tipo 1
| Ex vivo |
|
| In vivo |
|
En modelos animales, se han descrito un gran número de aproximaciones que tienen como objetivo reducir o eliminar la respuesta inmunitaria contra las células beta26–32. Sin embargo, actualmente es difícil que estas aproximaciones se trasladen a la clínica, ya que no existen marcadores fiables para predecir qué individuos van a desarrollar diabetes tipo 133.
Terapia génica curativaEsta estrategia pretende regenerar la masa de células beta in situ en el páncreas del paciente y, a su vez, contrarrestar la respuesta autoinmunitaria. El objetivo es incrementar la replicación de las células beta remanentes, o bien inducir la formación de nuevas células beta (neogénesis), para regenerar los islotes que han sido destruidos y conseguir que las nuevas células beta estén protegidas frente al ataque inmune. Esta aproximación supone un gran reto para la medicina regenerativa y, en caso de éxito, representaría la curación de la enfermedad.
Terapia génica sustitutivaDiferentes aproximaciones pretenden contrarrestar la hiperglucemia diabética y mantener la normoglucemia mediante el incremento de la captación de glucosa por los tejidos periféricos gracias a la expresión del gen de la insulina en tejidos extrapancreáticos. Otras aproximaciones están centradas en inducir un proceso de neogénesis de células beta en el hígado, mediante transferencia a este órgano de genes clave.
Terapia génica para las complicaciones secundariasEl objetivo es contrarrestar o retrasar la retinopatía, la nefropatía o la neuropatía diabéticas. Estas aproximaciones representan un área de investigación muy activa y, aunque la mayoría de ellas son aún experimentales34–37, existe ya algún ensayo clínico de terapia génica para la isquemia de las extremidades en pacientes diabéticos38–40.
A continuación, a modo de ejemplo, se presentan más detalladamente las aproximaciones desarrolladas en relación con la regeneración del páncreas in vivo y a la terapia génica sustitutiva.
Regeneración del páncreas endocrino: hacia una terapia curativa para la diabetesEsta estrategia pretende conseguir la regeneración de las células beta en el propio paciente y, a su vez, prevenir la respuesta autoinmunitaria contra las nuevas células beta. Ello se podría llevar a cabo mediante la transferencia de factores clave al páncreas in vivo. Sin embargo, el páncreas es un órgano difícil de manipular, ya que puede inducirse pancreatitis con mucha facilidad. Por ello, prácticamente no se han desarrollado técnicas de transferencia génica para este órgano. No obstante, en nuestro laboratorio hemos manipulado genéticamente el páncreas in vivo mediante la inyección sistémica de vectores Ad a ratones con la circulación hepática cerrada. Esta estrategia permite transferir genes de interés eficientemente a las células beta pancreáticas y en menor extensión a células acinares41. También se ha conseguido expresar con gran eficiencia genes de interés en el páncreas endocrino y exocrino mediante la utilización de vectores AAV42,43 y LV44. Sin embargo, todos estos estudios se han llevado a cabo en ratones, cuya estructura del páncreas difiere considerablemente de la humana. El páncreas del perro, en cambio, presenta un tamaño, una vascularización y una estructura muy similares al humano. En nuestro laboratorio hemos demostrado que la manipulación genética del páncreas de perro es posible mediante la utilización de vectores Ad45. Dado que existen modelos de diabetes experimental en perros46, la transferencia génica a páncreas de estos animales permitirá, en un futuro, el ensayo de nuevas estrategias de terapia génica regenerativa para la diabetes.
Utilizando herramientas para la transferencia génica es posible expresar factores involucrados en la diferenciación, mantenimiento y función de las células beta directamente en el páncreas. Mediante la utilización de vectores AAV se ha demostrado que la expresión específica de interleucina 4 en las células beta pancreáticas protege a éstas del ataque autoinmune en ratones NOD47. Además de proteger las células beta, se puede incrementar la replicación de estas células en ratones diabéticos transfiriendo el gen GLP-1 utilizando vectores AAV48. Otra aproximación es la formación de células beta a partir de otros tipos celulares gracias a la expresión de una combinación de factores de transcripción importantes para el proceso de diferenciación de las células beta. Así, mediante la transferencia de los genes Pdx-1, Ngn-3 y MafA se ha conseguido la formación de células productoras de insulina a partir de células exocrinas49. Otro de los genes candidatos para la regeneración del páncreas endocrino podría ser el IGF-I, ya que hemos observado que la expresión de este factor específicamente en las células beta de ratones transgénicos contrarresta la hiperglucemia diabética y regenera la masa de células beta en el páncreas50. Además, la expresión de IGF-I en las células beta previene el ataque autoinmune contra estas células en un modelo animal transgénico51.
Estos primeros estudios indican que mediante la combinación de genes «terapéuticos» clave, vectores más eficientes y vías de administración más específicas se podrá conseguir regenerar el páncreas en un futuro.
Terapia génica sustitutiva para la diabetes: manipulación genética de tejidos extrapancreáticosLa terapia sustitutiva con insulina exógena no garantiza la normoglucemia. Por tanto, es de gran interés desarrollar nuevas terapias que permitan una regulación eficiente de la homeostasis de la glucosa. Ello ha llevado al desarrollo de aproximaciones de terapia génica centradas en la expresión de genes clave en tejidos periféricos para incrementar la captación de glucosa y mantener la normoglucemia.
Manipulación del hígadoEl hígado fue el primer tejido extrapancreático manipulado genéticamente para producir insulina. En ratones transgénicos demostramos que la expresión del gen de la insulina bajo el control del promotor de la fosfoenolpiruvato carboxicinasa (que se activa durante el proceso diabético) contrarrestaba las alteraciones diabéticas a nivel hepático y reducía parcialmente la hiperglucemia52. Desde entonces, la mayoría de aproximaciones de terapia génica para expresar insulina extrapancreáticamente han utilizado el hígado como órgano diana53–55. En la mayoría de los estudios, la expresión del gen de la insulina es regulada mediante el uso de promotores sensibles a los niveles circulantes de glucosa, como el de la piruvatocinasa53. Sin embargo, la respuesta de secreción de la hormona es inadecuada, ya que el control transcripcional mediado por glucosa es demasiado lento, de manera que se prolonga la hiperglucemia después de las comidas y existe un riesgo de hipoglucemia varias horas más tarde.
Una alternativa a la introducción del gen de la insulina es conseguir diferenciar las células hepáticas a células productoras de insulina mediante la expresión de genes clave para la diferenciación de las células beta pancreáticas. Células hepáticas de ratón o de hígado fetal humano se pueden manipular in vitro hasta conseguir células productoras de insulina56. De una forma similar, la transferencia mediante vectores virales de genes involucrados en la diferenciación de células beta (Pdx-1, NeuroD, Ngn3) a hígado de ratones puede llevar a la formación de células productoras de insulina en este tejido57–59.
Manipulación del músculo esqueléticoTras una comida, el músculo esquelético es el tejido más importante del organismo en la eliminación de glucosa de la sangre, captando aproximadamente un 70% del total. Además, el músculo esquelético es un excelente candidato para la terapia génica de la diabetes por su fácil accesibilidad y su capacidad de secretar proteínas.
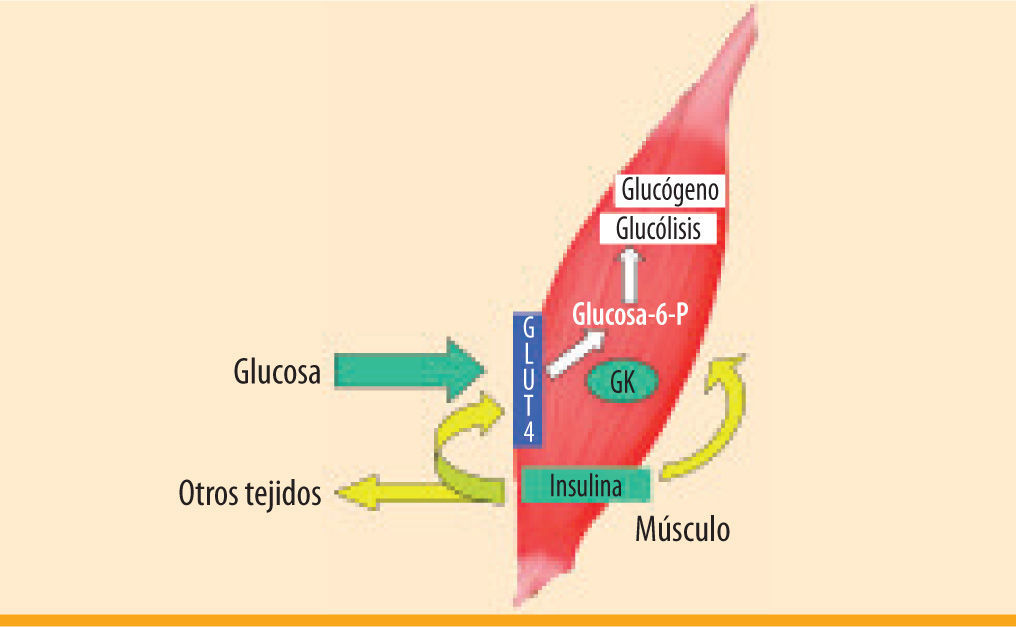
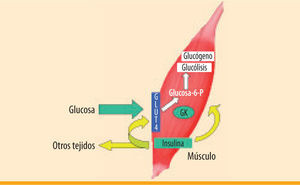
En nuestro laboratorio hemos estudiado la capacidad del músculo esquelético manipulado genéticamente para incrementar la captación de glucosa y contrarrestar la hiperglucemia diabética. Este objetivo se puede conseguir mediante la generación de un «sensor de la glucosa» como resultado de la coexpresión del gen de la insulina y el de la glucocinasa (GK). La GK es una enzima hepática con una elevada Km (constante de Michaeelis-Menten) para la glucosa (alrededor de 8 mM), que no es inhibida por la glucosa-6-fosfato y además muestra una cinética de cooperación con la glucosa60. Estas características permiten captar la glucosa sólo cuando ésta se encuentra en elevadas concentraciones, tal como se ha descrito en las células beta pancreáticas61. Estudios en nuestro laboratorio en animales transgénicos han mostrado que la expresión de niveles basales de insulina en el músculo esquelético incrementa la captación de glucosa, manteniendo la normoglucemia en ayunas62. También hemos observado que la expresión de GK en el músculo esquelético de ratones diabéticos, junto con la inyección subcutánea de dosis bajas de insulina soluble, lleva a la normalización de la glucemia63.
Recientemente hemos demostrado que la expresión de insulina conjuntamente con GK en el músculo esquelético de ratones diabéticos mediante vectores adenoasociados de serotipo 1 (AAV1) lleva a la completa normalización de la glucemia tanto en condiciones de alimentación como en ayunas, sin causar la aparición de hipoglucemia64 (figura 1). Estos animales también muestran un incremento en la captación de glucosa por el músculo, en la normalización del metabolismo glucídico hepático y en la tolerancia a la glucosa. Estos resultados indican que la secreción basal de insulina, junto con el incremento de la captación de glucosa por parte del músculo esquelético, permite una regulación fina de la glucemia en animales diabéticos64. Después de demostrar la eficacia de esta aproximación en ratones diabéticos, hemos iniciado un estudio en perros diabéticos para determinar los efectos a largo plazo, la seguridad y la viabilidad de esta aproximación como un paso previo para el desarrollo de un futuro ensayo clínico en pacientes diabéticos.
Generación de un sensor de la glucosa en el músculo esquelético mediante la expresión de insulina y glucocinasa. Durante la diabetes el músculo esquelético puede manipularse genéticamente para producir niveles reducidos de insulina de forma constitutiva. Así, se mantiene la presencia de GLUT4 en la membrana plasmática y la expresión de hexocinasa-II, manteniendo la normoglucemia durante el ayuno. La coexpresión de la enzima hepática glucocinasa (GK) incrementaría la fosforilación y utilización de la glucosa, conduciendo a una normalización de la glucemia también en condiciones de alimentación. La GK posee una elevada Km para la glucosa, y actuaría como un sensor de la glucosa evitando episodios de hipoglucemia, ya que la captación de glucosa sólo ocurriría durante la hiperglucemia
Las diferentes aproximaciones de terapia génica para la diabetes aquí descritas representan un área de investigación muy activa y prometedora. No obstante, las estrategias son aún experimentales y su aplicación en clínica parece lejana. Además, previamente a cualquier protocolo clínico, se deberá demostrar la eficacia y seguridad a largo plazo en modelos animales diabéticos.
- •
Los elementos clave que es preciso considerar en toda estrategia de terapia génica son el gen terapéutico, el vector de transferencia, el tipo celular que se va a manipular y la vía de administración del vector.
- •
Los vectores integrativos permiten la transferencia del gen terapéutico a las células hijas y comprenden los vectores retrovirales y lentivirales. Los vectores no integrativos mantienen el gen terapéutico a nivel episomal y comprenden los vectores adenovirales y adenoasociados.
- •
Las estrategias de terapia génica para la diabetes tipo 1 pueden ser de tipo preventivo, con la idea de reducir o eliminar la respuesta inmunitaria; de tipo curativo, para intentar regenerar la masa de célula beta; de tipo sustitutivo, para inducir la expresión de insulina en tejidos extrapancreáticos (hígado o músculo esquelético) y, por último, para el tratamiento de las complicaciones secundarias.
Una importante limitación en el proceso es la falta de buenos modelos diabéticos en grandes animales (perros, primates), en los que generalmente se utiliza un tratamiento combinado de estreptozotocina y aloxán46. Además, es necesario incrementar la eficacia de la transferencia génica, mejorando los vectores tanto virales como no virales. La introducción de nuevos y mejores mecanismos reguladores para controlar la expresión de la insulina y de otros genes terapéuticos será también de gran importancia.
Finalmente, además de tratar la diabetes tipo 1, en estos últimos años se está progresando significativamente en el conocimiento de los mecanismos que llevan a la resistencia a la insulina, al fallo de las células beta y al desarrollo de diabetes tipo 2. Por ello, se espera también poder poner en marcha nuevas aproximaciones de terapia génica para esta enfermedad.
Así pues, estudios preclínicos en modelos animales sugieren que un día, mediante la terapia génica, muy probablemente podrán curarse la diabetes y sus complicaciones secundarias. No obstante, aún queda un largo camino que recorrer.
AgradecimientosEl trabajo realizado en el laboratorio de los autores ha sido financiado por proyectos del Plan Nacional I+D+I (SAF2005-01262 y SAF2008-00962), el Instituto de Salud Carlos III (PI061417) y el Centro de Investigación Biomédica en Red en Diabetes y Enfermedades Metabólicas asociadas (CIBERDEM), en España, y por fondos de la Unión Europea (EUGENE2 [LSHMCT-2004-512013], BetaCellTherapy [LSHB-CT-2005-512145] y CLINIGENE [LSHB-CT-2006-018933]).
Declaración de potenciales conflictos de interesesE. Ayuso, C. Mann, X. Anguela y F. Bosch declaran que no existen conflictos de intereses en relación con el contenido del presente artículo.