La estenosis aórtica es la causa más común de enfermedad valvular en EE. UU. y Europa. En la actualidad el reemplazo valvular quirúrgico es el tratamiento de elección para los pacientes con estenosis aórtica grave, sin embargo, el implante valvular aórtico percutáneo permite el tratamiento de la estenosis aórtica de una manera menos invasiva en pacientes de riesgo elevado o no candidatos a cirugía. Dado que en el implante percutáneo no hay una visualización directa del campo quirúrgico, es necesario evaluar con precisión la anatomía vascular de manera preoperatoria. Por lo tanto, para mejorar los resultados y evitar las complicaciones, la tomografía multidetector se considera parte del estudio rutinario de estos pacientes, ya que la información que se obtiene de la aorta y arterias iliacas permite al médico una planeación precisa antes de la intervención. En esta revisión describimos los aspectos básicos del procedimiento y la importancia clínica de la tomografía multidetector.
Aortic stenosis is the most common valvular disorder in the United States and Europe. Nowadays, surgical aortic valve replacement remains the standard treatment for patients with severe aortic stenosis; however, transcatheter aortic valve implantation represents a less invasive treatment option for aortic stenosis patients considered as high-risk or not suitable for surgical management. Because of the lack of direct visualization of the operative field in transcatheter aortic valve implantation, there is an increased need for precise pre-operative assessment of vascular anatomy. Therefore, in order to improve outcome and avoid complications, multidetector tomography is part of the routine evaluation of patients considered for this treatment. The data obtained covering the aorta and iliac arteries, allows the physician a precise planning prior to the intervention. In this review, we described basic aspects of the procedure, and the clinical relevance of the multidetector tomography.
La estenosis aórtica (EA) es la causa más común de enfermedad valvular en EE. UU. y Europa, y su principal causa es la calcificación de la válvula aórtica nativa, generalmente en personas de edad avanzada (>75 años), o secundaria a la degeneración de una válvula aórtica bicúspide que ocurre en personas de menor edad; otras posibles etiologías incluyen la enfermedad valvular reumática la cual tiene una mayor prevalencia en países no desarrollados1. En México se desconoce la prevalencia de la EA.
Los pacientes con EA se mantienen asintomáticos hasta llegar a estadios avanzados de la enfermedad y cuando los síntomas se presentan el pronóstico suele ser desfavorable, con una supervivencia de 2 años en pacientes con insuficiencia cardiaca, de 3 años en aquellos con síncope y de 5 años en los que se presentan con angina. En los pacientes de edad avanzada con alto riesgo quirúrgico y por tanto tratados médicamente, la mortalidad a un año es del 50%2. En la actualidad el reemplazo valvular quirúrgico es el tratamiento de elección para los pacientes en quienes se demuestra EA grave3,4. Sin embargo, dado que un porcentaje considerable de enfermos son octogenarios, con riesgo cardiovascular elevado y con un gran número de comorbilidades (función sistólica ventricular disminuida, enfermedad arterial coronaria, enfermedad arterial periférica, enfermedad pulmonar obstructiva crónica, diabetes e insuficiencia renal crónica, entre otras) no son considerados candidatos para reemplazo valvular quirúrgico5,6. Por tal motivo, desde hace una década se ha implementado una nueva técnica que permite el tratamiento de la EA de una manera menos invasiva. Esta modalidad terapéutica es el implante valvular aórtico percutáneo (TAVI por sus siglas en inglés: transcatheter aortic valve implantation) 7. Según los informes más recientes se han implantado en el mundo cerca de 50,000 válvulas por vía percutánea, y se ha demostrado en estudios aleatorizados la factibilidad, seguridad y beneficios en mortalidad, así como las posible complicaciones a corto y largo plazo8–10. Resultados del estudio PARTNER demuestran que el grupo de pacientes tratados con TAVI tienen una disminución de la mortalidad del 20% en comparación con el manejo conservador2. En la actualidad el TAVI se ha posicionado como una novedosa modalidad terapéutica para pacientes con elevado riesgo quirúrgico y como uno de los temas de mayor interés en investigación.
Tipos de válvulasLas válvulas más utilizadas hasta el momento son: la válvula expandible con balón Edwards Sapien (Edwards Lifesciences, Irvine, California, EE. UU.) y la válvula autoexpandible CoreValve (Medtronic, Minneapolis, Minnesota, EE. UU.). La Edwards Sapien ha sido aceptada para su uso clínico en Europa y EE. UU., mientras que la CoreValve aún no tiene autorización para su uso clínico en este último; en México se han realizado los primeros implantes de ambas válvulas.
Estructura valvular, vía de acceso y fijación aórticaLa estructura básica de estas válvulas consiste en un anillo metálico cubierto en su exterior por material sintético, en el que encuentra montada una válvula biológica de pericardio. La válvula Edwards Sapien puede ser implantada de forma percutánea desde la vía femoral o quirúrgicamente desde el ápex o la aorta ascendente; la válvula CoreValve puede ser colocada por vía femoral o subclavia. Un aspecto importante para su colocación es la dimensión de los introductores necesarios para la vía percutánea, pues la Edwards Sapien utiliza introductores de 16 a 19F de diámetro y la CoreValve de 18F. Dichas válvulas presentan diferencias no solo en la estructura, sino también en la manera en que son colocadas y en su sitio de fijación; la Edwards Sapien debe ser colocada bajo estimulación ventricular rápida para disminuir transitoriamente el gasto cardiaco mientras es expandida, la CoreValve no lo requiere. Con respecto al sitio de fijación, la válvula Edwards Sapien es fijada en el anillo y plano valvular, mientras que la CoreValve es fijada en el anillo, plano valvular y la aorta ascendente (tabla 1)8,9.
Diferencias en características estructurales valvulares y sitio de fijación
| Edwards Sapien | Medtronic CoreValve | |
|---|---|---|
| Estructura metálica | Acero inoxidable | Nitinol (níquel-titanio) |
| Tipo de pericardio | Bovino | Porcino |
| Dimensiones del dispositivo (mm) | 2326 | 262931 |
| Diámetro del introductor (F) | 2224 | 18 |
| Longitud del dispositivo (mm) | 14-16 | 53-55 |
| Expansión | Con balón | Autoexpandible |
| Fijación anular | Sí | Sí |
| Fijación en aorta ascendente | No | Sí |
Existen diferencias en las limitantes y posibles complicaciones observadas hasta el momento con ambas válvulas, lo anterior principalmente relacionado con la estructura con que han sido diseñadas. El bloqueo auriculoventricular es una de las complicaciones frecuentes después del procedimiento; en registros como el FRANCE 2 Investigators y el UK TAVI10,11 el 15.6% y el 16.3% de los pacientes respectivamente requirió la colocación de un marcapasos definitivo; en estos como en otros registros, la necesidad de marcapasos ha sido más común al emplear la válvula CoreValve (Sapien 7.4-11.5% vs. CoveValve 24.2-24.4%), asociado probablemente a la mayor longitud de la prótesis, ya que su sistema de fijación se extiende hasta la vía de salida del ventrículo izquierdo, lo que genera compresión del sistema de conducción en el septum. La obstrucción coronaria es una complicación muy grave pero poco frecuente y se ha observado con mayor frecuencia con el uso de la válvula Edwards Sapien.
Evaluación previa al procedimientoUno de los aspectos más importantes para llevar a cabo este procedimiento es la evaluación multidisciplinaria de cada caso en particular con el objetivo de valorar detenidamente el riesgo-beneficio de cualquier procedimiento, de tal forma que se pueda ofrecer al paciente el más apropiado para su condición clínica. Esta evaluación debe ser realizada por un equipo de médicos con experiencia en este procedimiento, en el que se incluyan diferentes especialistas como cardiólogos clínicos, intervencionistas, cirujanos, anestesiólogos y especialistas en imagen cardiovascular12.
Cabe mencionar que una de las limitantes del TAVI es que el operador no tiene visión directa del campo quirúrgico y gran parte de las decisiones tomadas antes, durante y después del procedimiento dependen de la información obtenida por los diferentes métodos de imagen cardiovascular. Es aquí donde la tomografía multidetector (TM) tiene un papel muy importante, ya que permite obtener una gran cantidad de información en un solo estudio; como limitante, la TM no puede emplearse durante el implante, a diferencias de otras técnicas como el ecocardiograma bi- o tridimensional.
La importancia de la tomografía multidetector en la adecuada selección de pacientes para implante valvular aórtico percutáneoLa evaluación inicial así como la determinación de la severidad y la repercusión hemodinámica de la estenosis aórtica se realizan de manera rutinaria mediante la ecocardiografía bidimensional. Es en este método en el que se basaron los primeros procedimientos de TAVI; sin embargo, en la actualidad es necesaria una evaluación más amplia de la estructura cardiovascular previa al procedimiento. A este respecto, la TM se ha posicionado como un método sumamente completo para responder a las preguntas relevantes antes de realizar un TAVI con la mayor seguridad posible.
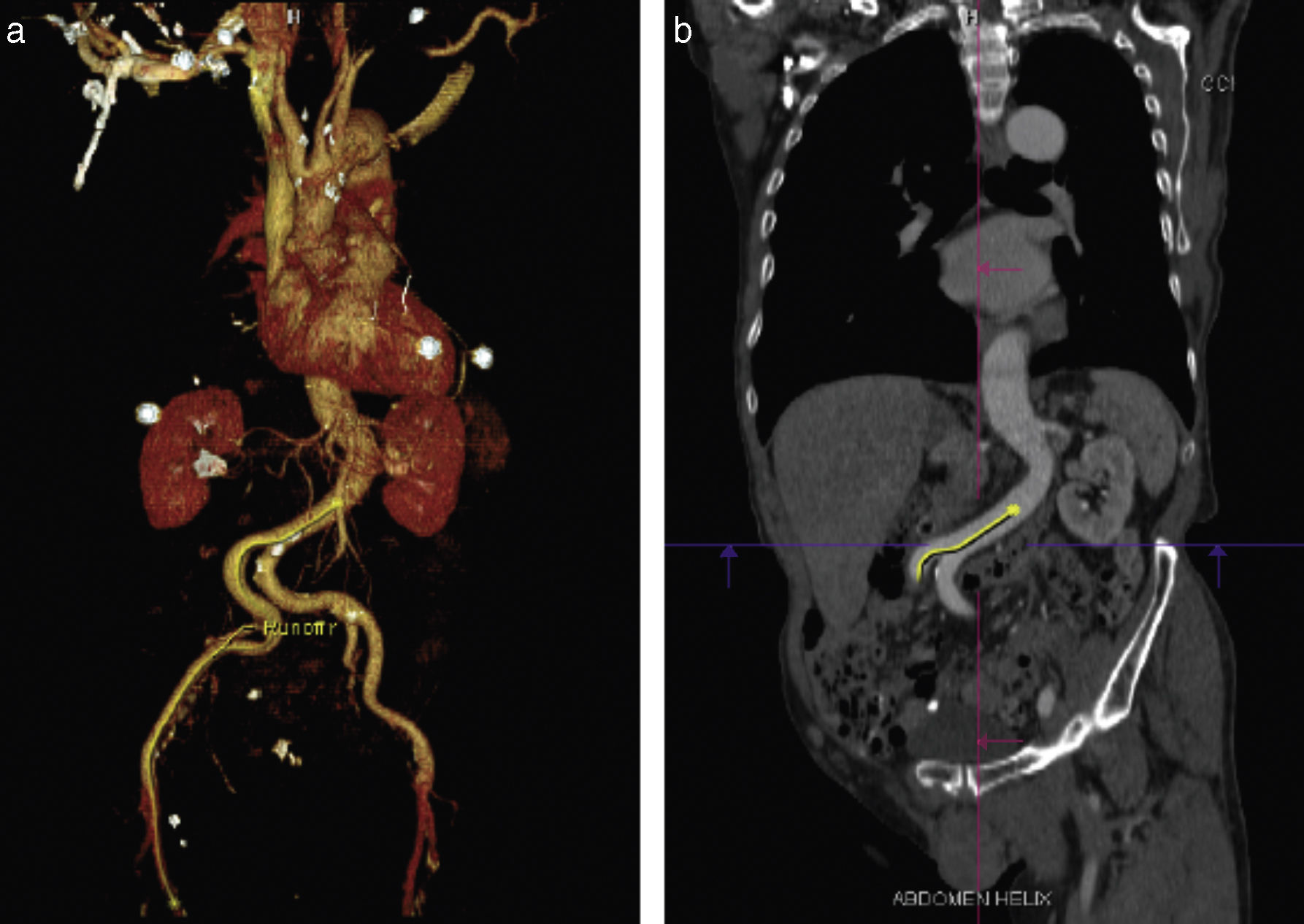
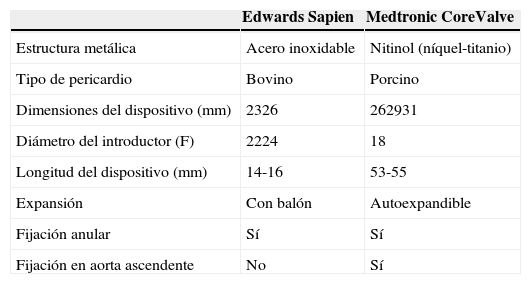
Adquisición de las imágenesLos protocolos para adquirir las imágenes pueden variar dependiendo de la experiencia local y del equipo disponible. Se recomienda utilizar un tomógrafo de por lo menos 64 detectores. El estudio debe de incluir toda la aorta y las arterias iliacas, femorales y subclavias. Por la movilidad de la válvula, raíz y aorta ascendente, se debe adquirir una secuencia sincronizada con electrocardiograma con el fin de disminuir los artefactos de movimiento y asegurar la exactitud de las medidas obtenidas. La adquisición del resto de la aorta e iliacas puede realizarse con un estudio sin sincronización electrocardiográfica (fig. 1)9.
La dosis de radiación en tomografía es sin duda uno de los aspectos que actualmente requieren mayor vigilancia; sin embargo, en la población estudiada para TAVI la dosis de radiación no es una limitante, ya que estos pacientes son de edad avanzada en su mayoría y los efectos adversos por radiación no son significativos, ya que generalmente, estos ocurren a largo plazo. Por otra parte, uno de los aspectos críticos en el momento de realizar un TAVI es la administración de medio de contraste, por lo que siempre deberá considerarse el riesgo-beneficio antes de hacer un estudio contrastado. En caso de que exista una contraindicación para la administración del material de contraste, un estudio simple puede ofrecer información valiosa sobre el diámetro de las estructuras, trayectos, tortuosidad y calcificación9.
Medición y características del anillo aórticoLa adecuada caracterización del anillo aórtico (AA) es un aspecto crucial en el momento de planear la colocación de una válvula percutánea, ya que una inadecuada evaluación de las características del AA puede asociarse a complicaciones graves como rotura de dicho anillo o migración valvular y más comúnmente con regurgitación paravalvular, la cual es un importante predictor de mal pronóstico a largo plazo, aun cuando sea de pequeña magnitud10–15.
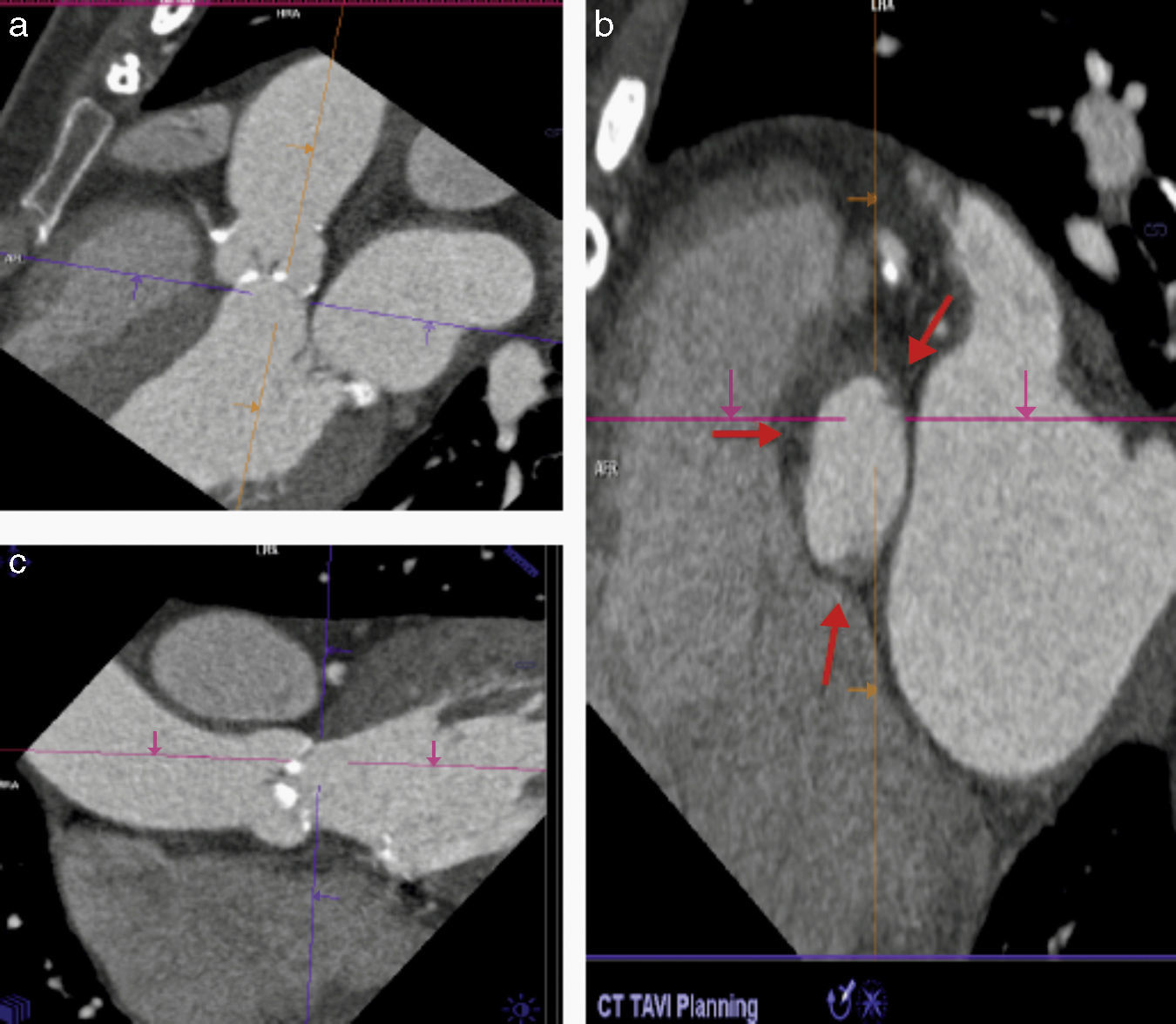
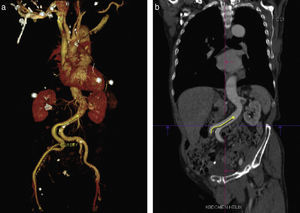
La elección del tamaño adecuado de la prótesis se realiza en función de la medición no invasiva del AA. En estudios iniciales esta medida se realizaba utilizando el ecocardiograma transtorácico, sin embargo se ha observado que los métodos bidimensionales suelen subestimar la dimensión del AA ya que se asume una estructura circular del anillo16, lo cual influye en el desarrollo de regurgitación valvular pos-TAVI si se selecciona una prótesis de menor dimensión17,18. El AA es una estructura elíptica la mayoría de las veces y es por ello que las técnicas de imagen que permiten realizar una reconstrucción multidimensional pueden determinar con mayor precisión sus diámetros reales (fig. 2)19,20.
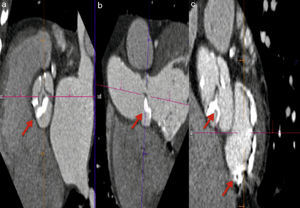
Método propuesto para la medición correcta del anillo aórtico. a) Se identifica el plano justo por debajo de la inserción de las valvas (línea morada). b) Asegurarse de que las 3 comisuras se encuentren en el mismo plano (las flechas indican la inserción de las comisuras). c) Lo propuesto en b) se obtiene orientando la imagen en diferentes proyecciones (sagital, coronal y axial).
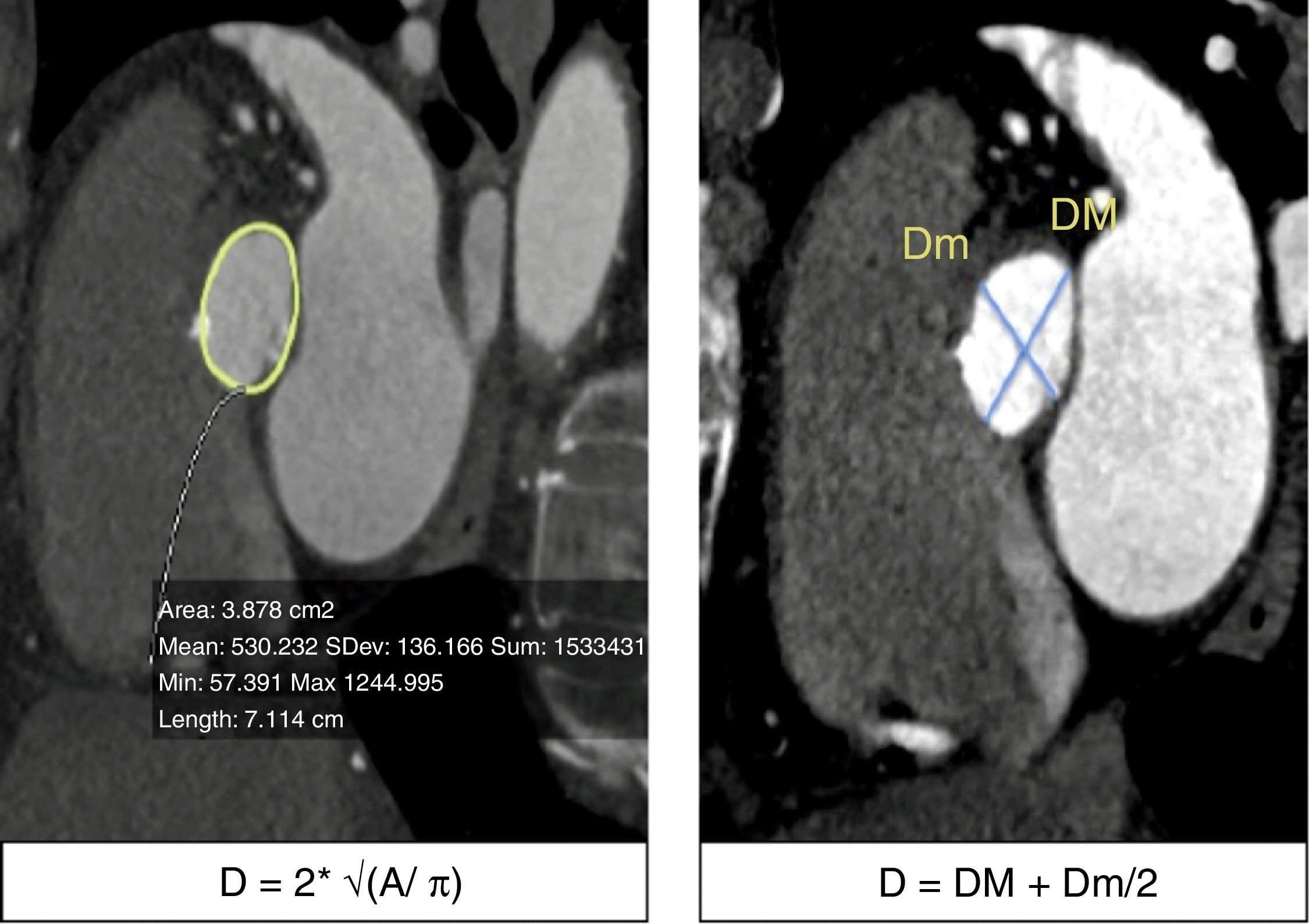
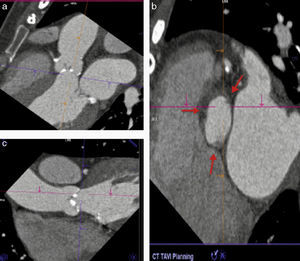
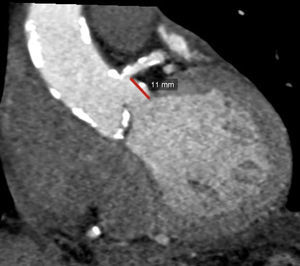
La TM ha demostrado tener un excelente desempeño al medir las dimensiones del AA con una buena correlación inter- e intraobservador, además, ha demostrado que los resultados de estas mediciones modifican el tamaño de las válvulas seleccionadas por ecocardiograma en aproximadamente un 40% de los pacientes20,21. Las medidas que han demostrado tener mejor exactitud para medir el AA son el promedio de la máxima y mínima dimensión del anillo y el diámetro calculado a partir del área del anillo (fig. 3)22–24.
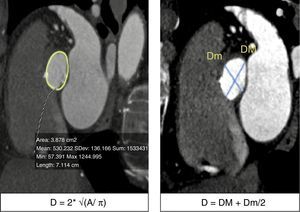
a) Trazo del área del anillo aórtico y ecuación para calcular el diámetro del anillo: se realiza una raíz cuadrada del área medida (elipse trazada con línea amarilla) dividida entre 3.1416, este resultado se multiplica por 2 para obtener el diámetro del anillo. b) Medición del diámetro mayor (DM) y menor del anillo (Dm); se suman estas 2 determinaciones y se dividen entre 2 para obtener el diámetro promedio.
Un aspecto importante es la determinación del calcio a nivel valvular y del anillo y su relación con la insuficiencia aórtica pos-TAVI25,26; en estudios preliminares se ha encontrado una asociación significativa entre una calcificación mayor de 2,000UA (unidades Agatston) medida por una escala (score) de calcio en la zona de implantación y la presencia de regurgitación aórtica pos-TAVI27–29. La calcificación extensa en el sitio de implantación también se ha asociado con rotura del anillo y una mayor necesidad de marcapasos posprocedimiento30,31, insuflación con balón poscolocación de la prótesis32, migración del dispositivo33,34 y oclusión del origen coronario por desplazamiento de placa2. Por todo lo anterior, la TM es realizada de manera rutinaria para medir las dimensiones y analizar las características del AA antes de colocar una prótesis percutánea (fig. 4).
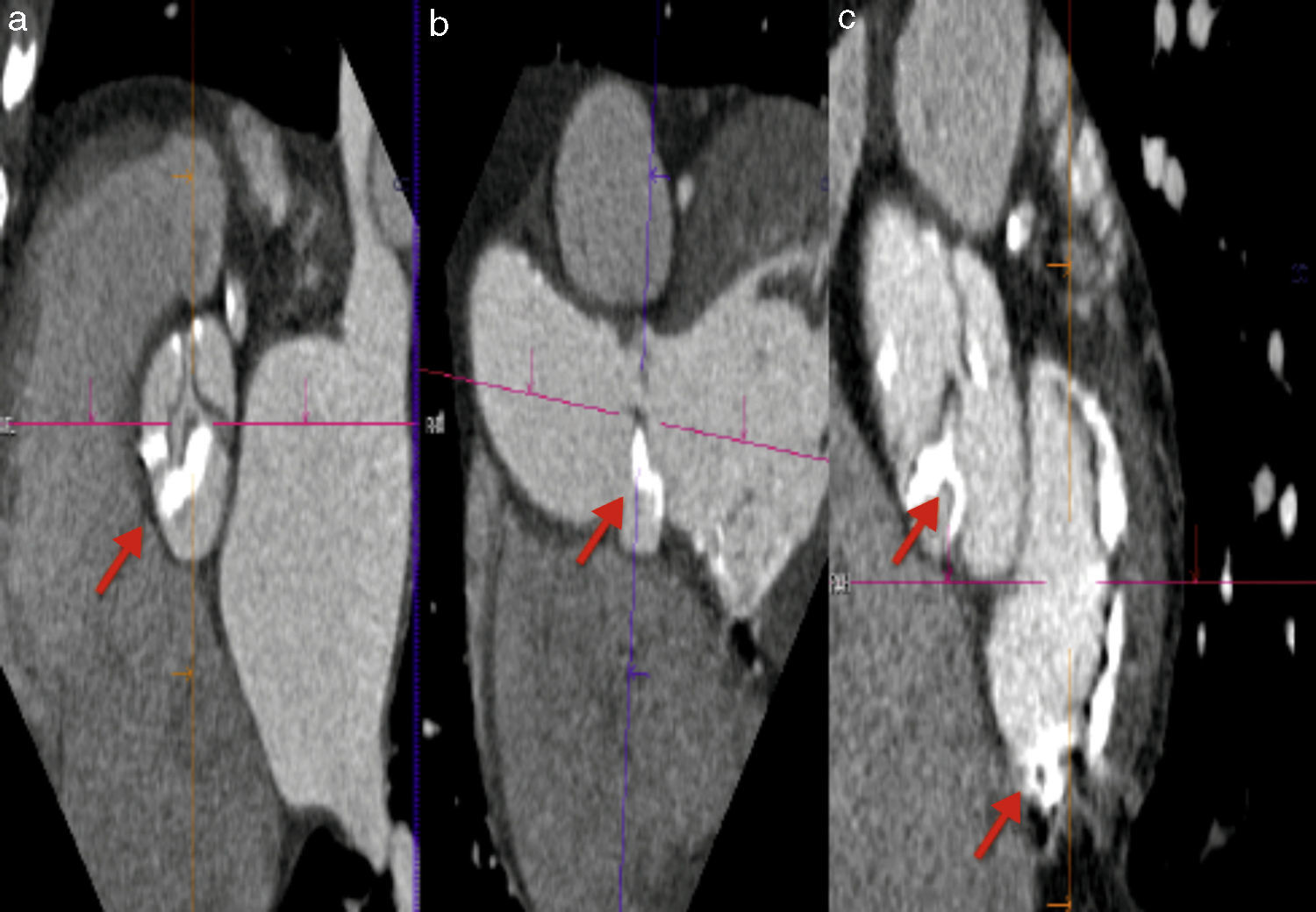
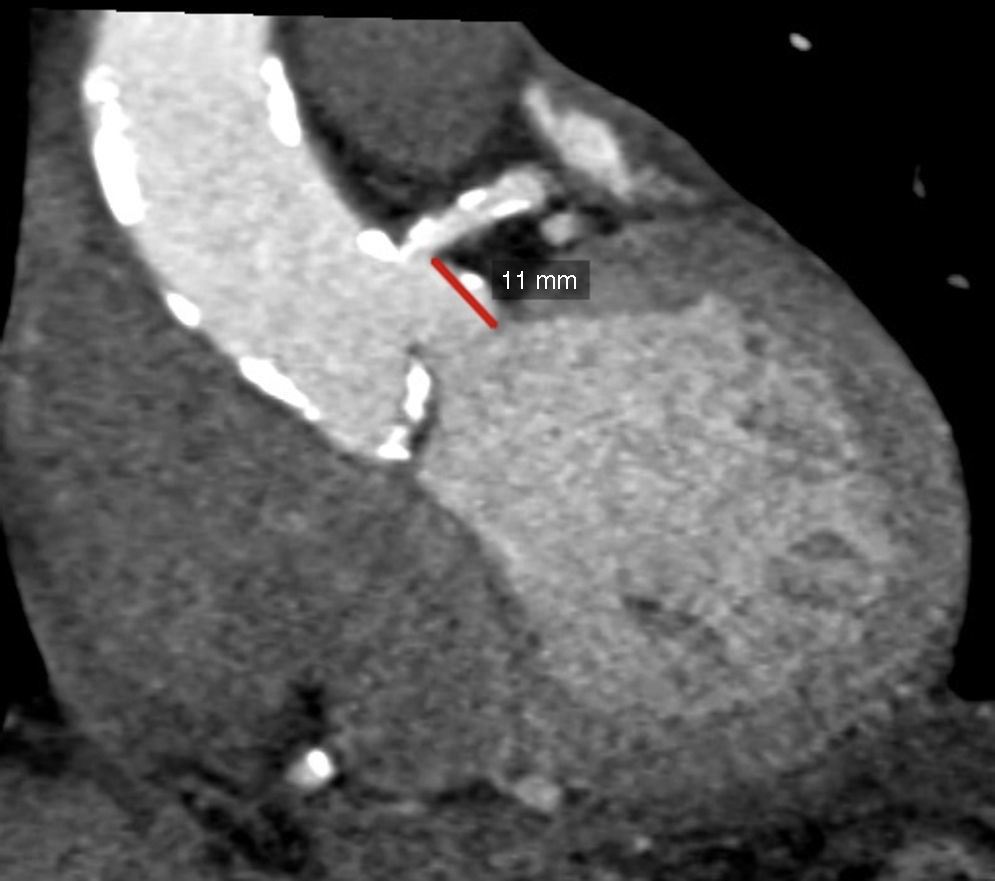
Distancia del plano valvular al origen coronario, evaluación de raíz aórtica y aorta ascendenteUna complicación grave pero infrecuente durante la colocación de una prótesis percutánea es la oclusión del tronco coronario izquierdo (TCI)10,32; en el caso de una implantación valvular «alta» existe el riesgo de que la prótesis se desplace y ocluya el origen coronario. De igual forma, si la distancia del plano valvular al origen del TCI es corta, el anillo de la prótesis implantada o una cúspide izquierda redundante pueden ocluir el origen del TCI. En este sentido la TM es considerada actualmente el estándar de referencia para medir la distancia del AA al origen del TCI, esto mediante una reconstrucción tridimensional de la vía de salida del ventrículo izquierdo y la raíz aórtica (fig. 5). Una distancia AA-TCI menor a 10mm incrementa el riesgo de oclusión coronaria35–37. La TM se considera también como el estándar de referencia para medir la simetría y tamaño de las valvas de la aorta.
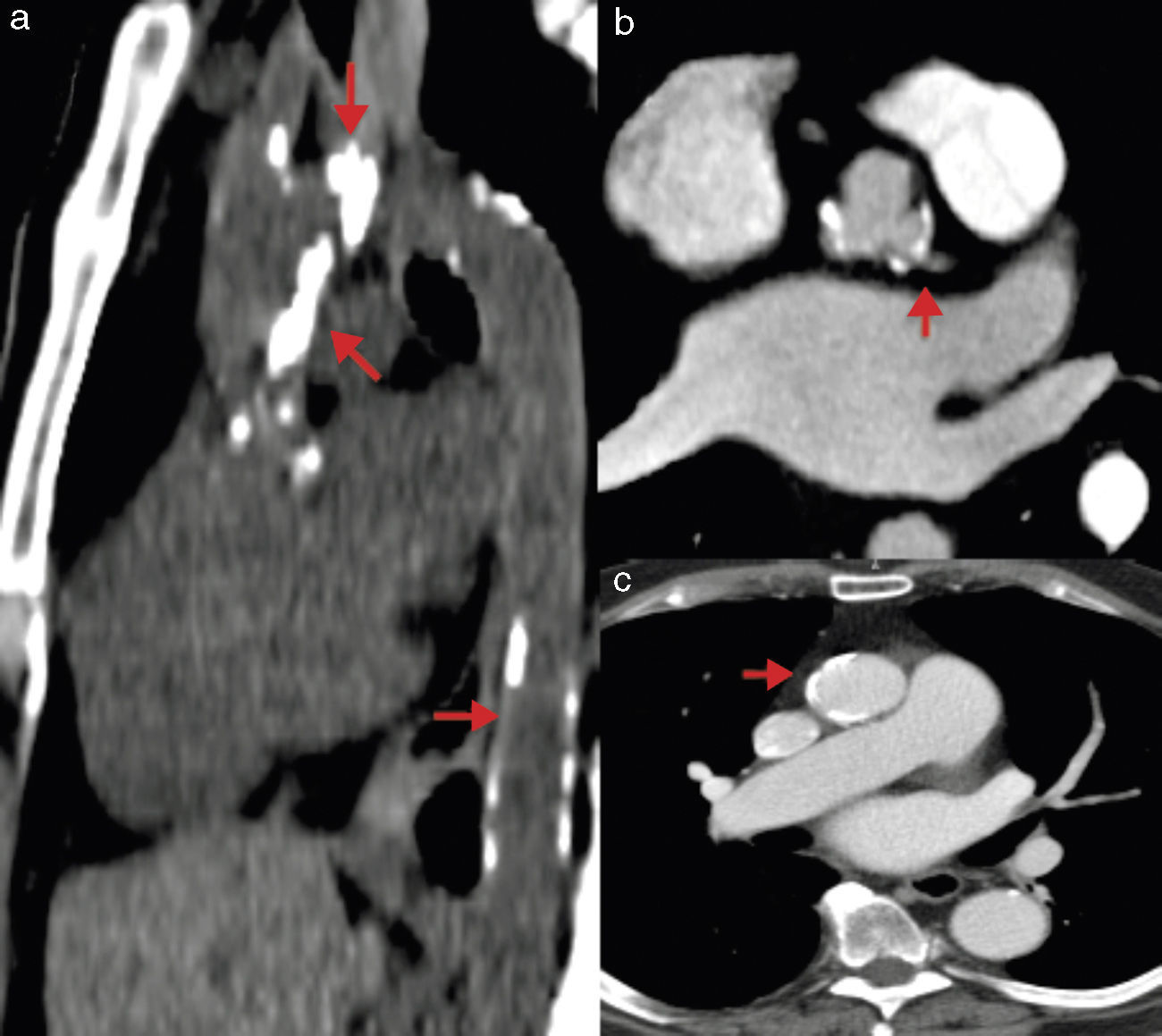
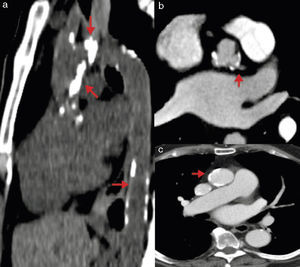
Mediante la TM se puede realizar una medición adecuada de las dimensiones vasculares en una reconstrucción tridimensional o curviplanar de los senos de Valsalva, unión sinotubular y aorta ascendente. Se consideran como dimensiones adecuadas menos de 27mm en senos de Valsalva y menos de 43mm en la aorta ascendente; la presencia de aneurisma o disección aórtica contraindica el procedimiento. Estas dimensiones son muy importantes sobre todo cuando se planea implantar una válvula CoreValve, ya que esta es fijada en la aorta ascendente. Otra ventaja de la TM es la posibilidad de evaluar el grado de placa aterosclerosa y calcificación aórtica, ya que ambas se asocian a posibles complicaciones por embolismo sistémico (principalmente cerebral), además de contraindicarse el acceso quirúrgico a través de la aorta ascendente si la calcificación es extensa (fig. 6)38.
Calcificación en aorta. a) Tomografía sin contraste en la que se observan zonas extensas de calcificación en aorta ascendente, cayado y aorta descendente. b) Angiotomografía contrastada con placa calcificada cercana al origen del tronco de la coronaria izquierda. c) Angiotomografía contrastada con calcificación en aorta ascendente.
La adecuada colocación de la prótesis requiere la orientación coaxial de la misma con el plano valvular nativo. Esta orientación se realizaba previamente de manera rutinaria con 2-3 aortogramas antes de iniciar la colocación de la prótesis, identificando la posición en la que la válvula se encuentra perpendicular al plano valvular. Esta orientación del plano valvular se puede realizar con la TM previa al estudio, mediante reconstrucciones multiplanares dobles oblicuas para localizar la proyección oblicua anterior derecha, oblicua anterior izquierda, con diferente grado de angulación caudal o craneal. Esta determinación ha demostrado: correlacionar adecuadamente con las medidas por angiografía convencional39,40, disminuir el tiempo del procedimiento, reducir la cantidad de medio de contraste utilizado y potencialmente asegurar una adecuada angulación de la prótesis41.
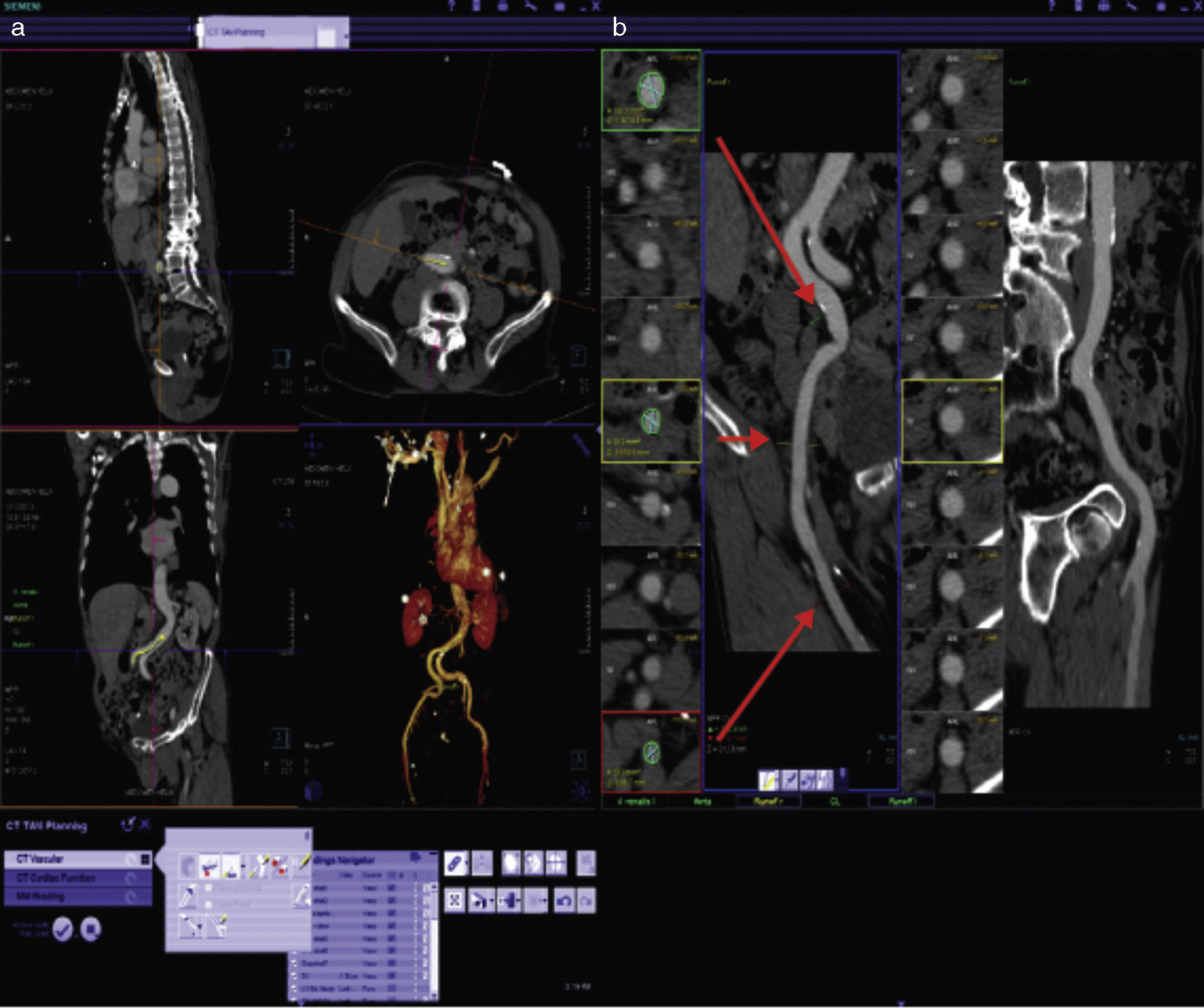
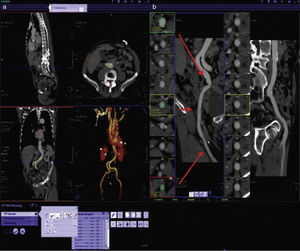
Evaluación de la vía de accesoSin duda una de las aportaciones más importantes de la TM es la de permitir la evaluación de las características de todos los posibles sitios de inserción antes del procedimiento con una alta eficacia y en un solo estudio (fig. 7).
a) Imagen representativa de la reconstrucción tridimensional de las imágenes en una estación de trabajo dedicada al análisis de los estudios previos al TAVI. b) Reconstrucción centrolineal (centerline reconstruction) que permite realizar mediciones exactas en diferentes segmentos de las estructuras vasculares. Las flechas rojas señalan los sitios en que se realizan mediciones de diámetros y áreas vasculares.
Vía femoral. La vía femoral es la más comúnmente empleada para la implantación protésica percutánea. En los estudios iniciales se identificó una alta frecuencia de complicaciones asociadas al sitio de inserción, estas complicaciones incrementan la morbimortalidad de los pacientes. Los factores que se han asociado a un mayor número de complicaciones en el sitio de inserción son: diámetro iliofemoral pequeño (en relación con el diámetro externo del introductor), calcificación arterial moderada a grave, tortuosidad de los vasos y enfermedad arterial periférica42,43.
La calcificación iliofemoral se ha identificado como un factor que incrementa la frecuencia de complicaciones vasculares. El índice entre el diámetro externo del introductor y el diámetro mayor de la arteria femoral ayuda a predecir complicaciones a 30 días y su punto de corte es>1.05 (1.10 si no hay calcificaciones y 1 si hay calcificación iliofemoral)44.
En presencia de alguno de los factores asociados a complicaciones vasculares, se recomienda utilizar un abordaje diferente, ya que disminuye la morbimortalidad del procedimiento45. Se espera que con el desarrollo de introductores de menor calibre y material más flexible disminuya la frecuencia de complicaciones.
Abordaje apical, aorta ascendente y subclavia: el abordaje apical se utiliza para implantar de manera anterógrada la válvula Edwards Sapien en aquellos pacientes con riesgo elevado de complicaciones vasculares iliofemorales46,47. En este caso la TM es de gran ayuda al poder medir directamente la distancia del tórax al ápex del ventrículo izquierdo, descartar la presencia de trombos intracavitarios, orientar sobre la angulación para avanzar el dispositivo, además de poder realizar las mediciones habituales del anillo, raíz y aorta ascendente. Para el abordaje por la subclavia se pueden hacer las mediciones del diámetro arterial48. En el abordaje de aorta ascendente se puede identificar el diámetro aórtico y placas calcificadas en la aorta ascendente, además de poder identificar cambios posquirúrgicos a nivel mediastínico y localizar hemoductos para prevenir complicaciones.
ConclusiónLa TM se ha posicionado como una herramienta diagnóstica importante en la evaluación de los pacientes que son tratados con TAVI. Su principal ventaja es la posibilidad de obtener una gran cantidad de información relevante antes del procedimiento, lo que influye directamente en las decisiones tomadas por el equipo médico. Lo anterior permite ofrecer una mayor seguridad al paciente y potencialmente un mejor resultado en la implantación de la prótesis.
Por estas características, la TM ha sido incluida como parte del estudio rutinario en los centros de referencia para el tratamiento con TAVI. En España se han informado los resultados del registro nacional de más de 1,400 pacientes tratados con TAVI y en México se incrementa constantemente el número de procedimientos realizados49. Es por esto que los médicos (cardiólogos, intensivistas, cirujanos, intervencionistas, etc.) que participen en el manejo de pacientes con EA deberán conocer los aspectos relacionados con la adecuada selección de los pacientes para lograr los mejores resultados posibles. La importancia de la TM está bien demostrada en la actualidad, sin embargo mientras las técnicas de tratamiento de enfermedades como la EA evolucionen, también los métodos de diagnóstico continuarán su evolución50.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Adriana Elizabeth Monsiváis Urenda por la revisión crítica de este artículo.