El compromiso de la vena cava inferior por un trombo tumoral secundario a neoplasias adrenales o renales es una complicación frecuente en estadios avanzados que ocurre aproximadamente en un 15% de estos pacientes1.
Varios tipos de tumores malignos han sido asociados con compromiso tumoral intravascular en la vena cava inferior, entre ellos el más frecuente es el carcinoma de células renales. Otras neoplasias como el tumor de Wilms, carcinoma adrenocortical, leiomioma uterino y tumores malignos hepáticos también comprometen a la vena cava inferior extendiéndose hasta el corazón en sus cavidades derechas1,2.
La intervención quirúrgica radical ha sido universalmente aceptada como el único tratamiento curativo, pues la quimioterapia y la radioterapia por sí solas no son efectivas. La extensión del trombo tumoral dentro de la vena cava inferior incrementa la complejidad de la cirugía y la morbimortalidad. Reportes previos han mostrado que una completa resección quirúrgica brinda entre un 40-70% de sobrevida a 5 años en ausencia de metástasis o compromiso de nódulos linfáticos y menor al 20% si las metástasis están presentes3–7.
La extensión del trombo tumoral en la vena cava inferior hacia cavidades cardíacas derechas se ha clasificado en 4 niveles que orientan la planificación del abordaje quirúrgico, siendo los niveles avanzados los de mayor complejidad y desafío1–6.
La práctica más común en los niveles avanzados es el abordaje toracoabdominal para controlar la vena cava inferior intrapericárdica utilizando circulación extracorpórea, arresto circulatorio e hipotermia profunda3.
En este artículo presentamos nuestra experiencia en 5 casos de tumores intraabdominales con extensión tumoral a vena cava inferior y cavidades cardiacas derechas cuyo abordaje quirúrgico se realizó vía abdominal utilizando bypass sin arresto cardiaco y sin hipotermia profunda.
CasosDesde abril del 2013 a septiembre del 2015 se recopilaron 5 casos de pacientes de forma retrospectiva en la Fundación Cardiovascular de Colombia, todos con diagnóstico de compromiso tumoral de la vena cava inferior, secundario a tumor intraabdominal. El estadio prequirúrgico y compromiso intravascular del tumor fueron evaluados con angiotomografía de tórax y abdomen. Posterior al diagnóstico todos fueron programados para resección quirúrgica del tumor y trombo tumoral.
En la tabla 1 se muestra la clasificación y recomendaciones del abordaje quirúrgico propuesta por Schimmer, que ha servido como orientación para la resección de estos tumores según su extensión8.
Niveles según el compromiso de la vena cava inferior
| Nivel | Características | Abordaje quirúrgico indicado |
|---|---|---|
| I | Tumor que invade la vena renal | Abordaje abdominal: control de la VCI por encima y por debajo del tumor. No se requiere CEC |
| II | Extensión del tumor limitada a la VCI intrahepática | Abordaje abdominal: control de la VCI por encima y por debajo del tumor. No se requiere CEC |
| III | Trombo tumoral con extensión a la VCI retrohepática | Abordaje toracoabdominal para controlar la VCI intrapericárdica. Si es necesario puede utilizarse CEC con o sin parada circulatoria |
| IV | Extensión del tumor al interior de la aurícula derecha | Abordaje toracoabdominal: esternotomía y CEC con o sin parada circulatoria |
CEC: circulación extracorpórea; VCI: vena cava inferior.
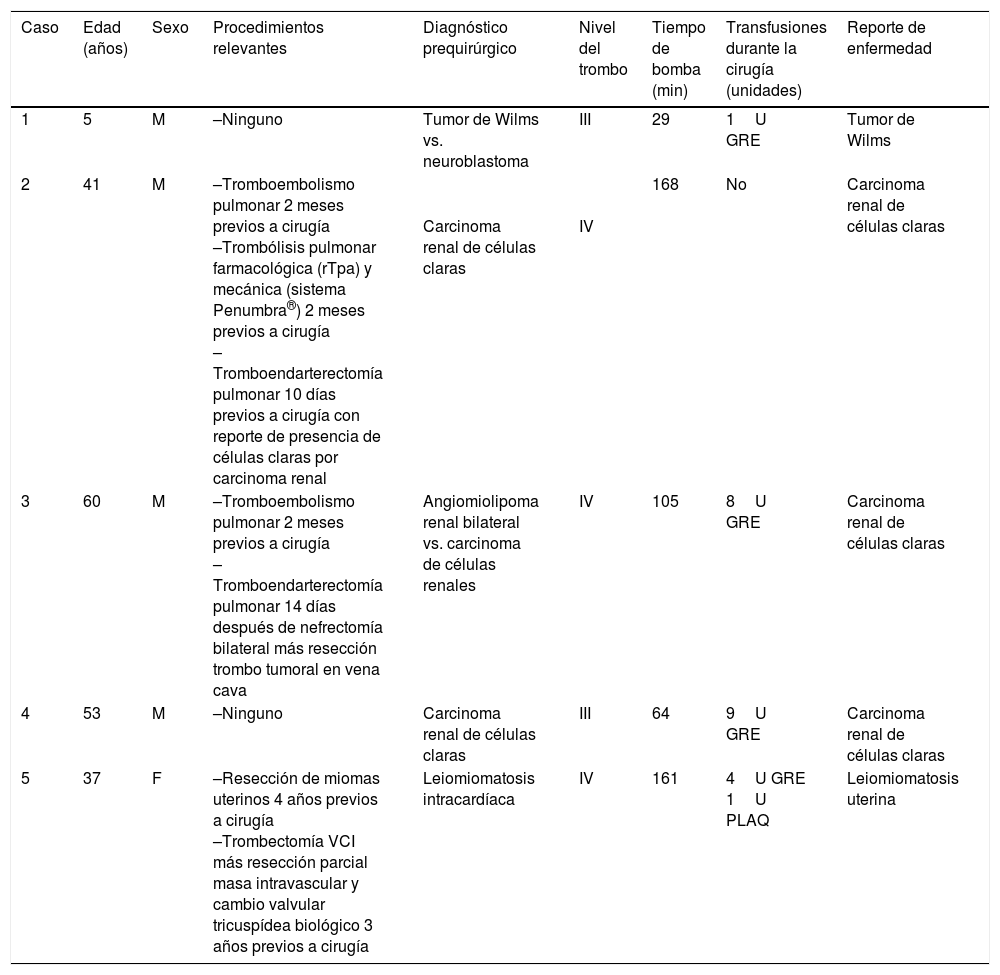
En la tabla 2 se muestran los datos relevantes de la historia clínica de los pacientes.
Datos relevantes de la historia clínica de los pacientes
| Caso | Edad (años) | Sexo | Procedimientos relevantes | Diagnóstico prequirúrgico | Nivel del trombo | Tiempo de bomba (min) | Transfusiones durante la cirugía (unidades) | Reporte de enfermedad |
|---|---|---|---|---|---|---|---|---|
| 1 | 5 | M | –Ninguno | Tumor de Wilms vs. neuroblastoma | III | 29 | 1U GRE | Tumor de Wilms |
| 2 | 41 | M | –Tromboembolismo pulmonar 2 meses previos a cirugía –Trombólisis pulmonar farmacológica (rTpa) y mecánica (sistema Penumbra®) 2 meses previos a cirugía –Tromboendarterectomía pulmonar 10 días previos a cirugía con reporte de presencia de células claras por carcinoma renal | Carcinoma renal de células claras | IV | 168 | No | Carcinoma renal de células claras |
| 3 | 60 | M | –Tromboembolismo pulmonar 2 meses previos a cirugía –Tromboendarterectomía pulmonar 14 días después de nefrectomía bilateral más resección trombo tumoral en vena cava | Angiomiolipoma renal bilateral vs. carcinoma de células renales | IV | 105 | 8U GRE | Carcinoma renal de células claras |
| 4 | 53 | M | –Ninguno | Carcinoma renal de células claras | III | 64 | 9U GRE | Carcinoma renal de células claras |
| 5 | 37 | F | –Resección de miomas uterinos 4 años previos a cirugía –Trombectomía VCI más resección parcial masa intravascular y cambio valvular tricuspídea biológico 3 años previos a cirugía | Leiomiomatosis intracardíaca | IV | 161 | 4U GRE 1U PLAQ | Leiomiomatosis uterina |
GRE: glóbulos rojos empaquetados; PLAQ: plaquetas; rTpa: activadores recombinantes del plasminógeno tisular; VCI: vena cava inferior.
El paciente del caso 2 fue llevado a tromboendarterectomía 10 días antes de la cirugía abdominal al presentar oclusión total de la rama izquierda de la arteria pulmonar. El reporte de esta enfermedad informó de la presencia de carcinoma renal de células claras.
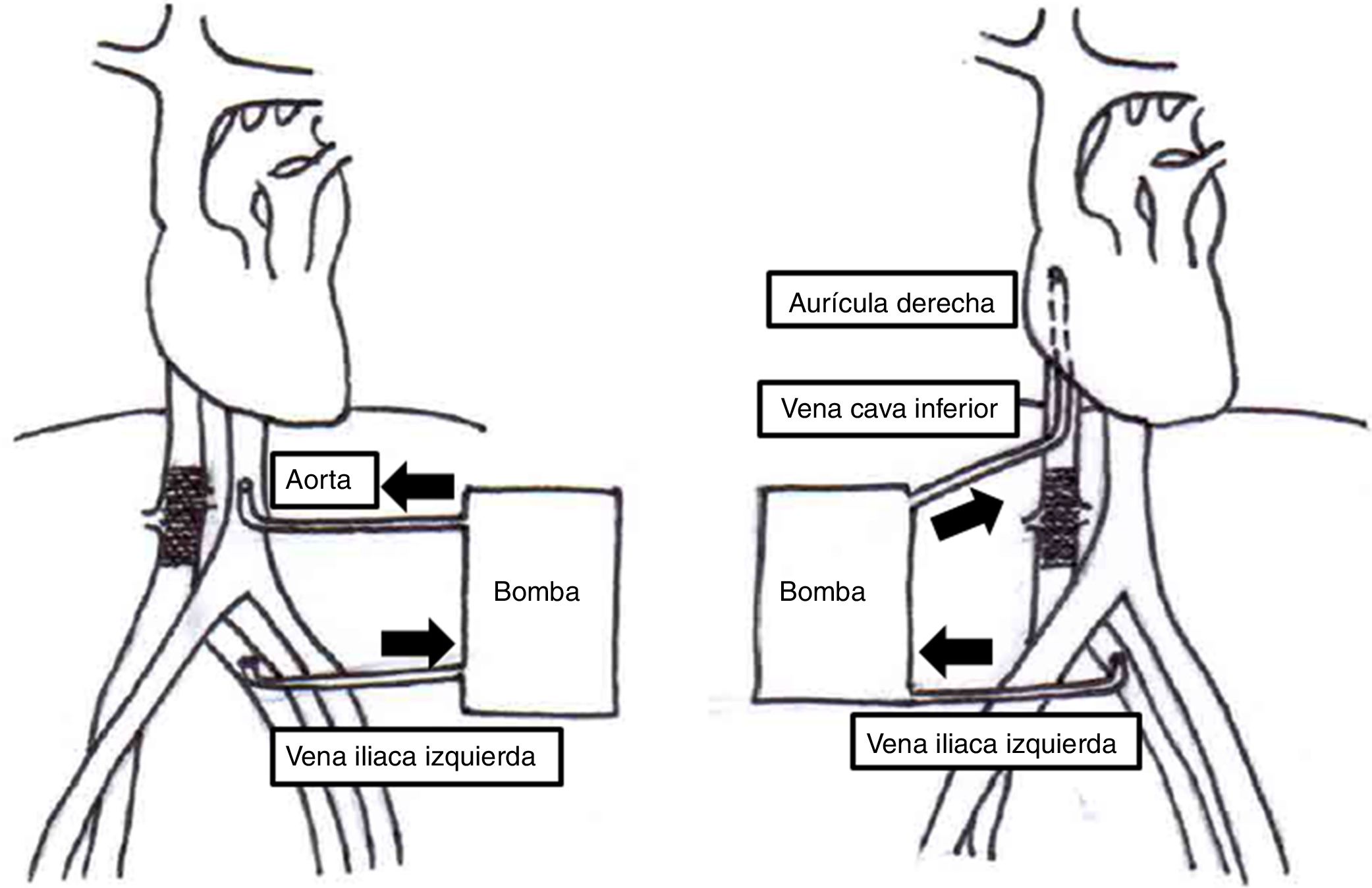
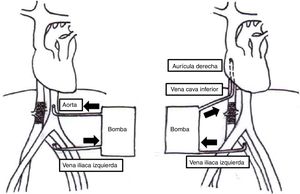
Los procedimientos se realizaron mediante abordaje abdominal utilizando el separador de Thompson. El siguiente paso consistió en la movilización del riñón para realizar nefrectomía radical unilateral llevada a cabo en 3 casos. En un caso se realizó nefrectomía radical bilateral y para el último caso que correspondía a un tumor ginecológico se realizó histerectomía radical modificada. Posteriormente se procedió a la liberación de ligamentos triangulares, falciformes hepáticos y en algunos casos de la vena cava retrohepática. Se abordó el saco pericárdico a través del centro frénico del diafragma para tener acceso a la aurícula derecha. Al finalizar esta disección se inició heparinización total. Según la extensión del tumor se decidió realizar bypass veno-venoso en 2 casos y en 3 casos se realizó bypass cardiopulmonar. En los pacientes en que se utilizó bypass veno-venoso se canuló la vena cava inferior para drenar hacia la aurícula derecha, y en los casos de bypass cardiopulmonar se realizó drenaje venoso doble desde vena cava inferior y aurícula derecha hacia aorta infrarrenal vía transdiafragmática (fig. 1). En todos los casos se llevó el paciente a hipotermia moderada. En este momento se realizó resección del trombo tumoral con posterior reconstrucción de la vena cava con parche de pericardio bovino; consecutivamente se inició recalentamiento, destete de perfusión, decanulación, reversión de heparinización y cierre de la cavidad abdominal. Todos los pacientes se trasladaron a la unidad de cuidados intensivos para continuar el manejo postoperatorio.
No se requirieron reintervenciones por sangrado. El paciente del caso 2 presentó un hematoma subcapsular hepático en el postoperatorio inmediato que se manejó de forma médica. El paciente del caso 3 presentó vasoplejía durante la realización de la nefrectomía bilateral, lo cual motivó un cambio en la estrategia quirúrgica realizando en un segundo tiempo, hacia el día 14 del postoperatorio, la endarterectomía pulmonar con resección de nódulos pulmonares. Los casos 2 y 5 presentaron injuria renal Acute Kidney Injury Network (AKIN) I y II en el postoperatorio inmediato resolviendo con manejo médico en 48 h sin requerir soporte dialítico. No se presentaron eventos embólicos o neurológicos en el perioperatorio. Tampoco se presentó mortalidad perioperatoria y todos los pacientes lograron el alta domiciliaria. La estancia en cuidados intensivos estuvo en el rango entre 2-7 días y el alta hospitalaria entre 4-26 días posterior al procedimiento quirúrgico.
DiscusiónLa práctica más común, cuando el nivel de invasión tumoral es alto (nivel III y IV) es el uso del bypass cardiopulmonar con hipotermia profunda y arresto1. Esta técnica permite tener un campo quirúrgico exangüe, mínima probabilidad de fragmentación del tumor, reducción del riesgo de diseminación de células tumorales, disminución de la incidencia de embolismo pulmonar y de hemorragia grave de las venas intra y suprahepáticas. Entre sus desventajas se encuentra que requiere un tiempo de circulación extracorpórea más prolongado, ya que es necesario el enfriamiento y posterior recalentamiento del paciente, incrementando el riesgo de coagulopatía, falla renal, lesiones neurológicas y hemorragia retroperitoneal3,5,9. En las revisiones bibliográficas se reporta una mortalidad entre el 0-44% y las complicaciones presentadas están frecuentemente relacionadas con la necesidad del uso de arresto cardiaco3,5.
Por otro lado, se encuentra el uso de bypass cardiopulmonar o bypass veno-venoso sin hipotermia profunda y sin arresto circulatorio3,7,10, el cual permite disminución del tiempo quirúrgico y del riesgo de sangrado. Como desventajas existe una reducción en cuanto a visualización, riesgos de isquemia hepática, embolismo pulmonar intraoperatorio y necrosis tubular aguda3,5. Las revisiones bibliográficas evidencian una mortalidad entre el 0-37% con una mayor necesidad de transfusiones sanguíneas intraoperatorias3,5. En nuestros casos, el equipo quirúrgico llevó a cabo todos los procedimientos con abordaje abdominal como única vía, con una adecuada visualización del campo quirúrgico, sin utilizar hipotermia profunda ni arresto circulatorio.
No se presentaron complicaciones relacionadas, como reintervenciones por sangrado, lesiones hepáticas, necrosis tubular aguda o lesiones neurológicas. Se presentaron 2 casos de lesión renal aguda (40%) que resolvieron con manejo médico sin necesidad de diálisis. En series con mayor número de casos se reporta lesión renal aguda en un rango entre el 3-10%3,5.
En cuanto al requerimiento de transfusión de glóbulos rojos, los reportes varían entre 5 a 29 unidades por paciente3,5 y para nuestra serie de casos el requerimiento fue menor.
La mortalidad en nuestro grupo de pacientes estuvo dentro del límite inferior de lo reportado, al no haber tenido ningún caso asociado al procedimiento.
ConclusionesEl diagnóstico tardío de los tumores intraabdominales con extensión cavoauricular implica un desafío terapéutico.
En nuestra experiencia el uso de esta técnica con abordajes de menor amplitud y sin arresto circulatorio permitió la resección quirúrgica en los niveles más avanzados de extensión tumoral con mínima morbimortalidad.