Definición
La definición de hemorragia mayor de lo habitual (HMH) es muy variable, ya que diversos autores difieren en relación con la cantidad y el tiempo de sangrado permisibles. También se la conoce como hemorragia anormal, excesiva o microvascular. En realidad, la hemorragia es un episodio esperado luego de la práctica de una operación cardiaca, siempre que no rebase ciertos límites en términos de cantidad y tiempo; sin embargo, cuando la hemorragia supera estos parámetros, se la debe considerar una complicación; es entonces una hemorragia mayor de lo habitual, un término que aceptó de manera uniforme el grupo de expertos que participó en el panel.
Con base en la evidencia publicada disponible, y el consenso del grupo, se estableció que en presencia de esta complicación era necesario tomar medidas para controlarla, de acuerdo con los siguientes criterios: hemorragia > 300 ml la primera hora después de la intervención, > 200 ml en la segunda hora y >100 ml de la tercera hora en adelante. Hay que considerar que esta complicación sólo se presenta en las primeras 24 h posteriores al acto quirúrgico, de manera más específica en las primeras 12 h, cuando se la identifica y se trata.
Una característica de la HMH es que puede ser secundaria al manejo quirúrgico o a la reexploración del paciente, por lo que pueden reconocerse causas quirúrgicas y causas médicas o por coagulopatía. Los pacientes se incluyen dentro de las causas quirúrgicas si en el momento de la reexploración se identifica un sitio específico de sangrado, puede controlarse por medios quirúrgicos y se reduce más del 80% el gasto de las sondas torácicas. El control quirúrgico se definió como la aplicación de suturas, cauterio eléctrico o un sellador de fibrina para uno o más puntos hemorrágicos. La hemorragia microvascular es un sangrado difuso sin una fuente quirúrgicamente corregible y a simple vista la sangre no coagula (Tabla 1).
Etiología
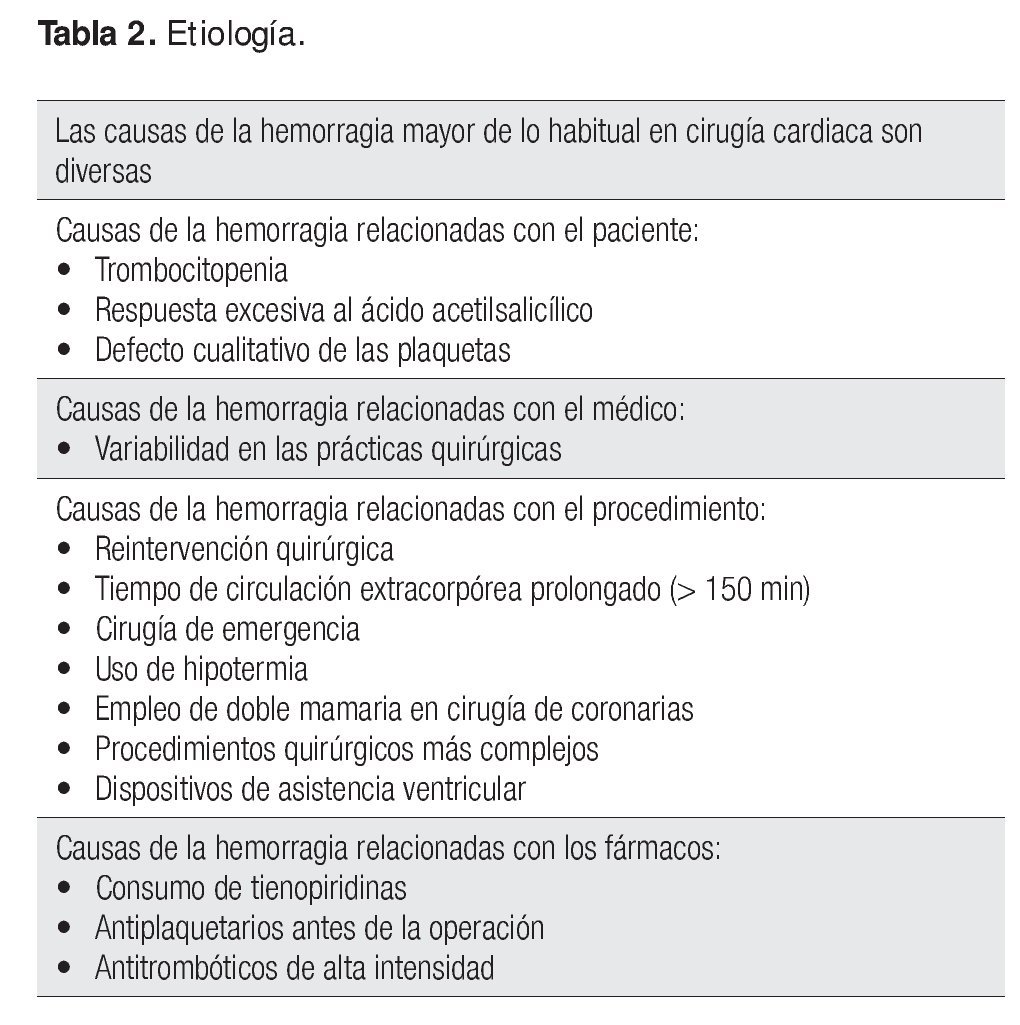
Las causas de la HMH después de un procedimiento cardiaco son diversas y pueden relacionarse con la complejidad quirúrgica, el uso de heparina, antiplaquetarios y anticoagulantes durante la operación, la coexistencia de aberraciones hemostáticas múltiples que se producen durante el bypass cardiopulmonar, la lesión de la pared de los vasos durante la intervención y la calidad del tejido subyacente posterior al procedimiento quirúrgico. También pueden intervenir defectos adquiridos en la hemostasia, entre ellos coagulopatía por hipotermia, hemodilución o fibrinólisis anormal, contribución anormal de las plaquetas a la hemostasia debido al consumo previo de antiplaquetarios, activación de las plaquetas por el circuito del bypass, consumo o pérdida de plaquetas. A pesar de la reversión completa de la heparina y la administración de agentes antifibrinolíticos, el sangrado excesivo todavía ocurre.
La HMH se ha vinculado con una duración de la circulación extracorpórea mayor de 2.5 h (150 min), procedimientos repetidos o combinados, disfunción renal, edad avanzada, área de superficie corporal pequeña y utilización de anticoagulantes o antiplaquetarios. Desde la demostración del beneficio de ASA en el curso de la isquemia aguda y el infarto al miocardio, el cirujano debe enfrentar el riesgo incrementado de encontrar un sangrado mediastínico en la cirugía de revascularización miocárdica.
La HMH posoperatoria resistente al tratamiento complica un número significativo de procedimientos de la cirugía cardiaca e incrementa tanto la morbilidad como la mortalidad. Existen medidas convencionales que afectan la hemostasia, desde la reexploración quirúrgica hasta la administración de productos sanguíneos. En algunos casos, la hemorragia intratable persiste y ello obliga a instituir alternativas de tratamiento. Las causas pueden dividirse como sigue:
1. Causas de la hemorragia relacionadas con el paciente.
2. Causas de la hemorragia relacionadas con el procedimiento.
3. Causas de la hemorragia relacionadas con el médico.
4. Causas de la hemorragia relacionadas con los fármacos.
Causas de la hemorragia relacionadas con el paciente
Son los pacientes que tienen trombocitopenia (número de plaquetas < 50 000), con una respuesta excesiva al ácido acetilsalicílico u otros fármacos antiplaquetarios. Se manifiesta por pruebas de función plaquetaria anormal, tiempos de sangrado prolongados y defecto cualitativo de las plaquetas; constituye un grupo de individuos con elevado riesgo de hemorragia. Por lo tanto, las técnicas de conservación de sangre tienen la mayor importancia en la cirugía de este grupo de enfermos.
Nivel de evidencia B
Causas de la hemorragia relacionadas con el procedimiento
Corresponden sobre todo a procedimientos de reintervención, urgentes o que requieren la inducción de hipotermia. En el caso de la cirugía de revascularización coronaria, en la que se utilizan las dos arterias mamarias, la tasa de hemorragia es mayor que en los procedimientos que emplean una sola arteria mamaria, o bien injertos venosos de safena. Asimismo, el reemplazo valvular aórtico con autoinjerto pulmonar (procedimiento de Ross) es técnicamente una operación más difícil, con una tasa mayor de sangrado y necesidad de realizar una reexploración quirúrgica, y una tasa más elevada de mortalidad. La disfunción hemostática y las anormalidades de la coagulación concomitantes son comunes en sujetos sometidos a la implantación de dispositivos de asistencia ventricular o corazones artificiales.
Causas de la hemorragia relacionadas con el médico
Las prácticas quirúrgicas difieren ampliamente y pueden influir en la hemorragia perioperatoria y la necesidad de efectuar una transfusión. Existen diferencias en la aplicación consistente de criterios homogéneos para el uso de sangre en el perioperatorio entre médicos y en distintos centros hospitalarios; algunas medidas son conservadoras y otras liberales para su empleo. Las diferencias en los patrones de prácticas relacionadas con el reconocimiento, corrección y exploración, en el caso de una hemorragia posoperatoria excesiva, también contribuyen a la amplia variabilidad de uso de los productos sanguíneos.
Causas de la hemorragia relacionadas con los fármacos
Es razonable suspender las tienopiridinas de cinco a siete días antes del procedimiento quirúrgico para limitar la pérdida de sangre y las necesidades de transfusión, aunque es necesario tomar precauciones al suspender súbitamente los antiplaquetarios en pacientes portadores de stent liberadores de fármacos. Esto puede precipitar trombosis del stent, por lo que el equipo quirúrgico debe instituir medidas para evitarlo. Lo anterior puede incluir hospitalización del paciente y el cambio de la tienopiridina por un inhibidor IIb/IIIa de acción corta por unos pocos días antes de la intervención.
Nivel de evidencia B
Es razonable discontinuar los antiplaquetarios de baja intensidad (ácido acetilsalicílico) en pacientes electivos y sin síndrome coronario agudo antes de la operación con la esperanza de que la transfusión sanguínea sea reducida.
Nivel de evidencia A.
Muchos fármacos antiplaquetarios y antitrombóticos de alta intensidad, como el activador tisular del plasminógeno, estreptocinasa, heparinas de bajo peso molecular, inhibidores de los receptores ADP, inhibidores directos de la trombina, inhibidores de las glucoproteínas plaquetarias, se relacionan con un incremento de la hemorragia en la cirugía de corazón; en consecuencia, está indicado suspender estos medicamentos un tiempo razonable (cinco a siete días antes de la intervención), de acuerdo con su vida media y capacidad de revertir sus efectos. La heparina no fraccionada es el único fármaco que sí puede suspenderse inmediatamente antes de la operación (Tabla 2).
Nivel de evidencia C.
Valoración hematológica preoperatoria
Si se toma en cuenta que la HMH es la primera causa de morbilidad en la cirugía cardiaca, que se indican productos sanguíneos en un 30% por lo menos de los pacientes sometidos a una revascularización coronaria y que la causa es multifactorial, los grupos hospitalarios que atienden a estos pacientes deben identificar en su evaluación preoperatoria a los sujetos con alto riesgo de sufrir sangrado, ya que requieren una evaluación preoperatoria por un hematólogo y las medidas necesarias para evitar el sangrado, reducir sus efectos y prever las medidas terapéuticas de una forma dirigida. También es necesario documentar en el expediente clínico del paciente esta valoración y las medidas instituidas, con la finalidad de prevenir una mayor morbilidad y mortalidad en este grupo de individuos. Por lo tanto, deben identificarse en el preoperatorio a las personas de alto riesgo y aplicar medidas efectivas en términos del costo para solicitar formas de conservación de sangre.
Se consideran pacientes de alto riesgo de HMH los sujetos son problemas hematológicos conocidos con alteraciones en exámenes de laboratorio, operaciones cardiacas de reintervención, procedimientos urgentes, personas en quienes se anticipa una circulación extracorpórea prolongada (> 150 min), individuos sometidos a hipotermia profunda, procedimientos quirúrgicos complejos (revascularización coronaria con recambio valvular, cirugía de aorta, doble valvular en sujetos con congestión hepática crónica), pacientes programados para la colocación de dispositivos de asistencia ventricular o corazones artificiales, e individuos en quienes no pueden suspenderse los antiagregantes plaquetarios potentes.
En este grupo particular de pacientes debe existir un protocolo de atención que incluya al hematólogo y que acate las indicaciones para minimizar esta complicación (Tabla 3).
Criterios de reexploración por sangrado
Los sujetos que tienen criterios para reexploración son aquellos que experimentan sangrado > 500 ml en la primera hora, > 400 ml/h por 2 h, > 300 ml/h por 3 h y > 200 ml/h en las primeras 4 h. Para ello es preciso primero corregir las anormalidades de coagulación. La morbilidad y mortalidad en estos enfermos son mayores, dado que se exponen a un mayor número de productos sanguíneos, una mayor incidencia de síndrome de bajo gasto cardiaco, insuficiencia renal, tiempo de ventilación mecánica, sepsis, estancia prolongada en la unidad de cuidados intensivos, y una mayor mortalidad (hasta cinco veces más que la mortalidad esperada, según algunas publicaciones).
Diagnóstico
Pruebas de coagulación convencionales
La hemorragia es a menudo etiológicamente multifactorial, pero se consideran los siguientes criterios para establecer una causa originada en defectos de la coagulación:
• Tiempo de protrombina (TP)/INR (International normalized ratio) >15 s, o 1.5 veces el control normal.
• Tiempo parcial de tromboplastina (TPT) o tiempo de tromboplastina parcial activado (TTPA) > 55 s, o 1.5 veces el control normal.
• Recuento de plaquetas < 100 000 si hay hemorragia, o 50 000 si no la hay.
• Fibrinógeno < 50 mg/dl o < 80 a 100 mg/dl si es "refractario" al uso de plaquetas y plasma fresco congelado.
• Nivel del dímero D, que es un producto de la degradación de la fibrina; su presencia indica un proceso de fibrinólisis posterior a una trombosis y su valor normal no debe ser mayor de 500 ng/ml.
• Los productos de la degradación del fibrinógeno o PDF (proteínas X, Y, D y E), que son fragmentos proteicos solubles formados por la acción proteolítica de la plasmina sobre la fibrina o el fibrinógeno, y que dañan profundamente el proceso hemostático, son la causa principal de la hemorragia en la coagulación intravascular y la fibrinólisis. Su elevación indica anormalidad y valores normales no deben ser mayores de 5 μg/dl.
• Las pruebas estándar que deben solicitarse en todo paciente programado para una operación de cirugía cardiaca en el posoperatorio inmediato, y que sirven para identificar alteraciones comunes de la coagulación, son TP, TPT, plaquetas y fibrinógeno.
• Todas estas alteraciones hemostáticas deben interpretarse en el contexto de un paciente con HMH; si no hay hemorragia, no debe intentarse la corrección de estas anormalidades de laboratorio (Tabla 4).
Tromboelastografía
Es el método que cuantifica las propiedades viscoelásticas de la sangre. El tromboelastograma es un dispositivo computarizado que determina las propiedades viscoelásticas de la sangre de una forma dinámica y global, ya que documenta la integración de las plaquetas con la cascada de la coagulación. Esta prueba se realiza in vitro y emplea una cubeta o copa en la cual se depositan 0.36 cm3 de sangre, la cual se gradúa previamente de acuerdo con la temperatura del paciente y durante un periodo de 10 s. La muestra se somete a un proceso de rotación y oscilación a 4°45". La sangre depositada en la copa se encuentra en contacto con un pin, el cual se halla suspendido libremente dentro de la muestra y a su vez conectado por su extremo distal a una guía o cable de torsión que lo hace girar; a medida que la sangre se coagula modifica la resistencia del pin; estas variaciones obtenidas por las características del coágulo y su etapa evolutiva las registra un transductor electromecánico, que convierte la rotación del pin en una señal eléctrica y documenta así las distintas etapas de la coagulación, es decir, la formación de la fibrina, la retracción del coágulo, la agregación plaquetaria y la lisis del coágulo.
Las diferentes etapas de la coagulación se verifican en sus respectivos momentos mediante el uso de siete variables: R o tiempo de reacción, K o tiempo de coagulación, ángulo α, MA o amplitud máxima, LY30, G, e índice de coagulación.
El uso de un tromboelastógrafo es una prueba muy útil, dado que puede utilizarse en quirófano y en la unidad de cuidados intensivos, sus resultados se obtienen en poco tiempo y permite tomar decisiones en tiempo real; como desventaja debe mencionarse su bajo poder de penetración en México.
Dado que la hemorragia anormal o excesiva después de una operación cardiaca ocurre en 3% a 11% de los pacientes, se requiere una reexploración quirúrgica en aproximadamente 5% de los casos, en los cuales se identifica una hemostasia inadecuada en alrededor del 50% al 60% de los sujetos, con un incremento de la mortalidad de tres a cuatro veces. Es muy útil guiar el tratamiento de la causa de la hemorragia en tiempo real y hace posible disminuir los requerimientos de transfusión por el uso de la tromboelastografía (Tabla 5).
Tratamiento
El tratamiento médico inicial incluye la transfusión de plaquetas en forma empírica, y protamina cuando esté indicado; el plasma fresco congelado debe solicitarse con posterioridad; puede ser necesaria la transfusión de paquete globular en este escenario. En la hemorragia más grave se administran plasma fresco congelado y plaquetas de manera simultánea, en forma empírica. Sólo de manera ocasional se utilizan crioprecipitados y factor VII activado, cuando fracasa el uso de plasma y plaquetas. Dos situaciones exigen un regreso urgente al quirófano: la hemorragia excesiva y persistente, y el taponamiento cardiaco.
Protamina
El sulfato de protamina es un fármaco indicado para revertir, por unión molecular, los efectos anticoagulantes de la heparina. Hoy en día se produce a través de biotecnología recombinante. Este medicamento está indicado para el tratamiento de pacientes con hemorragia por sobredosis de heparina, en pacientes sometidos a un procedimiento cardiovascular con circulación extracorpórea que necesitan neutralizar el efecto de la heparina utilizada.
En la actualidad, el uso de la circulación extracorpórea, en la que se utilizan grandes cantidades de heparina para evitar la coagulación de la sangre en el circuito extracorpóreo, se vigila a través del tiempo de coagulación activado (TCA), al inicio de la operación y antes de la administración de heparina; se toma un control, que debe ser normal, luego se vigila el TCA hasta alcanzar las cifras deseadas de anticoagulación requerida, y al final de la operación se obtiene otro control; a continuación se neutraliza la heparina circulante, por lo que se toma un TCA final al terminar la circulación extracorpórea, el cual se espera normal, lo que indica que toda la heparina utilizada se ha neutralizado con heparina. Si se considera esto y que la protamina se une a la heparina (aunque si se administra en ausencia de heparina circulante puede actuar como anticoagulante), su uso en el transoperatorio es aceptable y útil en el posoperatorio, en el caso de un paciente con un TCA normal; puede ser cuestionable su utilidad si se emplea de forma empírica.
Por otro lado, la protamina no es benigna y puede causar hipotensión durante su administración, sobre todo en pacientes diabéticos. Esta inestabilidad hemodinámica resulta de la liberación de tromboxano, que induce vasoconstricción pulmonar, bradicardia e hipotensión, y produce una insuficiencia cardiaca derecha (Tabla 6).
Antifibrinolíticos
La terapia antifibrinolítica con derivados de la lisina (ácido ε aminocaproico, ácido tranexámico) o los inhibidores de las proteasas como la aprotinina han sido las principales medidas para reducir las pérdidas sanguíneas perioperatorias en la cirugía cardiaca e intervenciones de alto riesgo.
Los análogos de la lisina como el ácido aminocaproico ε y el ácido tranexámico están indicados como intervenciones terapéuticas para limitar la necesidad de transfusión y disminuir la hemorragia; su perfil de seguridad es mejor que el de la aprotinina.
Recomendación clase I, nivel de evidencia A
El ácido aminocaproico ε es un fármaco que ha superado la prueba del tiempo y su uso e indicaciones han cambiado, pero hoy en día es útil en estos escenarios: uso en quirófano, apoyo en la tromboelastografía y pacientes con factor de riesgo, como son la circulación extracorpórea prolongada y la insuficiencia hepática, a la que puede añadirse la congestión pasiva crónica del hígado (Tabla 7).
Desmopresina
El uso del acetato de desmopresina (DDAVP) es poco razonable para atenuar la hemorragia excesiva en ciertos pacientes con disfunción plaquetaria específica y que responden a estos agentes (disfunción plaquetaria causada por la circulación extracorpórea, disfunción plaquetaria urémica, enfermedad de von Willebrand tipo I).
Recomendación clase IIb, nivel de evidencia B
El uso profiláctico sistemático del DDAVP no es recomendable para reducir la hemorragia o la indicación de transfusión después de una operación cardiaca en la que se utiliza circulación extracorpórea.
Clase de indicación III, nivel de evidencia A
Numerosos estudios, incluidos tres meta-análisis que evalúan la eficacia de utilizar DDAVP para limitar la hemorragia en cirugía cardiaca, no fundamentan su uso en forma profiláctica.
Factor VII recombinante
El 25 de marzo de 1999, la U.S. Food and Drug Administration aprobó el uso del factor VIIa recombinante (rFVIIa) para la hemorragia en pacientes con hemofilia A o B, o con inhibidores de los factores VIII o IX. El rFVIIa se ha estudiado de manera prospectiva en diversas operaciones electivas, incluidas las prostatectomías retropúbicas, resección hepática e intervenciones cardiacas. Estos estudios pequeños han mostrado una reducción de los requerimientos de transfusión en los pacientes tratados, pero un bajo beneficio en la mortalidad o la mejoría a largo plazo. Es claro que se requieren estudios bien diseñados, con ensayos clínicos que prueben una hipótesis para guiar a los clínicos en el quirófano, la unidad de cuidados intensivos; de esta manera es posible considerar la aplicación de este potente pero costoso fármaco y cuyo uso puede provocar morbilidad.
Tritapepe y colaboradores demostraron que la terapia de rescate con rFVIIa es efectiva para reducir los requerimientos de transfusión, corregir la coagulopatía y controlar la hemorragia que pone en riesgo la vida en individuos con disección aórtica aguda que requirieron una operación con paro circulatorio hipotérmico profundo. Todos los pacientes recibieron ácido tranexámico y rFVIIa en el cuarto de operaciones o la unidad de cuidados intensivos al final de un protocolo de transfusión, en el cual la hemorragia significativa fue evidente a pesar de la reanimación radical y la exploración quirúrgica exhaustiva. Cuatro personas necesitaron una segunda dosis del medicamento debido a persistencia de la hemorragia.
En cuanto al uso del factor rFVIIa, casi toda su experiencia es empírica. Hasta que no se disponga y documente una mayor evidencia, el uso de este fármaco debe ponderarse en relación con su riesgo y beneficio, y sólo se recomienda como terapia de rescate para hemorragia grave intratable sin una fuente quirúrgica reconocida y sin respuesta al tratamiento regular, después de procedimientos cardiacos que utilizan circulación extracorpórea.
Se necesitan estudios prospectivos, multicéntricos, controlados por placebo y doble ciego, con un adecuado poder estadístico, específicamente en el campo de la cirugía cardiaca con paro circulatorio e hipotermia profunda. Esta área es pequeña y el riesgo de morbilidad (insuficiencia renal aguda y enfermedad vascular cerebral) y mortalidad son elevados. El alto costo del rFVIIa (alrededor de 7 000 dólares para una dosis simple de 70 μg/kg en un paciente de 70 kg) y las circunstancias extremas para las que se administra deben convertir en un reto para los comités de revisión institucionales la aprobación de su uso.
Por último, debe señalarse que la administración de factor rFVIIa debe utilizarse como terapia de rescate y, como dato adicional, nunca en sujetos mayores de 65 años.
Conclusiones
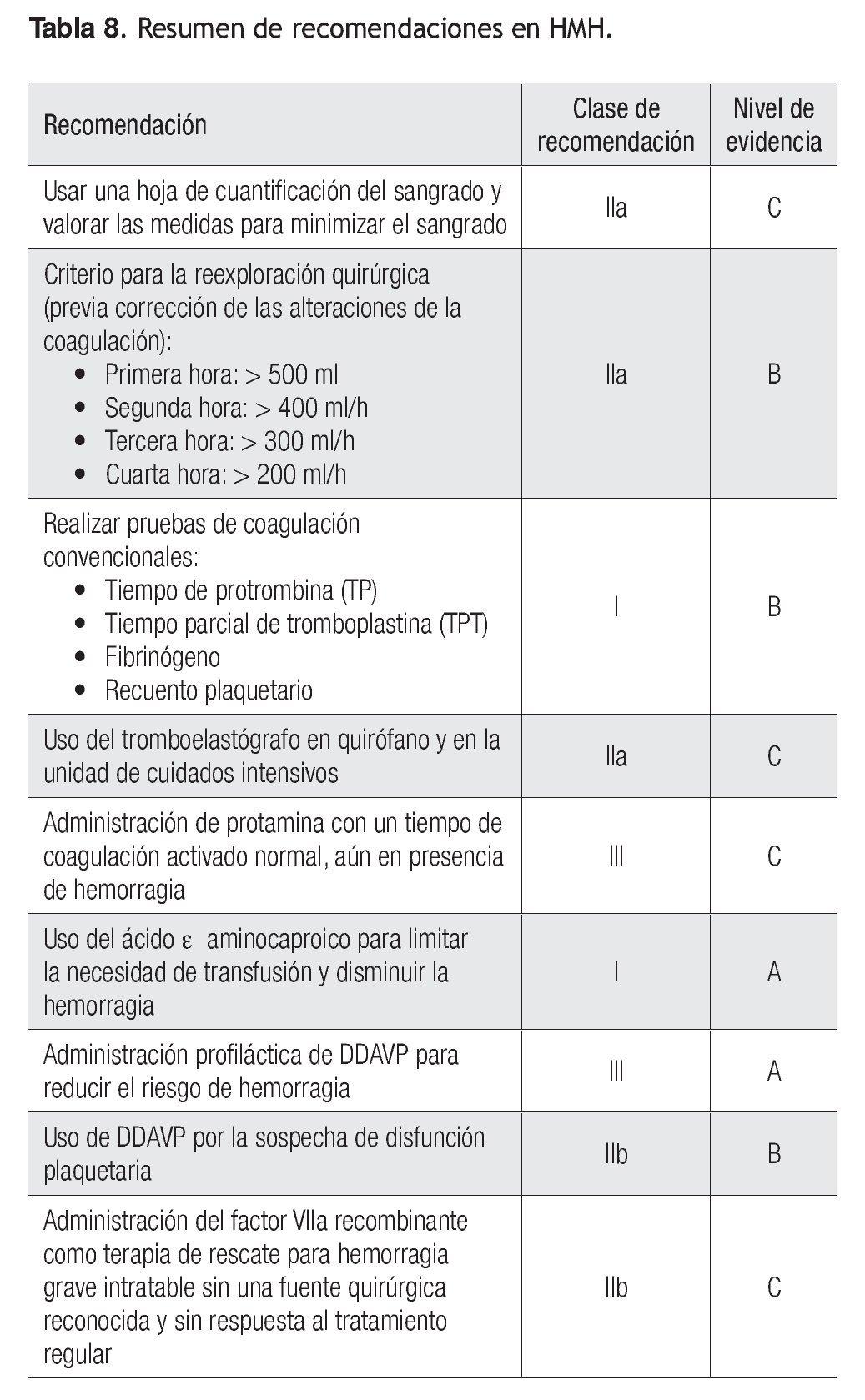
La HMH figura dentro de las principales complicaciones de la cirugía cardiaca; su efecto en el pronóstico establece la necesidad de conocer su fisiopatología, así como los métodos necesarios para instituir una adecuada prevención y terapéutica; además, no debe perderse de vista que su tratamiento implica efectos secundarios, en lo absoluto insignificantes, y que esto debe obligar a los hospitales que practican este tipo de procedimientos a crear protocolos terapéuticos para establecer una prevención y tratamiento adecuados (Tabla 8).
Bibliografía
Andreé ACST, Del Rossi A. Hemodynamic management of patients in the first 24 hours after cardiac surgery. Crit Care Med 2005;33:2082-2093.
Balsam LB, Timek TA, Pelletier MP. Factor eight inhibitor bypassing activity (FEIBA) for refractory bleeding in cardiac surgery: review of clinical outcomes. J Card Surg 2008; 23:614-621.
Brown JR, Birkmeyer NJ, O´Connor GT. Meta-analysis comparing the effectiveness and adverse outcomes of antifibrinolytic agents in cardiac surgery. Circulation 2007;115:2801-2813.
Castells Molina S, Hernández-Pérez M. Farmacología en enfermería, 2daª. Edición. España: Elsevier, España, 2007; p. 294.
Del Campo AJA, Heredia y PI, Ramos Cano VH, et al. Evaluación de factores predisponentes para el sangrado mediastinal en cirugía de revascularización miocárdica. Papel del ácido acetilsalicílico, otros agregantes antiplaquetarios, y anticoagulantes. Arch Cardiol Mex 2004;74(2):118-125.
Despotis GJ, Filos KS, Zoys TN, et al. Factors associated with excessive postoperative blood loss and hemostatic transfusion requirements: a multivariate analysis in cardiac surgical patients. Anesth Analg 1996;82:13-21. Disponible en: http://circ.ahajournals.org/manual/manual_IIstep6.shtml
Engoren MC, Habib RH, Zacharias A, et al. Effect of blood transfusion on long-term survival after cardiac operation. Ann Thorac Surg 2002;74:1180-1186.
Fergusson DA, Hébert PC, Mazer CD, et al. A comparison of aprotinin and lysine analogues in high-risk cardiac surgery. N Engl J Med 2008;358: 2319-2331.
Ferraris VA. Perioperative blood transfusion and blood conservation in cardiac surgery: The Society of Thoracic Surgeons and the Society Cardiovascular Anesthesiologists Clinical Practice Guidelines. Ann Thorac Surg 2007;83:S27-S86.
Hall TS, Brevetti GR, Skoultchi AJ, et al. Re-exploration for hemorrhage following open heart surgery differentiation on the causes of bleeding and the impact on patient outcomes. Ann Thorac Cardiovasc Surg 2001;7:352-357.
Karkouti K, Cohen MM, McCluskey SA, Sher GD. A multivariable model for predicting the need for blood transfusion in patients undergoing first-time elective coronary bypass graft surgery. Transfusion 2001;41:1193-1203.
Moulton MJ, Creswell LL, Mackey ME, et al. Reexploration for bleeding is a risk factor for adverse outcomes after cardiac operations. J Thorac Cardiovasc Surg 1996;111:1037-1046.
Munoz JJ, Birkmeyer NJ, Dacey LJ, et al. Trends in rates of reexploration for hemorrhage after coronary artery bypass surgery. Northern New England Cardiovascular Disease Study Group. Ann Thorac Surg 1999;68:1321-1325.
Raffán SF, Ramírez FJ, Cuervo JA, et al. Tromboelastografía. Rev Col Anest 2005; 33(3):181-186.
Ranucci M, Bozzetti G, Ditta A, et al. Surgical reexploration after cardiac operations: Why a worse outcome? Ann Thorac Surg 2008;86:1557-1562.
Ray MJ, O`Brien MF. Comparison of epsilon aminocaproic acid and low-dose aprotinin in cardiopulmonary bypass: efficiency, safety and cost. Ann Thorac Surg 2001;71:838-843.
Sellman M, Intonti MA, Ivert T. Reoperations for bleeding after coronary artery bypass procedures during 25 years. Eur J Cardiothorac Surg 1997;11:521-577.
Silver DA. Recombinant activated factor VII in cardiac surgery - Will we ever know for sure? Crit Care Med 2007;35:1782-1783.
Steiner ME, Despotis GJ. Transfusion algorithms and how they apply to blood conservation: the high-risk cardiac surgical patient. Hematol Oncol Clin N Am 2007;21:177-184.