Los modelos animales son una herramienta muy útil para la evaluación de los mecanismos de la enfermedad y las tecnologías de diagnóstico y tratamiento. En este estudio hemos realizado un análisis descriptivo de los cambios funcionales y estructurales cardíacos acontecidos como consecuencia de un infarto agudo por oclusión coronaria en cerdos y su evolución a 5 semanas.
MétodosSe utilizaron 19 cerdos, Large White, de 20kg de peso, distribuidos aleatorizadamente en 3 series experimentales. Tras estereotomía, se ocluyó la arteria coronaria descendente anterior. Duración de la oclusión: serie 1 (n = 6) 60 min; serie 2 (n = 8) 90 min; serie 3 (n = 5) 60 min, con seguimiento de 5 semanas. Se evaluaron parámetros de función cardíaca global (ECG, presiones de ventrículo y aurícula izquierdos, flujo aórtico y ecocardiografía cardíaca), regional (sonometría), niveles de troponina T y CK-MB, análisis macroscópico e histológico.
ResultadosLa oclusión coronaria alteró la función cardíaca global transitoriamente y produjo daño celular con incremento de marcadores, alteración de la contractilidad regional y cambios histológicos. El incremento de tiempo de isquemia (60 vs. 90 min) aumentó el tamaño del infarto (13.4±5.4% S1 vs. 22.9±7.8% S2; p=0.04). A las 5 semanas eran patentes los cambios morfológicos por remodelado. En el 79% de los casos la isquemia desencadenó fibrilación ventricular.
ConclusiónEl modelo porcino de infarto agudo y reperfusión posterior a tórax abierto es válido para el estudio de la fisiopatología de la isquemia coronaria, permite el análisis directo de la función miocárdica regional y es fácilmente recuperable en caso de arritmias graves.
Animal models are a useful tool for the evaluation of disease mechanisms and also for technologies for diagnosis and treatment. In this study we performed a descriptive analysis of the functional and structural cardiac changes occurred as a result of acute coronary occlusion in pigs and its evolution during 5 weeks.
Methods19-Large White pigs, weighing 20kg, randomized into 3-experimental series were used. After sternotomy, anterior descending coronary artery was occluded. Duration of occlusion: Series 1 (n=6) 60min; series 2 (n=8) 90min; series 3 (n=5) 60min followed for 5 weeks. The following parameters where then analyzed: global cardiac function (ECG, left ventricular and atrium pressures, aortic flow and cardiac echocardiography), regional contractility, troponin T and CK-MB levels, macroscopic and histological analyzes.
ResultsCoronary occlusion transiently altered the global cardiac function and produced increased cell damage markers, impaired regional contractility and produced histological changes. The increment of ischemic time (60 vs. 90min) increased infarct size (13.4±5.4% vs. 22.9±7.8 S1 S2%; P=.04). After 5 weeks, morphological remodelling changes were evident. In 79% of cases ischemia triggered ventricular fibrillation.
ConclusionThe porcine open chest model of acute myocardial infarction and reperfusion is valid for studying the pathophysiology of coronary ischemia, allows direct analysis of regional myocardial function and is easily retrievable in the event of serious arrhythmias.
Los modelos animales, a pesar de que no son capaces de replicar completamente la complejidad de las condiciones patológicas humanas, son la herramienta para la evaluación de los mecanismos de la enfermedad y las tecnologías de diagnóstico y tratamiento1.
En los últimos años se han reconocido 2 importantes cambios en el enfoque clínico del infarto de miocardio. En primer lugar, la fisiopatología del infarto agudo de miocardio es un proceso que se produce no solo por la obstrucción de la arteria epicárdica coronaria, sino porque también hay alteraciones en la microvasculatura, así como cambios en el metabolismo del miocardio2–4. En Segundo lugar, existe un amplio abanico terapéutico que va desde la disolución de los trombos epicárdicos mediante la fibrinólisis hasta la apertura mecánica con angioplastia y stents. Pero tras el restablecimiento del flujo sanguíneo en las arterias epicárdicas pueden producirse nuevas lesiones debidas a la reperfusión5, con consecuencias funcionales y estructurales.
La oclusión de una arteria coronaria origina el cese súbito de la perfusión regional, lo que conduce rápidamente al cese del metabolismo aeróbico, la depleción de la creatina-fosfato y el comienzo de la glucólisis anaeróbica; esto se sigue de acumulación de lactato y catabolitos y reducción progresiva de los niveles de ATP. Si la isquemia continúa, se desarrolla acidosis tisular y se produce alteración del intercambio iónico celular, la función de la membrana celular se altera, lo que desencadena el comienzo de la muerte del miocito. El daño miocárdico irreversible comienza en el subendocardio a los 20 min de la oclusión coronaria y se extiende como un frente de onda hacia las capas subepicárdicas6; al cabo de una hora de oclusión coronaria el subendocardio dependiente y parte del miocardio quedan lesionados de forma irreversible; la extensión transmural se completa con 4-6 h de isquemia.
La reperfusión conlleva un reaprovisionamiento de sustratos, fundamentalmente oxígeno, que intervendrá en la oxidación de los ácidos grasos a nivel mitocondrial. La restauración completa de la función contráctil se alcanza cuando los niveles de ATP se normalizan y desaparece el exceso de ADP (agonista de la agregación plaquetaria). Existen otros factores, como los cambios del flujo de calcio (por alteraciones de membrana) o las alteraciones en el metabolismo de ácidos grasos libres, que serán responsables de la prolongada anormalidad de la contracción después de la isquemia7–9. El daño endotelial activa la cascada de la coagulación con agregación plaquetaria y de hematíes que contribuyen a la disfunción microvascular10; la respuesta inflamatoria con la activación del complemento también influye en la disfunción de la perfusión miocárdica11 y otros cambios como la depleción de glucógeno y ATP, el edema mitocondrial y el agrupamiento de cromatina nuclear se correlacionan con el empeoramiento de la función miocárdica tras la isquemia (miocardio aturdido)12–14.
El modelo experimental de infarto en animal grande (cerdo) se puede realizar mediante la oclusión externa de la arteria coronaria seleccionada, tras la apertura del tórax, o con tórax cerrado mediante balón intracoronario. La realización de oclusión coronaria con tórax abierto tiene las ventajas de permitir una visualización directa de la coronaria ocluida y zona dependiente de ella, controlar la oclusión, medir la contractilidad regional directamente en distintas zonas del corazón, medir parámetros metabólicos e incluso medir directamente el flujo en las arterias coronarias y en la raíz aórtica con técnicas de ultrasonidos. Pero también tiene sus inconvenientes, que son los propios de la cirugía y de los cambios debidos a la apertura de tórax y epicardio que puedan influir en el remodelado miocárdico en los modelos crónicos.
La oclusión por debajo de la primera diagonal de la arteria coronaria descendente anterior durante 60 min son la localización y el tiempo más factibles para desarrollar un modelo porcino de infarto de miocardio reperfundido15–17.
Existe una dificultad añadida en el modelo porcino de infarto de miocardio: esta es la alta incidencia de fibrilación y taquicardia ventricular que conlleva una elevada mortalidad; una de las ventajas del modelo quirúrgico con tórax abierto es la facilidad de reversión de estas arritmias mediante masaje y choque eléctrico de baja energía.
ObjetivosDescripción de un modelo experimental «in vivo» de infarto agudo de miocardio en animal grande y su evolución a las 5 semanas. Caracterización de parámetros de función cardíaca global y regional, de parámetros bioquímicos y morfológicos.
Material y métodosSeries experimentalesSe utilizaron 19 cerdos, hembras, de 2 meses de edad, con un peso medio de 21,02±2,9kg, estabulados en la Unidad de Veterinaria del Centro de Investigación. Los experimentos fueron realizados respetando la legislación española sobre protección de animales usados en experimentación y otros propósitos científicos y las directivas de la Comunidad Europea al respecto (Real Decreto 1201/2005).
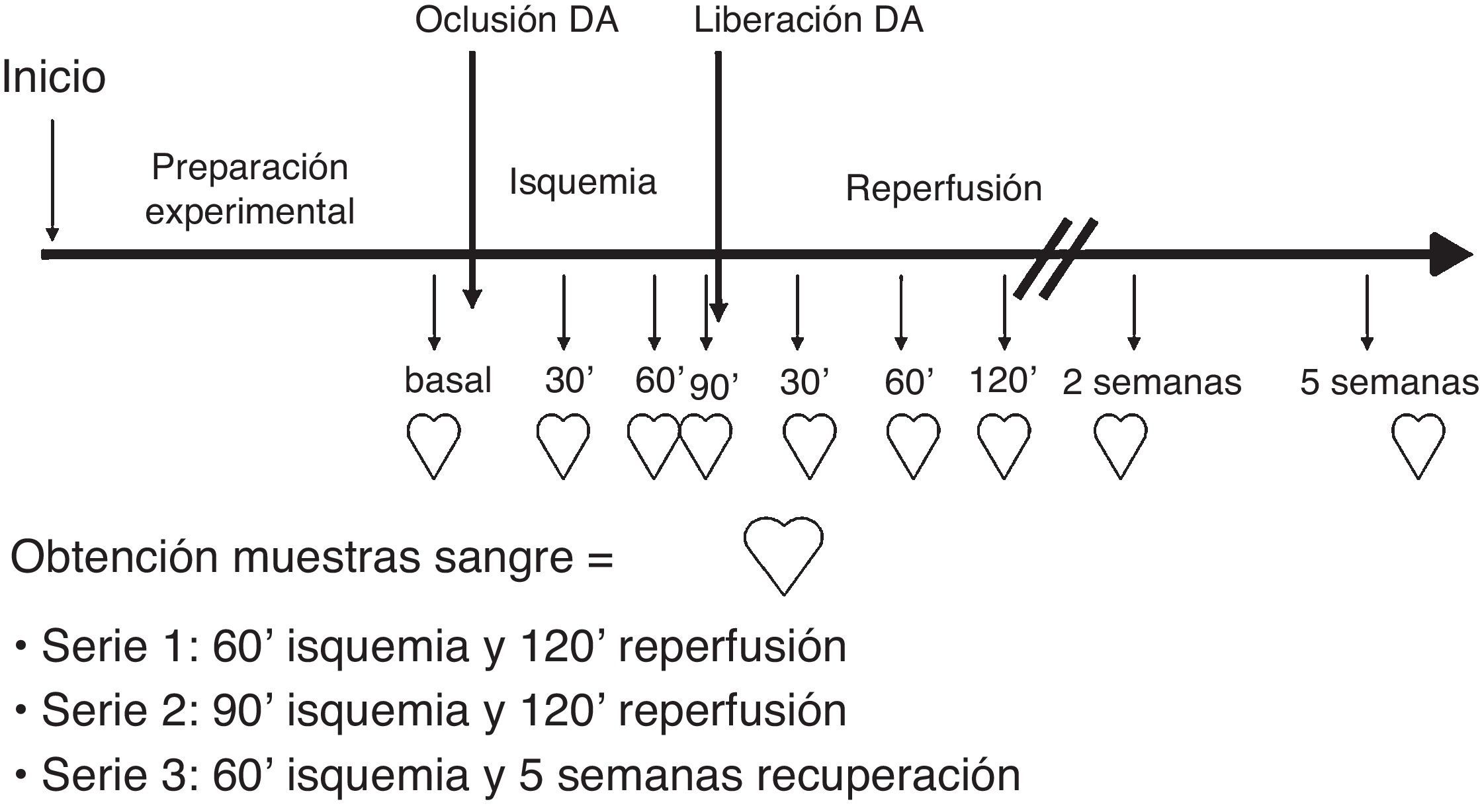
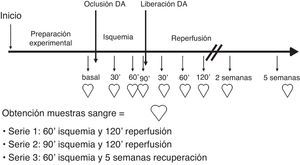
Se formaron 3 series experimentales por asignación directa de los animales a cada una, siguiendo un método de azar por el personal de estabularios. No se utilizó ningún procedimiento específico de enmascaramiento de la distribución. En todas las series se procedió a la oclusión mecánica de la arteria coronaria descendente anterior (CDA). Serie 1 (S1) (n = 6), se realizó oclusión de CDA durante 60 min con posterior liberación y seguimiento durante 2 h; serie 2 (n = 8) se ocluyó la CDA durante 90 min, seguido de 2 h de reperfusión y en la serie 3 (n = 5) se realizó oclusión de 60 min y seguimiento de 5 semanas (fig. 1).
Preparación experimentalLa anestesia se indujo con propofol intravenoso (iv) (6mg/kg). Se mantuvo la anestesia con sevofluorano (2.5%) en una mezcla del 40% de oxígeno y del 60% de protóxido de nitrógeno, suministrada en un respirador Temel VT3. La analgesia y la relajación muscular se obtuvieron con cloruro mórfico (1mg/kg) en bolo iv y bromuro de vecuronio (0.08mg/kg/iv), respectivamente. El mantenimiento se alcanzó con las mismas dosis de ambos en 50 cc de suero fisiológico en bomba de infusión a 12ml por hora. Se realizaron gasometrías para controlar y corregir los parámetros respiratorios; se monitorizó la temperatura rectal y se mantuvo en 38-39°C con manta eléctrica. El registro del ECG periférico se realizó con electrodos subcutáneos en las extremidades.
Se realizó una esternotomía y posterior pericardiotomía para exposición del corazón. Tras la disección de la CDA en su tercio medio, proximal a la segunda diagonal, se colocó una referencia para la posterior oclusión coronaria. Se colocó un medidor de flujo (Transonic Systems) en la raíz aórtica; se implantaron 3 pares de microcristales ultrasónicos (Biopac Systems): un par en el subendocardio de la zona de base del ventrículo izquierdo (VI) (subsidiario de la coronaria circunfleja, zona control), otro par en subendocardio de cara anterior del VI junto a la 2.ª diagonal (zona periisquémica) y un tercer par en la zona del ápex del VI (por debajo de CDA ocluida, zona isquémica). A través de la pared libre del VI y de la orejuela de la aurícula izquierda se implantaron 2 catéteres para el registro de la presión ventricular (PVI) y auricular izquierdas (PAI).
En la serie 3, se realizaron registros de ECG y PVI y no de contractilidad regional con microcristales ni flujo de aorta, con la intención de manipular lo menos posible para mejorar su supervivencia. Tras la isquemia y una hora de reperfusión controlada, se pasó al cierre del tórax y al despertar del animal.
Se realizó estudio ecocardiográfico basal (el día antes del protocolo isquémico) y otro a las 5 semanas de la inducción del infarto. A las 5 semanas se procedió a la anestesia y apertura del tórax con exposición del corazón; se realizaron los registros de presiones y ECG así como la toma de muestras sanguíneas.
Estudios morfológicosEn todos los animales se procedió a la eutanasia mediante la inyección iv de cloruro potásico (KCl 10ml), para producir parada cardíaca en diástole, estando anestesiado y con respirador mecánico; posteriormente se procedió a la extracción de la pieza y al lavado con solución salina fisiológica. A continuación se cortaron desde el ápex 4 secciones de 5-7mm de grosor; estas se incubaron a 37°C durante 20 min en una solución de cloruro de trifeniltetrazolio al 1% (TTZ). El TTZ reacciona con las células en función de su actividad mitocondrial (deshidrogenasas); en el miocardio viable es convertido en rojo de formazán por acción de las deshidrogenasas, que tiñen de rojo oscuro el tejido. Dado que la actividad de las deshidrogenasas se encuentra abolida en las células necróticas, en los cortes miocárdicos sometidos a la incubación descrita se aprecia una zona pálida que corresponde al área de necrosis, lo que permite la medida del tamaño de tejido necrótico (fig. 2 A).
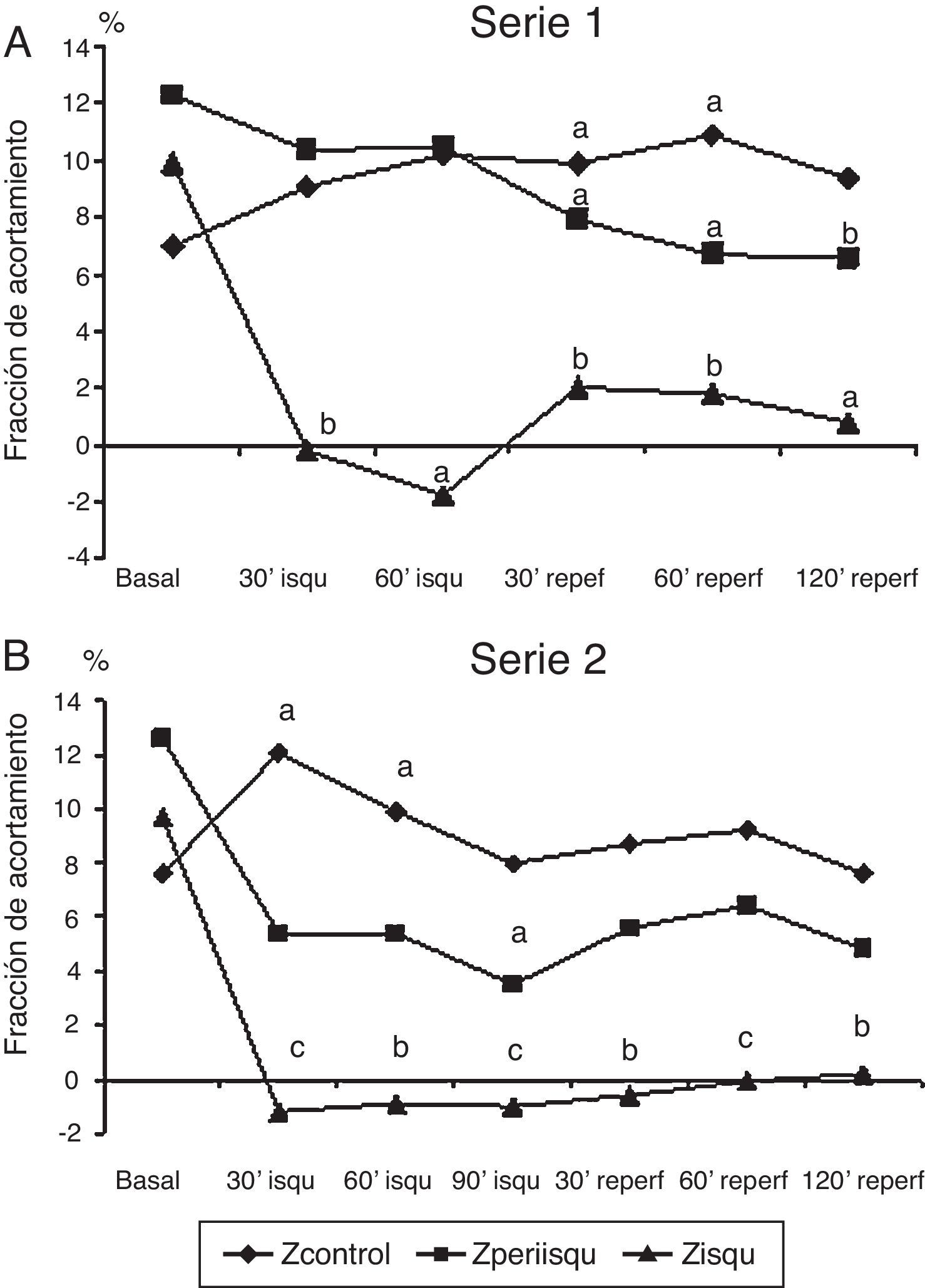
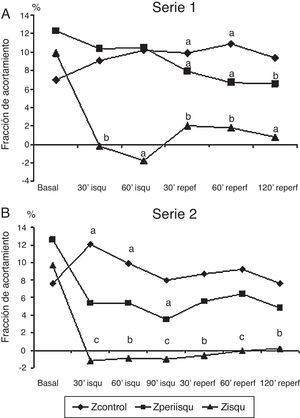
Representación gráfica de la fracción de acortamiento segmentario (FAc) en 3 zonas del ventrículo izquierdo, zona isquémica, zona periisquémica y zona control. A) En serie 1 (60 min de isquemia). B) En serie 2 (90 min de isquemia). Comparación de los valores promedio en cada fase respecto al valor basal. Significación estadística: a p<0.05; b p<0.01; c p<0.001.
Se midió el tamaño de la zona necrótica mediante un programa de imagen (Scion Image) y se calculó el área infartada, el volumen de infarto (multiplicando el área infartada por el grosor de cada sección) y el porcentaje de la zona necrótica respecto al ventrículo izquierdo analizado.
Con el paso del tiempo el tejido necrótico es sustituido por tejido fibroso, por lo que la tinción con TTZ no es útil; en la serie 3 en que los animales se sacrificaron a las 5 semanas del protocolo isquémico (60 min de oclusión coronaria), se midió el grosor (mm) de 4 puntos en cada sección de ventrículo izquierdo. Los puntos medidos fueron: tabique interventricular (TIV), pared lateral izquierda, pared anterior y pared posterior (fig. 2 B). Los datos obtenidos en esta serie se compararon con los datos de grosor de pared en los 4 puntos de la serie 1.
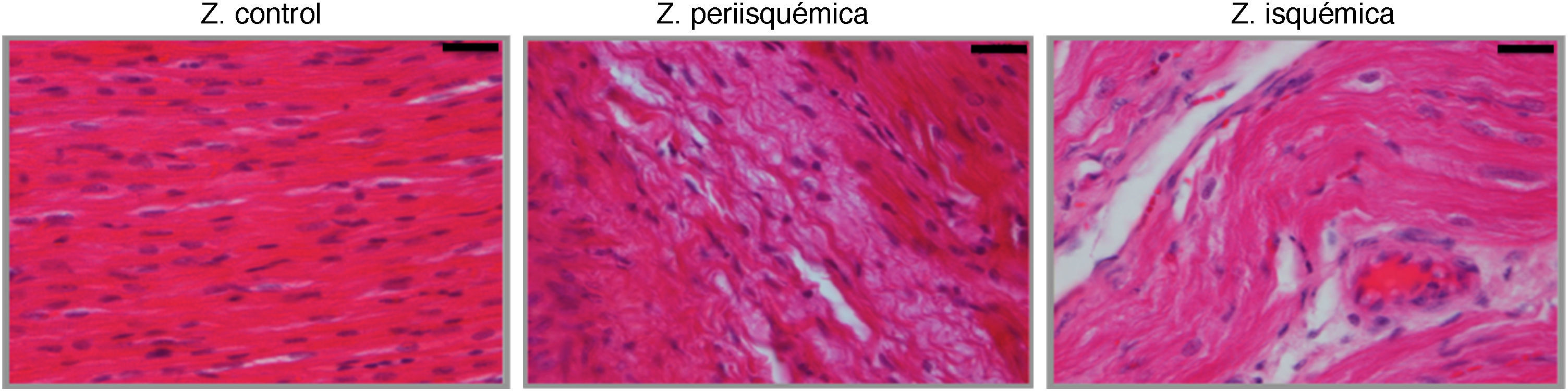
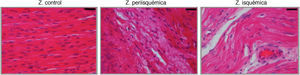
Se realizó análisis histológico en muestras de tejido de las zonas control, periisquémica e isquémica de las series 1 y 3 mediante la tinción con hematoxilina-eosina (H-E) (fig. 3).
Se digitalizaron y almacenaron en una memoria electrónica parámetros de función cardíaca global: ECG (derivada II o III), presión del VI (sistólica pico [PVI] y telediastólica [PTDVI] en mmHg), primera derivada de la presión con respecto al tiempo (dP/dt de PVI en mmHg/s), presión media de aurícula izquierda (PAI), flujo aórtico de raíz aórtica (promedio de ml cada 3 latidos, FlAo); gasto cardíaco calculado (volumen latido × frecuencia cardíaca, l/min) y parámetros de función miocárdica segmentaria: longitudes telediastólica y telesistólica (mm) y fracción de acortamiento (FAc % sobre la longitud telediastólica) de las 3 zonas de la cara anterior del VI: base, media y ápex correspondientes a zonas control, periisquémica e isquémica, respectivamente.
Para el estudio ecocardiográfico se utilizó un ecocardiógrafo General Electrics modelo Vivid S5 con sonda de 3MHz. Los parámetros ecocardiográficos medidos fueron: volumen de VI en telesístole y telediástole (vista apical de 4 y 2 cámaras); grosor de pared de VI en corte transversal por debajo de la inserción de los músculos papilares en zona anterior (GPA), lateral (GPL), posterior (GPP) y tabique interventricular (GTIV) (en la vista paraesternal eje corto VI, en 2D y en modo M) y alteraciones de la contractilidad en los diferentes segmentos. Mediante doppler color se realizó una valoración de posibles alteraciones valvulares. La función sistólica de VI se estimó mediante el cálculo de la fracción de acortamiento (a partir del diámetro telediastólico y telesistólico del VI) y la fracción de eyección por el método Simpson a partir de los volúmenes del VI telesistólico y telediastólico.
Se evaluó el daño miocárdico mediante la medición de niveles en plasma de troponina T (TnT, ng/ml) y creatincinasa MB (CK-MB, ng/ml) a partir de la extracción de 10ml de sangre venosa en cada fase. Las muestras de sangre se extrajeron en tubos estériles con EDTA, se centrifugaron a 3.000rpm a 4°C durante 10 min; el plasma obtenido se almacenó a –80°C hasta su estudio en tubos de criopreservación.
Fases de estudio de los registros de parámetros de función y de las muestras sanguíneas: 1) basal previo a la isquemia, 2) 30 min de isquemia, 3) 60 min de isquemia, 3b) 90 min de isquemia (S2), 4) 30 min de reperfusión, 5) 60 min de reperfusión, 6) 2 h de reperfusión (S1 y S2), 7) y 2 y 5 semanas tras la isquemia (S3) (fig. 1).
Análisis estadísticoSe muestran los resultados de las variables como media y desviación estándar; se comprobó la normalidad de la distribución de las variables mediante el test de Kolmogorov-Smirnov; se compararon los resultados de las variables en cada fase del estudio respecto a su situación basal. En las variables con distribución normal, se estudiaron las diferencias de medias para parámetros cuantitativos mediante la aplicación de ANOVA (N muestras) y el test de la t de Student para comparación de 2 medias (pareadas y no pareadas). Se compararon entre series los parámetros de estudio del tamaño de infarto y remodelado; se aplicó el test t de Student para muestras independientes. En las variables cuya distribución no cumplía la normalidad se utilizaron las pruebas no paramétricas de Mann-Whitney (pareadas) o el test de Wilcoxon (no pareadas) para 2 grupos y el test de Kruskall-Wallis para más de 2 grupos. Se consideró que existían diferencias estadísticamente significativas cuando p<0.05, con un intervalo de confianza del 95%. Se utilizó el programa estadístico SPSS 11.0.
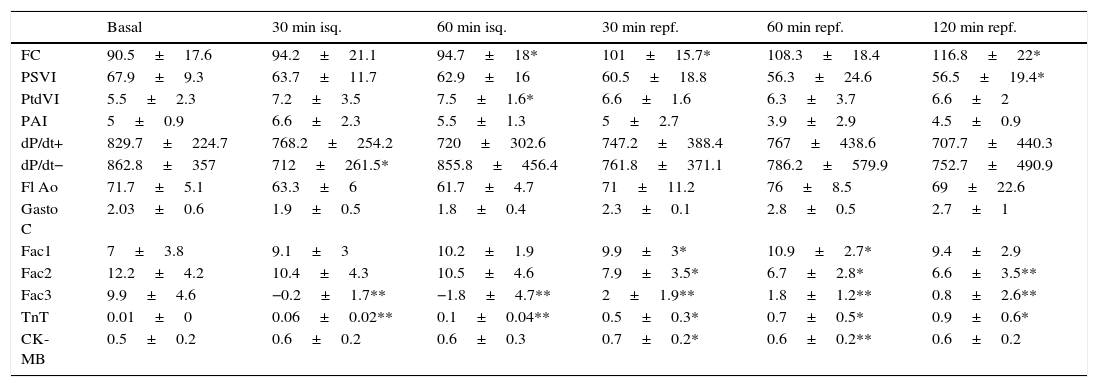
ResultadosSerie 1: isquemia de 60 min y 2 h de reperfusión (tabla 1)La inducción de la isquemia y posterior reperfusión dio lugar a pocos cambios en los parámetros de función cardíaca global; se produjeron alteraciones a nivel regional (parámetros de contractilidad regional) y celular (niveles de TnT y CK-MB).
Serie 1: isquemia 60 min y 120 min de recuperación
| Basal | 30 min isq. | 60 min isq. | 30 min repf. | 60 min repf. | 120 min repf. | |
|---|---|---|---|---|---|---|
| FC | 90.5±17.6 | 94.2±21.1 | 94.7±18* | 101±15.7* | 108.3±18.4 | 116.8±22* |
| PSVI | 67.9±9.3 | 63.7±11.7 | 62.9±16 | 60.5±18.8 | 56.3±24.6 | 56.5±19.4* |
| PtdVI | 5.5±2.3 | 7.2±3.5 | 7.5±1.6* | 6.6±1.6 | 6.3±3.7 | 6.6±2 |
| PAI | 5±0.9 | 6.6±2.3 | 5.5±1.3 | 5±2.7 | 3.9±2.9 | 4.5±0.9 |
| dP/dt+ | 829.7±224.7 | 768.2±254.2 | 720±302.6 | 747.2±388.4 | 767±438.6 | 707.7±440.3 |
| dP/dt− | 862.8±357 | 712±261.5* | 855.8±456.4 | 761.8±371.1 | 786.2±579.9 | 752.7±490.9 |
| Fl Ao | 71.7±5.1 | 63.3±6 | 61.7±4.7 | 71±11.2 | 76±8.5 | 69±22.6 |
| Gasto C | 2.03±0.6 | 1.9±0.5 | 1.8±0.4 | 2.3±0.1 | 2.8±0.5 | 2.7±1 |
| Fac1 | 7±3.8 | 9.1±3 | 10.2±1.9 | 9.9±3* | 10.9±2.7* | 9.4±2.9 |
| Fac2 | 12.2±4.2 | 10.4±4.3 | 10.5±4.6 | 7.9±3.5* | 6.7±2.8* | 6.6±3.5** |
| Fac3 | 9.9±4.6 | −0.2±1.7** | −1.8±4.7** | 2±1.9** | 1.8±1.2** | 0.8±2.6** |
| TnT | 0.01±0 | 0.06±0.02** | 0.1±0.04** | 0.5±0.3* | 0.7±0.5* | 0.9±0.6* |
| CK-MB | 0.5±0.2 | 0.6±0.2 | 0.6±0.3 | 0.7±0.2* | 0.6±0.2** | 0.6±0.2 |
CK-MB: creatincinasa-MB (ng/mL); dP/dt: derivada de la presión respecto al tiempo (mmHg/s), + máxima positiva, − máxima negativa; FAc: fracción de acortamiento segmentario (%); FC: frecuencia cardíaca (lpm); Fl Ao: flujo en raíz aórtica (ml/3 latidos); isq: isquemia; PAI: presión media de aurícula izquierda (mmHg); PSVI: presión sistólica del ventrículo izquierdo (mmHg); PtdVI: presión telediastólica del ventrículo izquierdo (mmHg); repf: reperfusión; TnT: troponina T (ng/mL).
Significación estadística: * p<0.05; ** p<0.01; *** p<0.001.
Comparación de promedios de cada fase con situación basal.
La presión sistólica del VI se mantuvo con valores similares a los basales (67.9±9.3mmHg) durante todo el protocolo. A los 120 min de reperfusión la PVI sistólica descendió de forma significativa (56.5±19.4mmHg; p<0.05). La presión telediastólica del VI ascendió de forma significativa durante la isquemia, para volver posteriormente a sus valores basales. No hubo cambios significativos en la evolución de la dP/dt máxima positiva, mientras que en la mínima negativa hubo un ascenso significativo a los 30 min de isquemia, recuperando los valores basales el resto del estudio. Los valores de la PAI no variaron significativamente a lo largo del proceso.
La frecuencia cardíaca se incrementó a partir de la realización de la isquemia y se mantuvo significativamente más elevada durante todo el seguimiento. El flujo de aorta, así como el volumen latido y el gasto cardíaco descendieron en la isquemia, pero se recuperaron en la reperfusión, en relación con el incremento de la frecuencia.
La fracción de acortamiento miocárdico regional mostró una afectación clara en la zona isquémica (FAc 3) durante la oclusión coronaria con valores que indicaron discinesia y que no llegaron a recuperarse en el periodo de reperfusión; la zona periisquémica mostró una afectación de la contractilidad regional (FAc 2) con descenso de sus valores, que se mantuvieron significativamente más bajos que en la situación basal durante la reperfusión; la zona control o de la base del VI (FAc 1) mostró un incremento de la contractilidad durante y después de la isquemia (fig. 2A).
Se produjo fibrilación ventricular (FV) en 3 casos (50%) durante el periodo de isquemia (entre los 30 y 45 min); en todos los casos la FV remitió con masaje y desfibrilación eléctrica de 20 J de energía.
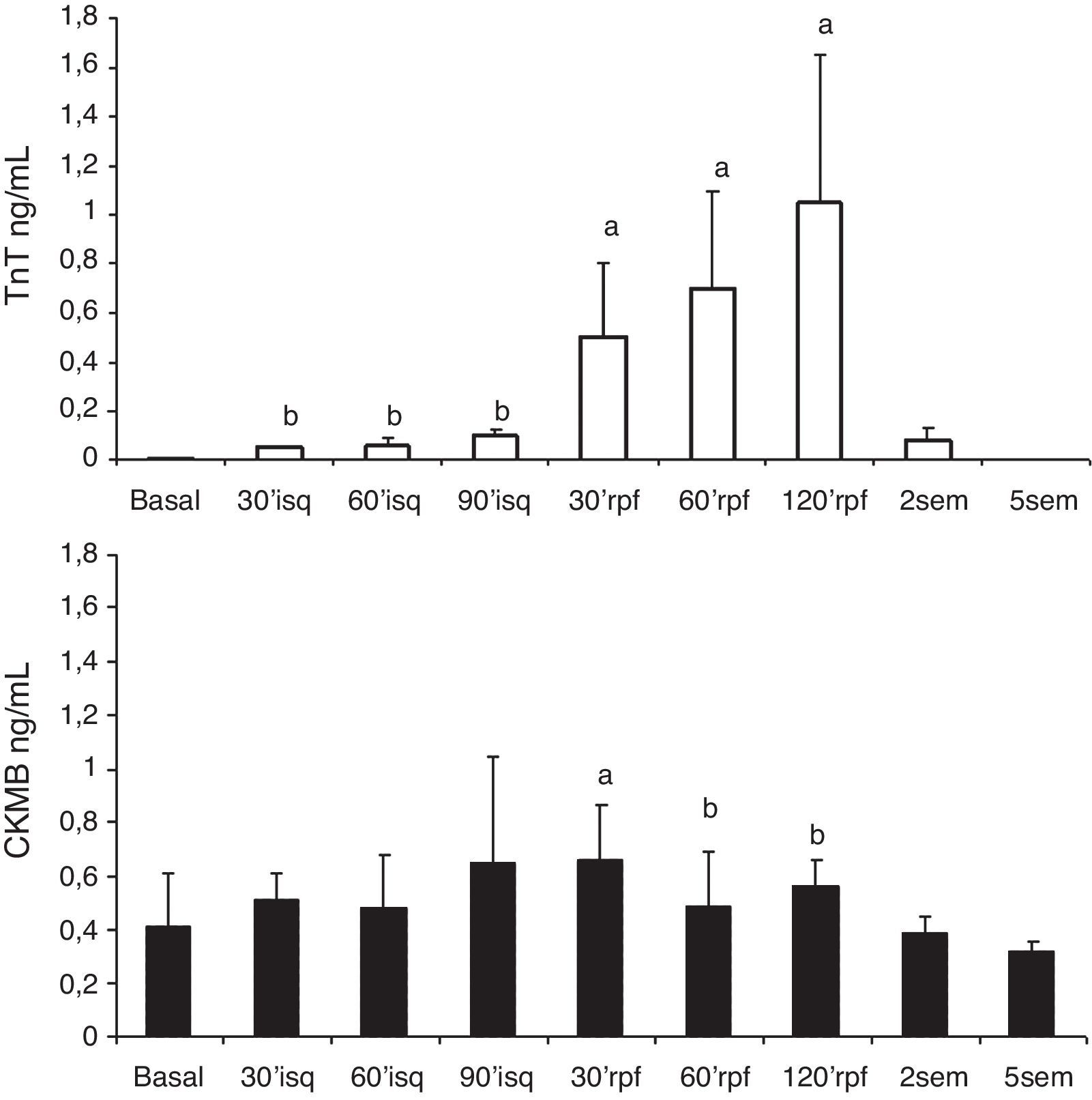
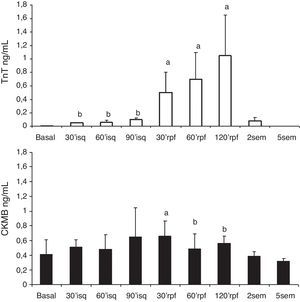
Los niveles plasmáticos de TnT se incrementaron significativa y progresivamente respecto al nivel basal, desde la inducción de la isquemia. Los niveles de CK-MB se elevaron tras la isquemia (fig. 3).
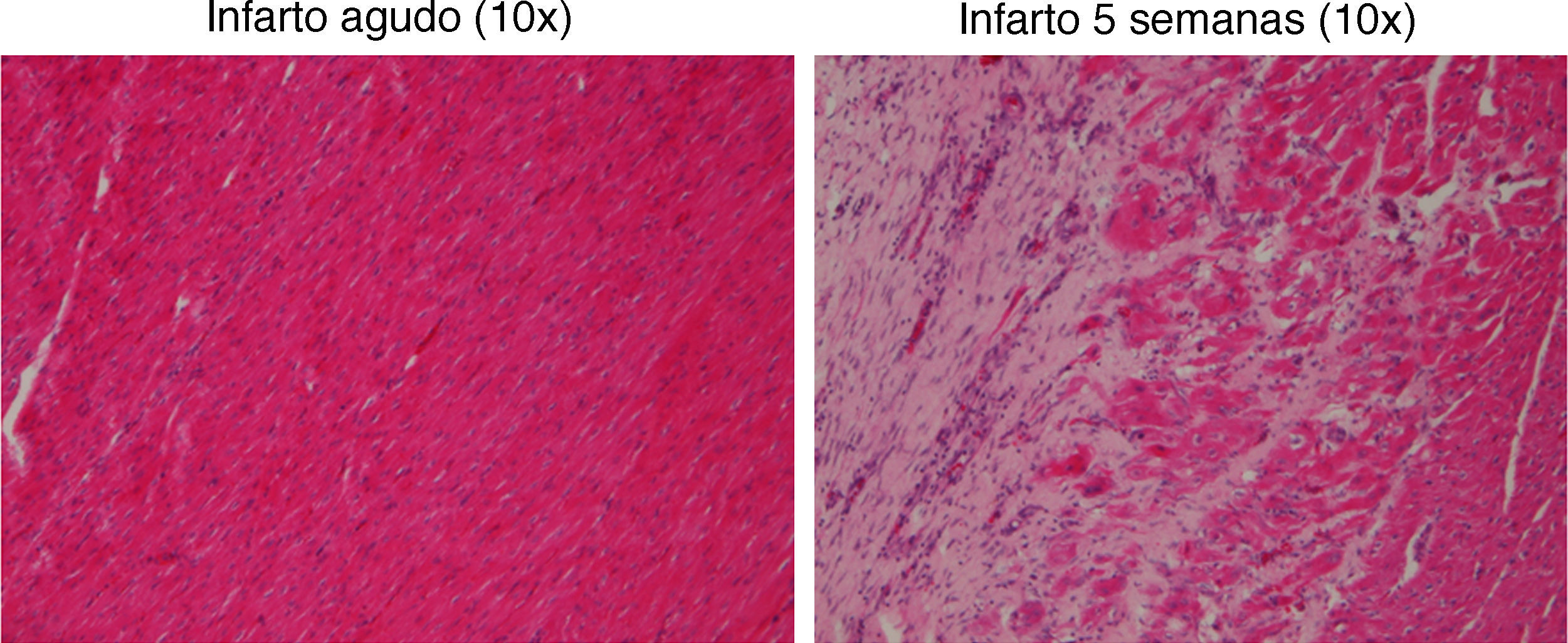
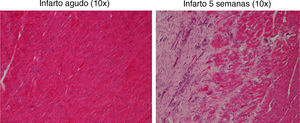
La tinción con H-E mostró diferencias en el tejido miocárdico entre las 3 zonas; en la zona sana se observan las bandas lineales de los sarcómeros y en la zona isquémica se observa la disposición en oleaje de las bandas (fig. 4).
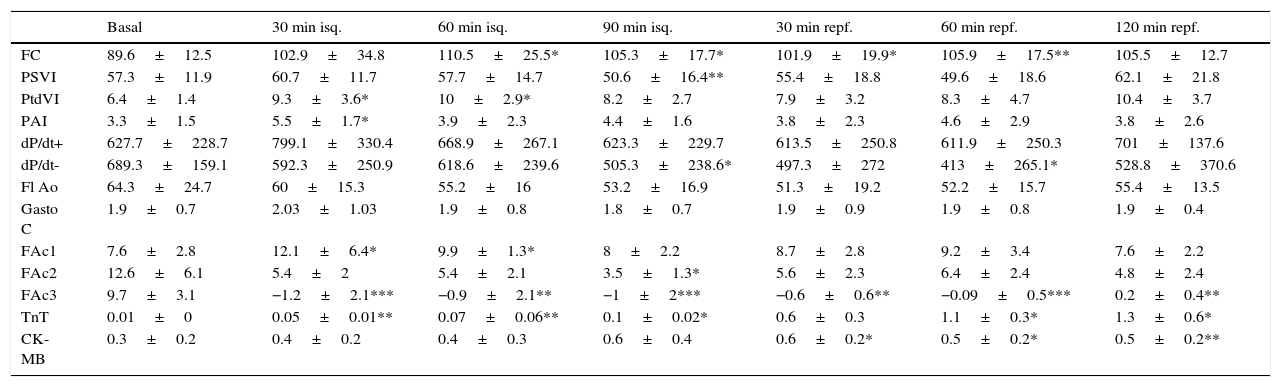
Serie 2: isquemia de 90 min y 2 h de reperfusión (tabla 2)En esta serie se incluyeron 8 cerdos con un peso promedio de 21±2.6kg. La presión de VI descendió significativamente durante la isquemia y se recuperó a las 2 h del seguimiento; la frecuencia cardíaca se incrementó significativamente durante la isquemia y se mantuvo alta en el periodo de reperfusión, mientras que el flujo aórtico descendió. La contractilidad regional mostró la misma respuesta que con 60 min de isquemia, con mejoría de la contractilidad en la zona control, disminución de la contractilidad (hipocinesia) en la zona periisquémica y discinesia sin recuperación tras la isquemia en la zona isquémica (fig. 2B). Los niveles de TnT se elevaron significativamente y en mayor grado con los 90 min de isquemia, aunque las diferencias entre las series no fueron significativas; también hubo elevación significativa de CK-MB.
Serie 2: 90 min de isquemia y 120min de reperfusión
| Basal | 30 min isq. | 60 min isq. | 90 min isq. | 30 min repf. | 60 min repf. | 120 min repf. | |
|---|---|---|---|---|---|---|---|
| FC | 89.6±12.5 | 102.9±34.8 | 110.5±25.5* | 105.3±17.7* | 101.9±19.9* | 105.9±17.5** | 105.5±12.7 |
| PSVI | 57.3±11.9 | 60.7±11.7 | 57.7±14.7 | 50.6±16.4** | 55.4±18.8 | 49.6±18.6 | 62.1±21.8 |
| PtdVI | 6.4±1.4 | 9.3±3.6* | 10±2.9* | 8.2±2.7 | 7.9±3.2 | 8.3±4.7 | 10.4±3.7 |
| PAI | 3.3±1.5 | 5.5±1.7* | 3.9±2.3 | 4.4±1.6 | 3.8±2.3 | 4.6±2.9 | 3.8±2.6 |
| dP/dt+ | 627.7±228.7 | 799.1±330.4 | 668.9±267.1 | 623.3±229.7 | 613.5±250.8 | 611.9±250.3 | 701±137.6 |
| dP/dt- | 689.3±159.1 | 592.3±250.9 | 618.6±239.6 | 505.3±238.6* | 497.3±272 | 413±265.1* | 528.8±370.6 |
| Fl Ao | 64.3±24.7 | 60±15.3 | 55.2±16 | 53.2±16.9 | 51.3±19.2 | 52.2±15.7 | 55.4±13.5 |
| Gasto C | 1.9±0.7 | 2.03±1.03 | 1.9±0.8 | 1.8±0.7 | 1.9±0.9 | 1.9±0.8 | 1.9±0.4 |
| FAc1 | 7.6±2.8 | 12.1±6.4* | 9.9±1.3* | 8±2.2 | 8.7±2.8 | 9.2±3.4 | 7.6±2.2 |
| FAc2 | 12.6±6.1 | 5.4±2 | 5.4±2.1 | 3.5±1.3* | 5.6±2.3 | 6.4±2.4 | 4.8±2.4 |
| FAc3 | 9.7±3.1 | −1.2±2.1*** | −0.9±2.1** | −1±2*** | −0.6±0.6** | −0.09±0.5*** | 0.2±0.4** |
| TnT | 0.01±0 | 0.05±0.01** | 0.07±0.06** | 0.1±0.02* | 0.6±0.3 | 1.1±0.3* | 1.3±0.6* |
| CK-MB | 0.3±0.2 | 0.4±0.2 | 0.4±0.3 | 0.6±0.4 | 0.6±0.2* | 0.5±0.2* | 0.5±0.2** |
CK-MB: creatincinasa-MB (ng/ml); dP/dt: derivada de la presión respecto al tiempo (mmHg/s), + máxima positiva, − máxima negativa; FAc: fracción de acortamiento segmentario (%); FC: frecuencia cardíaca (lpm); Fl Ao: flujo en raíz aórtica (ml/3 latidos); gasto C: gasto cardíaco (l/min); isq: isquemia; PAI: presión media de aurícula izquierda (mmHg); PSVI: presión sistólica del ventrículo izquierdo (mmHg); PtdVI: presión telediastólica del ventrículo izquierdo (mmHg); repf: reperfusión; TnT: troponina T (ng/ml).
Significación estadística: * p<0.05; ** p<0.01; *** p<0.001.
Comparación de promedios de cada fase con situación basal.
En todos los casos se produjo FV durante el periodo de isquemia (entre los 30 y 60 min de isquemia) y en 2 casos también se produjo FV en los primeros 30 min de reperfusión. En todos los casos se aplicó masaje cardíaco y choque eléctrico de 20 J de energía para la desfibrilación.
En esta serie con más tiempo de isquemia, la FAc 3 (zona isquémica) se afectó en mayor grado y durante más tiempo que en la serie con isquemia de 60 min. En ambas series se midió el tamaño del infarto con la técnica de tinción con TTZ; el volumen de tejido necrótico medido en la S2 fue significativamente mayor que en la S1 (6.7 vs. 2.4 cm3; p=0.012). Respecto al volumen de tejido del VI medido, correspondió a un infarto del 13.9% en la SI y 22.9% en la S2 (p=0.04).
El incremento en el tiempo de la isquemia se tradujo en un aumento del daño miocárdico regional tanto funcional como estructuralmente, sin diferencias en la función cardíaca global.
Serie 3: isquemia de 60 min y 5 semanas de reperfusión (tabla 3)En todos los casos se produjo FV durante el periodo de isquemia y en un caso también en la reperfusión. La FV revirtió en el 100% de los casos con masaje y choque de 20 J. La supervivencia a las 5 semanas fue del 100%.
Serie 3: isquemia de 60 min, seguimiento 5 semanas
| Basal | 30 min isq. | 60 min isq. | 30 min repf. | 60 min repf. | 5 semanas | |
|---|---|---|---|---|---|---|
| FC | 95±21 | 105.6±36.8 | 100.2±24.1 | 110.3±24.2 | 114.3±29 | 98.2±14.7 |
| PSVI | 56.5±8 | 53.1±7.5 | 47.5±5.9** | 47.8±7.3 | 49.5±8.4 | 71.1±12.4 |
| PtdVI | 4.8±2.4 | 6.7±3.8 | 6.3±.6 | 8.8±7.5 | 6.3±3.7 | 6.6±2 |
| dP/dt+ | 660±246.1 | 692.2±255.1 | 618.2±184.9 | 553.3±155.8 | 663.2±238.6 | 712.8±259.1 |
| dP/dt- | 735±184.4 | 644.8±151 | 581.6±150.9* | 578.5±192.7* | 625.3±222.2 | 1,041.4±277.9 |
| TnT | 0.01±0 | 0.03±0.01* | 0.4±0.1** | 0.003±0*** | ||
| CK-MB | 0.3±0.1 | 0.4±0.1 | 0.2±0.1 | 0.3±0.3 |
CK-MB: creatincinasa-MB (ng/ml); dP/dt: derivada de la presión respecto al tiempo (mmHg/s), + máxima positiva, − máxima negativa; FC: frecuencia cardíaca (lpm); isq: isquemia; PSVI: presión sistólica del ventrículo izquierdo (mmHg); PtdVI: presión telediastólica del ventrículo izquierdo (mmHg); repf: reperfusión; TnT: troponina T (ng/ml).
Significación estadística: * p<0.05; ** p<0.01; *** p<0.001.
Comparación en distintos tiempos con situación basal.
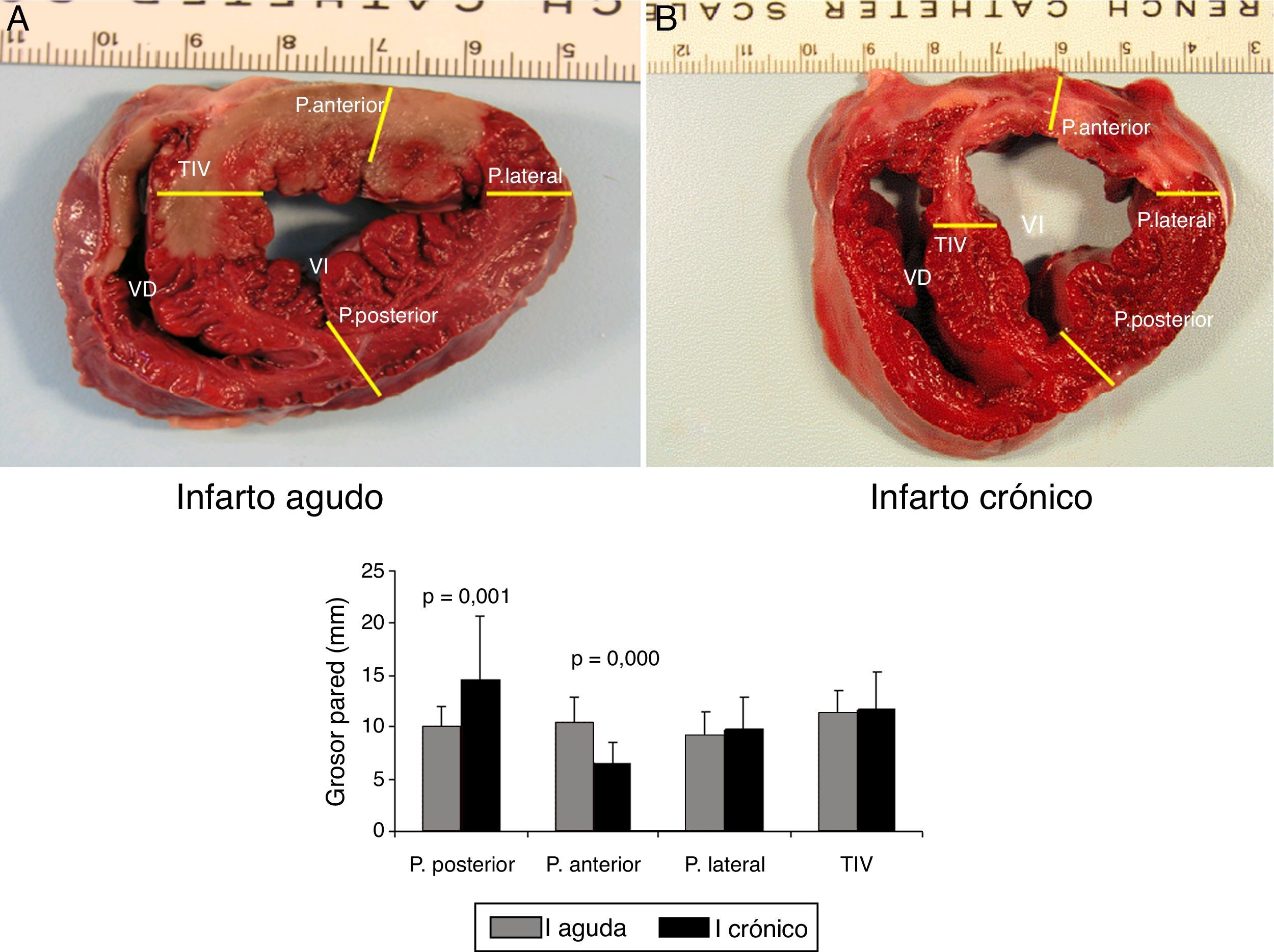
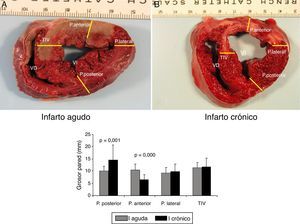
A las 5 semanas del infarto la función cardíaca se recuperó totalmente con valores de los parámetros de presión ventricular, frecuencia cardíaca y dP/dt similar a los basales. Se produjo remodelado cardíaco, traducido en un adelgazamiento producido en la pared anterior (zona isquémica) del VI, con un aumento compensador del grosor de la pared posterior del VI (fig. 5).
Imágenes macroscópicas de una sección de corazón. A) Representa una sección de corazón que ha sufrido una isquemia de 60 min seguida de 2 h de reperfusión (infarto agudo). B) Imagen de una sección de corazón a las 5 semanas del infarto (infarto crónico). Se muestran los puntos en que se ha medido el grosor de pared anterior; lateral, posterior y del tabique interventricular.
En la gráfica de barras se muestra el valor promedio y DE de cada punto en todas las secciones en el modelo agudo (serie 1) y en el crónico (serie 3). Las diferencias fueron estadísticamente significativas en los segmento de pared anterior y posterior entre ambas series.
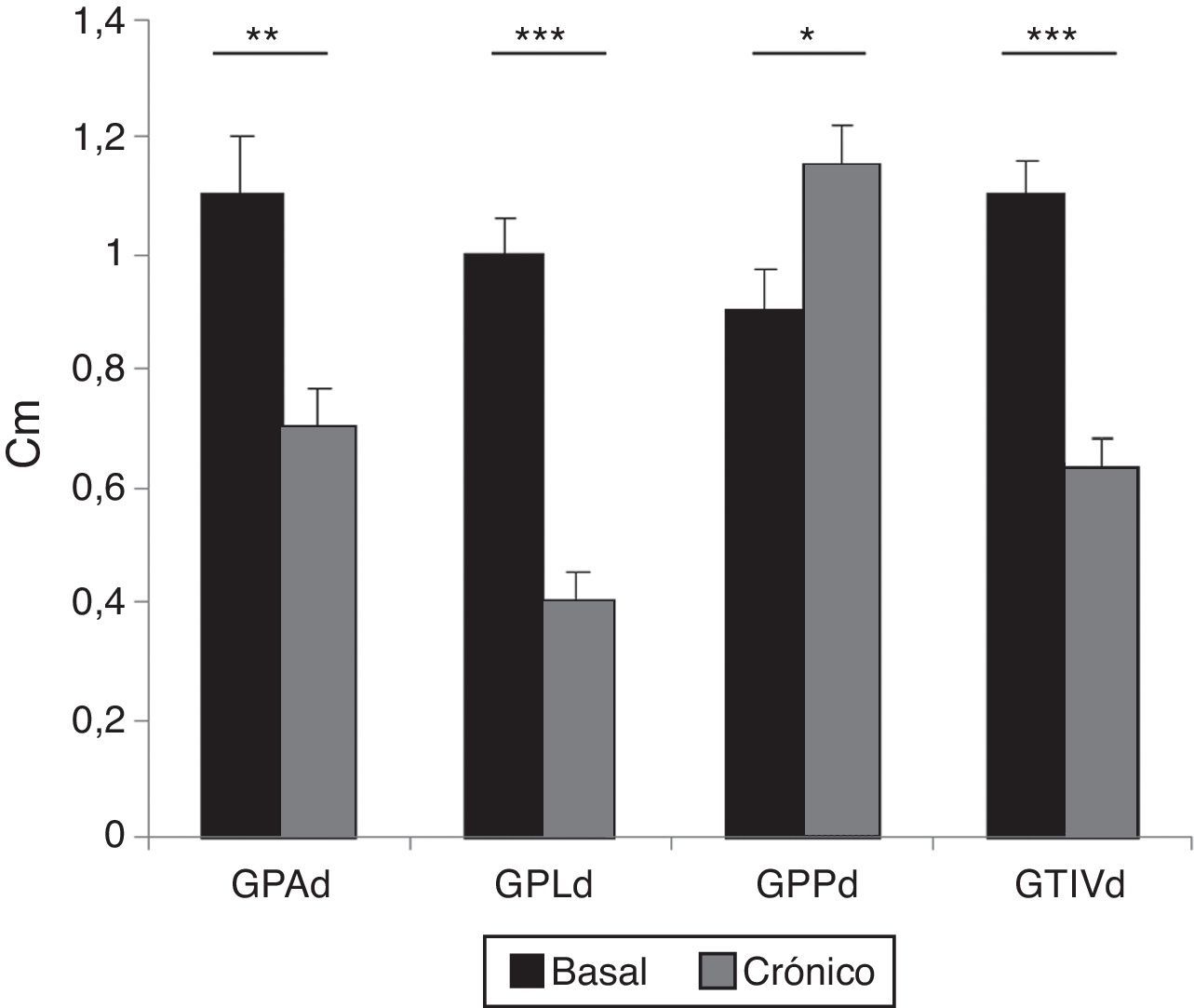
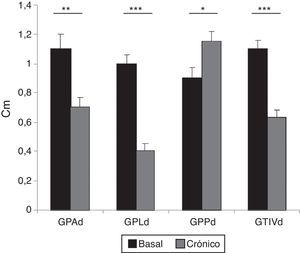
El estudio ecocardiográfico a las 5 semanas del infarto mostró una disminución, aunque no significativa, tanto de la fracción de acortamiento (29±1.4% basal vs. 21±5.6% 5 semanas) como de la fracción de eyección calculada por el método Simpson (60±5% basal vs. 40.5±6.4% 5 semanas). La medida del grosor de las paredes mostró el remodelado ventricular, al comparar los valores basales con los obtenidos a las 5 semanas, con disminución significativa del grosor de pared anterior, lateral y del TIV y aumento significativo del grosor de la pared posterior (fig. 6).
Valores del grosor de las paredes de VI al inicio y al final del experimento (ECO modo M). d: diástole; GPA: grosor de la pared anterior; GPL: grosor de la pared lateral; GPP: grosor de la pared posterior; GTIV: grosor del tabique interventricular.
Los valores se representan como la media±DE (*p<0.05; **p<0.01; ***p<0.001).
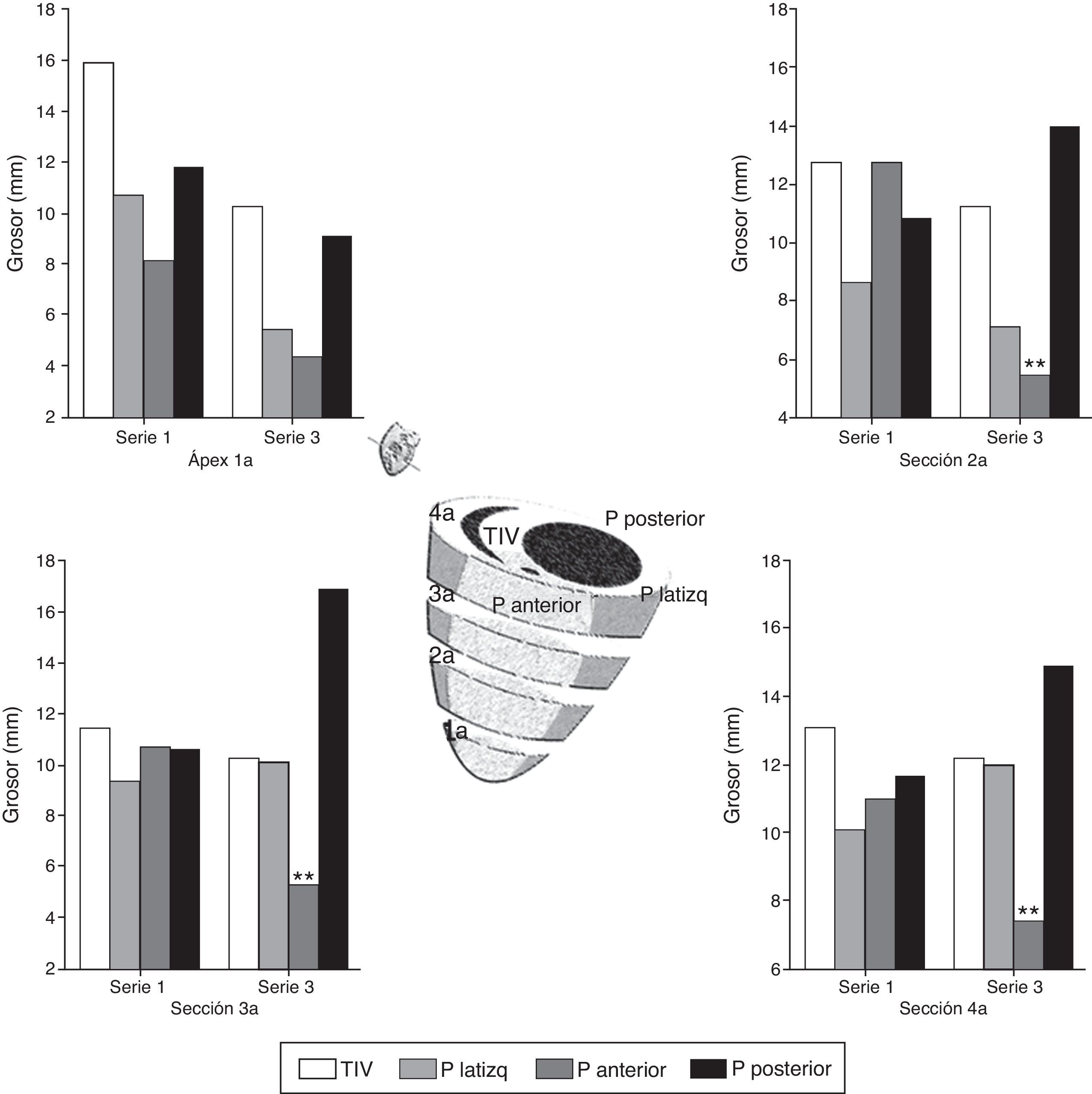
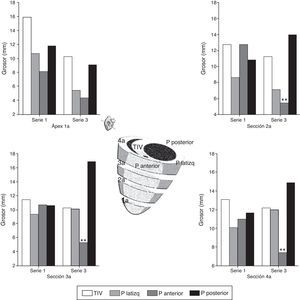
En el estudio posmortem se obtuvieron 4 secciones del ventrículo izquierdo de 5-7mm de grosor por debajo del punto de oclusión coronaria hasta ápex; se midió la distancia desde el epicardio hasta el endocardio (grosor) de 4 puntos en cada sección situadas en el TIV, la pared lateral izquierda, la pared anterior y la pared posterior (fig. 5). En la tabla 4 y figura 7, se muestran los valores promedio de grosor en cada punto y en cada sección en la parte superior (A) e inferior (B) de la serie 1 (agudo) y de la serie 3 (crónico); se estudiaron las diferencias de grosor en cada punto entre ambas series.
Grosor de pared de VI en series 1 y 3
| TIV S1 vs. S3 | P. lat. izquierda S1 vs. S3 | P. anterior S1 vs. S3 | P. posterior S1 vs. S3 | |
|---|---|---|---|---|
| Sección 1 | 15.9±0/10.2±7.6 | 10.7±0/5.4±3.6 | 8.1±0/4.8±1.6 | 11.8±0/8.7±5.6 |
| Sección 2A | 12.7±2.6/11.2±3.5 | 8.1±2.0/7.1±1.7 | 11.7±2.8/5.4±2.2** | 10.4±1.7/14.1±4.4 |
| Sección 2B | 11.4±2.2/11.1±3.1 | 9.9±3.9/7.5±2.7 | 11.3±2.4/5.9±1.5** | 10.6±1.3/14.1±10.2 |
| Sección 3A | 11.4±1.2/10.2±3.1 | 9.2±2.2/10.0±2.7 | 10.6±1.6/5.2±1.1*** | 10.5±2.6/16.7±7.3 |
| Sección 3B | 11.4±1.8/10.3±4.0 | 9.4±2.1/10.3±2.1 | 11.4±2.8/6.8±1.2** | 10.3±2.2/14.9±3.5* |
| Sección 4A | 13.0±1.9/12.2±4.9 | 10.0±1.8/11.9±2.8 | 10.9±2.1/7.3±2.2** | 11.6±2.5/14.9±3.0 |
| Sección 4B | 12.5±2.2/12.6±3.3 | 9.9±2.0/13.0±2.2* | 10.1±2.6/6.9±1.2* | 10.8±3.0/16.1±3.7* |
A: cara superior de las secciones; B: cara inferior de las secciones; lat: lateral; P: pared; TIV: tabique interventricular.
Valores presentados como media y desviación estándar del grosor de pared (mm). Comparación de valores de cada punto de la serie 1 con la serie 3.
Significación estadística: *p<0.05; **p<0.01; ***p<0.001.
Representación gráfica del grosor de pared en 4 puntos: pared anterior, pared lateral, pared posterior y tabique interventricular de 4 secciones del corazón en su cara anterior (1a, 2a, 3a, 4a). Comparación entre la serie 1 y la serie 3. En el esquema central se muestra la situación de cada sección. p.: pared: TIV: tabique interventricular.
Significación estadística: ** p<0.01.
La comparación de los datos obtenidos entre la serie 1 (reperfusión de 120 min) y la serie 3 (5 semanas) mostraron diferencias significativas en los puntos correspondientes a la pared anterior del VI. En la S3 se produjo un marcado adelgazamiento con un aumento de grosor de la pared posterior del VI (fig. 5).
El estudio histológico de miocardio teñido con H-E mostró el tejido cicatricial correspondiente a la zona afectada por el infarto en el que el tejido miocárdico fue sustituido por tejido fibroso (colágeno) (fig. 8).
Se produjeron arritmias ventriculares malignas (FV) en un 79% de los casos; tan solo en 4 casos no se desencadenó FV durante el protocolo isquémico ni en la reperfusión. Las FV en el periodo de isquemia se dieron siempre en los primeros 60 min de la isquemia, no hubo ninguna FV de isquemia después de los 60 min; hubo 3 casos con FV en la reperfusión, 2 de ellos en el protocolo de isquemia de mayor duración. Debido a la facilidad de desfibrilación (tórax abierto y choques de baja energía 10-20J) y de recuperación, se completó el protocolo en todos los casos.
El porcentaje de infarto fue significativamente mayor en la S2 (22.9±7.8% vs. 13.4±5.4%; p=0.04); se produjo distensión de la zona isquémica con abombamiento y una hipo/discinesia sin diferencias entre los animales que no fibrilaron (FAc3 0.4±1.05%) y los que tuvieron FV durante la isquemia (Fac3 −1.8±3.7%).
DiscusiónEl modelo experimental más utilizado para el estudio de daño cardíaco en animal grande es el modelo en el cerdo; la circulación colateral coronaria y la anatomía arterial en estos animales son muy similares a las del ser humano, por lo que en ciertos aspectos son comparables, como es en la predicción del tamaño de infarto, o en la fisiopatología de la cardiopatía isquémica. Modelos de isquemia y reperfusión tanto en animal grande (cerdos) como pequeño (ratas) coinciden en que un tiempo mínimo de 60 min de isquemia y otros 60 min de reperfusión permiten la producción de un infarto y, en el caso de las ratas, este se muestra homogéneo18–20.
Presentamos un estudio descriptivo de los acontecimientos morfológicos y funcionales debidos a la inducción de una isquemia aguda durante un tiempo suficiente para producir un infarto agudo. La utilización de un modelo experimental con tórax abierto permite la observación macroscópica de los cambios en la superficie cardíaca, la utilización de soniometría que permite la medida directa de la contractilidad miocárdica regional y la diferenciación de zonas dependiendo de su irrigación. El tórax abierto también ha permitido la implantación de medidores de flujo en raíz aórtica y, en el caso de aparición de FV, tanto el masaje cardíaco como la desfibrilación con choque de baja energía fueron efectivos en todos los casos.
Se muestran los cambios que la isquemia aguda produce sobre la función global cardíaca y los cambios que se producen en el miocardio regional en 3 zonas del VI con distinta afectación por la isquemia. Se describe la afectación en la zona dependiente de la falta de riego por la oclusión coronaria en la que se produce una alteración de la contractilidad que no se recupera con la reperfusión por la necrosis del tejido miocárdico, con elevación de los niveles de TnT en plasma, falta de tinción con TTZ por la eliminación de deshidrogenadas en ese tejido y adelgazamiento y sustitución por tejido fibroso con el paso del tiempo (secciones a las 5 semanas). Hemos visto que el tamaño del infarto fue dependiente del tiempo de isquemia, mayor con 90 min de isquemia.
Por otro lado, se describe un incremento en la contractilidad en la zona, no dependiente de la coronaria ocluida durante la isquemia, que va a compensar la función global del corazón. En las secciones de corazón a las 5 semanas del infarto se observa un aumento del grosor de la pared posterior del VI, zona enfrentada a la zona infartada como muestra del remodelado que se produce. Los resultados fueron similares con el ecocardiograma.
La incidencia de arritmias espontáneas graves, se han contabilizado solo las FV, fue muy elevada (79%) durante la isquemia, los factores mecánicos debidos a la distensión de la pared ventricular potencian la vulnerabilidad del miocardio frente a las arritmias malignas21. En el periodo de reperfusión se produjeron arritmias en 3 casos; aunque la zona infartada se mantiene hipocinética, ha desaparecido la distensión que se producía en esta zona durante la isquemia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.