En este artículo hemos querido establecer que el bloqueo interauricular existe como entidad anatomoeléctrica y que debe ser considerado como un verdadero bloqueo. El bloqueo interauricular presenta diferentes grados al igual que otros bloqueos del sistema de conducción. Puede presentarse como expresión de remodelado puramente eléctrico o acompañar alteraciones estructurales que dilaten las aurículas. Se encuentra asociado a arritmias supraventriculares y es probablemente un predictor de accidente cerebrovascular cardioembólico. El bloqueo interauricular puede presentarse de manera transitoria, y en ciertas circunstancias clínicas, puede ser reversible. El aporte del mapeo endocavitario ha incrementado el conocimiento sobre su anatomía y fisiopatología, y posiblemente la magnetocardiografía podría contribuir al estudio no invasivo de esta entidad.
La terminología a utilizar debería ser bloqueo interauricular de primer, segundo y tercer grado o alternativamente, y en función de simplificar: parcial o avanzado. La morfología de la onda P, en función de diagnosticar el grado avanzado, siempre debería ser tenida en cuenta.
Para finalizar, debemos reconocer el aporte fundamental que el Dr. Bayés de Luna ha establecido sobre la relación del bloqueo interauricular con las arritmias supraventriculares conformando un síndrome arrítmico indiscutido; lo cual a nuestro criterio representa un aporte mayor al conocimiento de la electrocardiografía y la electrofisiología, y hace meritorio que este síndrome arrítmico sea denominado «síndrome de Bayés».
In this article we aimed to establish that interatrial block exists as an anatomical-electrical entity, which should be considered a true block. Interatrial block presents with different degrees as other blocks in the conduction system. It shows a correlation with the left atrium size, however, it can be seen in patients with normal atrial size too. Interatrial block is strongly associated with atrial arrhythmias and it could be considered a predictor of cardioembolic stroke. Interatrial block is an expression of atrial electrical remodeling and dysfunction. IAB can be transient and in certain clinical circumstances, may be reversible. The contribution of endocardial mapping has increased our knowledge of the anatomy and pathophysiology of interatrial block. Magnetocardiography could be a possible non-invasive procedure to further investigate this entity.
The interatrial block classification should include first, second and third degree or alternatively, in order to simplify the terminology: partial or advanced. The P wave morphology should always be taking into consideration when diagnosing this condition.
Finally, without the initial description of interatrial block made by Dr. Bayés de Luna, it would be impossible to understand interatrial block as an anatomical and electrical substrate for atrial arrhythmias. It is our opinion that this represents a major contribution to the knowledge of electrocardiography and electrophysiology, and makes commendable that this arrhythmic syndrome should be called «Bayés’ syndrome»
Hasta el año 1979 existían pocos estudios sobre alteraciones de la conducción a nivel auricular, al mismo tiempo que los libros de texto no identificaban estos trastornos como entidades diferentes, e incluso tampoco había una unificación de criterios con respecto a la terminología y definiciones de los mismos1.
Ese año, Bayés de Luna et al. propusieron que los trastornos de la conducción a nivel auricular debían dividirse en bloqueos intraauriculares e interauriculares (BIA). El BIA se sugería separarlo en 2 categorías: a) parcial, donde existiría un retraso en la zona de conducción del haz de Bachmann, pero la mayoría de la conducción de derecha a izquierda todavía se produce a nivel del techo auricular; y b) avanzado donde existiría un bloqueo total del haz de Bachmann y la conducción hacia la aurícula izquierda se produciría a partir de la parte baja de la aurícula derecha con una dirección retrógrada caudocraneal mayormente a través del seno coronario, y en menor medida a través de la fosa ovallis1.
Con base en estos hallazgos comienzan a publicarse diversos artículos sobre BIA utilizando diferentes definiciones (lo que introdujo algunas dificultades a la hora de planear protocolos de investigación o tratamientos involucrando series de pacientes a gran escala), y vinculando el BIA con diferentes aspectos eléctricos, mecánicos e implicancias clínicas. A continuación, en este artículo de revisión, detallaremos algunas de estas controversias y algunas certezas que hemos aprendido a lo largo de los años, en lo que pretendemos ahora denominar, el síndrome de Bayés, en homenaje a quien describió su existencia, especuló con certeza sobre el mecanismo fisiopatológico y encontró la relación con las arritmias supraventriculares.
MétodosSe realizó una revisión no sistemática de la literatura, utilizando PubMed como principal navegador. Se buscaron las siguientes palabras clave: interatrial block; interatrial conduction; interatrial conduction delay; Bachmann bundle; atrial fibrillation; atrial remodeling; endocardial mapping; magnetocardiography; electrical cardioversion; coronary artery bypass graft. Los artículos incluidos en esta revisión fueron seleccionados a criterio de los autores como los más representativos para justificar el uso de esta nueva terminología (síndrome de Bayés). Las listas de referencias fueron utilizadas para completar la búsqueda.
Consideraciones anatómicasEl haz o fascículo de Bachmann (FB) es una estructura en forma de banda compuesta por fibras miocárdicas que cruzan a nivel subepicárdico desde el final de la cresta terminalis frente a la vena cava superior, entre la convexidad de las paredes auriculares, y las conecta en el cuadrante superior del surco interauricular. El borde superior es más largo que el borde inferior, dando una forma trapezoidal2. El FB se considera una vía ultrarrápida de activación interauricular. En animales se demostró que la velocidad de conducción en el FB es casi 2 veces mayor que en el resto del miocardio auricular. El período refractario efectivo del FB también es significativamente más largo que el del miocardio de la aurícula derecha (AD) y el de la aurícula izquierda (AI), con lo cual el FB puede ser bloqueado particularmente cuando el tejido auricular adyacente todavía está listo para ser activado. Esto representa un sustrato potencial para arritmias auriculares por reentrada pero también automáticas (fundamentalmente aleteo atípico y fibrilación auricular [FA]). Además del FB, la conducción interauricular en condiciones normales ocurre a través de las bandas musculares en la superficie auricular inferior cerca del seno coronario (SC) (10-15%) y posteriormente en las proximidades de las venas pulmonares cercanas a la fosa ovallis (5-10%). Otras vías para la conducción interauricular en el área del SC son las bandas musculares que se extienden desde la AD a la musculatura del SC. La musculatura auricular en la fosa ovallis se compone de bandas musculares que están dispuestas a lo largo del eje anteroposterior y tienen conexiones con el miocardio de las aurículas3. Tapanainen et al. publicaron un estudio en pacientes con FA paroxística en ritmo sinusal, donde la mayoría (72%) presentó un sitio único de conducción interauricular, en la que el FB fue dicha vía en el 69% de los casos, seguido por el área cerca a la fosa ovallis (19%) y por último el ostium del SC (11%)4. Esta distribución es altamente variable y nuevos estudios utilizando mapas de activación electroanatómica demuestran esta dispersión interpersonal5.
Remodelado eléctrico auricularPara poder entender las implicancias del BIA en la fisiología y dinámica auricular, es necesario repasar brevemente el concepto de remodelado auricular. El mismo sucede a diferentes niveles: estructural, ultraestructural, autonómico, iónico y eléctrico. Este último resulta de especial interés cuando se analiza las alteraciones de la duración de la onda P y los cambios de morfología, como sucede en el BIA avanzado.
Bosch et al. estudiaron los potenciales de acción y las corrientes iónicas utilizando la técnica de patchclamp en miocitos auriculares de pacientes con FA crónica y los compararon con pacientes en ritmo sinusal. La presencia de FA se asoció con una marcada reducción de la duración de los potenciales de acción y una disminución en la respuesta de la repolarización auricular. La corriente de calcio (/Ca, L) y la corriente transitoria hacia el exterior (Ito) se redujeron alrededor del 70% en miocitos de pacientes con FA. La corriente de potasio rectificadora hacia adentro (/KI) y la corriente de potasio activada por la acetilcolina (/KACh) se incrementaron en casos de FA, en los potenciales de hiperpolarización. La inactivación voltaje-dependiente de la corriente rápida de sodio se trasladó a voltajes más positivos en FA. Los autores concluyeron que la FA en los seres humanos conduce a cambios importantes en la corriente de potasio y calcio que probablemente contribuyen a la disminución de la duración del potencial de acción. Estos cambios contribuyen a la remodelación eléctrica que se produce en pacientes con FA y por lo tanto son factores importantes para la perpetuación de la arritmia6.
Morillo et al. demostraron que la FA sostenida fue inducible fácilmente en la mayoría de los perros estudiados (82%) después de estimulación auricular rápida durante varias semanas. Este modelo se asoció consistentemente con miopatía biauricular y cambios marcados en la vulnerabilidad auricular. El área posterior de la AI, donde se encuentra la urgencia de las venas pulmonares, demostró tener el ciclo más corto de FA, lo que llevó a los autores a sospechar la presencia de un rotor de activación único. Los resultados de la restauración del RS y la prevención de la inducibilidad de la FA después de la crioablación en esta área de la AI sugieren que esta zona es crítica en el mantenimiento de la FA7. La prolongación de la duración de la onda P que se observa en candidatos a ablación de FA paroxística y su consecuente reducción luego de la ablación son elementos que fuertemente sugieren un mecanismo de remodelado eléctrico más que un daño estructural crónico e irreversible8.
Wijffels et al. casi simultáneamente, publicaron un artículo incluyendo 12 cabras que fueron instrumentadas con múltiples electrodos suturados al epicardio de ambas aurículas. En las segunda y tercera semanas posteriores, los animales fueron conectados a un marcapasos auricular que los mantuvo artificialmente en FA. Los autores concluyeron que el mantenimiento artificial de una FA conduce a un acortamiento marcado del período refractario efectivo de la aurícula con un aumento de la tasa, la inducibilidad y la estabilidad de la FA. Todos estos cambios fueron completamente reversibles a la semana en ritmo sinusal9.
Estos 2 artículos sentaron las bases del proceso de remodelado eléctrico auricular, tal como lo conocemos hoy en día7. Su impacto sobre el entendimiento de las alteraciones eléctricas de la aurícula resultaron contribuciones mayores para diseñar estrategias invasivas para el tratamiento de la FA.
Healey et al. recientemente demostraron en un estudio que incluyó a 2,580 pacientes con marcapasos bicameral y sin historia de FA, que el grupo que desarrolló taquiarritmias auriculares presentaba mayor duración de la onda P tanto durante el período con marcapasos como durante el sensado. Los autores concluyeron que la prolongación de la onda P se asoció con el desarrollo de arritmias auriculares en pacientes portadores de marcapasos10. Este modelo permite un seguimiento diario de los pacientes (utilizando los electrogramas almacenados en los dispositivos). Esta modalidad de investigación resulta muy atractiva, ya que determinar la presencia de FA subclínica puede resultar muy complejo.
Repercusión sobre la dinámica auricular izquierdaLas evidencias que demuestran que los pacientes con BIA avanzado presentan alteraciones que afectan la hemodinamia auricular son múltiples.
Ramsaran y Spodick realizaron un estudio incluyendo a 16 pacientes con BIA y un grupo control sin BIA de 8 pacientes y compararon los intervalos electromecánicos de la AD y AI e inicios de la actividad de llenado del ventrículo derecho e izquierdo, utilizando Doppler cardíaco. El principal hallazgo de este estudio fue que la AI tuvo retraso en su actividad mecánica de manera estadísticamente significativa en el grupo con BIA11.
Goyal y Spodick analizaron los ecocardiogramas y electrocardiogramas (ECG) de pacientes con agrandamiento auricular izquierdo. Veinticuatro pacientes tenían BIA, y 16 pacientes no lo presentaban, los cuales conformaron el grupo control. Se calcularon los volúmenes de la AI, los tiempos de aceleración de la onda A, el volumen sistólico de la AI, la fracción de eyección, y la energía cinética. El resultado fue que los pacientes con BIA tuvieron iguales volúmenes de AI, significativamente más prolongados los tiempos de aceleración de la onda A y volumen sistólico, fracción de eyección y energía cinética. Los autores concluyeron que los pacientes con BIA tienen una lenta y mala función contráctil de la AI, y la extensión de la disfunción está relacionada con el grado de retardo eléctrico del BIA. Según los autores, el BIA debe ser considerado como un marcador de disfunción primariamente eléctrico y con repercusión mecánica en la AI y por lo tanto un factor de riesgo para el desarrollo de FA e insuficiencia cardíaca congestiva12. A su vez, queda claro que el trastorno eléctrico interauricular puede producirse independientemente del tamaño de la AI aunque en general se asocia con AI de mayores dimensiones.
Definición de bloqueo interauricularFue Bayés de Luna quien empezó a pulir la definición actual a finales de los setenta, cuando se refirió al BIA como un trastorno de conducción entre las aurículas; manifestado en el ECG de superficie como una onda P≥120mseg a lo cual denominó BIA parcial y si se agregaba a la prolongación de la onda P la morfología ± (positiva/negativa) en las derivaciones inferiores lo denominó BIA avanzado. Algunos autores incluso utilizaron otros puntos de corte como 110mseg para referirse al BIA lo que dificulta su medición en el ECG de superficie11.
En el año 2012 se publicó un consenso coordinado por el genial maestro catalán con motivo del 50 aniversario del Curso de Electrocardiografía que el Dr. Bayés de Luna en forma ininterrumpida ha coordinado desde Barcelona, donde se determinó que el BIA cumple con los 3 criterios que definen un patrón electrocardiográfico como bloqueo o deterioro de la conducción13:
- a)
El patrón del ECG puede aparecer de forma transitoria, y puede cambiar de forma brusca o progresiva a formas más avanzadas;
- b)
puede aparecer sin estar asociada a otra enfermedad como el agrandamiento de cavidades cardíacas, isquemia, valvulopatías aunque en muchos casos, uno o más de estas condiciones pueden coexistir; y puede ser reproducido experimentalmente.
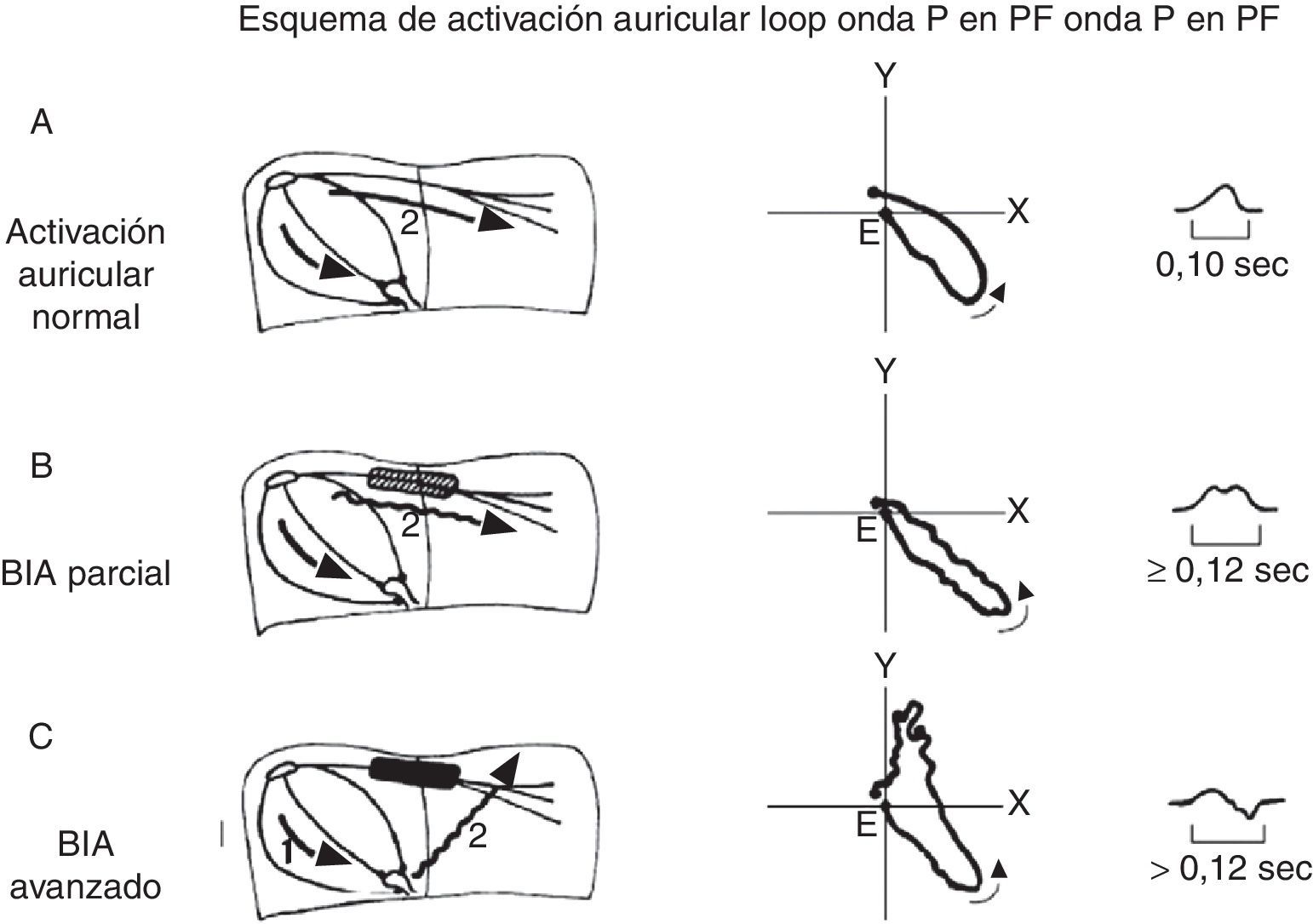
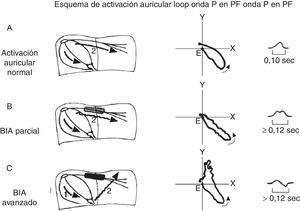
Los BIA, por analogía con otros tipos de bloqueos, se podrían clasificar como de primer grado (parcial), de segundo grado (bloqueo transitorio interauricular o aberrancia de la conducción auricular), o de tercer grado (avanzado) (fig. 1)13.
Diagrama de la conducción interauricular como fue descrita originalmente por el Dr. Bayés de Luna. La conducción interauricular se produce a 3 niveles: a. Nivel superior o Haz de Bachmann, es responsable del 80-85% de la conducción interauricular, la cual es predominantemente craneocaudal; b. Nivel medio o fosa ovallis, es responsable del 5-10% de la conducción; y c. Nivel inferior o seno coronario, responsable del 10-15% de la conducción interauricular. Existen significativas variaciones interpersonales y estos porcentajes son solo estimativos en función de estudios anatomopatológicos.
Diagrama de la activación interauricular normal (A), BIA de primer grado o parcial (B), BIA de tercer grado o avanzado (C). BIA: bloqueo interauricular; PF: plano frontal. Derechos obtenidos para su publicación del artículo de Goyal y Spodick12. Reproducido con permiso.
El bloqueo de primer grado se define como la presencia de una onda P≥120mseg, generalmente bimodal que es especialmente visible en las derivaciones i,, ii o iii, y puede presentar una morfología negativa en su fase final en la derivación V1. El bloqueo de tercer grado se define como la presencia de una onda P≥120mseg y una morfología de la onda P (bifásica) o ± en las derivaciones ii, iii y AVF. El bloqueo de segundo grado se clasifica como la presencia de una onda P que cambia su morfología de normal a patrones de BIA, o por presentar en un mismo registro electrocardiográfico un BIA de primer grado que progresa a uno de tercer grado o viceversa, con o sin relación con latidos prematuros o extrasístoles13. Los autores de esta revisión favorecen la clasificación en parcial y avanzado, dado que las repercusiones clínicas son muy importantes y deberían poder ser identificadas por todos aquellos miembros de los equipos de salud (enfermeros, técnicos, médicos); y la sencillez de esta clasificación quedaría al alcance de todos.
Cabe destacar aquí los aportes de la «Escuela Mexicana de Electrocardiografía» al entendimiento del BIA mediante estudios experimentales en perros con daño auricular artificialmente creado utilizando inyecciones subepicárdicas de alcohol al 96%. En un magnífico estudio, los autores selectivamente produjeron daño auricular en las bandas interauriculares a ambos lados del septum. Las alteraciones de la despolarización auricular durante el daño selectivo del tejido auricular izquierdo, produjeron un claro retraso de la conducción interauricular y el desarrollo de ondas P bimodales14.
Epidemiología y prevalenciaBayés de Luna et al. analizaron 81,000 ECG, demostrando una prevalencia de BIA avanzado (tercer grado) del 0.1%, mientras que cuando se seleccionó solo a los pacientes con cardiopatía estructural la prevalencia fue del 2%15.
Jairath y Spodick publicaron un trabajo donde encontraron BIA parcial (primer grado) en 328 pacientes (41%) entre 797 pacientes no seleccionados que se encontraban en RS en una población de un hospital general. El BIA fue más común en hombres que en mujeres, más frecuente en mayores de 60 años de edad, en hipertensos y en pacientes con antecedentes de enfermedad coronaria16.
El mismo grupo evaluó 1,000 ECG de forma consecutiva, midiendo la onda P en las 12 derivaciones del ECG, y la prevalencia fue del 43% para BIA, definido únicamente como una onda P≥120mseg, confirmando lo publicado anteriormente referente a la edad donde a partir de los 60 años la prevalencia se incrementa superando el 50%17. Cabe destacar aquí las diferencias de la escuela catalana (Bayés de Luna) y la americana (Spodick) en cuanto a la definición de BIA. Mientras que Spodick solo menciona la «duración» de la onda P, Bayés incorpora la morfología de la misma. Esta diferencia no es puramente semántica y envuelve el concepto anatómico-eléctrico de lo que consideraremos el síndrome de Bayés. Sin embargo, los autores de esta revisión quieren destacar aquí que, durante más de un década, fue el grupo de Spodick y Ariyarajah los que mantuvieron vivo el concepto de BIA, alimentando la literatura con varias publicaciones de alto nivel.
Frisella et al. demostraron que de 500 ECG evaluados de manera consecutiva, 203 pacientes tenían BIA (utilizando el criterio de onda P≥120mseg de Spodick), representando el 40.6%. En solo 23 pacientes la onda P se encontró prolongada en una sola derivación, en 68 únicamente en las derivaciones precordiales y en 19 solamente en las derivaciones de los miembros. La derivación DII tuvo una sensibilidad del 54% para detectar el BIA; la derivación V4 fue la que mostró la mayor sensibilidad (59.5%)18.
Bloqueo interauricular como predictor de fibrilación auricularEn el año 1988 Bayés de Luna et al. publicaron un trabajo comparando 16 pacientes con BIA avanzado con diferentes cardiopatías con un grupo control de iguales características clínico-ecocardiográficas, donde a todos los pacientes se les realizó registros de monitorización con Holter. El 93.7% de los pacientes con BIA presentaron en un seguimiento a 30 meses taquicardias paroxísticas supraventriculares, mientras que solo las padecieron el 27.7% de los pacientes del grupo control (p<0.01). Al mismo tiempo, el grupo con BIA avanzado presentó mayor prevalencia de extrasístoles supraventriculares (75%) en comparación al grupo control (16.6%) con significación estadística (p<0.01)19. Este es el primer trabajo que demuestra una franca asociación entre arritmias supraventriculares (extrasístoles auriculares, FA y aleteo atípico) con BIA avanzado. Con base en esta descripción, se publicó una avalancha de artículos en la misma dirección. Esta asociación está ahora claramente demostrada y es la base para la postulación de esta nueva terminología. Creemos que el mérito corresponde al Dr. Bayés de Luna, y desde nuestro humilde entender, la descripción del fenómeno eléctrico, su prevalencia y su asociación con arritmias supraventriculares constituyen un síndrome arrítmico que merece ser distinguido como tal. Rindiendo homenaje a aquel que sentó las bases para su descubrimiento, proponemos denominarlo «síndrome de Bayés».
Agarwal et al. publicaron un estudio donde compararon 2 grupos (308 pacientes en cada uno) con 16 meses de seguimiento: un grupo con nueva FA y otro grupo control que continuaba en ritmo sinusal. Los grupos fueron ajustados por edad y sexo. La prevalencia de BIA fue del 52% en el grupo con FA versus 18% en el grupo con ritmo sinusal (p<0.001)20.
Ariyarajah et al. realizaron un estudio donde incluyeron a 118 pacientes hospitalizados y fueron divididos en 3 grupos según el ECG basal: con BIA, 41 pacientes; sin BIA, 51 pacientes; y con taquiarritmia auricular, 24 pacientes. Los pacientes fueron posteriormente seguidos durante 12 meses. Los puntos finales fueron: insuficiencia cardíaca, embolia periférica, ataques isquémicos transitorios y accidentes cerebrovasculares, taquiarritmias auriculares (FA y aleteo auricular) y muerte. Este estudio falló en demostrar una asociación entre BIA y FA, que a nuestro criterio se debió al escaso número de pacientes que se incluyeron, ya que como puede observarse en el estudio previamente mencionado del mismo autor en donde cada rama incluyó a 308 pacientes, la asociación fue estadísticamente significativa entre BIA y FA21.
Bloqueo interauricular como predictor de accidente cerebrovascularAriyarajah et al. publicaron otro trabajo donde investigaron a 85 pacientes de un hospital general que habían sido admitidos a la unidad de accidente cerebrovascular por presentar dicha patología de causa cardioembólica. En 66 de los casos, el ECG demostró ritmo sinusal. Estos fueron evaluados para determinar si presentaban BIA o no, dividiéndolos en 2 grupos acorde a dicho criterio22.
Fueron recabadas las variables clínicas, Doppler de arterias carotídeas y ecocardiogramas durante la admisión; 40 pacientes (61%) presentaban BIA y el 55% evidenciaba agrandamiento de la AI (p<0.01). La presencia de trombo en la AI o contraste espontáneo fue encontrado en 6 pacientes con BIA (15%) pero en ninguno de los pacientes sin BIA (p<0.04). Estos autores concluyeron que el BIA puede ser un factor de riesgo para accidente cerebrovascular cardioembólico como consecuencia del agrandamiento de la AI (criterio con el cual discrepamos, ya que muchos pacientes con BIA tienen AI normal) y disfunción electromecánica que predispondrían a un incremento de la trombosis, con lo cual consideran que el uso de anticoagulación debería ser investigado en este grupo de pacientes22.
Los mismos autores publicaron otro artículo donde de 293 pacientes admitidos por accidente cerebrovascular, 85 presentaban una causa cardioembólica, mientras que en los 208 pacientes restantes se descartó dicha causa21. El 88% de los pacientes admitidos por accidente cerebrovascular cardioembólico presentaban ritmo sinusal y de estos el 61% tenían BIA. Cuando se realizó un análisis de correlación, solo la hipertensión (p<0.01; r=0.3) y el BIA (p<0.01; r=0.2) fueron estadísticamente significativos y tuvieron una correlación directa con accidente cerebrovascular. Estos autores concluyeron que el BIA debiera ser considerado como un novedoso factor de riesgo para accidente cerebrovascular cardioembólico y que se requiere de investigaciones incluyendo un mayor número de pacientes23.
Contribuciones del mapeo endocavitario, epicárdico y magnetocardiográficoCosío et al. mostraron, en un estudio de 21 pacientes que fueron sometidos a un mapeo electromagnético en ritmo sinusal estable, que la activación de la AD podía comenzar desde diferentes áreas o simultáneamente de áreas extensas dando como resultado diferentes patrones de activación en ambas aurículas tanto derecha como izquierda. La activación de la AI fue predominantemente descendente, pero en el bloqueo del FB esta comenzaba de manera ascendente y los potenciales dobles evidenciaban una localización del bloqueo a nivel del techo de la AI24. Recientemente, el mismo grupo publicó un hermoso caso presentando la contribución del mapeo no flurosocópico para la identificación del BIA25. Si bien el artículo nos pareció muy instructivo, la retórica del título motivó una respuesta de nuestra parte que fue aceptada en la misma26. Nuestra carta tuvo por objeto contribuir al esclarecimiento de la terminología apropiada, lo mismo que intentamos hacer con la presente revisión.
Jurkko et al. realizaron magnetocardiografía en 27 pacientes sometidos a una ablación por FA paroxística mientras se encontraban en ritmo sinusal, utilizando mapeo electromagnético. Los autores concluyen que la magnetocardiografía parece ser capaz de distinguir las diferentes vías de conducción interauricular de manera no invasiva con resultados similares al mapeo electromagnético. Esta técnica, si bien es únicamente utilizada en centros de investigación, podría contribuir a identificar a pacientes con BIA avanzado y potencialmente podría servir para iniciar terapia antiarrítmica profiláctica de manera más precoz. Este concepto, queda claro, debería ser validado mediante investigaciones precisas, antes de ser llevado a la práctica clínica27.
¿El bloqueo interauricular puede ser un fenómeno transitorio?Baranchuk et al. publicaron un caso donde demostraron que el BIA puede ser un fenómeno transitorio. En un paciente de 67 años que fue sometido a una cardioversión eléctrica con 2 descargas de un desfibrilador externo bifásico, logró reinstaurarse el ritmo sinusal. Posteriormente a ambas descargas, el paciente mostró diferentes valores de duración de onda P, es decir desde valores normales hasta valores máximos de 130mseg (segundo grado del consensus 2012) con semejantes intervalos P-P. Según los autores, el BIA luego de una cardioversión eléctrica exitosa es una situación clínica relativamente frecuente, pero que, sin embargo, no es comúnmente reportado en la literatura y no fue aún exhaustivamente investigado. Este fenómeno podría representar el estadio inicial de la recuperación auricular, lo que se conoce como remodelación eléctrica reversa28.
El BIA intermitente muestra que la AI comienza su despolarización desde diferentes sitios de activación o que, desde un mismo frente, conduce por 2 vías alternas.
De esta forma, consideramos que el BIA intermitente debería ser considerado como uno de los marcadores de disfunción electromecánica de la AI y un factor de riesgo para el desarrollo de recurrencia de FA, en este caso, poscardioversión eléctrica28.
Resta confirmar si el BIA intermitente después de de una cardioversión eléctrica exitosa es un marcador de recurrencia temprana (como sucedió en este caso), tardía (primeros 12 meses) o si no es un buen marcador para identificar a pacientes en mayor riesgo. En este sentido, nuestro grupo está coordinando un estudio internacional para determinar el verdadero valor del BIA como predictor de recurrencia de FA poscardioversión.
Caldwell et al. demostraron que la presencia de BIA (definido solo por prolongación de la onda P del ECG de superficie) predice mayor recurrencia de FA postablación de FA paroxística. El grupo de pacientes con BIA, durante la reablación requirió además ablación extendida a áreas de fraccionamiento de la AI8.
Remodelación eléctrica auricular reversaLa mejor manera de sustentar la idea de un proceso de remodelado eléctrico que puede ser transitorio fue analizar la evidencia de que el BIA puede desaparecer si las condiciones que lo generaron son debidamente tratadas.
Pang et al. realizaron una revisión sistemática a través de PubMed y EMBASE en inglés desde 1990 hasta mayo de 2011, incluyendo estudios en animales y en humanos. Incluyeron estudios de remodelado eléctrico auricular donde este fenómeno hubiera sido analizado antes y después de una intervención. El concepto de remodelado eléctrico auricular reverso es intrigante. Esta interesante revisión discute el remodelado auricular reverso en diferentes situaciones clínicas (poscomisurotomía mitral, poscardioversión eléctrica, posresincronización cardíaca, etc.).
Los autores concluyeron que, en los casos poscardioversión de FA, el acortamiento de la duración media de la onda P y la prolongación del período refractario efectivo auricular (si estuvo disponible) representaron una conducción interauricular más rápida, lo cual proporciona pruebas claras para la existencia de un remodelado eléctrico auricular reverso. En pacientes con terapia de resincronización cardíaca que fueron considerados como buenos respondedores se observó, además, una disminución en el tamaño auricular izquierdo a los 3 y 6 meses de seguimiento. En pacientes poscomisurotomía por estenosis mitral, se observó una disminución del tamaño y presión media de la AI, y un acortamiento de la duración de la onda P.
En la población con apnea del sueño que utilizó presión continua positiva en la vía aérea (CPAP) se demostró una disminución de la duración media de la onda P en comparación con aquellos que no utilizaron CPAP29.
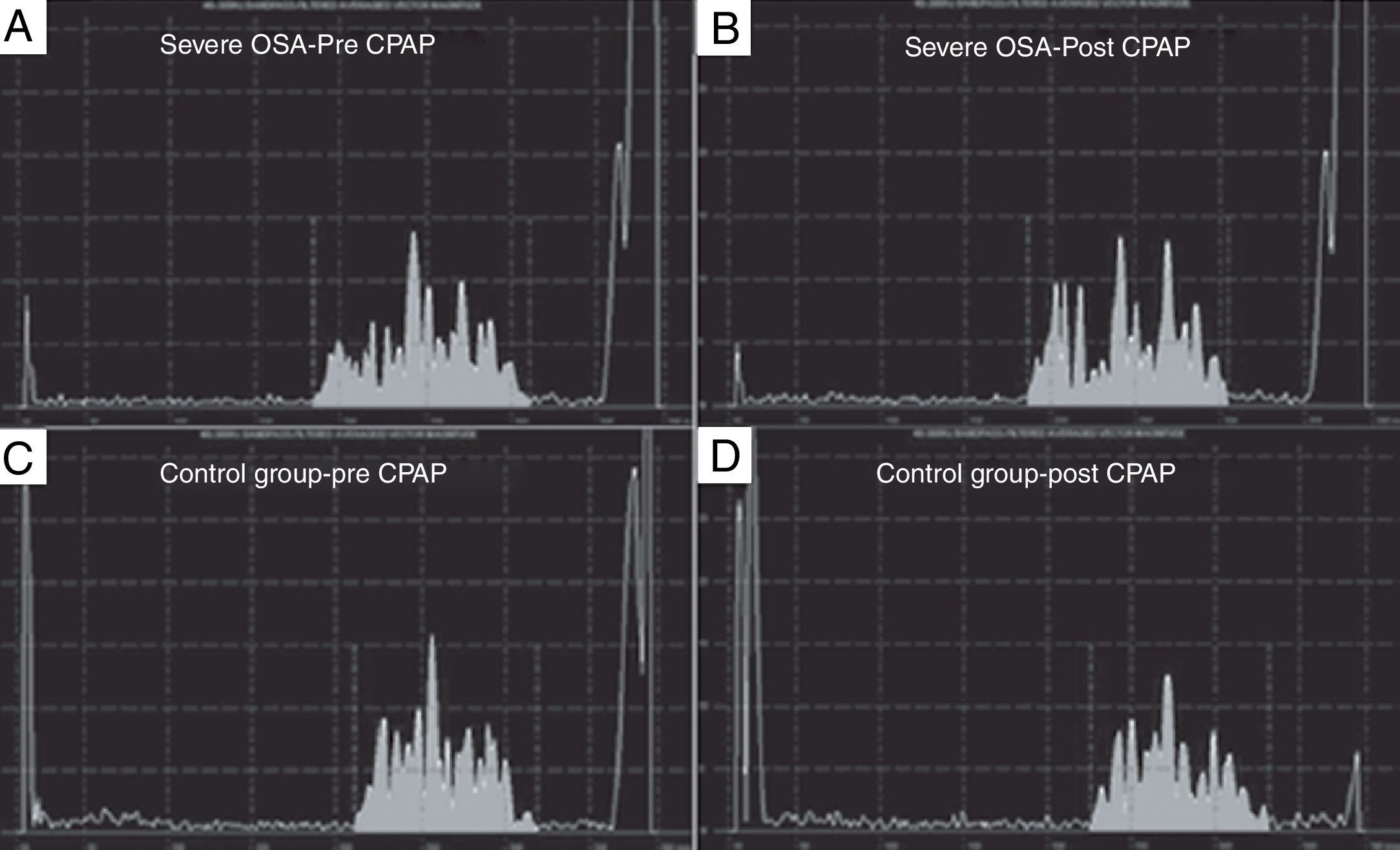
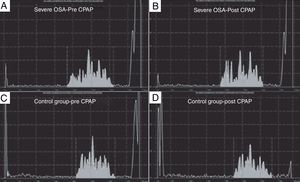
Baranchuk et al. publicaron un trabajo donde incluyeron a 19 pacientes con criterios para apnea obstructiva del sueño (OSA) severa y 10 pacientes controles balanceados para otras variables clínicas. Se determinó la duración media de la onda P utilizando «señal promediada de la onda P» al ingreso y a la cuarta y sexta semanas luego de realizar tratamiento con CPAP en los pacientes con OSA. En el grupo control se repitió el estudio para descartar que los cambios fueran operador-dependiente. Los resultados arrojaron que la duración media de la onda P disminuyó significativamente en los pacientes con OSA severa tratados con CPAP, mientras que no hubo cambios en el grupo control. Los autores concluyeron que el tratamiento con CPAP induce remodelado eléctrico auricular reverso en pacientes con OSA severa, representada por una significativa reducción de la duración media de la onda P (fig. 2)30.
Análisis de señal promedia de la onda P (SAPW) en un paciente con apnea del sueño (OSA) obstructiva grave (paneles A y B) y en un paciente del grupo control (paneles C y D). Hay una reducción en la duración SAPW después de 4 a 6 semanas de presión positiva continua en vía aérea (CPAP) en el paciente con OSA grave, pero ningún cambio en el paciente del grupo control. El área en gris representa la onda-p promedio de 100 latidos. El eje X representa el tiempo en milisegundos, mientras que el eje Y representa la amplitud en microvoltios. Reproducido con permiso.
Dado los resultados de los estudios presentados aún no completamente concluyentes, los interrogantes todavía existentes y patologías o procedimientos aún no investigados en su totalidad en relación con el BIA, se encuentran en marcha 2 estudios clínicos. Uno de ellos evalúa si el BIA detectado en un ECG de superficie durante el ritmo sinusal antes de una cardioversión eléctrica por FA puede predecir recurrencia de arritmias auriculares en el seguimiento a largo plazo. El otro estudio investigará la capacidad predictiva del BIA para el desarrollo de FA después de una cirugía de revascularización miocárdica. Estos 2 estudios contribuirán a determinar la capacidad predictiva de un estudio sencillo de realizar, de bajo costo y al alcance de la mayoría.
Consideraciones finales acerca del uso del epónimo «síndrome de Bayés»En el desarrollo de este artículo hemos querido establecer que el BIA existe como entidad anatomoeléctrica, que debe ser considerado como un verdadero bloqueo, que tiene diferentes grados al igual que los otros bloqueos del sistema de conducción, que guarda una relación con el tamaño de la AI (si bien puede producirse en pacientes con AI normal), que se encuentra fuertemente asociado con arritmias supraventriculares (especialmente aleteo atípico y FA) y que es probablemente un predictor de accidente cerebrovascular cardioembólico. El BIA es una clara expresión del remodelado eléctrico auricular y está relacionado con la disfunción electromecánica de las aurículas. Al mismo tiempo, puede presentarse de manera transitoria y en ciertas circunstancias clínicas puede ser reversible. El aporte del mapeo endocavitario ha incrementado el conocimiento sobre su anatomía y fisiopatología y probablemente la magnetocardiografía sea un posible estudio no invasivo para seguir investigando esta entidad.
La terminología a utilizar debería ser BIA de primer, segundo o tercer grado, y para simplificar: parcial o avanzado. La morfología de la onda P, como manera de diagnosticar el grado avanzado, siempre debería ser tenida en cuenta.
Para finalizar debemos reconocer que los hallazgos descritos inicialmente por Bayés de Luna destacando al BIA como un sustrato anatómico y eléctrico de arritmias supraventriculares, conforman un síndrome arrítmico indiscutido; lo cual a nuestro criterio representa un aporte mayor al conocimiento de la electrocardiografía y electrofisiología; y hace que este nuevo síndrome arrítmico sea merecedor de ser denominado «síndrome de Bayés» (figs. 3–5).
El Dr. Antoni Bayés de Luna junto al Dr. Ignacio Chávez hace algunos años en casa de Chávez. Dos genios de la electrocardiografía clínica, representando la escuela mexicana y la escuela catalana. Solo ellos sabrán qué han discutido, qué casos han compartido y qué proyectos conjuntos habrán imaginado. Cortesía archivo personal del Dr. Bayés.
Ninguna
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés