Los pacientes con trombosis venosas profundas iliofemorales tienen mayor riesgo de sufrir un tromboembolismo venoso recurrente y un síndrome postrombótico que los que padecen trombosis venosas proximales menos extensas. Aunque las heparinas y el fondaparinux son utilizados como terapia inicial, es muy probable que los nuevos anticoagulantes orales los sustituyan en un futuro próximo. La trombólisis sistémica y la dirigida por catéter están siendo reemplazadas por la percutánea mecánica y farmacomecánica debido a sus menores tasas de hemorragias, de tiempo de perfusión y de consumo de recursos hospitalarios. La trombectomía quirúrgica venosa se reserva para pacientes con contraindicaciones o fracaso de estas últimas. Aunque el tratamiento quirúrgico está indicado en casos severos de síndrome postrombótico, carecemos de estudios metodológicamente consistentes sobre su efectividad y seguridad.
Patients with iliofemoral deep vein thrombosis are at increased risk of recurrent venous thromboembolism and post-thrombotic syndrome than those with less extensive proximal venous thrombosis. Although heparins and fondaparinux are used as initial therapy, it is likely that new oral anticoagulants, mostly those replaced in the near future. Systemic thrombolysis and catheter-directed is being replaced by mechanical and pharmacomechanical percutaneous due to their lower rates of bleeding, infusion time and consumption of hospital resources. The venous thrombectomy should be reserved for patients with contraindications or failure of the latter. Although surgical treatment is this one indicated in severe cases of post-thrombotic syndrome, lack of methodologically robust studies on its effectiveness and safety.
Tradicionalmente las trombosis venosas profundas de los miembros inferiores (TVPMI) se han clasificado en proximales, lo que incluye las venas poplíteas y las situadas por encima de ellas, e infrapoplíteas o distales.
La trombosis venosa profunda iliofemoral (TVPIF) es una obstrucción parcial o completa de cualquier parte de la vena ilíaca o de la vena femoral común (VFC), con o sin afectación de otras venas de las extremidades inferiores o de la vena cava inferior (VCI)1. En un estudio de cohortes prospectivo y multicéntrico de pacientes con TVPMI sintomáticas, el 39% de las trombosis venosas profundas (TVP) proximales afectaban a la femoral o a la ilíaca2. Cuando se obstruye la vena femoral, la vía colateral primaria que aporta el flujo sanguíneo a la extremidad se realiza mediante el drenaje en la vena femoral profunda (VFP) que, a su vez, desemboca en la VFC3. Como consecuencia, la trombosis situada por encima del punto de entrada de la VFP provoca una obstrucción más grave que frecuentemente causa una sintomatología inicial más alarmante y secuelas clínicas tardías4.
La importancia de diferenciar la TVPIF de las demás TVP proximales se fundamenta en varios estudios prospectivos. En el primero de ellos, realizado con 1.149 pacientes con TVP sintomáticas, en los 3 meses siguientes, aquellos con TVPIF tenían 2,4 veces mayor riesgo de sufrir un trombembolismo venoso recurrente que los que presentaban una TVP proximal menos extensa5. En el segundo, efectuado en una cohorte de 387 pacientes con TVP sintomáticas, a los 2 años de seguimiento, los que tenían afectada la VFC o la ilíaca presentaban un síndrome postrombótico (SPT) más grave (p<0,01) que el resto de los enfermos estudiados6.
Estos hallazgos confirman los de estudios previos en los que la claudicación venosa, las úlceras venosas y el empeoramiento de su calidad de vida fueron comúnmente observados en estos pacientes7.
El objetivo de nuestro estudio es proporcionar al médico una revisión actualizada de las distintas opciones terapéuticas de la TVPIF y del SPT que le permita conocer en todo momento cómo enfocar estas enfermedades y, en consecuencia, ofrecer a cada tipo de paciente el tratamiento más adecuado.
Terapia anticoagulante inicialLas TVPIF deben anticoagularse inicialmente para prevenir la embolia pulmonar (EP) y los tromboembolismos venosos recurrentes (TEVR)8. En la mayoría de los casos estos objetivos se alcanzan con el tratamiento anticoagulante convencional por lo que, en ausencia de contraindicaciones, se recomienda iniciarlo con heparinas de bajo peso molecular (HBPM), fondaparinux o heparinas no fraccionadas (HNF)9.
Heparinas de bajo peso molecular comparadas con heparinas no fraccionadas intravenosasDistintos estudios sugieren que las HBPM se asocian con una disminución de la mortalidad, de las hemorragias mayores y de los TEVR comparadas con las HNF intravenosas.
Tienen la ventaja de su fácil administración que favorece el tratamiento ambulatorio y el inconveniente de su bioacumulación cuando existe un fallo renal, reflejado en los niveles supraterapéuticos de anti-Xa y en el incremento del riesgo hemorrágico. Por este motivo se recomiendan las HNF en enfermos con un CrCL< 30ml/min y en aquellos subsidiarios de trombólisis10,11.
Fondaparinux comparado con heparinas de bajo peso molecularLos resultados del ensayo Matisse indican que el fondaparinux presenta unas tasas de mortalidad, de hemorragias mayores y de TEVR similares a las alcanzadas por las HBPM, aunque la mediocre calidad de los datos obtenidos, por las imprecisiones del trabajo, no permite tener una certeza clara sobre su eficacia en el tratamiento de las TVP12.
Se ha sugerido solo a través de evidencias indirectas en pacientes con EP que el fondaparinux es igual de efectivo que las HBPM, aunque no se ha demostrado hasta el momento13.
Fondaparinux comparado con heparinas no fraccionadas intravenosasAl igual que en el caso anterior tampoco existe evidencia directa de que el fondaparinux sea igual de efectivo que las HNF en el tratamiento de la TVP13.
Una ventaja potencial de este fármaco es que raramente se asocia a trombocitopenia. Su inconveniente es que no debe administrarse a pacientes con CrCl < 30ml/min14.
Terapia anticoagulante a largo plazoEl tratamiento a largo plazo con HBPM solo está recomendado en embarazadas, en pacientes con cáncer, cuando exista alto riesgo de sangrado, en las complicaciones derivadas de las antivitaminas K (AVK) o ante la imposibilidad de realizar determinaciones de la relación internacional normalizada (INR) periódicas15.
A excepción de estos casos, la anticoagulación parenteral debe simultanearse con la administración de AVK durante un mínimo de 5 días y hasta que la INR sea igual o superior a 2, por lo menos durante 24h, momento en el que se suspende la medicación parenteral16.
Duración del tratamiento anticoagulanteAunque es posible que los pacientes con TVPIF tengan mayor peligro de padecer TEVR y SPT, no hay una clara evidencia que apoye la administración de anticoagulantes orales o parenterales durante largos períodos de tiempo17.
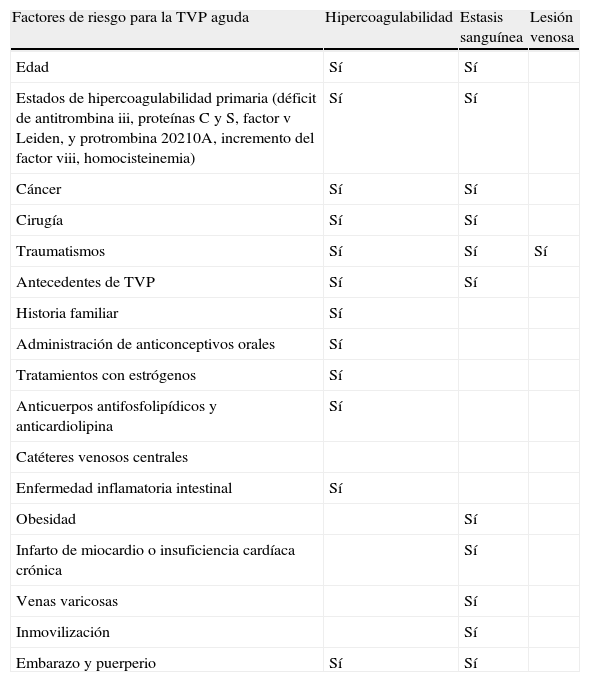
Decidir la duración del tratamiento debe basarse en los factores de riesgo18 (tabla 1), en la presencia de TEVR, en la tolerancia a la anticoagulación, en el peligro de sangrado y en las preferencias del paciente19.
Factores de riesgo para la trombosis venosa profunda aguda
| Factores de riesgo para la TVP aguda | Hipercoagulabilidad | Estasis sanguínea | Lesión venosa |
| Edad | Sí | Sí | |
| Estados de hipercoagulabilidad primaria (déficit de antitrombina iii, proteínas C y S, factor v Leiden, y protrombina 20210A, incremento del factor viii, homocisteinemia) | Sí | Sí | |
| Cáncer | Sí | Sí | |
| Cirugía | Sí | Sí | |
| Traumatismos | Sí | Sí | Sí |
| Antecedentes de TVP | Sí | Sí | |
| Historia familiar | Sí | ||
| Administración de anticonceptivos orales | Sí | ||
| Tratamientos con estrógenos | Sí | ||
| Anticuerpos antifosfolipídicos y anticardiolipina | Sí | ||
| Catéteres venosos centrales | |||
| Enfermedad inflamatoria intestinal | Sí | ||
| Obesidad | Sí | ||
| Infarto de miocardio o insuficiencia cardíaca crónica | Sí | ||
| Venas varicosas | Sí | ||
| Inmovilización | Sí | ||
| Embarazo y puerperio | Sí | Sí |
Fuente: Strijkers et al.18.
TVP: trombosis venosa profunda.
En este sentido pueden definirse 3 grupos:
- a)
En general, después de 3 meses, la anticoagulación puede suprimirse con seguridad en la mayoría de los pacientes con un primer episodio de TVP asociada a factores de riesgo reversibles como la cirugía reciente o los traumatismos20.
- b)
Las TVP recurrentes o idiopáticas deben anticoagularse indefinidamente con reevaluaciones periódicas del balance riesgo/beneficio21.
- c)
En pacientes con cáncer que desarrollan una TVP se recomienda administrar inicialmente HBPM al menos entre 3 y 6 meses, continuando posteriormente con AVK o HBPM mientras reciban tratamiento específico -por ejemplo quimioterapia-, o hasta que la neoplasia se considere bajo control y posiblemente curada22,23.
Actualmente se han desarrollado una serie de anticoagulantes orales como los inhibidores directos del factor Xa (rivaroxabán o apixabán) y de la trombina (etexilato de dabigatrán). Estos fármacos pueden sustituir a las AVK que son los únicos anticoagulantes orales disponibles y que, a pesar de su gran eficacia, no están exentos de problemas. Entre otros, su margen terapéutico estrecho que puede producir un incremento del riesgo hemorrágico y que la dosis-respuesta varíe en función de la edad, dieta, fármacos concomitantes, comorbilidades, polimorfismos genéticos y raza24,25. Todo ello obliga a realizar una monitorización costosa en tiempo y recursos.
De estos nuevos fármacos el único aprobado hasta el momento en España, como tratamiento inicial, es el rivaroxabán.
Ventajas26,27- -
Puede administrarse durante largos períodos de tiempo sin necesidad de monitorizar la coagulación ni ajustar la dosis del fármaco regularmente, al tener unas propiedades farmacocinéticas y farmacodinámicas previsibles.
- -
No interactúa con la mayor parte de los alimentos.
- -
Presenta menos interacciones farmacológicas que las AVK.
- -
Su acción se inicia rápidamente al alcanzar niveles terapéuticos efectivos entre las 2 y las 4h posteriores a su administración.
- -
No existen referencias suficientes sobre su comportamiento a largo plazo.
- -
No hay un antídoto específico para estos fármacos. Sin embargo, su corta vida hace que pocas veces sea necesaria su reversión en casos de sangrado.
- -
En pacientes con distintas comorbilidades: edades superiores a 75 años, pesos extremos (< 60 0 > 90kg) y ClCr < 49ml/min, los resultados no son tan favorables ya que muestran un incremento del riesgo de hemorragias mayores en comparación con los menores de 75 años, pesos entre 60 y 90kg y un ClCr > 50ml/min.
- -
Están contraindicados en hepatopatías asociadas a coagulopatías y con riesgo de hemorragias.
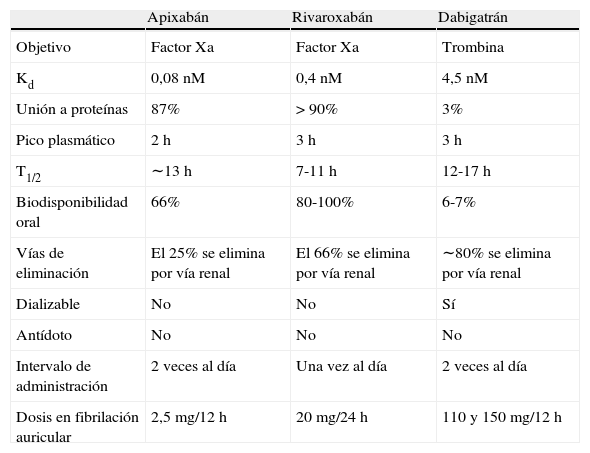
En las tablas 2 y 3 se recogen las características farmacodinámicas y farmacocinéticas30 de los nuevos anticoagulantes, así como sus indicaciones y dosis respectivas31.
Propiedades farmacodinámicas y farmacocinéticas del apixabán, rivaroxabán y dabigatrán
| Apixabán | Rivaroxabán | Dabigatrán | |
| Objetivo | Factor Xa | Factor Xa | Trombina |
| Kd | 0,08nM | 0,4nM | 4,5nM |
| Unión a proteínas | 87% | > 90% | 3% |
| Pico plasmático | 2h | 3h | 3h |
| T1/2 | ∼13h | 7-11h | 12-17h |
| Biodisponibilidad oral | 66% | 80-100% | 6-7% |
| Vías de eliminación | El 25% se elimina por vía renal | El 66% se elimina por vía renal | ∼80% se elimina por vía renal |
| Dializable | No | No | Sí |
| Antídoto | No | No | No |
| Intervalo de administración | 2 veces al día | Una vez al día | 2 veces al día |
| Dosis en fibrilación auricular | 2,5mg/12 h | 20mg/24h | 110 y 150mg/12h |
Fuente: Brenner y Hoffman30.
Kd: constante de disociación; nM: nanomolar; T1/2: vida media.
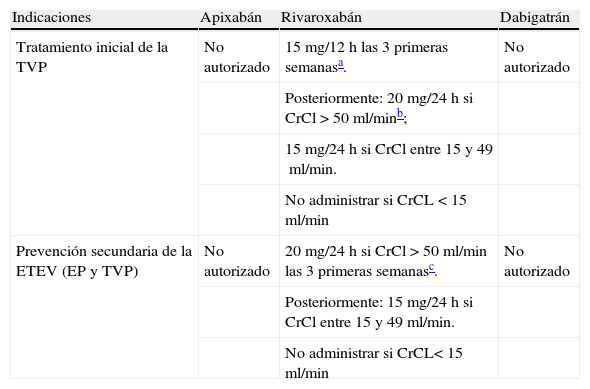
Dosis recomendadas de rivaroxabán en el tratamiento de la trombosis venosa profunda y en la prevención secundaria de la enfermedad tromboembólica venosa
| Indicaciones | Apixabán | Rivaroxabán | Dabigatrán |
| Tratamiento inicial de la TVP | No autorizado | 15mg/12h las 3 primeras semanasa. | No autorizado |
| Posteriormente: 20mg/24h si CrCl > 50ml/minb; | |||
| 15mg/24h si CrCl entre 15 y 49ml/min. | |||
| No administrar si CrCL < 15ml/min | |||
| Prevención secundaria de la ETEV (EP y TVP) | No autorizado | 20mg/24h si CrCl > 50ml/min las 3 primeras semanasc. | No autorizado |
| Posteriormente: 15mg/24h si CrCl entre 15 y 49ml/min. | |||
| No administrar si CrCL< 15ml/min |
Fuente: Turpie et al.31
EP: embolia pulmonar; ETEV: enfermedad tromboembólica venosa; TVP: trombosis venosa profunda.
No disponemos de datos sobre la administración de 15mg/12h en pacientes con CrCL< 30ml/min; por ello no se recomienda el uso rutinario de rivaroxabán en estos pacientes.
En pacientes con CrCl entre30 y 49ml/min y riesgo de sangrado debe realizarse un balance riesgo-beneficio antes de su administración.
Por otra parte, la anticoagulación con heparina seguida de AVK no evita el riesgo de presentar un SPT (43-47% a los 2 años) y un TEVR (30% a los 5 años) debido a que los anticoagulantes frenan la propagación del coágulo pero no su lisis, que solo se consigue de forma significativa o completa en el 5% de los pacientes32,33. Esto ha llevado a la búsqueda de nuevos tratamientos que reviertan la obstrucción venosa y restauren la función valvular con la menor tasa posible de hemorragias.
Tratamiento trombolítico de la trombosis venosa profunda iliofemoralTrombólisis sistémicaUtilizada desde los años 1970, no es recomendada como tratamiento de elección durante la fase aguda de la enfermedad debido a las conclusiones del metaanálisis publicado en 2004 por la Agencia Cochrane que incluye 11 ensayos y 700 pacientes, la mayoría tratados con altas dosis de estreptocinasa o urocinasa34.
El análisis concluye que los efectos adversos, principalmente las complicaciones hemorrágicas graves (10% con un incremento del riesgo relativo del 73%) sobrepasan considerablemente los beneficios observados (incremento relativo del 76% de la lisis total del coágulo, y una reducción del riesgo relativo del SPT del 33%). Sin embargo, la calidad de estos datos es baja, debido a sus imprecisiones y al riesgo de sesgos9. No existen comparaciones directas entre los distintos trombolíticos ya que las infusiones intravenosas prolongadas de estreptocinasa utilizadas predominantemente en los primeros trabajos se asocian a mayores tasas de hemorragias que con otros tratamientos9.
No hay estudios aleatorios que la comparen con la trombólisis dirigida por catéter (TDC), aunque un trabajo retrospectivo indica que la primera consigue una menor lisis (31 frente al 50%), una menor preservación funcional valvular (13 frente al 44%) y un mayor riesgo de sangrado que la segunda debido a las dosis más altas de trombolíticos utilizados35.
En la tabla 4 se recogen las contraindicaciones absolutas y relativas para el tratamiento trombolítico en las TVP agudas.
Contraindicaciones para el tratamiento trombolítico en la trombosis profunda venosa profunda iliofemoral aguda
| Contraindicaciones absolutas |
| • Antecedentes de hemorragia intracraneal |
| • Enfermedades cerebrovasculares estructurales conocidas (malformaciones arteriovenosas) |
| • Neoplasias intracraneales |
| • Infarto isquémico cerebral en los 3 meses anteriores |
| • Sospecha de disección aórtica |
| • Sangrado activo o diátesis hemorrágica |
| • Cirugía cerebral reciente o medular recientes |
| • Traumatismo reciente cerrado de cabeza o de cara, con evidencia radiográfica de fractura ósea o lesión cerebral |
| Contraindicaciones relativas |
| • Edad superior a 75 años |
| • Paciente anticoagulado |
| Embarazo |
| • Punciones vasculares no compresibles |
| • Resucitación cardiopulmonar traumática o prolongada más de 10 min |
| • Sangrado interno reciente (dentro de las 2-4 semanas precedentes) |
| • Historia de hipertensión arterial crónica severa mal controlada |
| • Hipertensión arterial severa no controlada en el momento de la presentación del EP |
| • Presión sistólica > 180mmHg o presión diastólica > 110mmHg) |
| Demencia |
| • Infarto isquémico cerebral > 3 meses |
| • Cirugía mayor en las 3 semanas anteriores |
| • Pericarditis o derrame pericárdico |
| • Retinopatía diabética |
| • Sexo femenino |
| • Raza negra |
| • Peso < 60kg |
Elaboración propia a partir de varios autores1,9.
En un esfuerzo por disminuir las altas tasas de hemorragias en los años noventa se introdujo la TDC, que es la infusión directa de un trombolítico en el interior del trombo a través de un catéter dirigido con eco-Doppler o flebografía.
Este tratamiento tiene 2 objetivos:
- 1.
Reducir la sintomatología aguda y el SPT al revertir directamente la obstrucción venosa y restaurar la función valvular.
- 2.
Disminuir el riesgo de hemorragias al conseguir con una menor dosis de trombolítico, una eliminación más rápida del trombo36. Este riesgo no se ha conseguido reducir ya que los distintos estudios realizados hasta ahora muestran que, a pesar de que la lisis del coágulo, se alcanza en el 79% de los casos con una reducción significativa del SPT, del reflujo y de la obstrucción venosa, este tratamiento se asocia con un 10-11% de hemorragias mayores comparado con el 8% de los pacientes tratados con heparina37,38.
Recientemente un estudio clínico comparativo, aleatorio y multicéntrico realizado en 209 pacientes, muestra que 24 meses después los tratados con TDC (alteplasa+heparina sódica) presentaban una menor incidencia de SPT (55,6 frente al 47%) que los que recibieron HBPM+warfarina y posteriormente solo warfarina (p=0,047). Esta diferencia se corresponde con una reducción del riesgo absoluto de desarrollar un SPT del 14,4%. Seis meses después la permeabilidad vascular en el grupo tratado con TDC fue del 65,9 frente al 45,7% del grupo control (p=0,012). Sin embargo, la tasa de hemorragias en el primer grupo fue del 9% (3% graves) y de 0 en el grupo control39.
Si a pesar de todo ello se decide realizar una TDC, puede efectuarse con alteplasa a dosis de 0,01mg/kg/h, sin sobrepasar los 20mg/24h y una duración máxima de 96h. Su eficacia se mide en función del grado de permeabilidad venosa alcanzado: grado i=lisis < 50%; grado ii=lisis entre el 50 y el 90%; grado iii=lisis completa. Durante su realización debe efectuarse una angioplastia percutánea transluminal con la colocación consiguiente de una endoprótesis vascular (stent) para tratar las lesiones obstructivas o compresivas y prevenir las retrombosis37,38.
Un metaanálisis de 19 estudios con 1.046 pacientes tratados con TDC o TFMDC describe el uso de stent en el 46% de los pacientes40. Aunque no se notificó el número total de extremidades inferiores con estenosis u obstrucciones descubiertas por la terapia lítica en el Registro Venoso Nacional, el 33% de los miembros afectados necesitaron tratamiento con stent metálico. Tras un año de seguimiento la permeabilidad venosa de los tratados fue del 74 frente al 53% de los no tratados37.
Recientemente un estudio realizado en 189 pacientes con TVPIF tratados con stent metálico demostró que al año de seguimiento la permeabilidad vascular fue del 94% y a los 3 años del 90%, mientras que las tasas de supervivencia al año fueron del 100% y a los 5 años del 97,3%41.
En la tabla 5 se expone el protocolo para la realización de la trombólisis en la TVPIF aguda.
Protocolo para la realización de la trombólisis en pacientes con trombosis profunda venosa profunda iliofemoral aguda
| • Suprimir la administración de HBPM 8 h antes |
| • Suprimir la anticoagulación oral. Comprobar que el INR sea inferior a 1,5 |
| • Administrar por vía venosa periférica un bolo de 5.000U de HNF |
| • Proseguir con perfusión de 15U/kg de HNF, para mantener un tiempo parcial de tromboplastina activada (aPPT) entre 1,2 y 1,7 el control |
| • Previa anestesia local, punción e introducción de un catéter en la vena poplítea bajo control ecográfico |
| • Colocación de la punta del catéter en el interior del trombo, con control flebográfico |
| • Administración de 20mg de alteplasa en 500ml de ClNa al 0,9% a un ritmo de 0,01mg/kg/hora hasta un máximo de 20mg en 24h |
| • Durante su perfusión, mantener en todo momento la estabilidad hemodinámica del paciente y la permeabilidad de la vía venosa |
| • Diariamente debe realizarse tanto un control venográfico como de los parámetros de la coagulación |
| • El tiempo máximo de tratamiento no debe superar las 96h |
| • Si es necesario, en la misma sesión, puede colocarse un stent en la vena ilíaca para tratar las lesiones obstructivas y prevenir las retrombosis |
| • Retirar el catéter y aplicar presión manual durante 2 h |
| • Continuar con anticoagulación estándar |
HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; stent: endoprótesis vascular.
Elaboración propia a partir de varios autores37,38.
La trombectomía percutánea mecánica (TPM) es la punción e introducción de un catéter bajo control ecográfico en la vena afectada con extracción del trombo mediante fragmentación, maceración y/o aspiración. No hay ninguna evidencia de que este método sea lo suficientemente efectivo por sí solo como terapia antitrombótica ya que su utilización sin trombólisis simultánea puede asociarse a un EP sintomático42,43. Sin embargo, estudios comparativos retrospectivos indican que la TPM junto con la TDC −conocida como trombólisis farmacomecánica (TFMDC)− proporciona una eficacia comparable a la de la TDC, pero con una mayor reducción de la cantidad de trombolítico (40 al 50%), tiempo de perfusión y utilización de recursos hospitalarios44,45.
Una revisión retrospectiva de 16 series de casos demostró una tasa de lisis grado ii-iii entre el 83 y el 100% de los pacientes, aunque el 7,5% necesitaron transfusiones sanguíneas debido a las complicaciones hemorrágicas46.
En un estudio comparativo de cohortes entre la TFMDC y la TDC las tasas de hemorragias fueron del 7,1 y del 8,7%, respectivamente47.
Selección de los pacientes para trombólisis dirigida por catéter o trombólisis farmacomecánicaDebido a que el balance riesgo-beneficio de la trombólisis es incierto en lo concerniente a las hemorragias mayores, todos los pacientes que no tengan un compromiso circulatorio grave que ponga en peligro el miembro afectado deben ser inicialmente anticoagulados.
Solamente está indicada en las TVPIF que presenten flegmasia cerulea dolens, una rápida extensión del trombo o un deterioro sintomático a pesar de recibir una anticoagulación adecuada, siempre que la sintomatología sea inferior a 14 días, tengan un buen estado funcional y una expectativa de vida superior a un año. No está indicada cuando la sintomatología sea superior a 21 días o haya alto riesgo de sangrado1,9,48.
Trombectomía quirúrgica venosaEs un método alternativo para disminuir la morbilidad a largo plazo causada por el SPT en pacientes con contraindicaciones a la terapia trombolítica o cuando ésta ha fracasado.
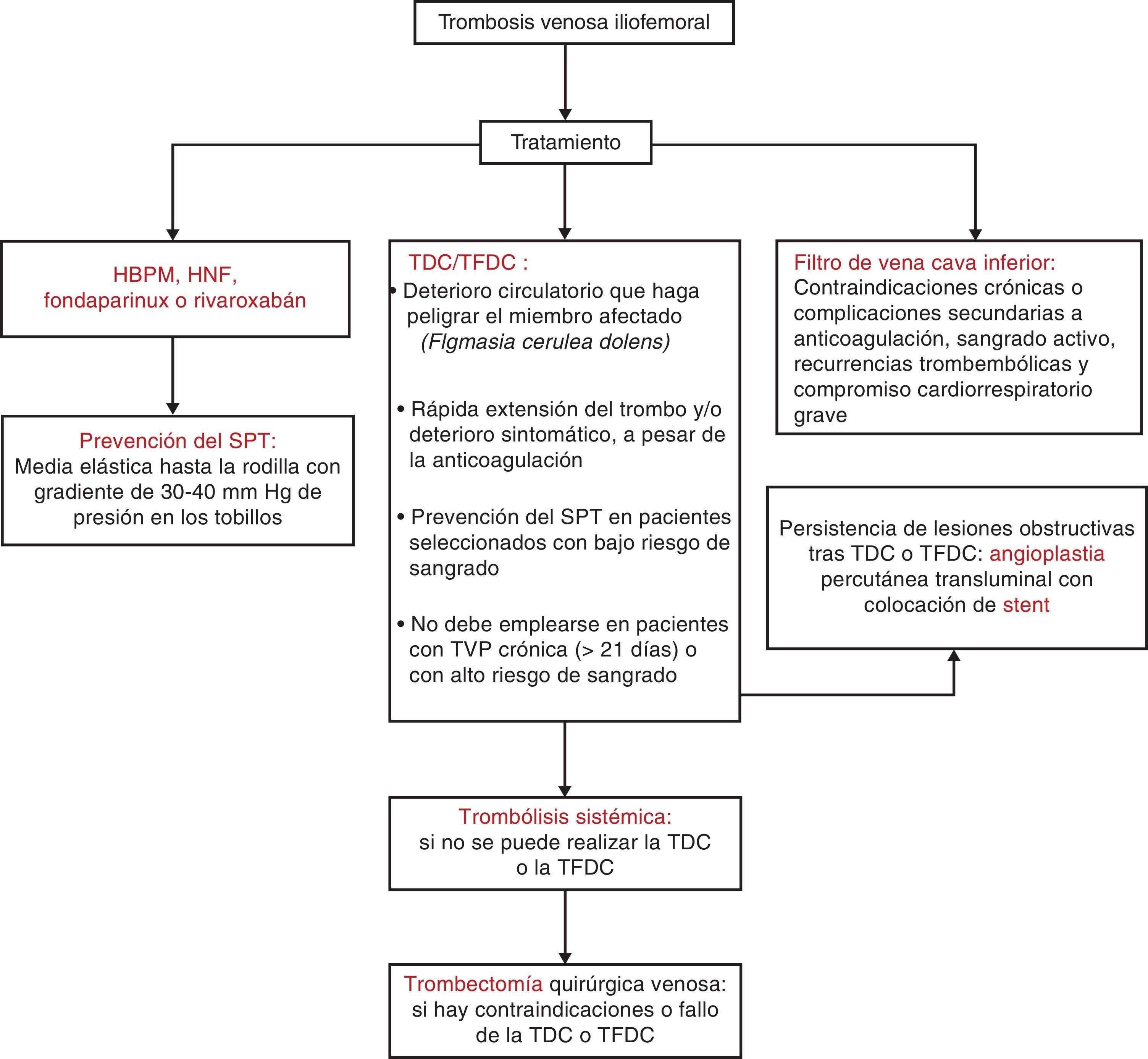
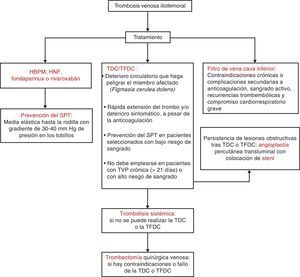
Debe considerarse en pacientes que tengan una sintomatología inferior a 7 días, un buen estado funcional, expectativa de vida igual o superior a un año y cuando se dispongan de los recursos adecuados y de equipos médicos competentes. Su principal inconveniente es que es invasiva, requiere anestesia general y conlleva un riesgo adicional de EP1,9,48. En la figura 1 se expone el algoritmo terapéutico de la TVPIF.
Algoritmo terapéutico de la TVIF. Elaboración propia a partir de varios autores1,9,48.
HBPM: heparinas de bajo peso molecular; HNF: heparinas no fraccionadas; SPT: síndrome postrombótico; stent: endoprótesis vascular; TDC: trombólisis dirigida por catéter; TFDC: trombólisis farmacomecánica dirigida por catéter; TVPIF: trombosis venosa profunda iliofemoral.
El SPT es una complicación crónica de la TVP. Aparece en un tercio de los pacientes con episodios trombóticos anteriores y en más de dos tercios de los que han presentado una TVPIF2,49. Sus síntomas típicos incluyen el dolor, la pesadez, el edema y los calambres en las piernas, que generalmente empeoran con la bipedestación y la deambulación. Para su evaluación clínica se emplea la escala de Villalta50.
Factores de riesgoTienen un alto riesgo de desarrollarlo quienes presentan TVPIF, TVP recurrente ipsolateral, obesidad y edad avanzada. Así mismo, los pacientes que mantienen niveles subterapéuticos de INR más del 50% del tiempo durante los 3 primeros meses de tratamiento con AVK tienen un riesgo 3 veces mayor. También se asocia con niveles persistentemente elevados de marcadores de inflamación y de dímero D en los meses siguientes a una TVP51.
PrevenciónDiversas investigaciones han demostrado que el empleo de medias elásticas hasta la rodilla con un gradiente de 30-40mmHg de presión en los tobillos en las 2 semanas posteriores a una TVP proximal, y durante un mínimo de 2 años, reduce el SPT en un 50%, aunque no alteran la frecuencia de los TEVR52,53.
Estos estudios tienen una serie de limitaciones ya que no son a ciegas, carecen de grupo control y no separan los resultados obtenidos en los distintos tipos de TVP proximales.
No se han realizado estudios comparativos sobre su eficacia según se coloquen hasta la rodilla o hasta el pliegue inguinal, así como tampoco en el tratamiento del SPT secundario a la TVPIF o en las TVP distales.
Sin embargo, puesto que existe una concordancia en los resultados obtenidos en los distintos estudios y la muy baja probabilidad de causar un daño al paciente con este tipo de indicación, se recomienda el uso diario de las medias de compresión al menos en los 2 años posteriores al diagnóstico de un primer episodio de YVP proximal. Si las medias de 30-40mmHg constrictivas son demasiado o difíciles de poner pueden emplearse las de 20-30mmHg1,51.
En pacientes con grandes edemas deben realizarse compresiones neumáticas intermitentes del miembro afectado que faciliten el retorno venoso, con la colocación posterior de medias de compresión54.
Tratamiento médicoEl tratamiento del SPT sintomático ha sido evaluado con distintos medicamentos y suplementos herbarios. En un ensayo clínico realizado durante un año en 120 pacientes, los hidroxietilrutósidos y las medias de compresión mejoraron de forma similar la sintomatología postrombótica55. Una revisión de 17 ensayos clínicos en los que se compararon las medias de compresión, la administración de un placebo y extractos de semillas del castaño de Indias (50-75mg/12h) demostró que estos últimos, a corto plazo, mejoraban el dolor y el edema además de ser bien tolerados56. Actualmente no contamos con estudios rigurosos que nos indiquen si estas terapias son seguras y eficaces a largo plazo.
Tratamiento quirúrgicoLas escasas y limitadas series de casos de que disponemos indican que las intervenciones quirúrgicas para corregir la obstrucción ileofemorocava o el reflujo venoso pueden beneficiar a determinados pacientes con SPT moderados o severos57–59.
Sin embargo, las limitaciones metodológicas de los estudios disponibles −falta de ensayos aleatorios controlados, ausencia de grupos control, tamaños reducidos de las muestras, períodos cortos de seguimiento, entre otros− hacen difícil determinar la aplicabilidad de estos estudios a la población general y en consecuencia determinar con certeza si estas terapias pueden o no beneficiar a nuestros pacientes60,61.
ConclusionesEn ausencia de contraindicaciones los pacientes con TVPIF deben tratarse inicialmente con HBPM, HNF o fondaparinux junto con AVK.
Debido a que el balance riesgo-beneficio de la trombólisis es incierto en lo concerniente a las hemorragias mayores, todos los pacientes que no tengan un compromiso circulatorio grave que ponga en peligro el miembro afectado deben ser inicialmente anticoagulados.
Durante la realización de la trombólisis debe efectuarse una angioplastia percutánea transluminal con la colocación consiguiente de un stent para tratar las lesiones obstructivas o compresivas y prevenir las retrombosis.
La trombectomía quirúrgica es un método alternativo cuando la trombólisis esté contraindicada o haya fracasado.
Para prevenir el SPT se recomienda el uso diario de medias elásticas hasta la rodilla con un gradiente de 30-40mm Hg de presión en los tobillos, al menos durante 2 años.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.