El uso del polidocanol en forma de espuma es una herramienta terapéutica ampliamente usada en el mundo de la flebología y con la que la mayoría de los cirujanos vasculares estamos habituados. Sus indicaciones son variables en función de la patología a tratar, las condiciones basales del paciente, la anatomía y hemodinámica del sistema venoso, y las preferencias del paciente y el terapeuta, pero hoy en día se acepta que en muchos casos puede constituir una opción de primera línea incluso en varices de gran tamaño, incluidas las malformaciones arteriovenosas.
Los linfoceles y seromas postoperatorios son una complicación que, aunque infrecuente, no es excepcional. Se producen por el acúmulo de linfa o de trasudado en una zona de cicatriz quirúrgica, habitualmente en el tejido celular subcutáneo, constituyendo tumoraciones que, aunque benignas, tienden al crecimiento y a la cronicidad, con posibilidad de infección, y que complican de forma importante los postoperatorios de diversas técnicas quirúrgicas (varices, cirugía de revascularización, explante de ejes venosos para bypass, cirugía protésica…). Su respuesta a los tratamientos clásicos (punción y evacuación, aspiración, instilación de sustancias vesicantes, compresión…) es en muchos casos poco satisfactoria, ya que se comportan de forma refractaria al tratamiento y con tendencia a la recidiva y aparición de complicaciones.
Los seromas periprotésicos son una entidad mucho más rara, pero que cuando aparecen poseen una elevada morbilidad. Se caracterizan por la aparición de una colección con tendencia a la cronicidad que rodea al implante de una prótesis vascular, aunque se han descrito en implantes de otros tipos (articulares, mamarios…). Su tratamiento es decepcionante en los resultados, con tendencia a la infección y recidiva, y, en los asociados a prótesis vasculares, pueden obligar al recambio de la prótesis afectada y revascularización alternativa, con riesgo no despreciable de infección, trombosis, o pérdida de la extremidad.
Hace ya 7 años, nuestra experiencia previa en la escleroterapia ecoguiada nos condujo, durante la evacuación de un linfocele recidivante secundario a una extracción de safena interna para revascularización extraanatómica en una paciente oncológica, a pensar en la posibilidad de cerrar la cavidad mediante la reacción vesicante producida por el polidocanol en espuma. El procedimiento cursó de forma muy satisfactoria, con resolución completa de la complicación en 3 sesiones de tratamiento.
Hasta este momento, hemos tratado con éxito 15 casos de linfoceles de tamaños variables, 5 de ellos superiores a 5cm de diámetro, con buenos resultados, usando sesiones de evacuación y escleroterapia (entre 2 y 6 sesiones).
Publicaciones con resultados similares concluyen que puede ser una técnica de recurso como alternativa a las técnicas quirúrgicas clásicas (puesta a plano y linfostasia, marsupialización, instilación de quimioterápicos y desinfectantes…)1.
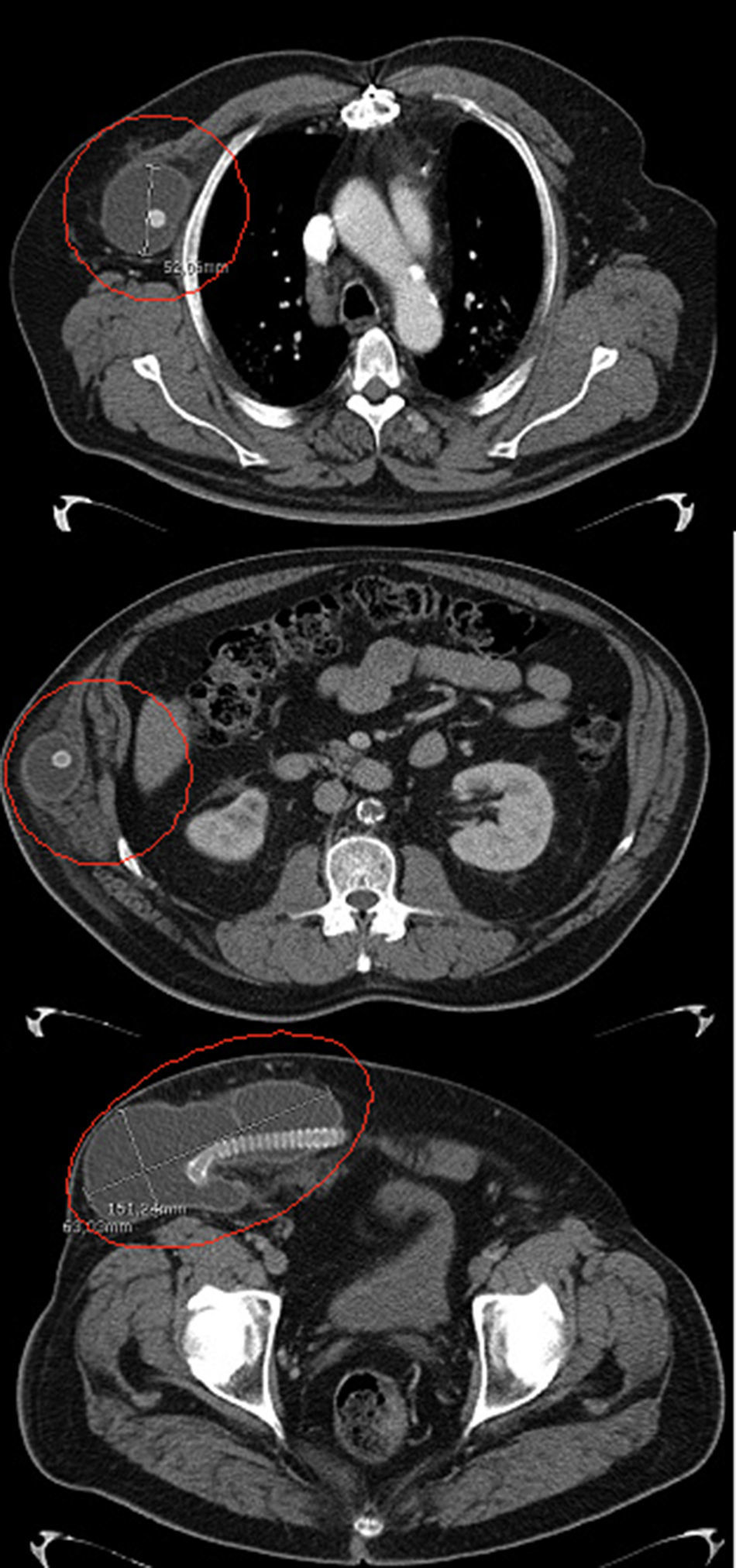
Por su similitud, aplicamos también esta técnica a un caso de seroma periprotésico de gran tamaño (>15cm de diámetro) en un paciente pluripatológico portador de un bypass axilobifemoral, frente a la opción quirúrgica clásica (extraanatómico contralateral y resección de la prótesis afecta)2,3 (figs. 1 y 2). En esta ocasión no hemos encontrado en la literatura descripción de casos similares, por lo que queremos presentarlo como una primicia terapéutica.
Aunque por ahora debemos considerarlo un uso off label, es decir, fuera de la especificación técnica del producto (y como tal debe ser entendido, incluso presentado al paciente y recogido de este modo en el consentimiento informado), creemos que por su facilidad de realización, sus escasos efectos secundarios, la visibilidad ecográfica de la espuma y su reproductibilidad (posibilidad de realizar tratamientos repetitivos) puede hacer que la escleroterapia de linfoceles y seromas periprotésicos sea una buena estrategia para el tratamiento de estas patologías.
TécnicaNuestra experiencia es aún limitada, y procede sobre todo de la aplicación de esta estrategia a linfoceles y a un caso de seroma periprotésico de gran tamaño.
El material preciso consiste en un ecógrafo para monitorización de la punción, evacuación e instilación de la espuma. Habitualmente lo usaremos en modo B dinámico, para tener mejor capacidad de discriminación en tiempo real. Inicialmente procederemos a una estimación del volumen; la más fácil, aunque no muy exacta, es la del elipsoide (volumen=0,52 × diámetro máximo anteroposterior × diámetro máximo transversal × diámetro máximo cefalocaudal), pero habitualmente la mejor forma de calcular el volumen de estimación es mediante la cantidad evacuada por aspiración.
Procedemos a la preparación de campo estéril con la desinfección de superficies y preparación de paños; en principio no es preciso el uso de anestésico local, aunque puede ser útil en función del paciente y de la zona; realizamos una cartografía ecográfica de la cavidad para decidir la mejor zona de tratamiento (la más abocada a la piel, evitando zonas inflamatorias, zonas de sufrimiento dérmico o cicatrices, si es posible) y pasamos a puncionar la cavidad de forma ecoguiada con un Abbocath de calibre variable en función del tamaño y la profundidad (números 14-16 habitualmente, ya que su mayor calibre evita el colapso de la luz del catéter) y extraemos la aguja, dejando el catéter en el seno del linfocele o del seroma. Mediante aspiración (inicialmente con una jeringa de mayor capacidad, 10-20cc, que transmite menos presión, aunque en algunos casos puede servirnos una de pequeño calibre 2-5cc) vamos evacuando el contenido, que trasvasamos a un recipiente (por ejemplo un bote de muestra de orina) para cuantificar volúmenes. El colapso de la cavidad se va siguiendo mediante eco, siendo a veces preciso masajear la zona con la mano o el ecógrafo, o proceder a la movilización del catéter para evitar remanentes en la cavidad. Una vez conseguida la evacuación de la cavidad en la mayor proporción posible, instilamos el esclerosante (habitualmente usamos polidocanol al 2 o 3%, en espuma laxa de Tessari, en proporción de una parte de líquido por 3 o 4 de aire) con control ecográfico a través del mismo Abbocath que hemos usado para la evacuación.
El volumen a instilar vendrá dado en función del previo de la cavidad y del evacuado, pero respecto al de la escleroterapia en vena hay una serie de consideraciones a tener en cuenta, tales como que no pasa a circulación sistémica (los volúmenes, concentraciones y cantidades de la técnica clásica no son limitantes), que nuestro objetivo es el cierre de una cavidad, por lo que podemos usar concentraciones altas de entrada, y que la velocidad y la presión de infusión pueden ser más elevadas.
Tras la instilación procedemos a masajear con el ecógrafo la zona tratada, para extender el contacto de la espuma con la superficie de la pseudocápsula de la cavidad. Dado que el esclerosante se inactiva rápidamente en contacto con las estructuras orgánicas, pasados un par de minutos procedemos a la aspiración del mismo, para disminuir la dosis y evitar su metabolización.
Una vez evacuada la espuma, realizamos nuevo control ecográfico y posteriormente pasamos a aplicar un vendaje o un apósito compresivo, con un empacado externo de la cavidad (torundas, gasas o foam) que colapsen la misma para favorecer el contacto de las paredes.
Aunque inicialmente realizábamos revisiones semanales y retratamiento si era preciso, actualmente revisamos al paciente a los 10-14 días, salvo que aparezca alguna circunstancia clínica (fiebre, dolor, tumoración…) que nos haga adelantarla. En la mayor parte de los casos, en 2 o 3 sesiones se ha conseguido el cierre de la cavidad, aunque en un caso se precisaron 6 sesiones hasta conseguirlo. Hemos transmitido la técnica a varios compañeros que nos han reportado los mismos buenos resultados.
No usamos cobertura antibiótica de forma habitual (es más, una de las técnicas clásicas en el manejo de esta patología era proceder a su contaminación séptica para que la reacción inflamatoria cerrase la cavidad), y hasta el momento no hemos tenido complicaciones infecciosas o inflamatorias que hayan requerido tratamiento o revisión específica. Hasta este momento no hemos actuado sobre linforragias, aunque pensamos que, al menos desde un punto de vista teórico, podrían ser tratadas de forma similar, evacuarse por compresión externa e instilar el esclerosante por el orificio de salida, pero no tenemos experiencia del comportamiento del esclerosante sobre una herida fresca.
Tampoco tenemos experiencia sobre la mayor o menor efectividad del tratamiento sobre un linfocele más o menos maduro (con las paredes más o menos organizadas), ya que es una patología que tratamos en cuanto es detectada.
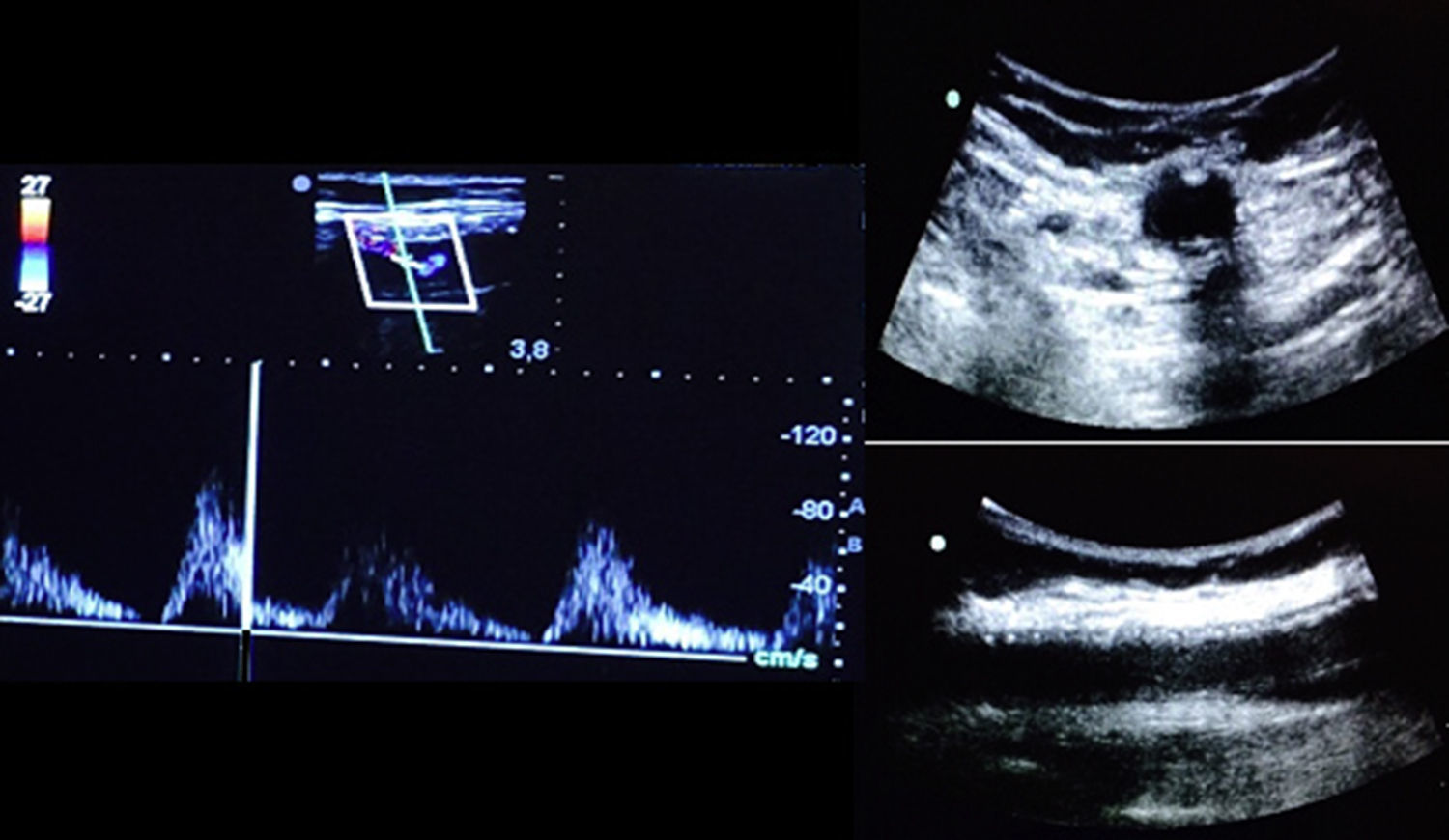
El hecho de tratar un seroma periprotésico con esta técnica partió de una serie de consideraciones previas, tales como la experiencia con linfoceles en procesos venosos (crosectomías, varicectomías, explante de vena safena para injerto arterial), y posteriormente extensión de la técnica con éxito a los casos que ocurrieron tras cirugía arterial (el primero de más de 10cm de diámetro mayor, tras el implante de una endoprótesis aórtica, en proximidad a la arteria femoral), el valorar que la alternativa clásica (explante y revascularización extralocal) tampoco está exenta de riesgos y, sobre todo, la excelente visibilidad ecográfica de esta patología, que permite el seguimiento de la espuma y su distribución. Es verdad que la hipotética infección de la prótesis supondría una complicación grave, pero a fin de cuentas sería tratada de la misma forma que el seroma (explante y derivación extralocal), por lo que en principio nos hizo considerar este abordaje como menos agresivo. En este caso, el paciente estaba ingresado para procederse a la cirugía antes descrita, y el ingreso, para seguimiento, se mantuvo 4 días tras el tratamiento.
ComentariosNuestra experiencia es aún limitada, pero este tratamiento nos parece más adecuado y con menos riesgos y complicaciones que el abordaje cruento clásico de estas patologías.
Debemos pensar que, frente a la escleroterapia clásica venosa, este procedimiento presenta varias diferencias:
- -
La evacuación previa del contenido de linfa o de líquido seroso nos permite estimar los volúmenes de forma muy adecuada y evita la dilución del esclerosante, optimizando la zona de contacto con la pseudocápsula y disminuyendo la inactivación del mismo por las proteínas orgánicas.
- -
La instilación del esclerosante en espuma se produce dentro de una cavidad, no en el torrente sanguíneo; esto hace que los volúmenes puedan ser más elevados (20 o 30cc) y las concentraciones más altas (3%), y al mismo tiempo se disminuye la posibilidad de las 2 complicaciones más temidas de la escleroterapia en vena: la enfermedad tromboembólica venosa y las complicaciones arteriales por foramen ovale permeable.
- -
La visibilidad de la espuma y de los límites de la cavidad a tratar, cuando se trata de lesiones en el subcutáneo, es excelente.
- -
El hecho de ser una cavidad aislada nos permite, dentro de lo posible, evacuar la espuma de la misma una vez realizado su efecto, ya que el esclerosante se inactiva al contacto con las proteínas y superficies biológicas.
- -
Las sesiones no tienen por qué decalarse tal como se hace en la patología venosa, aunque parece prudente esperar unos días para que el efecto irritativo del esclerosante sobre la mucosa haga su efecto.
- -
De todas formas, es un tratamiento off-label, y eso quiere decir que el consentimiento informado para realizarlo debe incluir, de forma especificada, este concepto, que debe ser conocido y aceptado por el paciente.
Los resultados hasta el momento son prometedores respecto a las opciones clásicas, usando un tratamiento fácil, poco invasivo, y con escasos efectos secundarios y dolor.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.