El empleo de prótesis vasculares conlleva un riesgo no despreciable de infección de las mismas. El tratamiento incluye la antibioticoterapia dirigida, y en la gran mayoría de los casos, la cirugía. En aquellos pacientes carentes de material autógeno apto para bypass, el empleo de aloinjertos arteriales criopreservados (AAC) es una opción razonable. Se presenta a continuación el caso de una paciente tratada en nuestro servicio mediante sustitución in situ de bypass femoropoplíteo protésico infectado por AAC, que sufre trombosis de este último a los 5 meses.
Se trata de una paciente de 69 años, con antecedentes de diabetes mellitus tipo 2, hipertensión arterial, dislipemia y cardiopatía isquémica tipo angor de esfuerzo. Es valorada en urgencias por dolor de reposo de 2 meses de evolución en miembro inferior derecho, que obliga al declive e impide el descanso, sin lesiones (categoría 4 de Rutherford). A la exploración presenta una obstrucción femoropoplítea bilateral con eritrosis franca del pie derecho, relleno capilar enlentecido y frialdad respecto al contralateral. El resto de exploración vascular es anodina. Analíticamente, solo destaca una leucocitosis de 12.500mm3 sin desviación izquierda, y sin otras alteraciones. El índice tobillo-brazo es de 0,3 en el miembro inferior derecho.
Se le realiza una angioresonancia magnética con gadolinio, donde se aprecia una oclusión mayor de 20cm de la arteria femoral superficial, con recanalización a nivel de la arteria poplítea supragenicular (TASC tipo D), por lo que se decide realizar un bypass fémoro-poplíteo a primera porción de arteria poplítea protésico (politetrafluoroetileno [PTFE]). Tras dicha intervención, mejora notablemente la perfusión del pie, recuperando pulso pedio. A partir del 6.° día postoperatorio, la paciente comienza a tener picos febriles y mala evolución de la herida quirúrgica, con exudado seropurulento del que se toma cultivo (crecen S. epidermidis y E. coli). Pese al tratamiento antibiótico (vancomicina 1g/12h y meropenem 1g/8h) prolongado y las curas realizadas, la evolución de la herida inguinal sigue siendo tórpida (precisa apertura de la misma, quedando la anastomosis proximal del bypass expuesta), aunque no asocia signos sistémicos de infección.
Se decide sustitución in situ del bypass protésico, empleando AAC, dado que la paciente carece de vena apta para bypass (vena safena interna con diámetro menor de 2mm en ambos miembros inferiores y largo recorrido extrafascial). Tras la intervención, se emplea terapia de presión negativa (VAC®) con lo que la herida evoluciona correctamente. A las 9 semanas del ingreso la paciente es dada de alta, con la herida prácticamente cicatrizada, cultivos negativos y bypass funcionante. En las revisiones posteriores, al mes y los 3 meses, el bypass se mantiene permeable y la herida inguinal cicatriza completamente.
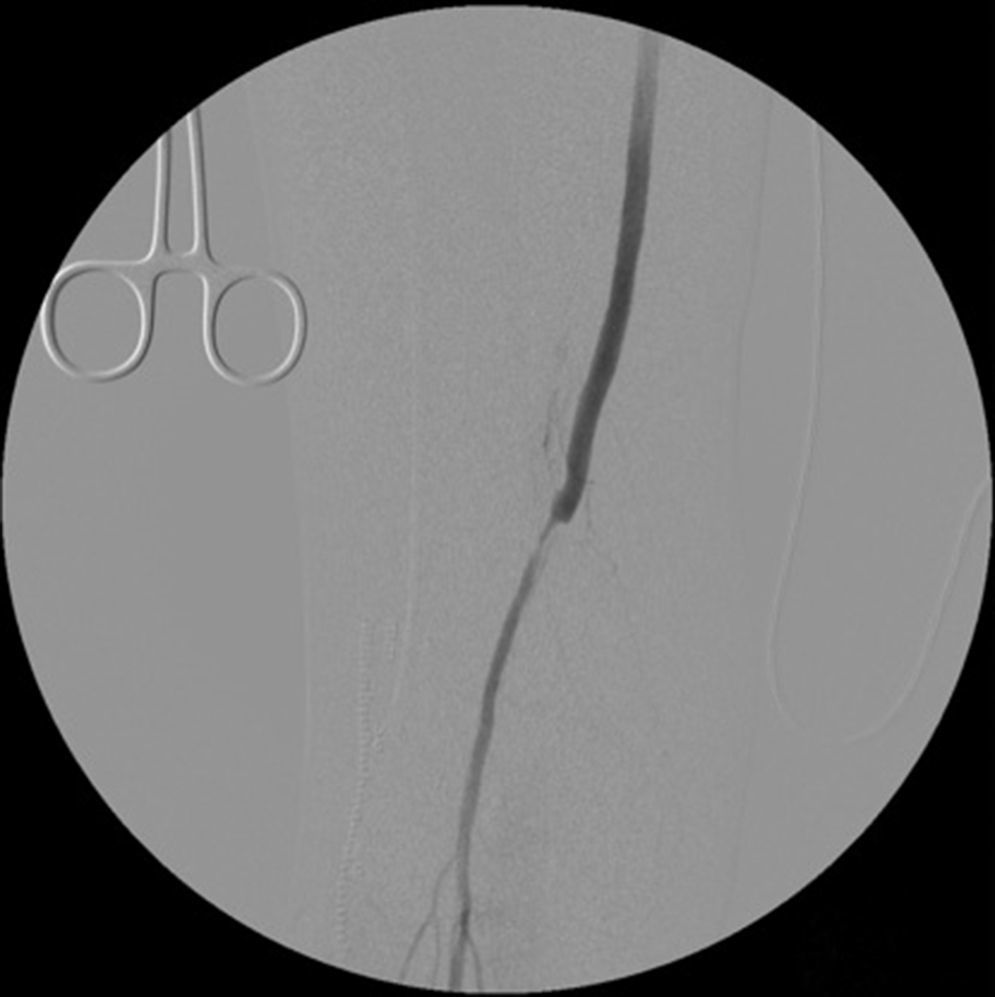
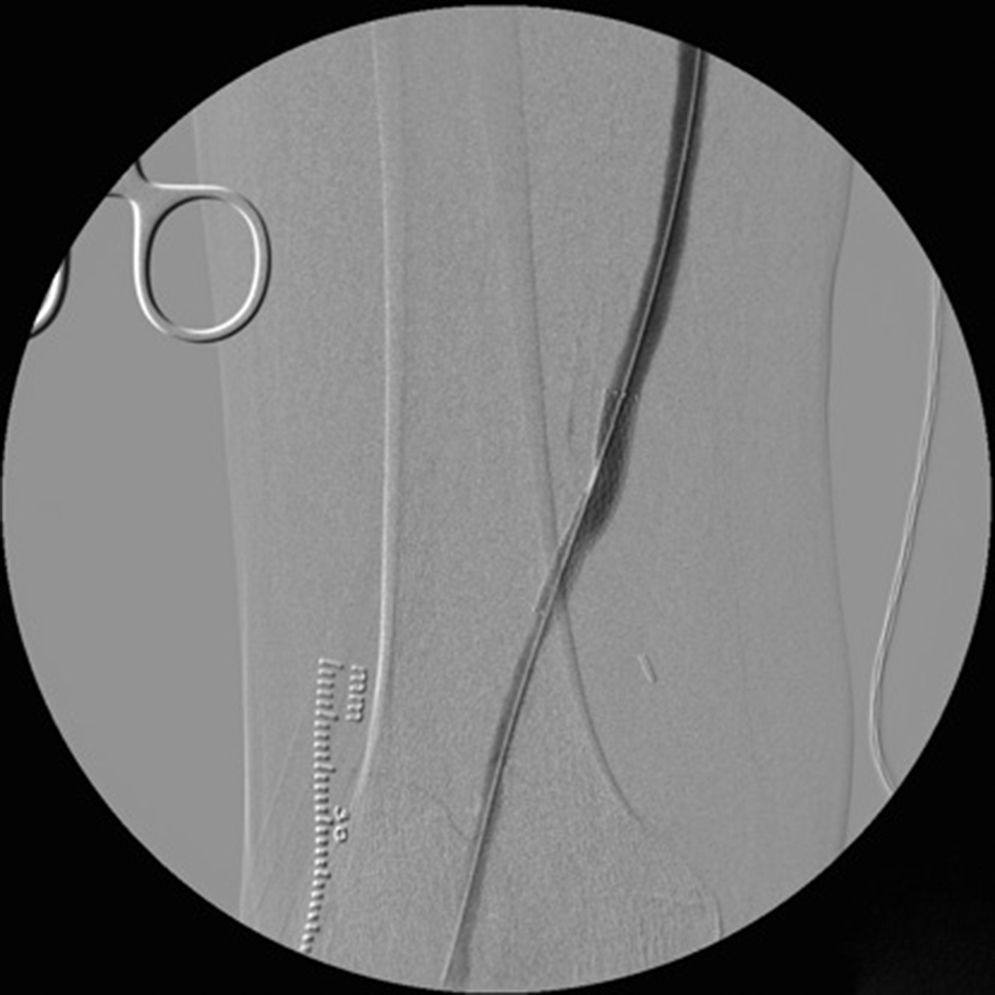
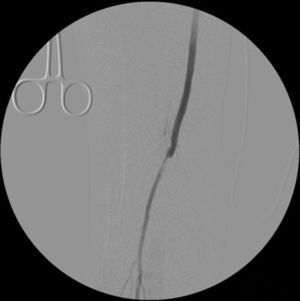
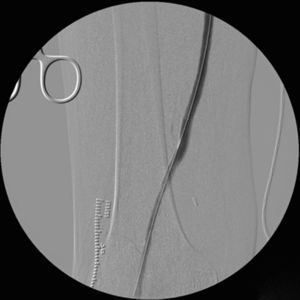
Cinco meses después de la última intervención, la paciente vuelve a urgencias con cuadro de isquemia aguda del miembro inferior derecho de 12h de evolución, por trombosis del bypass AAC. Se interviene de urgencia, abordando el bypass desde una incisión longitudinal en tercio proximal de muslo, desde donde se realiza una trombectomía obteniendo un pobre reflujo. En el control arteriográfico se aprecia una estenosis del bypass superior al 70% a nivel de la anastomosis distal (fig. 1), y en tercio medio de la arteria tibial anterior (mejor eje distal). Se decide dilatar la lesión de la arteria tibial anterior con un balón de 2×200mm (buen resultado arteriográfico) y la anastomosis distal del bypass con otro balón de 6×40mm, decidiéndose implantar un stent autoexpandible de 6×40mm (Complete, Medtronic®) (fig. 2) por recoil. Es dada de alta al 7.° día postoperatorio con bypass funcionante, pulso pedio y herida quirúrgica con buen aspecto.
La infección protésica ocurre entre el 0,2 y el 5% de los pacientes, e implica un riesgo vital para el paciente así como de pérdida de extremidad1. Es más probable en presencia de algunas circunstancias (anastomosis a nivel femoral, el sexo femenino2, la insuficiencia renal crónica, la cirugía de urgencia, las reintervenciones, la tunelización subcutánea), y S. aureus y S. epidermidis son los gérmenes más implicados.
El tratamiento se basa en el empleo de antibióticos y la cirugía. La sustitución in situ del injerto asociada a un desbridamiento agresivo es preferible a la conservación del injerto o a la extirpación simple, que son solo posibles en casos muy seleccionados y en combinación con otras terapias como la cobertura muscular o la terapia de presión negativa3,4. La sustitución in situ por vena autóloga obtiene los mejores resultados, aunque en pacientes que carecen de vena apta, puede emplearse AAC, injertos biosintéticos (colágeno ovino sobre una malla de poliéster) o material protésico impregnado en antibióticos5. En nuestro caso, preferimos emplear AAC por la experiencia en nuestro centro con el uso del mismo6, y la necesidad de estudios a largo plazo y con número suficiente de pacientes que demuestren la superioridad de los injertos biosintéticos7.
El empleo de AAC requiere un cuidadoso proceso de preparación y criopreservación previamente a su implante, así como un seguimiento a largo plazo dada la posibilidad de complicaciones. La tasa de rotura o degeneración tardía del mismo es aproximadamente del 17%6,8, mientras que la tasa de permeabilidad primaria y secundaria a los 18 meses es del 51-68 y 86% según las series y solo del 16% a los 5 años9,10.
El tratamiento endovascular de las complicaciones de los AAC es un tema sobre el que hay poca bibliografía disponible. Se han empleado stent recubiertos para excluir degeneraciones aneurismáticas muy localizadas en series de pocos casos10, pero no hay información acerca del tratamiento endovascular de lesiones de tipo estenótico, lo cual representa lo excepcional de este caso. El tratamiento endovascular en este caso tiene como ventajas su sencillez técnica, evitar realizar más heridas (en una paciente con problemas de cicatrización en cirugías previas) y reservar la extensión del bypass como posibilidad para el futuro.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.