El riñón en herradura (RH) es una de las malformaciones congénitas renales más frecuentes, cuya incidencia se sitúa en torno al 0,25%, siendo infrecuente su asociación con aneurisma de aorta abdominal (AAA). Presentamos los resultados del tratamiento endovascular (EVAR) en dos casos de AAA asociado a RH (AAA-RH). Caso 1: varón de 60 años, con antecedentes de obesidad, dislipemia y RH asintomático, diagnosticado casualmente de AAA de 62mm de diámetro asintomática. Caso 2: mujer de 71 años, con antecedentes de hipertensión arterial y artritis reumatoide, diagnosticada mediante angioTC en el contexto de abdominalgia inespecífica, de AAA infrarrenal de 50mm de diámetro sin signos de rotura asociado a RH. En ambos casos se realizó EVAR mediante endoprótesis bifurcada Zenith®. No se registraron endofugas ni oclusión de arterias renales en angiografías de control. No hubo complicaciones perioperatorias. La búsqueda realizada en Medline/Pubmed/Scopus mediante la introducción de los términos horseshoe, kidney, aneurysm, endovascular y EVAR identificó 19 casos descritos en la literatura desde 1991 en los que se empleó EVAR para tratar AAA-RH.
Horseshoe kidney (HSK) is one of the most common kidney malformations, the incidence is around 0.25%, but its association with abdominal aortic aneurysm (AAA) is uncommon. We present the results of endovascular treatment in two cases of AAA associated with HSK (AAA-HSK). Case 1. 60-year-old male with a history of obesity, dyslipidaemia, and asymptomatic HSK, incidentally diagnosed with an, also symptomatic, AAA of 62mm in diameter. Case 2. 71-year-old woman with a history of hypertension and rheumatoid arthritis, diagnosed by angio-CT with an infrarenal AAA 50mm in diameter with no signs of rupture associated with HSK in the context of non-specific abdominal pain. Both patients underwent endovascular repair (EVAR) by Zenith® endoprosthesis. There were no endoleaks or occlusion of renal arteries on angiography. There were no perioperative complications. The search in Medline/Pubmed/Scopus by introducing the terms «horseshoe», «kidney», «aneurysm», «endovascular» and «EVAR», identified 19 cases described in literature since 1991, which was used to treat AAA EVAR-HSK.
El riñón en herradura (RH) es una de las malformaciones congénitas renales más frecuentes, cuya incidencia se sitúa en torno al 0,25%1, variando esta cifra entre el 0,15 y el 0,33%2, lo que corresponde a 1 de cada 400 personas. Es dos veces más frecuente en el sexo masculino. Su asociación con aneurisma de aorta abdominal (AAA) es infrecuente, aproximadamente un caso por cada 710 autopsias realizadas3. Por otro lado, solo el 0,12% de los pacientes que son tratados de AAA presentan RH4.
Está producido por la fusión anómala de los parénquimas renales, usualmente a nivel del polo inferior en el 95% de los casos5. Dicho puente de unión, denominado istmo, puede tratarse de tejido parenquimatoso renal normal en el 85% de las ocasiones o, por el contrario, de tejido fibroso o displásico6. En el embrión, la anormalidad se produce entre la cuarta y la sexta semanas de gestación. El desarrollo anómalo de la pelvis renal y una alteración leve de la posición de los vasos umbilicales, pelvianos y mesentéricos inferiores podrían modificar la orientación de los riñones y determinar que se fusionen6. Se asocia normalmente a una función renal normal, permaneciendo asintomáticos la mayoría de los pacientes afectos7.
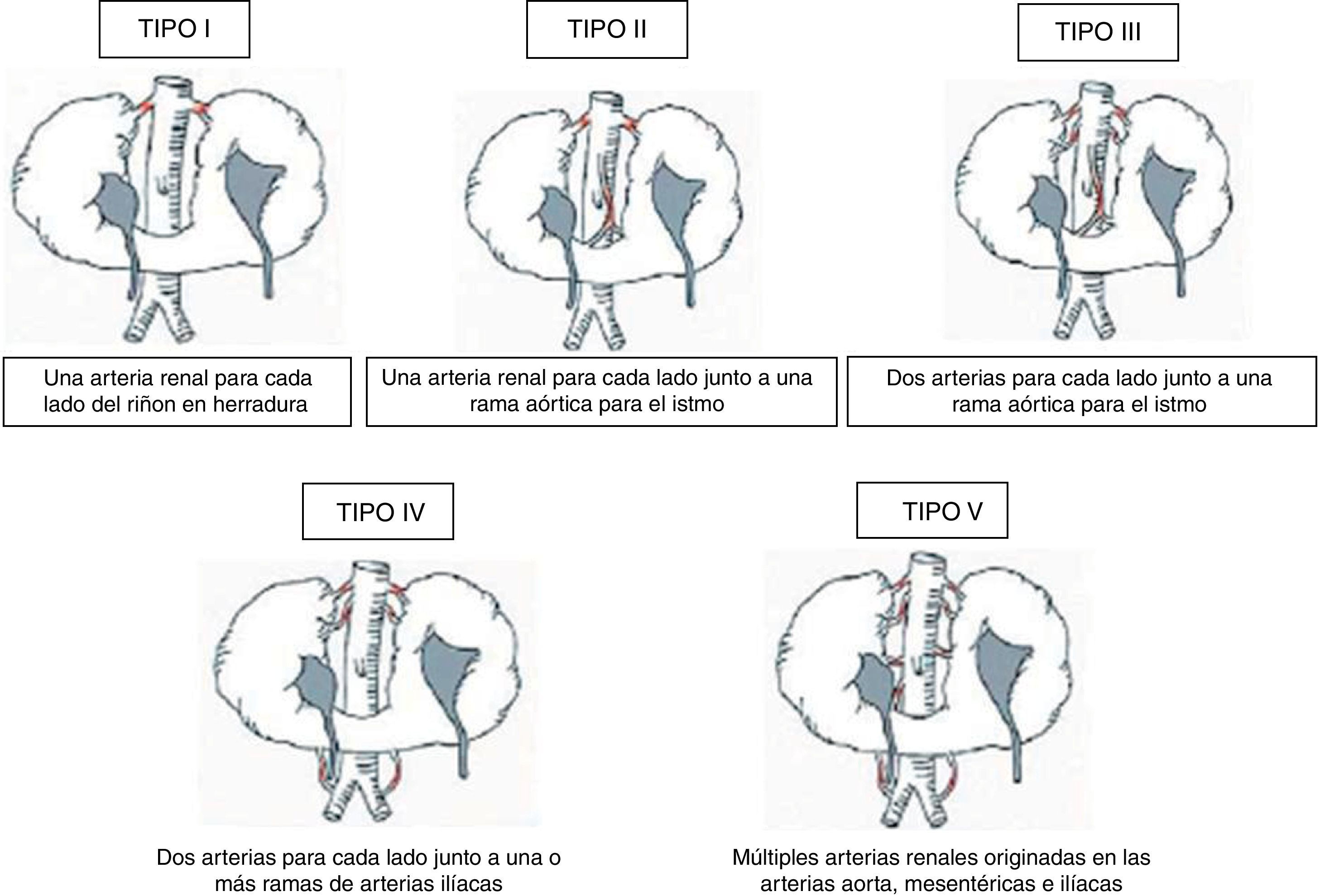
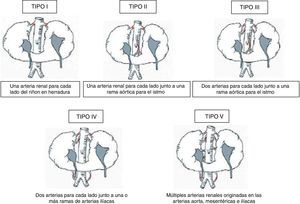
Las anomalías vasculares han sido halladas en el 60-80% de los casos descritos en la literatura8. Existen varias clasificaciones para establecer la variabilidad en cuanto al aporte sanguíneo arterial en el RH, siendo la más empleada la propuesta por Eisendrath et al.3 en 1925 (fig. 1). Según esta clasificación, el tipo más frecuente es el II (30% de los casos) según Faris y Buxton7,9.
Tipos de riñón en herradura atendiendo a la variabilidad en la vascularización. Modificada de Eisendrath et al.3,7.
Para un correcto diagnóstico y adecuada planificación del tratamiento quirúrgico del aneurisma aórtico asociado al RH, resultan indispensables la tomografía computarizada (TC) y la arteriografía, siendo importante diagnosticar la combinación de ambas patologías previamente a la intervención quirúrgica debido a las anomalías asociadas existentes en la vascularización arterial6,10. En este sentido, la TC ofrece la información más detallada en el 90% de los casos sobre la morfología del RH, así como de las relaciones anatómicas entre los riñones, los vasos sanguíneos y el aneurisma. Por otra parte, la urografía intravenosa presenta una sensibilidad del 88% y pone en evidencia las anomalías de las vías urinarias. La arteriografía, realizada en dos proyecciones (posteroanterior y lateral), revela la asociación entre el RH y el AAA en tan solo el 67% de los casos8, no proporcionando una correcta visualización de las anomalías vasculares del riñón.
La presencia de un RH conlleva una amplia gama de posibles malformaciones arteriales, venosas y renales que dificultan la cirugía aórtica7,11. Por el contrario, la reparación aneurismática mediante tratamiento endovascular (EVAR) es una valiosa alternativa cuando sea técnicamente factible, disminuyendo la morbimortalidad a corto y medio plazo. Presentamos los resultados del tratamiento endovascular en dos casos de AAA asociado a RH (AAA-RH), así como la discusión de los mismos en relación con la literatura revisada.
Pacientes y metodologíaDos pacientes con AAA-RH fueron intervenidos durante el mes de noviembre de 2010 en nuestro Servicio mediante EVAR.
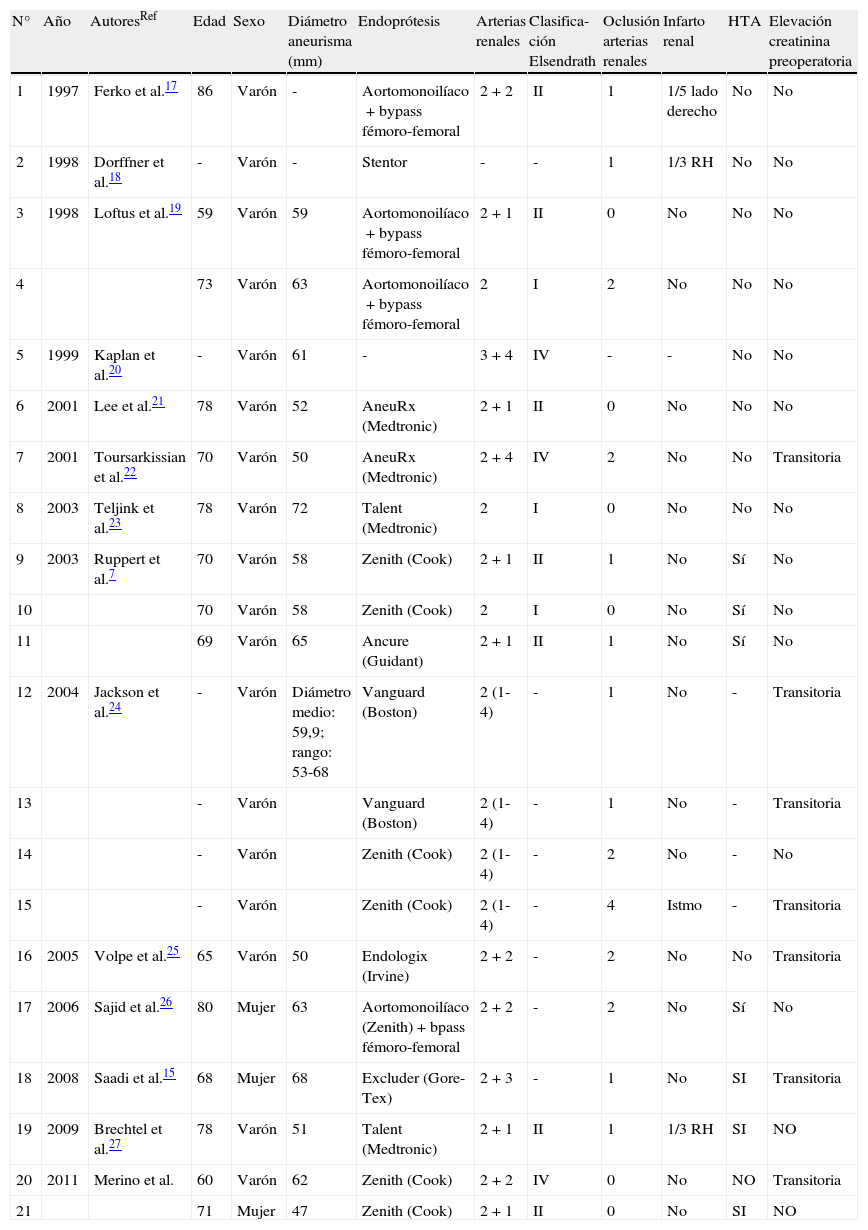
Asimismo, una búsqueda realizada en Medline/Pubmed/Scopus mediante la introducción de los siguientes términos, horseshoe, kidney, aneurysm, endovascular, y EVAR, identificó 19 casos descritos en la literatura desde 1991 en los que se empleó EVAR para tratar AAA-RH. Para los casos hallados, incluidos los nuestros, se recogieron en la tabla 1 las principales variables documentadas.
Revisión de la literatura del AAA-RH tratado mediante EVAR
| N° | Año | AutoresRef | Edad | Sexo | Diámetro aneurisma (mm) | Endoprótesis | Arterias renales | Clasifica-ción Elsendrath | Oclusión arterias renales | Infarto renal | HTA | Elevación creatinina preoperatoria |
| 1 | 1997 | Ferko et al.17 | 86 | Varón | - | Aortomonoilíaco+bypass fémoro-femoral | 2+2 | II | 1 | 1/5 lado derecho | No | No |
| 2 | 1998 | Dorffner et al.18 | - | Varón | - | Stentor | - | - | 1 | 1/3 RH | No | No |
| 3 | 1998 | Loftus et al.19 | 59 | Varón | 59 | Aortomonoilíaco+bypass fémoro-femoral | 2+1 | II | 0 | No | No | No |
| 4 | 73 | Varón | 63 | Aortomonoilíaco+bypass fémoro-femoral | 2 | I | 2 | No | No | No | ||
| 5 | 1999 | Kaplan et al.20 | - | Varón | 61 | - | 3+4 | IV | - | - | No | No |
| 6 | 2001 | Lee et al.21 | 78 | Varón | 52 | AneuRx (Medtronic) | 2+1 | II | 0 | No | No | No |
| 7 | 2001 | Toursarkissian et al.22 | 70 | Varón | 50 | AneuRx (Medtronic) | 2+4 | IV | 2 | No | No | Transitoria |
| 8 | 2003 | Teljink et al.23 | 78 | Varón | 72 | Talent (Medtronic) | 2 | I | 0 | No | No | No |
| 9 | 2003 | Ruppert et al.7 | 70 | Varón | 58 | Zenith (Cook) | 2+1 | II | 1 | No | Sí | No |
| 10 | 70 | Varón | 58 | Zenith (Cook) | 2 | I | 0 | No | Sí | No | ||
| 11 | 69 | Varón | 65 | Ancure (Guidant) | 2+1 | II | 1 | No | Sí | No | ||
| 12 | 2004 | Jackson et al.24 | - | Varón | Diámetro medio: 59,9; rango: 53-68 | Vanguard (Boston) | 2 (1-4) | - | 1 | No | - | Transitoria |
| 13 | - | Varón | Vanguard (Boston) | 2 (1-4) | - | 1 | No | - | Transitoria | |||
| 14 | - | Varón | Zenith (Cook) | 2 (1-4) | - | 2 | No | - | No | |||
| 15 | - | Varón | Zenith (Cook) | 2 (1-4) | - | 4 | Istmo | - | Transitoria | |||
| 16 | 2005 | Volpe et al.25 | 65 | Varón | 50 | Endologix (Irvine) | 2+2 | - | 2 | No | No | Transitoria |
| 17 | 2006 | Sajid et al.26 | 80 | Mujer | 63 | Aortomonoilíaco (Zenith)+bpass fémoro-femoral | 2+2 | - | 2 | No | Sí | No |
| 18 | 2008 | Saadi et al.15 | 68 | Mujer | 68 | Excluder (Gore-Tex) | 2+3 | - | 1 | No | SI | Transitoria |
| 19 | 2009 | Brechtel et al.27 | 78 | Varón | 51 | Talent (Medtronic) | 2+1 | II | 1 | 1/3 RH | SI | NO |
| 20 | 2011 | Merino et al. | 60 | Varón | 62 | Zenith (Cook) | 2+2 | IV | 0 | No | NO | Transitoria |
| 21 | 71 | Mujer | 47 | Zenith (Cook) | 2+1 | II | 0 | No | SI | NO |
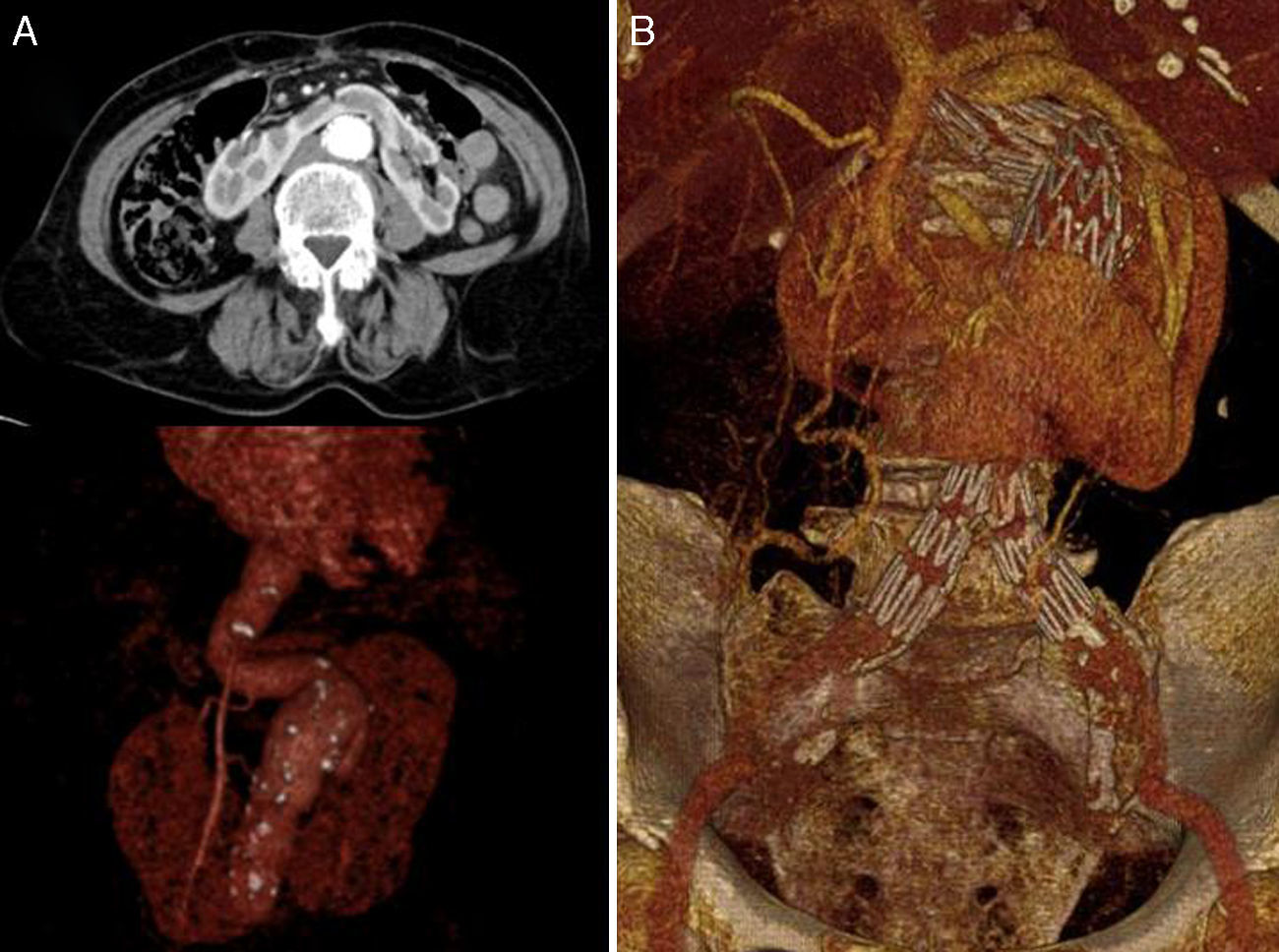
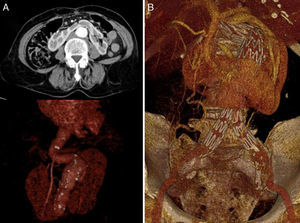
Varón de 60 años con antecedentes personales de obesidad, dislipemia, meniscectomía y RH asintomático (clasificación preoperatoria de la American Society of Anesthesiologists [ASA] II). Diagnosticado mediante ecografía doppler y posteriormente a través de TC de AAA infrarrenal de 62mm de diámetro máximo. Ambos riñones se hallaban en situación pélvica, siendo irrigados por ramas renales procedentes de las arterias iliaca externa e interna (RH tipo IV de la clasificación de Eisendrath3). A la exploración física el paciente se encontraba hemodinámicamente estable, asintomático, sin palparse hiperlatido abdominal y con presencia de pulsos a todos los niveles en ambas extremidades inferiores.
Caso 2Mujer de 71 años con antecedentes de hipertensión arterial y artritis reumatoide (clasificación preoperatoria ASA II). Diagnosticada mediante angioTC en el contexto de abdominalgia inespecífica de AAA infrarrenal de 50mm de diámetro máximo sin signos de rotura asociada a RH. Se evidenció una arteria renal accesoria procedente de la aorta (RH tipo II de la clasificación de Eisendrath3). A la exploración física la paciente se encontraba hemodinámicamente estable y con dolor a la palpación abdominal de forma difusa. Asimismo, no se palpó hiperlatido abdominal, estando los pulsos periféricos conservados a todos los niveles en ambas extremidades inferiores.
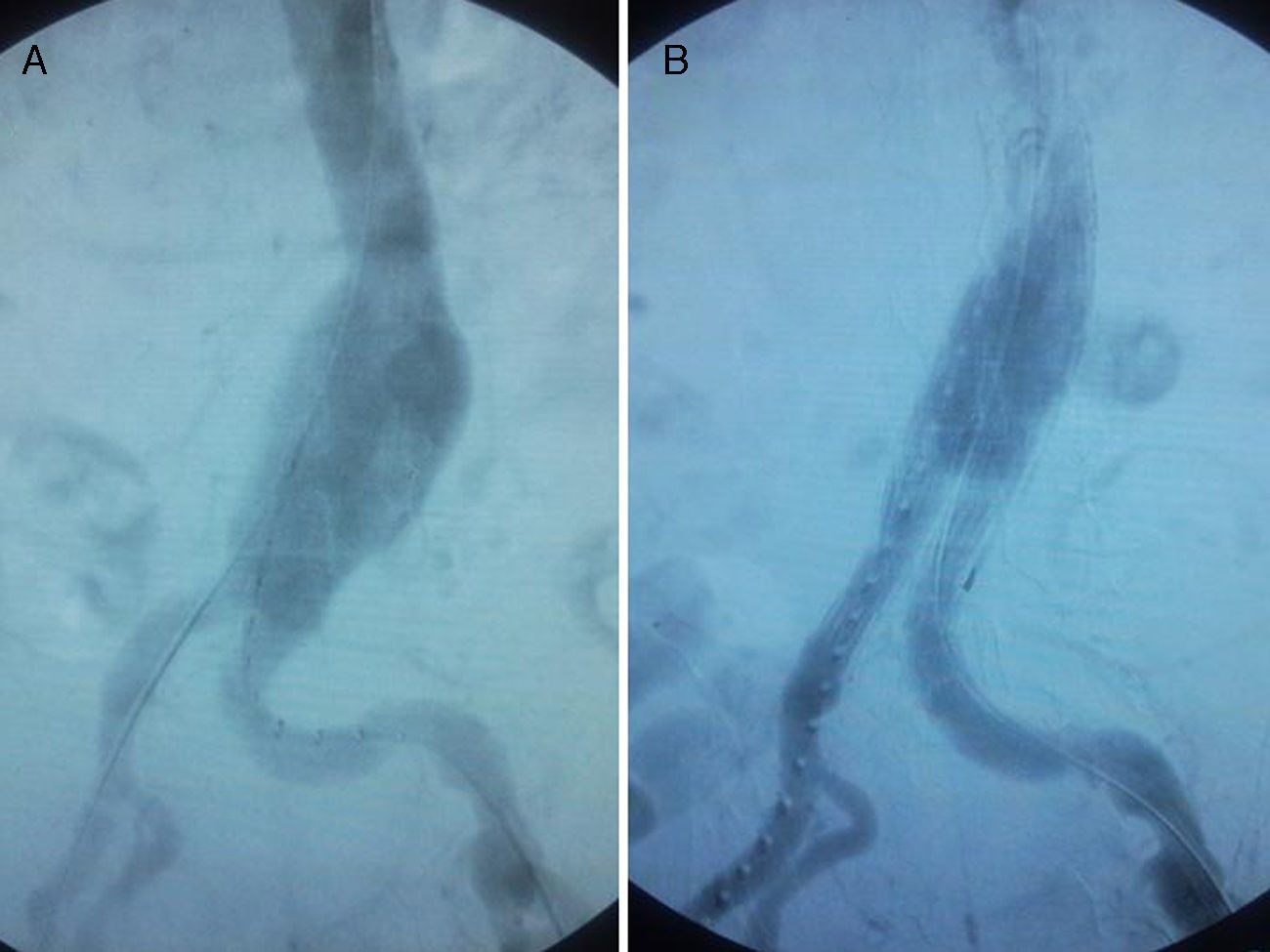
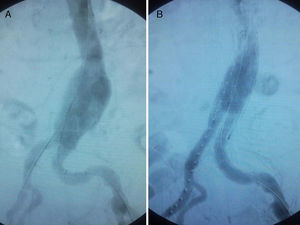
ResultadosEn el caso 1 el aneurisma fue tratado mediante endoprótesis bifurcada Zenith® (Wm Cook UK, Letchworth, Herts, UK) de 28×14×14mm (fig. 2) con anclaje distal a nivel de iliacas comunes, empleándose para el acceso un abordaje inguinal bilateral. El paciente fue valorado durante el postoperatorio por el Servicio de Nefrología de nuestro hospital debido a la elevación de los valores de creatinina y urea prequirúrgicos (urea y creatinina prequirúrgicos 93 y 3,16mg/dl respectivamente; valores postoperatorios 117 y 5,26mg/dl). Fue dado de alta a los 5 días tras la intervención quirúrgica, estando asintomático clínicamente y siendo ajustada su función renal. El tratamiento médico al alta consistió en clopidogrel 75mg de manera indefinida.
En el caso 2 la paciente fue tratada mediante endoprótesis bifurcada Zenith® (Wm Cook UK, Letchworth, Herts, UK) de 26×16×16mm (fig. 3) con anclaje distal a nivel de iliacas comunes, empleándose para el acceso un abordaje inguinal bilateral. No hubo complicaciones perioperatorias. Asimismo, no se registró alteración analítica significativa de la función renal durante el postoperatorio (urea y creatinina prequirúrgicas 30 y 0,52mg/dl respectivamente; valores postoperatorios 39 y 0,71mg/dl). La paciente fue dada de alta a los 7 días tras la intervención quirúrgica. El tratamiento médico al alta consistió en clopidogrel 75mg de manera indefinida.
DiscusiónLa primera cirugía con resultado satisfactorio en un paciente con AAA-RH fue descrita en 1957 por Phelan et al.12. Fue en 1969 cuando Scott et al. publicaron una serie de 8 pacientes sometidos a cirugía aórtica13.Dos aspectos técnicos han de tenerse en cuenta a la hora de planear la cirugía de AAA-RH. El primero es la elección del tipo de abordaje quirúrgico. Pueden utilizarse principalmente dos vías de abordaje: la transperitoneal y la retroperitoneal/extraperitoneal izquierda6. Así, el abordaje transperitoneal mediante laparotomía asegura la mejor exposición de los riñones, los uréteres, el aneurisma y de los vasos ilíacos, aunque el istmo renal puede constituir un problema para la reimplantación de las arterias renales aberrantes. El abordaje retroperitoneal del AAA-RH también es posible, a través de una incisión parietocólica, pudiéndose realizar la maniobra de Kocher cuando el AAA está muy cerca de los riñones. El abordaje extraperitoneal izquierdo parece ser, hasta la fecha, bien tolerado dado que es menos traumático y evita interferir con el istmo renal, las vías urinarias y los vasos renales. Presenta además la ventaja adicional de reducir el tiempo de isquemia si el cirujano necesita realizar la endarterectomía o reimplantar los vasos renales anómalos. Sin embargo, el acceso a los vasos ilíacos derechos es limitado. Cuando previamente a la cirugía se sabe que debe realizarse la revascularización renal, la vía extraperitoneal izquierda constituye una mejor opción8.El segundo problema de la cirugía de AAA-RH radica en decidir la conservación o, por el contrario, resección del istmo renal con el fin de mejorar el abordaje de la aorta. La evaluación del grado de fusión renal es importante para decidir o no la conservación del istmo renal. La literatura aporta tasas de resección ístmica del 30%8, estando esta cifra en descenso. Así, el istmo renal debe conservarse en la medida de lo posible, debiendo tener la resección del mismo una sólida indicación y requiriendo esta ser realizada con sumo cuidado. Una resección ístmica inapropiada puede conllevar graves secuelas como hemorragia, isquemia o filtración de orina al retroperitoneo si el muñón renal no se sutura cuidadosamente. La presencia de orina cerca de la prótesis puede ser perjudicial y poner en peligro la vida del enfermo, especialmente para los pacientes con RH, que entre el 15-30% de los casos comienzan con infección urinaria asintomática causada por vía ascendente y cuya etiología son microorganismos muy virulentos (gram negativos por lo general intestinales) tales como E. Coli, Enterococcus faecalis y especies de Klebsiella.
En cualquier caso, desde el punto de vista técnico, la coexistencia de RH y AAA no impide el tratamiento quirúrgico de este último mediante la sustitución del segmento aórtico aneurismático por prótesis. No obstante, las lesiones concomitantes deben ser descubiertas y estudiadas lo más minuciosamente posible antes de la cirugía. Para determinar el pronóstico en estos pacientes se debe realizar un estudio preoperatorio completo, una exploración cardiorrespiratoria así como una adecuada evaluación preoperatoria de la función renal.
Según Canova et al.8 en cirugía electiva de AAA las tasas de morbilidad y mortalidad en presencia de RH son similares a las existentes en presencia de riñones normales, aunque es difícil obtener resultados concluyentes y definitivos en cuanto a las tasas globales de morbimortalidad en la cirugía de AAA-RH8. Así, según O’Hara et al.14, en una revisión de la cirugía de AAA-RH durante sus 31 años de experiencia, concluyen que, pese a que sus tasas de morbimortalidad son algo menores para cirugía de AAA-RH que para la cirugía AAA, los datos publicados dependen de la experiencia del cirujano y de las características del paciente.
Como se ha ido mencionando, el tratamiento del AAA-RH mediante cirugía abierta reviste diversas dificultades técnicas y anatómicas como la necesidad de separar el istmo renal, que muy frecuentemente se halla localizado delante del aneurisma aórtico15. Asimismo, la presencia de vascularización arterial anómala dificulta en muchas ocasiones la cirugía16. Por todo ello, y asociado al creciente auge de la cirugía endovascular, el EVAR se impone como una adecuada y segura alternativa terapéutica en estos casos.
Así, desde 1991 han sido descritos en la literatura 19 procedimientos endovasculares realizados en pacientes con AAA-RH7,15,17–27, habiéndose empleado tanto endoprótesis aortomonoilíacas como bifurcadas (tabla 1), y siendo una de las principales dificultades técnicas inherentes al procedimiento la inevitable exclusión de las arterias renales anómalas24.
Los efectos renales derivados de la implantación de endoprótesis en AAA-RH fueron analizados mediante el estudio EUROSTAR. De los 130 pacientes en los que se realizó tratamiento endovascular desde 1995 a 2000, hubo 4 pacientes con AAA-RH y función renal normal. En estos casos el aneurisma fue excluido con éxito con la oclusión de una a cuatro arterias renales anómalas. Durante el seguimiento no se detectó clínicamente insuficiencia renal significativa15,24. De nuestros casos un paciente presentó durante el postoperatorio una elevación transitoria de los niveles basales prequirúrgicos de urea y creatinina. No obstante, está descrito en la literatura un caso de AAA-RH en un paciente con insuficiencia renal moderada26 tratado mediante EVAR sin consecuencias ni repercusión renal, así como otros 6 casos en los que se registró alteración analítica transitoria de la función renal durante el postoperatorio15,22,24,25. En definitiva, existe la posibilidad de elevación de creatinina y empeoramiento de función renal, siendo más común con el tratamiento endovascular debido al empleo de contrastes yodados intravenosos, aunque no esté demostrada por los casos publicados (7 casos de 21 con elevación transitoria).
Las arterias renales fueron ocluidas en 13 pacientes de los 19 casos descritos. En nuestros casos no hubo oclusión alguna. La posibilidad de aparición de infarto renal es más frecuente mediante el tratamiento endovascular debido a la oclusión de ramas arteriales. A este respecto, Aquino y Kaplan20,28 mostraron que, además de pequeños infartos renales segmentarios en el 21% de los casos, solo 1 de 24 pacientes con AAA-RH tratados mediante EVAR comenzaron con hipertensión arterial transitoria. No obstante, de forma empírica, Jackson et al.24 sugirieron que, con funciones renales dentro de la normalidad, la oclusión de arterias renales con diámetro menor de 3mm o que irriguen menos del 32% del parénquima renal no causará deterioro alguno de la función renal.
Asimismo, dado que las arterias renales accesorias que irrigan el RH son arterias terminales, solo deberían estar asociadas a endoleaks tipo II en el caso de que hubiera otras arterias colaterales como, por ejemplo, una arteria lumbar, proporcionando flujo sanguíneo anterógrado en el saco aneurismático y hacia la arteria renal. En la literatura fue descrita tanto por Ruppert et al. en uno de sus tres casos7 como por Brechtel et al.27 la embolización mediante coils de una arteria renal accesoria previamente al EVAR para prevenir un endoleak tipo II. No obstante, ninguno de los 4 casos descritos por Jackson et al.24 presentaron evidencia alguna de endoleak tipo II durante el seguimiento. Además, ningún estudio previo16,20,24 mostró indicios de endoleaks tipo II, incluso aquellos casos en los que las pruebas de imagen preoperatorias evidenciaban la procedencia de las arterias renales de la zona del saco aneurismático. Todo ello parece confirmar que la oclusión de las arterias renales anómalas procedentes del saco aneurismático mediante coils antes del EVAR no es obligatoria24.
En cuanto al procedimiento de elección (cirugía abierta o EVAR), las últimas publicaciones abogan por el EVAR como tratamiento de elección ante el AAA-RH. Así, Stroosma et al.16, tras una detallada revisión de 176 pacientes, concluyen que el tratamiento endovascular es preferible a la cirugía abierta para tratar los casos de AAA-RH. Por otro lado, Ruppert et al.7, en una revisión de la literatura publicada a este respecto, concluyen que en presencia de un RH con vascularización arterial tipo I o II de la clasificación de Eisendrath la reparación endovascular debe prevalecer sobre la cirugía abierta, siempre y cuando sea técnicamente factible y la función renal del paciente esté conservada. Sin embargo, afirman7 que ante los casos con vascularización arterial tipo III o IV de dicha clasificación la decisión sobre el tipo de procedimiento a emplear debe ser personalizada para cada paciente, valorando tanto su función renal como si el EVAR es ténicamente factible. Finalmente, en su opinión, los pacientes con aneurisma aórtico y RH con vascularización arterial tipo V no se pueden tratar mediante procedimientos endovasculares.
En conclusión, podemos afirmar que, dada la dificultad técnica y anatómica que supone la cirugía abierta en casos de AAA-RH, el EVAR debe ser considerado una técnica apropiada en estas situaciones, siempre y cuando la función renal y la anatomía del paciente lo permitan. No obstante, las limitaciones de este estudio radican en la falta de homogeneidad de las publicaciones existentes (tanto de cirugía abierta como endovascular) en cuanto a la especificación del tipo de vascularización de cada caso para obtener posibles conclusiones, así como en la ausencia de estudios prospectivos en los que se comparen las dos técnicas, sus resultados y tanto sus complicaciones como la evolución del paciente a corto y a largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.