Aportar y analizar los resultados de nuestra experiencia quirúrgica en 19 casos de trasplante renal en adulto utilizando injertos en bloque de donantes pediátricos.
Material y métodoEntre noviembre de 1996 y agosto de 2011 se han realizado en nuestro servicio 647 trasplantes renales en adultos, utilizando en 19 ocasiones (2,9%) injertos en bloque de donantes pediátricos. La media de edad de los donantes fue de 17,6 meses (intervalo: 5 días-48 meses). La media de edad de los receptores fue de 41,3 años (intervalo: 19-59 años). El peso medio de los donantes fue de 10,6kg (intervalo: 3,5-23kg) y el de los receptores fue de 63,6kg (intervalo: 43-93kg). Se valoró la función renal (creatinina sérica y aclaramiento de creatinina) en el postoperatorio inmediato y durante el seguimiento, así como la incidencia de complicaciones vasculares y su resolución.
ResultadosLa mediana del seguimiento fue de 22 meses (media: 34,9 meses; intervalo: 1-141 meses), siendo funcionantes 17 de los 19 injertos con creatinina dentro de la normalidad en 13 de los casos. Hubo complicaciones vasculares en 5 casos (26,3%), de los que solo 2 precisaron trasplantectomía precoz y 3 se resolvieron mediante angioplastia simple con mejoría morfológica y de la función renal.
ConclusionesLos trasplantes renales en bloque pediátrico suponen una alternativa válida en el trasplante renal del adulto, pero presentan mayores tasas de complicaciones vasculares postimplante. Una selección correcta de los donantes, una técnica vascular depurada y un tratamiento intensivo mediante angioplastia simple permite resolverlas en la mayoría de los casos.
To evaluate the outcome of our surgical experience in 19 cadaveric kidneys from pediatric donors, transplanted en bloc into adults recipients.
Material and methodFrom November 1996 to August 2011, we have performed 647 adult renal transplantations, using pediatric en bloc grafts in 19 cases (2.9%). The mean age of donors was 17.6 months (range: 5 days to 48 months). The mean age of recipients was 41.3 years (range: 19-59 years). The mean weight of donors was 10.6kg (range: 3.5-23kg) and the mean weight of recipients was 63.6kg (range: 43-93kg). We evaluated the renal function (serum creatinine and creatinine clearance) in the immediate postoperative period and during the follow-up, as well as the incidence of vascular complications and their resolution.
ResultsThe median follow-up was 22 months (mean: 34.9 months; range: 1-141 months). At the end of follow-up, 17 of the 19 grafts were functioning, with creatinine at normal levels in 13 of them. There were vascular complications in five cases (26.3%), only two cases required early transplantectomy, and the other three cases were resolved by renal or aortic graft angioplasty with morphological and renal function improvement.
ConclusionsPediatric en bloc kidneys are a valid alternative in adult renal transplantation, but show higher rates of vascular complications. A correct selection of donors, a correct vascular technique, an intensive treatment through simple angioplasty enable them to be resolved in most of the cases.
Debido al aumento del número de pacientes que reciben terapia renal sustitutiva y a unos criterios menos restrictivos para la inclusión en lista de espera, hay en la actualidad una demanda creciente de pacientes que precisan un trasplante renal. Se están adoptando estrategias para aumentar el número de donantes y poder reducir el tiempo en lista de espera. Entre las mismas está el uso de injertos renales procedentes de donantes con criterios expandidos, referidos a los injertos procedentes de pacientes de edad avanzada y a los de pacientes pediátricos (los de donantes menores de 4 años de edad y/o 15kg de peso)1,2. Clásicamente, los injertos renales pediátricos eran considerados subóptimos debido a la elevada incidencia de complicaciones vasculares y urológicas, así como a la peor supervivencia del injerto y del paciente por el tamaño de los vasos y uréter y tener una masa renal reducida. Sin embargo, cada vez surgen más trabajos que apoyan la tesis contraria y consideran estos injertos como aptos para ser implantados en bloque en receptores adultos3.
En el presente trabajo exponemos los detalles quirúrgicos del implante y analizamos la situación de 19 pacientes trasplantados con injertos renales en bloque procedentes de donantes en edad pediátrica.
Material y métodosEntre noviembre de 1996 y agosto de 2011 se han realizado en nuestro centro 647 trasplantes renales en adultos, utilizando en 19 ocasiones (2,9%) injertos renales pediátricos en bloque. El primer trasplante en bloque de donante pediátrico (TBDP) en nuestro hospital fue realizado en noviembre de 1999 y el siguiente en marzo de 2002, posteriormente esta actividad decayó por falta de donantes hasta los últimos 4 años en los que se han realizado 17 TBDP más.
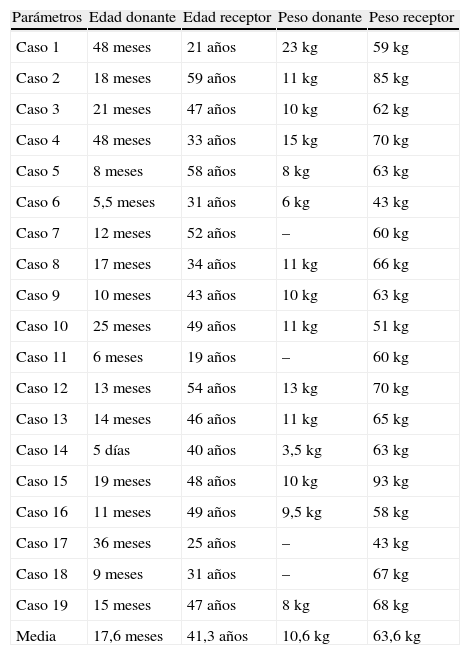
Los datos demográficos de los donantes y receptores se pueden observar en la tabla 1. La media de edad del donante fue de 17,6±14 meses, con un intervalo entre 5 días y 48 meses. En este grupo, 3 donantes (15,8%) fueron menores de 6 meses, 5 (26,3%) tenían entre 6 y 12 meses, 7 (36,8%) tenían entre 12 y 24 meses y 4 (21%) donantes eran mayores de 24 meses. El peso medio de los donantes fue de 10,6kg, con un intervalo entre 3,5 y 23kg. La media de edad de los receptores fue de 41,3 años (intervalo: 19-59 años), y el peso medio fue de 63,6kg (intervalo: 43-93kg).
Datos demográficos de los donantes y receptores
| Parámetros | Edad donante | Edad receptor | Peso donante | Peso receptor |
| Caso 1 | 48 meses | 21 años | 23kg | 59kg |
| Caso 2 | 18 meses | 59 años | 11kg | 85kg |
| Caso 3 | 21 meses | 47 años | 10kg | 62kg |
| Caso 4 | 48 meses | 33 años | 15kg | 70kg |
| Caso 5 | 8 meses | 58 años | 8kg | 63kg |
| Caso 6 | 5,5 meses | 31 años | 6kg | 43kg |
| Caso 7 | 12 meses | 52 años | – | 60kg |
| Caso 8 | 17 meses | 34 años | 11kg | 66kg |
| Caso 9 | 10 meses | 43 años | 10kg | 63kg |
| Caso 10 | 25 meses | 49 años | 11kg | 51kg |
| Caso 11 | 6 meses | 19 años | – | 60kg |
| Caso 12 | 13 meses | 54 años | 13kg | 70kg |
| Caso 13 | 14 meses | 46 años | 11kg | 65kg |
| Caso 14 | 5 días | 40 años | 3,5kg | 63kg |
| Caso 15 | 19 meses | 48 años | 10kg | 93kg |
| Caso 16 | 11 meses | 49 años | 9,5kg | 58kg |
| Caso 17 | 36 meses | 25 años | – | 43kg |
| Caso 18 | 9 meses | 31 años | – | 67kg |
| Caso 19 | 15 meses | 47 años | 8kg | 68kg |
| Media | 17,6 meses | 41,3 años | 10,6kg | 63,6kg |
Los aspectos técnicos más relevantes durante la extracción, la cirugía de banco y el implante fueron los que se exponen seguidamente.
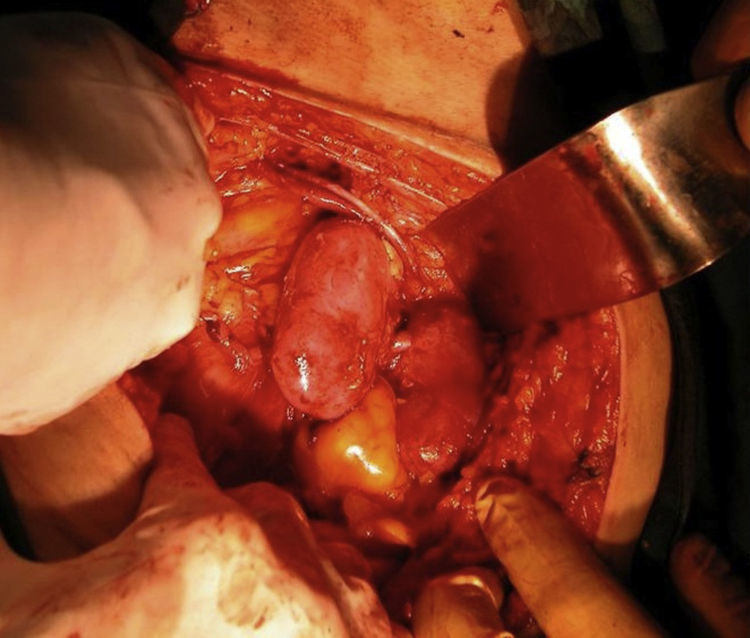
Los riñones fueron extraídos en bloque con un segmento extenso de cava y aorta supra e infrarrenal, tras la heparinización sistémica y la perfusión local de 1.500 a 2.000ml de solución Euro-Collins. Los uréteres se seccionaron lo más próximos a la vejiga posible y se extrajo todo el bloque (formado por ambos riñones, la aorta, la cava y ambos uréteres).
Durante la cirugía de banco, se resecó la mayor cantidad de grasa perirrenal posible. La porción suprarrenal de la aorta y de la cava fue suturada sobre sí misma a modo de fondo de saco, para que permitiera la estanqueidad de las suturas sin producir estenosis de los vasos renales. Los vasos lumbares y las arterias capsulares renales fueron ligados. Los uréteres se calibraron, y en función del tamaño de los mismos, se realizó una anastomosis laterolateral de los extremos mediales según la técnica de Wallace I, cuando se trataba de uréteres de pequeño calibre (generalmente en donantes menores de 15 meses) en los que se preveía que pudiera existir riesgo de estenosis si se realizaba la anastomosis ureterovesical por separado, o se dejaron separados para reimplantarlos de forma independiente en la vejiga si el calibre era suficiente como para asegurar que no existía riesgo de estenosis. Siempre que fuera posible, se prefirió la anastomosis por separado, para evitar que, en caso de estenosis ureteral, afectase a ambos uréteres a la vez.
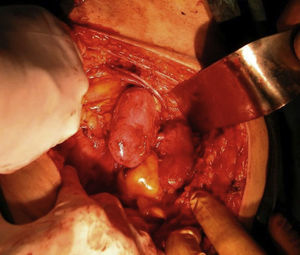
En la cirugía de implante (fig. 1) se realizó un abordaje extraperitoneal a través de una incisión de Gibson derecha o izquierda, según condicionantes del receptor (trasplantes previos, cirugía abdominal previa, catéteres de diálisis peritoneal) o preferencia del cirujano, disecando y controlando proximal y distalmente la arteria y vena ilíacas externas del receptor. La porción terminal de la aorta y de la cava fue anastomosada a la arteria y vena ilíacas externas respectivamente, en posición terminolateral, con sutura de polipropileno 6/0. En el reimplante ureteral, ya fuera por separado o con uréteres unidos en un Wallace I, la técnica utilizada fue la de Lich-Gregoir en todos los casos, con sutura de ácido poliglicólico de 4/0. Esta técnica consiste en la anastomosis de los uréteres a la mucosa vesical, y posteriormente el cierre del músculo detrusor sobre los uréteres creando un túnel antirreflujo. Se utilizó tutorización mediante catéter doble J 6 Fr de 14cm, uno por cada uréter.
El tiempo de isquemia fría fue de 15,7±5,5 h.
La función renal se estudió mediante las cifras séricas de creatinina, el aclaramiento de creatinina y la proteinuria en orina de 24 h. Los injertos fueron seguidos mediante ultrasonografía y estudios isotópicos. Los estudios de la función renal y ultrasonográficos fueron realizados en el postoperatorio inmediato y al mes, 3, 6, 12, 18 y 24 meses y luego anualmente. Los estudios isotópicos se realizaron en el postoperatorio inmediato y posteriormente no se volvieron a realizar salvo disfunción de uno o ambos de los 2 riñones del bloque.
Los resultados se expresaron como la media y desviación estándar para las variables cuantitativas continuas y como proporciones para las variables cualitativas. Se utilizó el programa estadístico SPSS 17.0 para Windows.
ResultadosDurante el periodo del estudio se han realizado 19 TBDP. La mediana de seguimiento fue de 22 meses (media: 34,9 meses; intervalo: 1-141 meses). La concentración sérica media de creatinina en el primer mes postrasplante fue de 1,7mg/dl, en el tercer mes fue de 1,3mg/dl, a los 6 meses fue de 1,1mg/dl y al año del trasplante fue de 0,9mg/dl, apreciándose una mejoría progresiva de la función renal conforme aumenta el tiempo desde el trasplante y la normalización de las cifras de creatinina a partir del tercer mes postrasplante (tabla 2). Del mismo modo, el aclaramiento de creatinina mejoró progresivamente conforme aumentó el tiempo desde el trasplante (tabla 3). La proteinuria en el primer mes fue de 0,28 g/24 h, a los 6 meses del trasplante fue de 0,08 g/24 h y al año del trasplante fue de 0,14 g/24 h, con disminución progresiva.
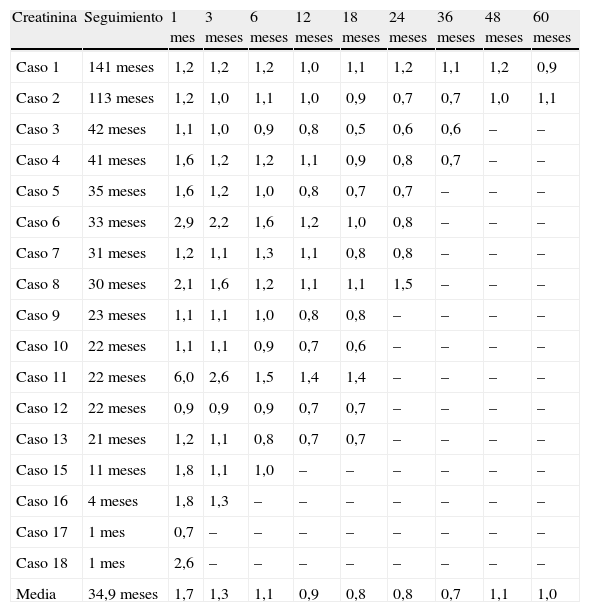
Cifras de creatinina sérica
| Creatinina | Seguimiento | 1mes | 3meses | 6meses | 12meses | 18meses | 24meses | 36meses | 48meses | 60meses |
| Caso 1 | 141 meses | 1,2 | 1,2 | 1,2 | 1,0 | 1,1 | 1,2 | 1,1 | 1,2 | 0,9 |
| Caso 2 | 113 meses | 1,2 | 1,0 | 1,1 | 1,0 | 0,9 | 0,7 | 0,7 | 1,0 | 1,1 |
| Caso 3 | 42 meses | 1,1 | 1,0 | 0,9 | 0,8 | 0,5 | 0,6 | 0,6 | – | – |
| Caso 4 | 41 meses | 1,6 | 1,2 | 1,2 | 1,1 | 0,9 | 0,8 | 0,7 | – | – |
| Caso 5 | 35 meses | 1,6 | 1,2 | 1,0 | 0,8 | 0,7 | 0,7 | – | – | – |
| Caso 6 | 33 meses | 2,9 | 2,2 | 1,6 | 1,2 | 1,0 | 0,8 | – | – | – |
| Caso 7 | 31 meses | 1,2 | 1,1 | 1,3 | 1,1 | 0,8 | 0,8 | – | – | – |
| Caso 8 | 30 meses | 2,1 | 1,6 | 1,2 | 1,1 | 1,1 | 1,5 | – | – | – |
| Caso 9 | 23 meses | 1,1 | 1,1 | 1,0 | 0,8 | 0,8 | – | – | – | – |
| Caso 10 | 22 meses | 1,1 | 1,1 | 0,9 | 0,7 | 0,6 | – | – | – | – |
| Caso 11 | 22 meses | 6,0 | 2,6 | 1,5 | 1,4 | 1,4 | – | – | – | – |
| Caso 12 | 22 meses | 0,9 | 0,9 | 0,9 | 0,7 | 0,7 | – | – | – | – |
| Caso 13 | 21 meses | 1,2 | 1,1 | 0,8 | 0,7 | 0,7 | – | – | – | – |
| Caso 15 | 11 meses | 1,8 | 1,1 | 1,0 | – | – | – | – | – | – |
| Caso 16 | 4 meses | 1,8 | 1,3 | – | – | – | – | – | – | – |
| Caso 17 | 1 mes | 0,7 | – | – | – | – | – | – | – | – |
| Caso 18 | 1 mes | 2,6 | – | – | – | – | – | – | – | – |
| Media | 34,9 meses | 1,7 | 1,3 | 1,1 | 0,9 | 0,8 | 0,8 | 0,7 | 1,1 | 1,0 |
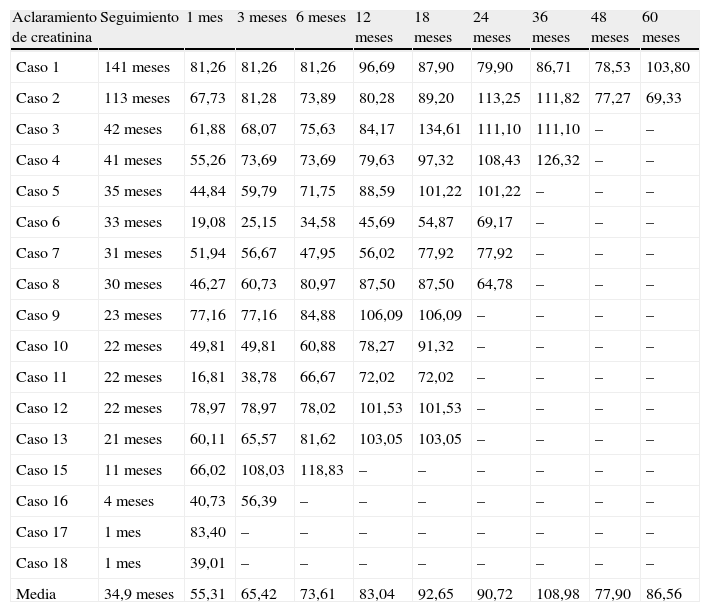
Cifras de aclaramiento de creatinina
| Aclaramiento de creatinina | Seguimiento | 1mes | 3meses | 6meses | 12meses | 18meses | 24meses | 36meses | 48meses | 60meses |
| Caso 1 | 141 meses | 81,26 | 81,26 | 81,26 | 96,69 | 87,90 | 79,90 | 86,71 | 78,53 | 103,80 |
| Caso 2 | 113 meses | 67,73 | 81,28 | 73,89 | 80,28 | 89,20 | 113,25 | 111,82 | 77,27 | 69,33 |
| Caso 3 | 42 meses | 61,88 | 68,07 | 75,63 | 84,17 | 134,61 | 111,10 | 111,10 | – | – |
| Caso 4 | 41 meses | 55,26 | 73,69 | 73,69 | 79,63 | 97,32 | 108,43 | 126,32 | – | – |
| Caso 5 | 35 meses | 44,84 | 59,79 | 71,75 | 88,59 | 101,22 | 101,22 | – | – | – |
| Caso 6 | 33 meses | 19,08 | 25,15 | 34,58 | 45,69 | 54,87 | 69,17 | – | – | – |
| Caso 7 | 31 meses | 51,94 | 56,67 | 47,95 | 56,02 | 77,92 | 77,92 | – | – | – |
| Caso 8 | 30 meses | 46,27 | 60,73 | 80,97 | 87,50 | 87,50 | 64,78 | – | – | – |
| Caso 9 | 23 meses | 77,16 | 77,16 | 84,88 | 106,09 | 106,09 | – | – | – | – |
| Caso 10 | 22 meses | 49,81 | 49,81 | 60,88 | 78,27 | 91,32 | – | – | – | – |
| Caso 11 | 22 meses | 16,81 | 38,78 | 66,67 | 72,02 | 72,02 | – | – | – | – |
| Caso 12 | 22 meses | 78,97 | 78,97 | 78,02 | 101,53 | 101,53 | – | – | – | – |
| Caso 13 | 21 meses | 60,11 | 65,57 | 81,62 | 103,05 | 103,05 | – | – | – | – |
| Caso 15 | 11 meses | 66,02 | 108,03 | 118,83 | – | – | – | – | – | – |
| Caso 16 | 4 meses | 40,73 | 56,39 | – | – | – | – | – | – | – |
| Caso 17 | 1 mes | 83,40 | – | – | – | – | – | – | – | – |
| Caso 18 | 1 mes | 39,01 | – | – | – | – | – | – | – | – |
| Media | 34,9 meses | 55,31 | 65,42 | 73,61 | 83,04 | 92,65 | 90,72 | 108,98 | 77,90 | 86,56 |
Hubo una incidencia de necrosis tubular aguda inicial (y en todos los casos autolimitada) del 40%, aunque solo 2 pacientes tuvieron que ser dializados en el postoperatorio inmediato.
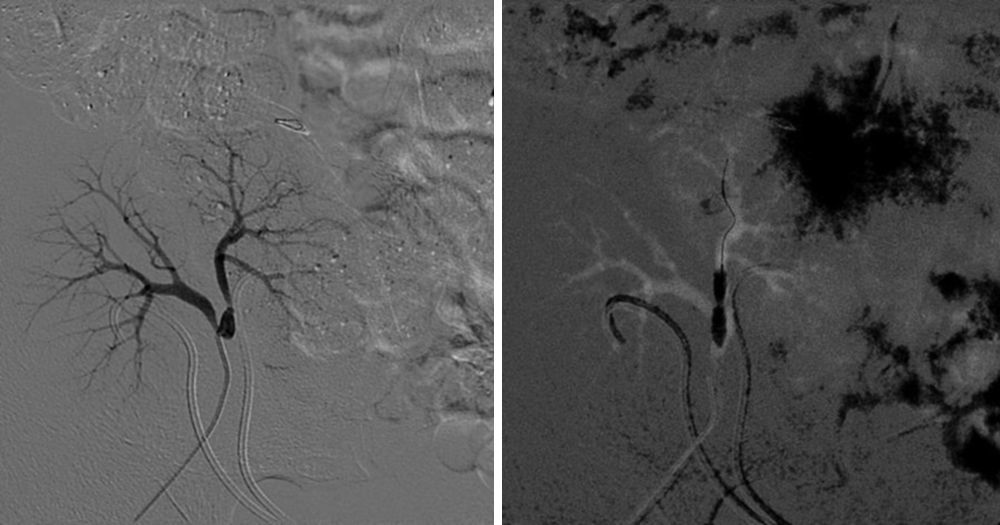
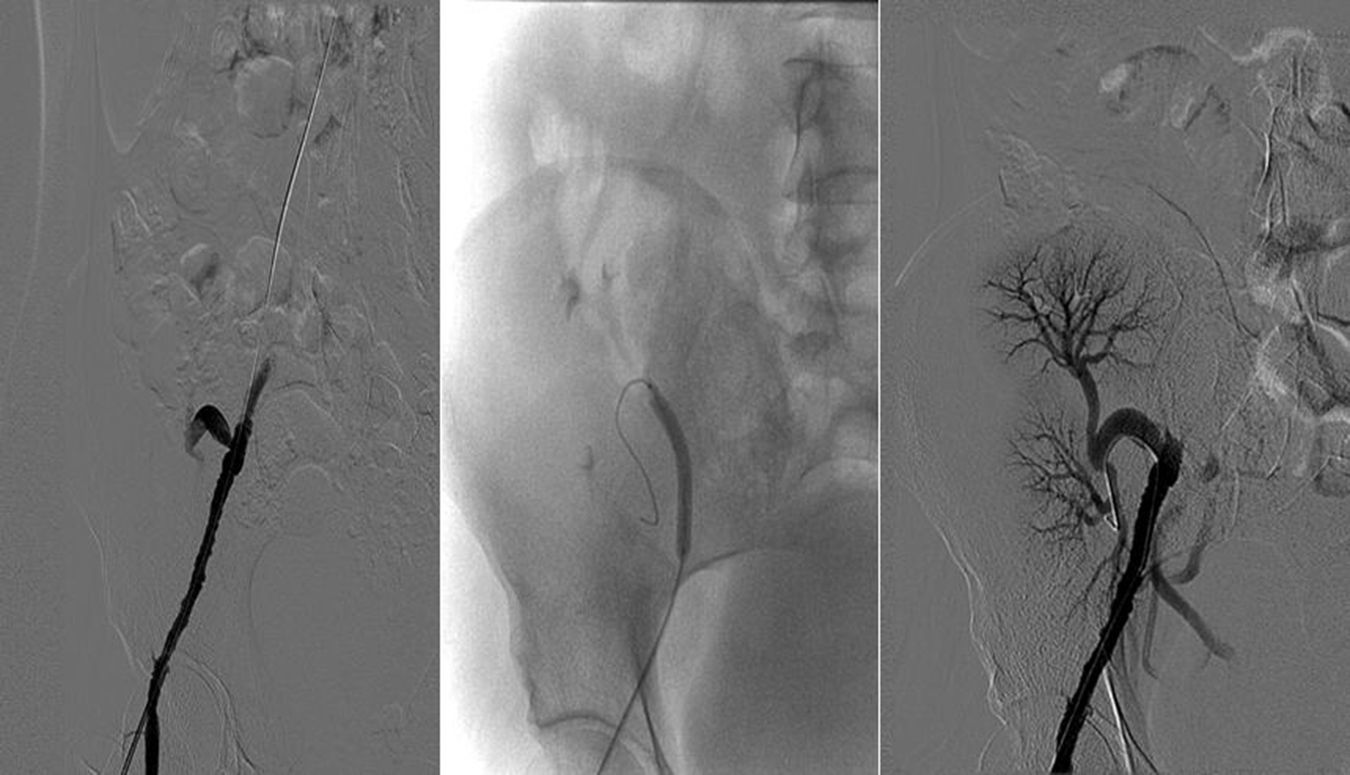
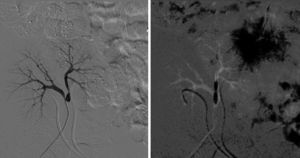
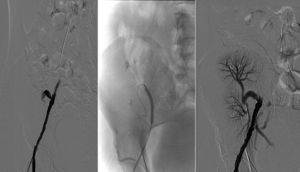
Se detectaron complicaciones vasculares en 5 casos (26,3%). Tres pacientes presentaron trombosis parcial o total del injerto. El primero (correspondiente al caso 6) era un donante de 5 meses de vida y 6kg de peso. El bloque presentaba una aorta suprarrenal de escasa longitud y a pesar de ello se realizó un cierre directo de la zona proximal, quedando el borde superior muy ajustado a ambas arterias renales, menores de 1mm de diámetro. Ya en el desclampaje se apreció una perfusión arterial retrasada del injerto izquierdo, y en la primera ecografía del injerto el primer día postrasplante se detectó el infarto del riñón debido a la trombosis de la arteria renal izquierda. Además, en ese mismo caso durante el seguimiento se detectó una estenosis de la arteria renal derecha, probablemente en relación con la sutura directa de la aorta suprarrenal, que requirió angioplastia percutánea, con mejoría de la función renal tras la misma. A pesar de estas complicaciones y de que se perdió uno de los injertos, el otro fue capaz de compensar la función renal, con mejoría progresiva de las cifras de creatinina sérica y de aclaramiento de creatinina, como se puede apreciar en las tablas 2 y 3. El segundo y el tercer caso (correspondientes al caso 14 y 19) eran un donante de 5 días de vida y 3,5kg de peso el primero y un donante de 15 meses y 8kg, en los que no hubo complicaciones ni durante la cirugía de banco ni durante el implante, salvo las inherentes al pequeño tamaño del bloque. El inicio de los trasplantes fue oligúrico y en la primera ecografía de los injertos el primer día postrasplante se detectó la trombosis de todo el bloque pediátrico. Se decidió la trasplantectomía urgente para disminuir la hipersensibilización. Durante la intervención no se apreciaron defectos técnicos en las anastomosis y la pieza se remitió para estudio histológico. El análisis microscópico reveló la existencia de un infarto hemorrágico renal bilateral, sin evidencias de infarto isquémico. En un paciente se detectó una estenosis bilateral de las arterias renales y en otro, una estenosis de la anastomosis entre la aorta y la arteria ilíaca externa, ambas resueltas con angioplastia simple, con buen resultado morfológico y mejoría de la función renal posprocedimiento (figs. 2 y 3).
Sin embargo, desde el punto de vista urológico no se han producido complicaciones en ningún paciente, ya sea estenosis, fístulas, hematurias significativas o complicaciones vesicales.
Se observó un aumento significativo del tamaño de los injertos en la evolución postrasplante. En la ecografía realizada durante la primera semana postrasplante la media del tamaño de los riñones era 67,7mm para el riñón medial y 75,9mm para el riñón lateral; en la ecografía de control a los 6 meses los injertos habían crecido significativamente a 85,1mm el riñón medial (p=0,02) y 91,7mm el riñón lateral (p=0,031).
DiscusiónEl incremento de la lista de espera para trasplante renal hace que se generen nuevas situaciones para incrementar el número de donaciones. Entre ellas podríamos mencionar la donación de órganos de donante vivo, la donación de donantes en asistolia o el uso de injertos renales procedentes de donantes con criterios expandidos, en edades extremas de la vida (procedentes de donantes pediátricos o de ancianos)1. El uso de injertos procedentes de pacientes pediátricos, sobre todo en los menores de 5 años, es controvertido y clásicamente se han considerado como injertos subóptimos en cuanto a la supervivencia del injerto se refiere por la gran incidencia de complicaciones vasculares, urológicas, inmunológicas o por síndrome de hiperfiltración2. Otros autores, sin embargo, obtienen unos resultados excelentes con el uso de estos injertos implantados en bloque, totalmente superponibles e incluso mejores que los procedentes de donantes únicos adultos3–7. Algunos autores defienden incluso el trasplante de injertos renales procedentes de donantes de menos de 5 años de edad como injertos únicos, aduciendo que la función a medio y largo plazo de estos injertos es excelente e incluso superior a la que ofrecen los riñones procedentes de donantes ideales8.
En nuestra experiencia, los injertos renales en bloque de donantes pediátricos ofrecen unos resultados excelentes a medio y largo plazo, en cuanto a función renal y presencia de proteinuria; si bien las complicaciones vasculares podrían estar aumentadas, especialmente en los donantes de muy bajo peso o de muy corta edad. De hecho, 3 de los 5 casos que tuvieron complicaciones vasculares eran los donantes de menor edad (menores de 6 meses) y de menor peso (menos de 6kg) de nuestra serie. No se han detectado complicaciones urológicas inmediatas ni durante el seguimiento. Las complicaciones vasculares guardan relación con una inadecuada técnica quirúrgica o selección del donante.
La deficiencia técnica en el primer caso podría atribuirse a la cirugía de banco. La realización de una sutura apoyada en un parche de vena cava del paciente (lo ideal sería con vena cava supra o infrarrenal) o con vena safena interna del receptor podría haber evitado la trombosis, aunque no existe bibliografía disponible al respecto. Otra posible explicación sería que se hubiera producido un acodamiento de los vasos de uno de los injertos.
La explicación a lo ocurrido en el segundo caso podría encontrarse en una inadecuada selección del donante por su escasa edad y la inmadurez de estos riñones para soportar un flujo arterial directo desde la arteria ilíaca de un adulto.
La explicación a la estenosis de ambas arterias renales podría ser un acodamiento de los vasos de uno de los injertos al estar demasiado expuestos, lo que les proporciona una gran movilidad y les permite rotar sobre su eje vascular; aunque la mayor compresibilidad de la vena renal hace que sea este vaso más frecuentemente afectado que la arteria renal, a diferencia de lo expuesto en este caso. Esta complicación se puede prevenir mediante varias técnicas como el posicionamiento paraórtico del bloque9, la colocación de uno de los riñones intraperitoneal y otro retroperitoneal10, la fijación del bloque al retroperitoneo11,12 o la unión de ambos riñones por su polo superior4.
La estenosis de la anastomosis aortoilíaca corresponde a un defecto técnico intraoperatorio, inherente a trabajar con vasos de pequeño calibre.
Por tanto, las soluciones a estos fracasos deberían venir en el sentido de una selección minuciosa de los donantes (excluyendo los donantes de menos de 6 meses de vida o 6kg de peso), en la «exigencia» de que los bloques sean extraídos y remitidos con la suficiente longitud de aorta y cava suprarrenal para poder garantizar un correcto cierre del muñón proximal sin producirse estenosis del ostium de las arterias renales del bloque y en una minuciosa técnica quirúrgica vascular.
En conclusión, pensamos que el uso de injertos en bloque procedentes de donantes pediátricos supone una alternativa válida para el trasplante renal en el adulto, asumiendo que el número de complicaciones vasculares es alto en este tipo de trasplante. A medio y largo plazo los resultados, referentes a la función renal, son excelentes. Una selección correcta, una minuciosa técnica vascular y un seguimiento y tratamiento intensivo de las complicaciones vasculares mejorarán estos resultados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.