El síndrome de hiperperfusión cerebral (SHC) constituye una complicación relativamente infrecuente, pero muy grave de la endarterectomía carotídea (EC).
ObjetivoDescribir los casos de SHC de una serie consecutiva de pacientes en que se realiza EC en un período de tiempo dado.
Material y métodosRevisión retrospectiva de una base de datos recogida prospectivamente de la cirugía de endarterectomía carotídea realizada en nuestro Servicio de Cirugía Vascular entre los años 2002 y 2009. Para el diagnóstico de la severidad de la estenosis (método NASCET) y establecer la indicación quirúrgica se utilizó la arteriografía o la combinación de dos pruebas no invasivas. La técnica realizada fue una endarterectomía carotídea abierta.
ResultadosSe realizan 172 endarterectomías carotídeas (EC) en este período, que corresponden un 86% a varones y un 14% a mujeres, con una edad media de 70,4 ± 7,7 años. En este período tienen lugar, en el postoperatorio inmediato, tres SHC en dos varones y una mujer entre los días segundo y tercero desde la cirugía. La edad media de los casos es de 73,6 años. En todos ellos existe el antecedente de tabaco e hipertensión arterial. La arteriografía evidencia signos de hipoperfusión cerebral crónica en los tres casos: dos muertes y un paciente con secuelas neurológicas.
ConclusiónEl SHC es una complicación potencial de la revascularización carotídea de consecuencias fatales. La identificación de pacientes de alto riesgo de SHC es fundamental para su prevención y tratamiento precoz, consistente en el control intensivo de la tensión arterial.
Cerebral hyperperfusion syndrome is a relatively rare but serious complication following carotid endarterectomy.
ObjectiveDescribe the cases of a consecutive series of patients who were operated on in a given period of time.
Material and methodsA retrospective review of a prospective database consisting of patients who had undergone carotid endarterectomy in our Vascular Department over a period of time (2002-2009). Patients underwent preoperative angiography or two minimally invasive techniques in order to determine the degree of carotid stenosis (NASCET method)
ResultsA total of 172 carotid endarterectomies were performed during this period of time (86% males-14% females), mean age 70.4± 7.7. During this period three patients showed cerebral hyperperfusion syndrome, two men and one woman, between the second and the third postoperative day. The mean age was 73.6 years. All of them were ex-smokers and hypertensive. Angiography demonstrated signs of chronic cerebral ischaemia. Two patients died and another is alive with neurological morbidity.
ConclusionCerebral hyperperfusion syndrome is a potential complication of carotid endarterectomy, with possible fatal consequences. The identification of patients with a risk of cerebral hyperperfusion syndrome is of paramount importance in order to prevent and treat it. Once hyperperfusion has been established the treatment consists of aggressive postoperative blood pressure control.
El síndrome de hiperperfusión cerebral (SHC) constituye una complicación excepcional, pero muy grave, de la cirugía de revascularización carotídea, asociada tanto a la endarterectomía carotídea (EC) como al stenting (SC), con una incidencia variable, según las series, entre 0,2 y 18,9%1. Considerando aisladamente ambas técnicas las cifras de incidencia son similares: 1,9% en EC y 1,16% en SC2.
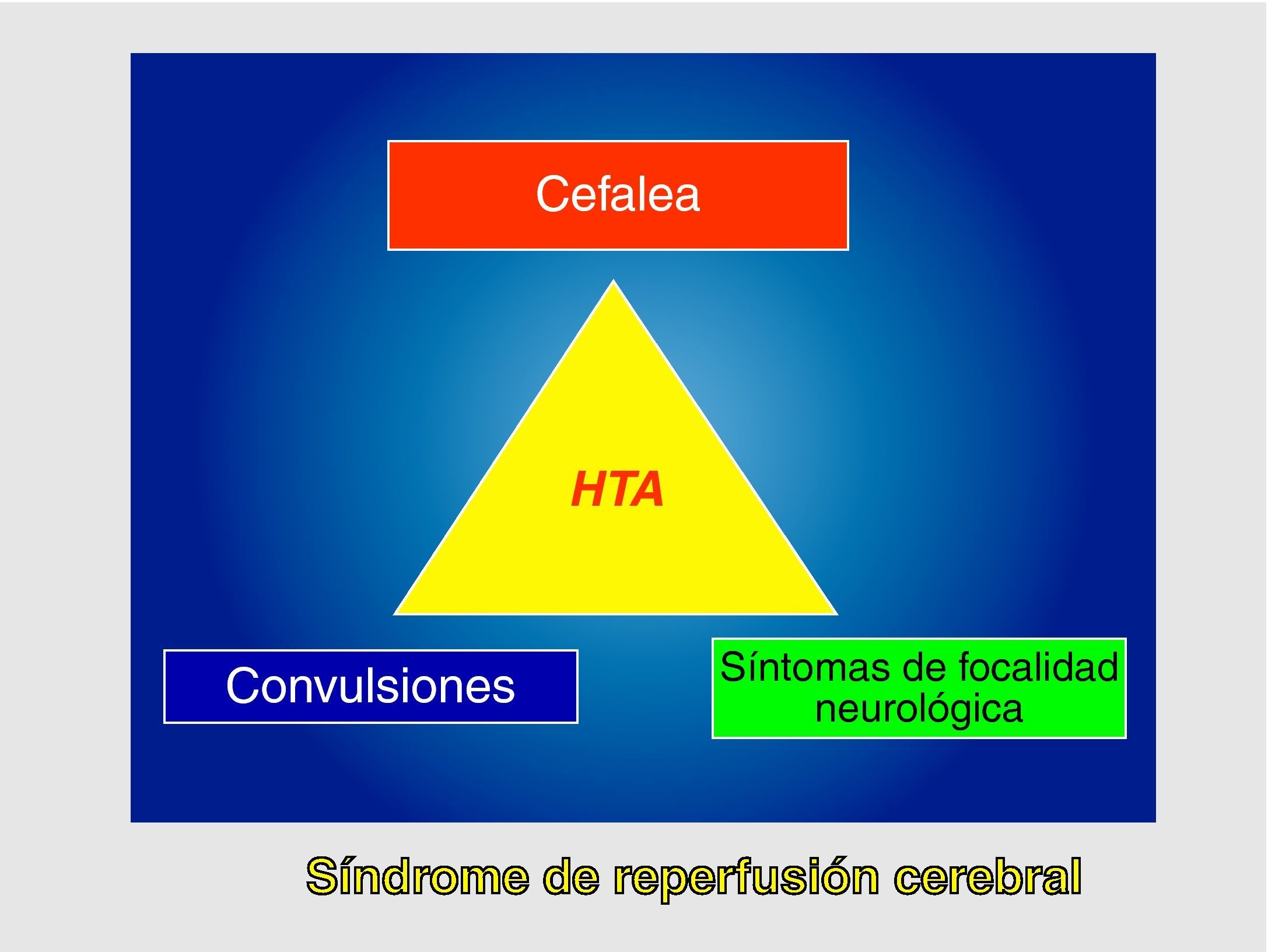
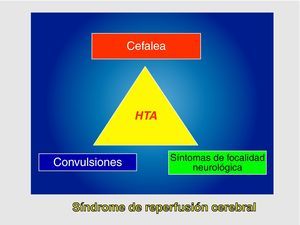
Este síndrome se define como la tríada clínica consistente en cefalea, convulsiones y síntomas de focalidad neurológica en asociación con hipertensión arterial (HTA), y todo ello en ausencia de isquemia cerebral. Posteriormente a esta definición original, preconizada por Sundt3, se han añadido como criterios diagnósticos el incremento del flujo sanguíneo cerebral (FSC) respecto a los valores basales preoperatorios y/ o la demostración de hiperperfusión en RMN o TAC4.
ObjetivoDescribir los casos de SHC de una serie consecutiva de pacientes en los que se realiza EC en un período de tiempo dado.
Material y métodosSe realiza una revisión retrospectiva de una base de datos recogida prospectivamente de la cirugía de endarterectomía carotídea realizada en nuestro Servicio de Cirugía Vascular entre los años 2002 y 2009, con objeto de hallar los pacientes que han presentado SHC tras la cirugía de revascularización. La base de datos incluye las siguientes variables: edad, sexo, factores de riesgo vascular (tabaco, HTA, diabetes mellitus [DM] y dislipemia), enfermedad arterial periférica (EAP), patología aneurismática, cardiopatía isquémica, fibrilación auricular, clínica carotídea (asintomático, síntomas hemisféricos, síntomas retinianos, síntomas inespecíficos o síntomas hemisféricos+retinianos), hallazgos angiográficos (signo de la cuerda, oclusión carotídea contralateral, circulación colateral), antiagregación perioperatoria, anticoagulación preoperatoria, empleo de shunt intraluminal durante el clampaje de la arteria carótida interna, período de tiempo entre el diagnóstico y la cirugía (timing) y cirugía bilateral. Además, se recogen las complicaciones neurológicas (AIT, ictus ipsilateral o contralateral).
Para el diagnóstico de la severidad de la estenosis (método NASCET) y establecer la indicación quirúrgica se utilizó la arteriografía o la combinación de dos pruebas no invasivas (eco-doppler, angio-RM o angio-TC). Todos los pacientes sintomáticos intervenidos presentaban una estenosis de arteria carótida interna severa, mayor del 70%, según criterio NASCET. Entre los asintomáticos, además de una estenosis carotídea severa mayor del 70%, los pacientes reclutados para cirugía tenían una expectativa de vida mayor de 5 años y una edad menor de 80.
El «signo de la cuerda» (strign sign) se consideró un hallazgo exclusivamente arteriográfico y se definió como la presencia de una estenosis crítica con flujo filiforme o colapso de la arteria carótida interna distal, diferente de la estenosis carotídea preoclusiva. En los casos en que otra prueba mostró signos sugestivos de strign sign se realizó una arteriografía, adicionalmente, para el diagnóstico de certeza.
Una pobre circulación colateral fue definida como la ausencia de circulación colateral, demostrada angiográficamente, al hemisferio ipsilateral vía comunicante anterior o posterior.
La técnica realizada fue endarterectomía carotídea con anestesia general en todos los casos.
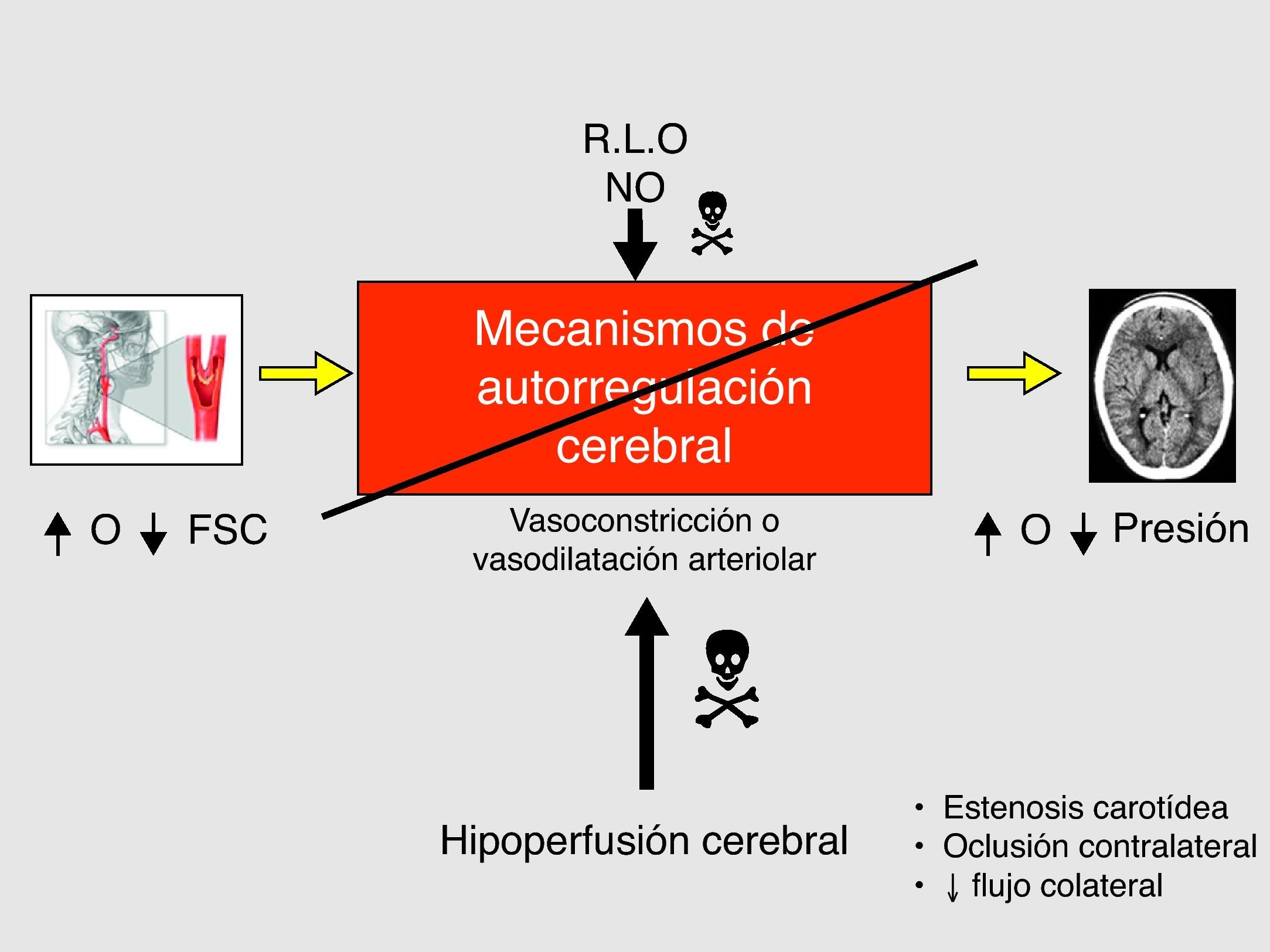
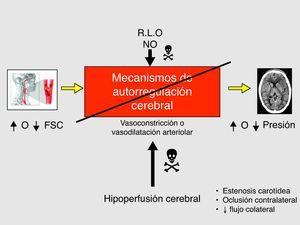
Se define como SHC a la presencia, aisladamente o en combinación, de una de las siguientes manifestaciones (fig. 1): a) cefalea ipsilateral (a la carótida intervenida) de localización retroorbitaria, frontal o temporal; b) convulsiones; y c) focalidad neurológica, asociándose siempre HTA y ausencia de isquemia cerebral.
Los pacientes que cumplían criterios de SHC fueron vigilados estrechamente con tratamiento intensivo de la HTA hasta valores, al menos, por debajo de los preoperatorios y realización de TAC seriados para la detección de hemorragia intracraneal en la evolución. La hemorragia intracraneal queda definida como la existencia en TAC de hiperdensidad, sugestiva de hematoma, en el parénquima cerebral o en el espacio subaracnoideo.
El resultado muerte fue considerado si este evento se producía dentro del primer mes postoperatorio.
Se realiza un análisis descriptivo de los datos obtenidos.
ResultadosSe realizan 172 endarterectomías carotídeas (EC) en el período estudiado, que corresponden un 86% a varones y un 14% a mujeres, con una edad media de 70,4 ± 7,7 años. En este período tienen lugar, en el postoperatorio inmediato, 3 SHC, en dos varones y una mujer, entre los días segundo y tercero desde la cirugía. La edad media de los casos es de 73,6 años. En todos ellos existe el antecedente de tabaquismo e HTA. Otro factor de riesgo vascular recogido fue la dislipemia en 2 pacientes y diabetes mellitus en 0 pacientes. Solo uno de los casos presentaba EAP con isquemia crónica de miembros inferiores por oclusión fémoro-poplítea en GII de Fontaine.
Los tres pacientes presentaban una estenosis carotídea severa > 70% sintomática con clínica hemisférica; además, en uno de los casos se suma a la clínica hemisférica la presencia de amaurosis fugax. La forma de presentación de la estenosis carotídea es AIT en dos casos e ictus (stroke) en un caso.
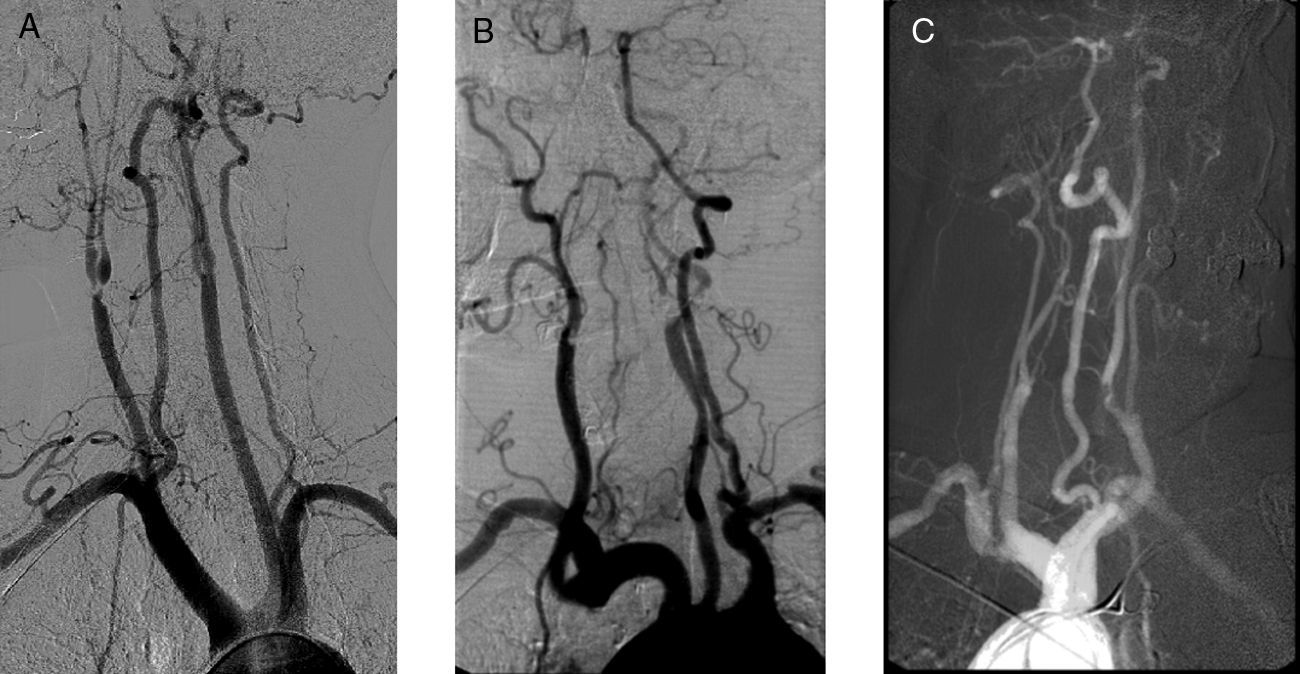
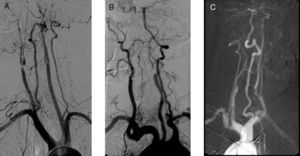
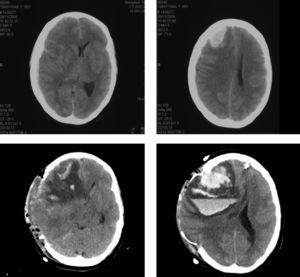
En los tres casos se realiza como prueba de imagen diagnóstica preoperatoria una arteriografía. Los signos arteriográficos comunes son indicativos de hipoperfusión cerebral crónica: en dos pacientes se establece la existencia de oclusión contralateral y en el otro la presencia de «signo de la cuerda» en la carótida intervenida. En todos los casos es patente la pobre circulación colateral hallada (fig. 2).
La cirugía realizada consiste en una EC, sin incidencias, con colocación de shunt de Javid en un paciente debido a la ausencia de reflujo desde la arteria carótida interna distal. En los otros dos se desestimó su empleo por la existencia de reflujo. Se mantiene la antiagregación durante la cirugía en uno de los pacientes; otro de los casos, en tratamiento previo con Sintrom® por cardiopatía valvular, es intervenido con heparina sódica. Solo uno de los casos es intervenido sin antiagregante-heparina, pero se introduce clopidogrel en el tercer día postoperatorio antes de surgir la complicación de SHC.
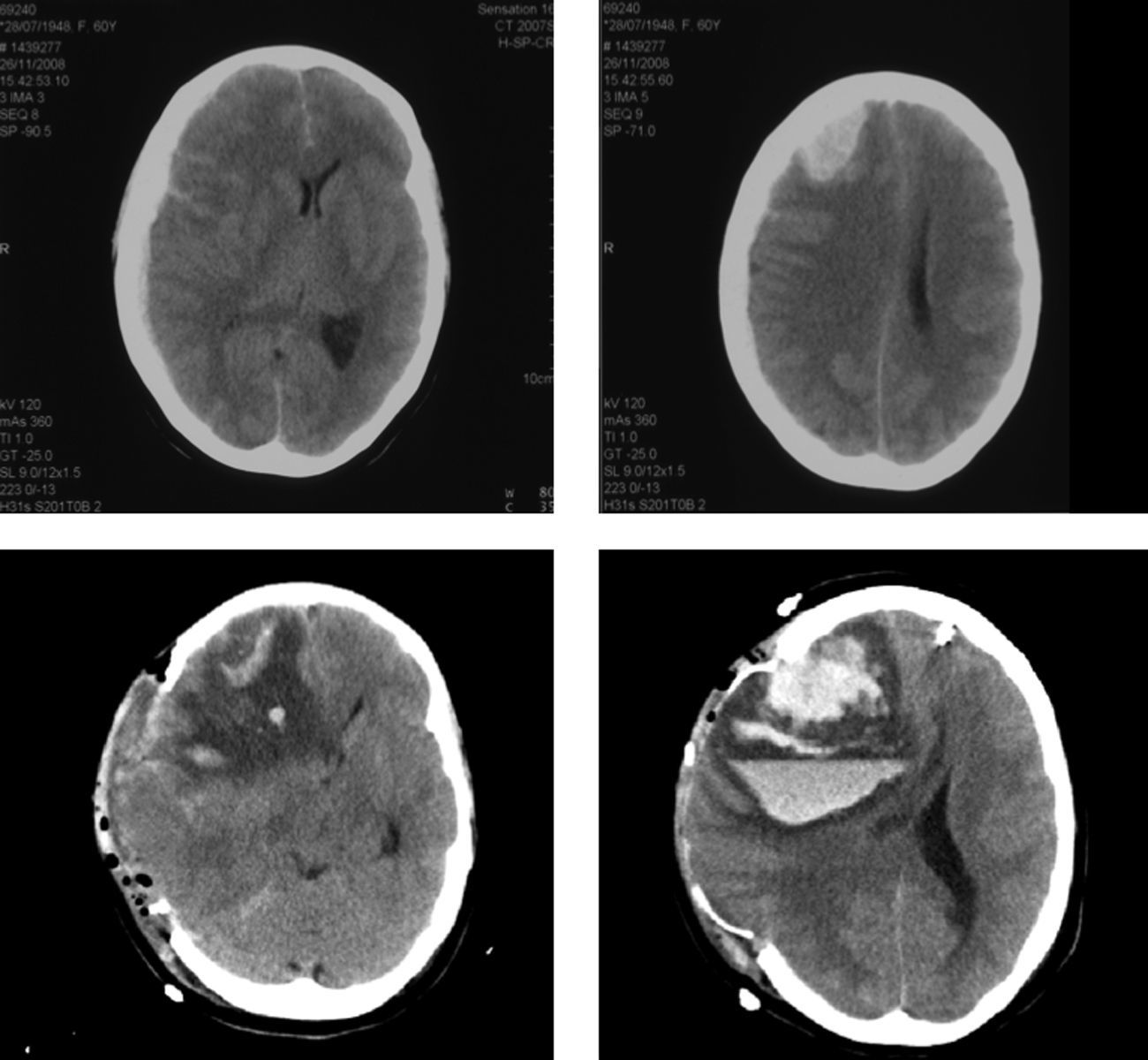
El postoperatorio inmediato transcurre sin incidencias, salvo por la aparición, en todos ellos, de HTA de difícil control (tratada con bloqueadores beta, calcioantagonistas). La clínica de SHC aparece entre los días segundo y tercero con cefalea, convulsiones, focalidad neurológica y/ o disminución del nivel de consciencia. Se realiza TAC cerebral a las 24 y 48 horas, y eco-doppler de TSA que excluyen isquemia cerebral por trombosis carotídea. Los pacientes pasan a la unidad de reanimación de pacientes críticos para monitorización estrecha y control estricto de HTA. Los tres pacientes cumplen criterios clínicos de SHC que se confirma con TAC; dos de ellos, además, desarrollan hematoma parenquimatoso y en el espacio subaracnoideo (fig. 3).
En el postoperatorio inmediato (< 30 días) ocurren dos muertes y un paciente con secuelas neurológicas.
DiscusiónLa EC produce siempre un aumento, modesto y transitorio, de la perfusión y del FSC, por eso se considera «hiperperfusión» al aumento del FSC > 100% respecto al valor basal preoperatorio5. Aunque el SHC se desarrolla, mayoritariamente, en pacientes con hiperperfusión, de forma excepcional puede producirse para aumentos discretos del FSC (inferiores al 100%), coligiéndose de ello la potencial implicación del daño por isquemia-reperfusión en su génesis6–13.
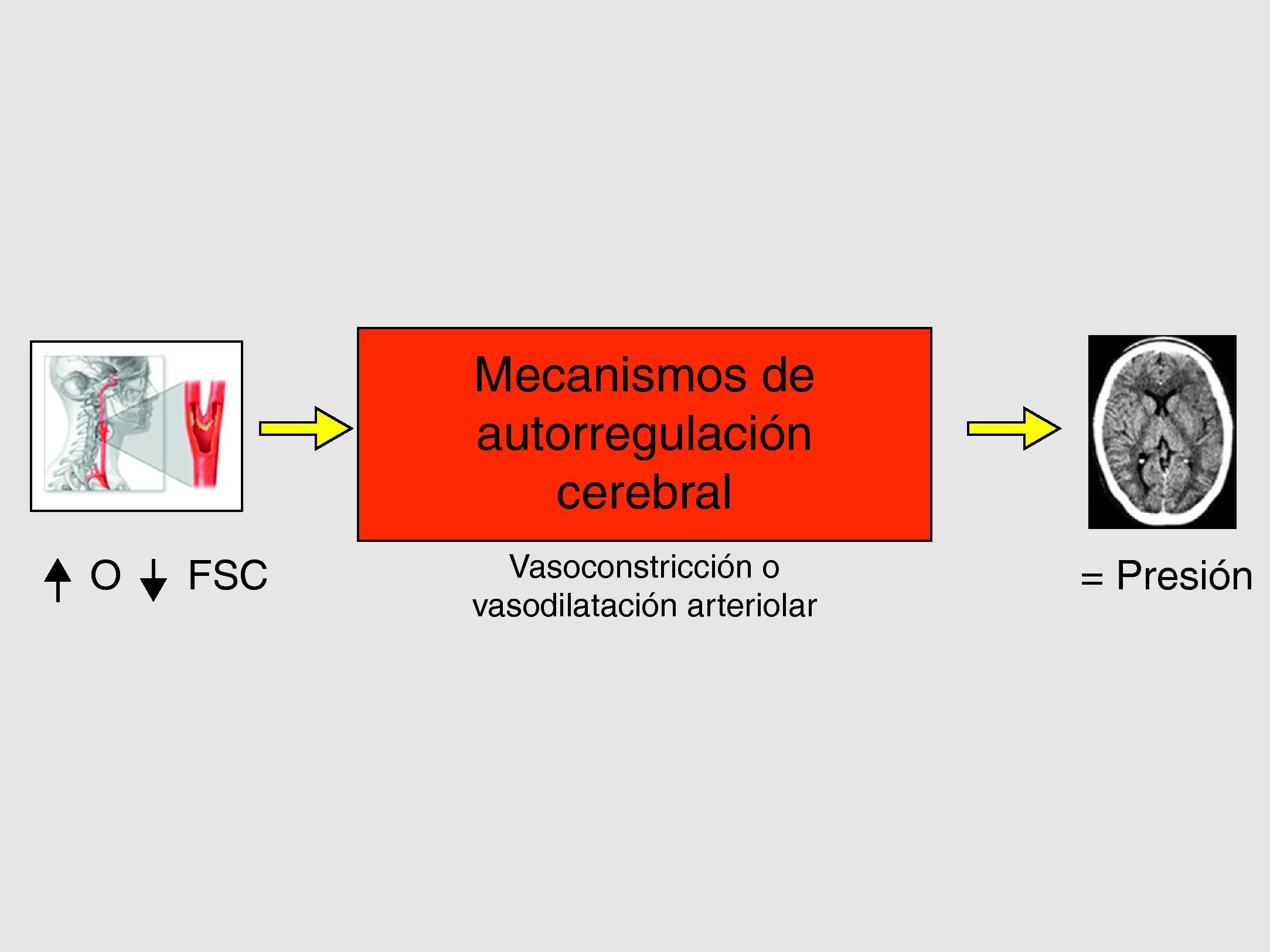
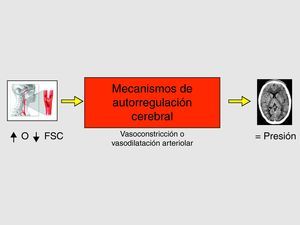
En el aumento del FSC existen dos mecanismos fisiopatológicos, sinérgicos e interrelacionados entre sí: la alteración de los mecanismos de autorregulación cerebro-vascular (figs. 4 y 5) (hecho clave) y el aumento de la presión arterial sistólica postoperatoria14–17.
En nuestra serie el diagnóstico ha sido fundamentado en criterios clínicos por existir síntomas altamente sugestivos de SHC; la aparición de cefalea con convulsiones/y o focalidad neurológica (con el trasfondo de HTA) ha de orientar siempre la sospecha, ya que son formas de comienzo poco frecuentes en otras complicaciones de la EC.
Aunque el SHC aparece, típicamente, en los primeros días postoperatorios18, la posibilidad de que surja tardíamente aconseja el tratamiento estricto de la HTA (TAS: 90-140mm Hg) hasta 6 semanas después de la intervención19,20.
El evento más devastador que puede suceder en el SHC es la hemorragia cerebral21 secundaria a la hiperperfusión (0,37%). Cuando se presenta se añaden al cuadro manifestaciones de hipertensión intracraneal, como vómitos o alteraciones del sensorio.
La aparición en la literatura de cifras de incidencia del SHC tan dispares (0,2-18,9%) resulta confusa. Probablemente, la ausencia de consenso referida a los criterios diagnósticos, así como la multiplicidad de definiciones para esta complicación justifica la inclusión heterogénea de los casos según los estudios; de este modo, dependiendo del rigor de los criterios diagnósticos, la incidencia aumenta o disminuye. Su aparición infrecuente favorece que, en los distintos estudios, los criterios de inclusión sean laxos y variables.
En nuestra opinión, el SHC es una entidad «infradiagnosticada» cuyo conocimiento («conocer que existe») es fundamental para diagnosticarlo. Según Hingorani22 hasta el 40% de los ictus que se producen en el postoperatorio de una EC podrían ser atribuibles a la hiperperfusión cerebral.
Básicamente hay dos modos para detectar qué pacientes tienen un riesgo alto de SHC: demostrar hipoperfusión cerebral preoperatoria o demostrar hiperperfusión perioperatoria o postoperatoria. En cualquier caso, la predicción definitiva de subgrupos de pacientes de riesgo es difícil.
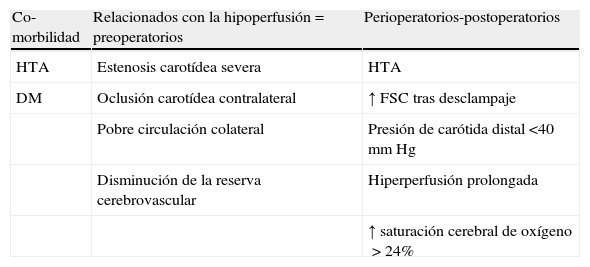
La presencia de factores de riesgo preoperatorios de SHC (tabla 1)23–26 podría ser justificación suficiente para la realización sistemática, a todos los pacientes que van a someterse a cirugía de revascularización carotídea, de un doppler transcraneal (DTC), por ser esta una prueba sencilla, al tiempo que fundamental, para la detección precoz del síndrome27–29. Si se confirma hiperperfusión debe realizarse un control intensivo de la tensión arterial. Por tanto, el diagnóstico se apoya, de forma importante, en la fase preoperatoria, por eso la ausencia de mediciones del FSC en este período puede ser otra causa de la menor incidencia reportada.
Factores de riesgo de síndrome de hiperperfusión cerebral
| Co-morbilidad | Relacionados con la hipoperfusión=preoperatorios | Perioperatorios-postoperatorios |
| HTA | Estenosis carotídea severa | HTA |
| DM | Oclusión carotídea contralateral | ↑ FSC tras desclampaje |
| Pobre circulación colateral | Presión de carótida distal <40mm Hg | |
| Disminución de la reserva cerebrovascular | Hiperperfusión prolongada | |
| ↑ saturación cerebral de oxígeno>24% |
Para su tratamiento se desaconseja la utilización de vasodilatadores (hidralazina, nitratos, calcioantagonistas, etc.)30, siendo los antihipertensivos de elección labetalol y clonidina, que no repercuten en la circulación cerebral.
La TAC preoperatoria no aporta información predictiva porque no es capaz de detectar los factores de riesgo de SHC, y además, en el postoperatorio puede ser normal en pacientes sintomáticos. La RMN, en tanto en cuanto aporta información referida a factores de riesgo preoperatorios, puede ser útil4. La SPECT detecta alteraciones de la perfusión cerebral y de la reactividad cerebrovascular en el preoperatorio. Es una prueba sensible, que diferencia isquemia de hiperperfusión31,32. Recientemente se ha propuesto el empleo de una variante de angiorresonancia para identificar pacientes de riesgo33. La oximetría con infrarrojos (NIRS [near infrared spectroscopy]) ha demostrado ser útil para detectar hiperperfusión a través de valores altos en la saturación de oxígeno34; la sensibilidad y especificidad de esta prueba tomando como patrón de referencia la SPECT ha sido del 100%35. La administración de «barrenderos» de RLO, como la edaravona, puede prevenir el SHC, lo que consolida la teoría de la implicación de los RLO en el SHC36.
La suspensión de la antiagregación durante la cirugía carotídea como medio para evitar la aparición del SHC no está justificada; creemos que sus beneficios compensan sobradamente su dudosa asociación con el SHC.
A modo de conclusión, subrayar la importancia de un control estricto y mantenido de la presión arterial, por ser esto crucial para la prevención y el tratamiento precoz del SHC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.