La infección endoprotésica es una entidad clínica de rara aparición y sintomatología insidiosa. Sin embargo, sus consecuencias clínicas son devastadoras, suponiendo alta morbimortalidad para el paciente. Por ello, su diagnóstico precoz e instauración de tratamiento antibiótico, así como el manejo quirúrgico, son primordiales para mejorar los resultados. Existen diversas opciones terapéuticas que varían desde el manejo conservador en pacientes con riesgo quirúrgico prohibitivo, hasta el drenaje percutáneo, la reconstrucción in situ utilizando materiales recubiertos con antibiótico o plata, o incluso de material protésico habitual no impregnado o el tratamiento clásico de reconstrucción extraanatómica dejando muñón aórtico. Sin embargo, en los últimos años la extracción completa del dispositivo y la reconstrucción aórtica in situ ha ido ganando adeptos por sus buenos resultados en cuanto a permeabilidad y el uso de otros materiales protésicos. Basándonos en nuestra experiencia clínica, por su durabilidad y alta resistencia a la reinfección, recomendamos el empleo de venas femorales superficiales como material autólogo y del parche de pericardio bovino como xenoinjerto, e incluso, una combinación de ambos materiales en caso de injertos más largos.
The endograft infection is a rare clinical entity that usually has insidious symptoms. However, its clinical consequences are devastating for the patient, with high morbidity and mortality in the published literature. Therefore, early diagnosis and establishment of antibiotic treatment, as well as surgical management, are essential to improve the results. There are several therapeutic options, ranging from conservative management in patients with prohibitive surgical risk, to percutaneous drainage, in situ reconstruction using antibiotic or silver coated prosthetic grafts, or even uncoated prosthetic material and extra-anatomic reconstruction, leaving an aortic stump. However, in recent years, complete removal of the device and aortic in situ reconstruction has gained popularity due to its good results in terms of patency and resistance to infection. Based on our clinical experience, due to its durability and high resistance to reinfections, it is recommended to use superficial femoral veins as autologous material and the bovine pericardium patch as a xenograft, and even a combination of both materials, if a longer graft is needed.
El tratamiento endovascular de la patología aórtica (TEVAR, EVAR, EVAR con ramas o chimeneas) está en auge por su menor morbimortalidad, menor estancia hospitalaria y similares resultados a la cirugía abierta a corto y medio plazo1. Además, su baja tasa de complicaciones, siendo mayoritariamente menores y remediables en forma de procedimientos endovasculares, lo ha convertido en el tratamiento de elección para los pacientes de alto riesgo quirúrgico y edad avanzada2.
La infección de las endoprótesis implantadas es una complicación rara, rondando entre el 0,2 y el 5%, según las series publicadas3. Sin embargo, su prevalencia posiblemente esté en aumento con la expansión y la mayor aplicabilidad del manejo endovascular. Asimismo, las infecciones endoprotésicas son potencialmente letales, de difícil diagnóstico y tratamiento, siendo este último frecuentemente desafiante en pacientes de alto riesgo quirúrgico, que inicialmente fueron desestimados para cirugía abierta4.
Nuestro objetivo fue presentar el algoritmo de tratamiento de infección endoprotésica en nuestro centro y revisar la literatura hasta la actualidad.
Caso 1Mujer de 44 años que fue tratada en 2004 mediante colocación de endoprótesis torácica (TEVAR) (Talent, Medtronic, Santa Rosa, California, EE. UU.) por rotura contenida de la aorta torácica descendente en el contexto de accidente de tráfico. Tras la intervención presentó varias intervenciones quirúrgicas por fractura de fémur precisando osteosíntesis y, más tarde, retirada de la misma, diverticulitis aguda complicada con perforación intestinal y peritonitis, requiriendo colectomía parcial con colostomía y posterior reconstrucción complicada con infección de la herida quirúrgica.
Díez años tras la colocación de la endoprótesis torácica, comenzando con hemorragia digestiva masiva, la paciente fue diagnosticada de infección endoprotésica y fístula aortoesofágica, siendo desestimada para tratamiento en otro centro terciario. Posteriormente, fue trasladada a la Unidad de Cuidados Intensivos (UCI) de nuestro hospital para manejo y plantear posible tratamiento quirúrgico. El estudio mediante angio-tomografía computarizada (TAC) evidenciaba fístula aortoesofágica a nivel del extremo endoprotésico distal a la altura de la vena pulmonar izquierda. Los hemocultivos fueron positivos para Streptococcus intermedius, sin resistencias antibióticas aparentes.
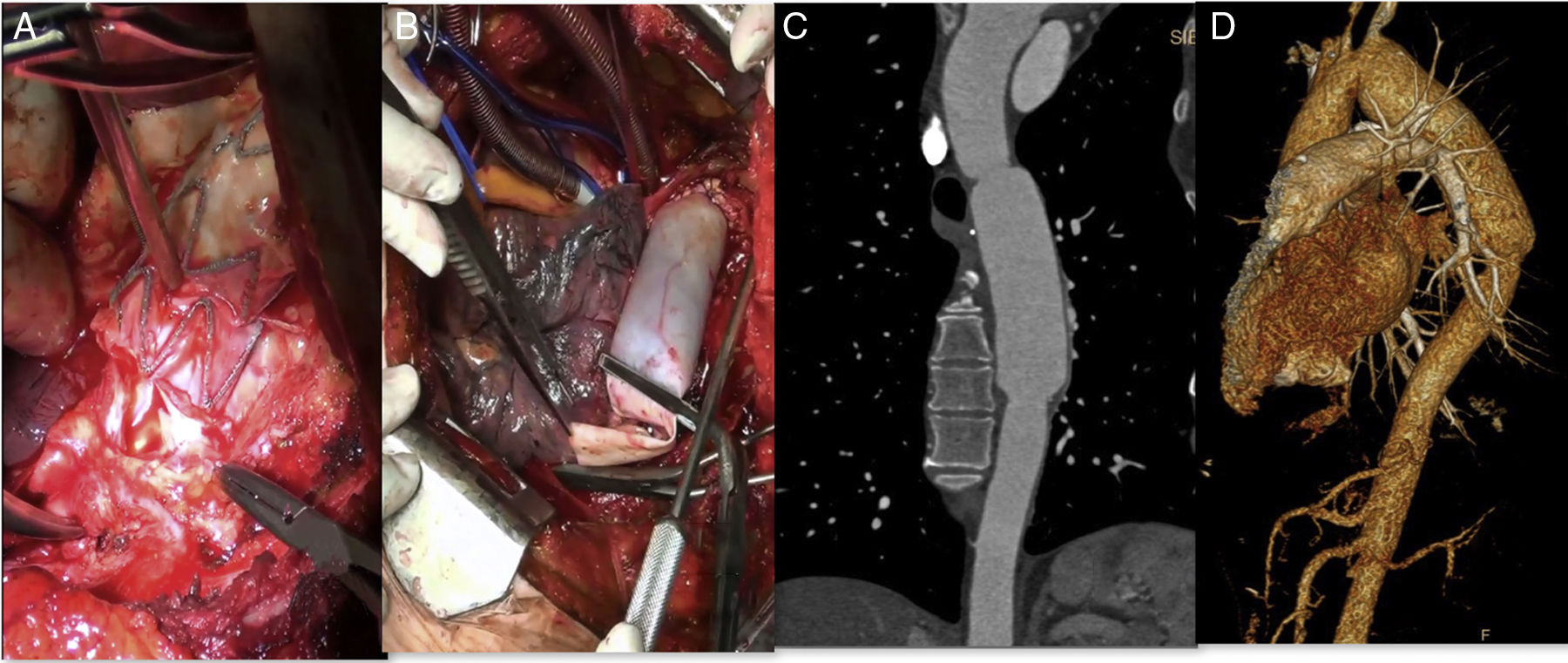
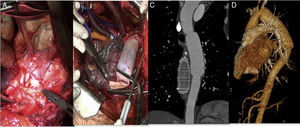
La paciente fue tratada de forma multidisciplinar, con abordaje mediante toracotomía izquierda por el quinto espacio intercostal. Tras disección del cayado aórtico y aorta torácica descendente, bajo condiciones de hipotermia, se instauró circulación extracorpórea y arresto cardiaco. Se realizó exéresis endoprotésica completa y colocación de injerto tubulizado con parche de pericardio bovino (PPB) (Edwards Lifesciences, Irvine, CA, EE. UU.) desde la aorta distal a subclavia izquierda hasta unos centímetros por debajo de la endoprótesis previa (fig. 1 A y B). El Servicio de Cirugía General realizó esofagectomía con yeyunostomía y esofagostomía cervical asociadas. Tras 72 h en UCI y 17 días en planta de hospitalización, fue dada de alta con buena evolución. Aproximadamente 5 meses tras la intervención se reconstruyó el tránsito esofágico mediante tubulización gástrica con ascenso retroesternal y anastomosis a esofagostoma. A 4 años de seguimiento, la paciente se muestra asintomática, con permeabilidad del injerto sin degeneración aneurismática ni otras complicaciones o signos de reinfección (fig. 1 C y D).
Explante de endoprótesis torácica infectada y reconstrucción aórtica utilizando parche de pericardio bovino (PPB). A) Aortotomía y exposición del dispositivo infectado visualizando su desintegración de la pared y material purulento contiguo. B) Reconstrucción aórtica utilizando PPB tubulizado; realizada anastomosis proximal. C y D) Reconstrucción angiográfica a 4 años de seguimiento sin signos de infección ni degeneración aneurismática.
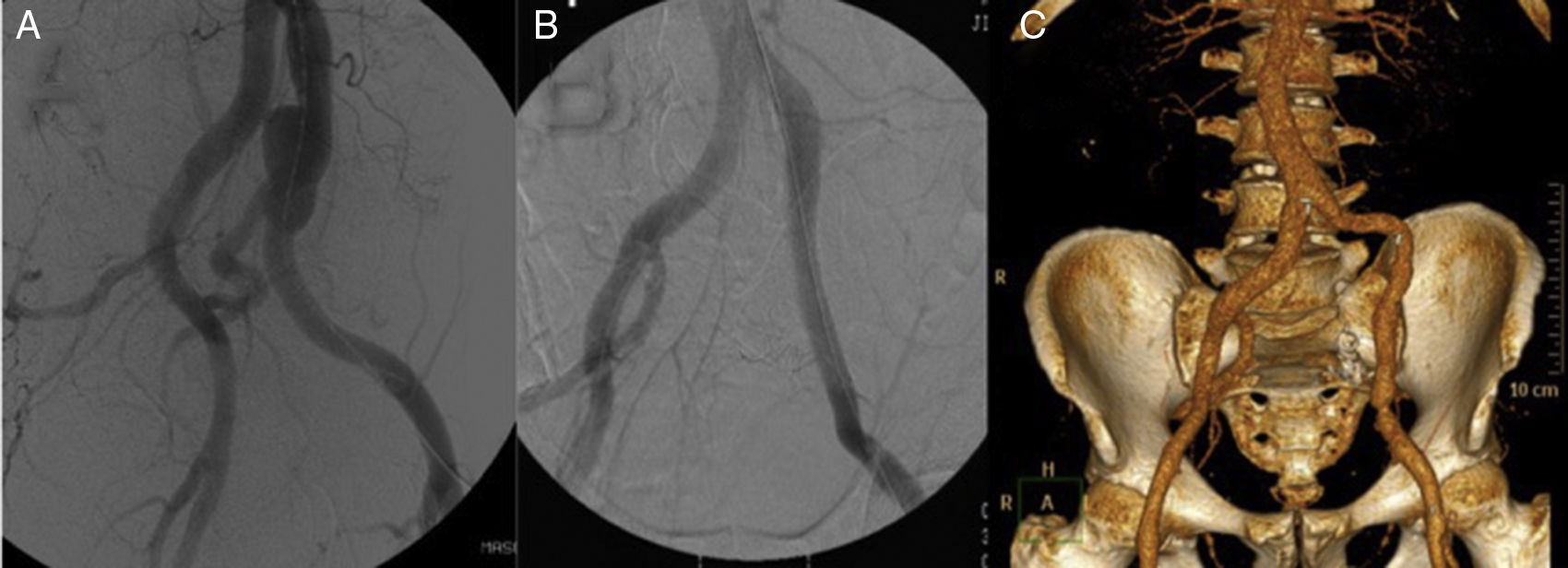
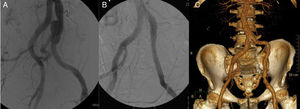
Varón de 65 años, con antecedentes de aneurisma iliaco común izquierdo con afectación hipogástrica (fig. 2 A) tratado hacía 10 años mediante colocación de endoprótesis iliaca (Excluder, Gore & Associates, Inc, Flagstaff, Arizona, EE. UU.) y embolización hipogástrica (fig. 2 B). Veinte días tras la intervención se presentó en el servicio de urgencias con dolor inguinal, malestar general y fiebre. En la TAC se objetivó alteración de la grasa retroperitoneal adyacente que, en conjunto con los datos clínicos, sugería infección endoprotésica. Intraoperatoriamente, se objetivó intensa reacción inflamatoria y fibrótica asociadas. Se retiró la totalidad del dispositivo realizando desbridamiento y lavado de la zona adyacente. Se interpuso injerto de vena femoral superficial (VFS) de la misma pierna desde origen de iliaca común hasta iliaca externa. Tanto los hemocultivos como los cultivos de la prótesis resultaron positivos para Staphilococcus aureus, sin resistencia antibiótica aparente. El paciente evolucionó favorablemente sin datos de reinfección presentando permeabilidad del injerto a más de 10 años de seguimiento (fig. 2 C).
Tratamiento endovascular de aneurisma iliaco izquierdo. A) Aneurisma de arteria iliaca común izquierda. B) Tratamiento endovascular interponiendo rama de endoprótesis y embolizando la arteria hipogástrica mediante coils. C) Reconstrucción angiográfica a 10 años de seguimiento sin signos de reinfección del injerto venoso ni otras complicaciones.
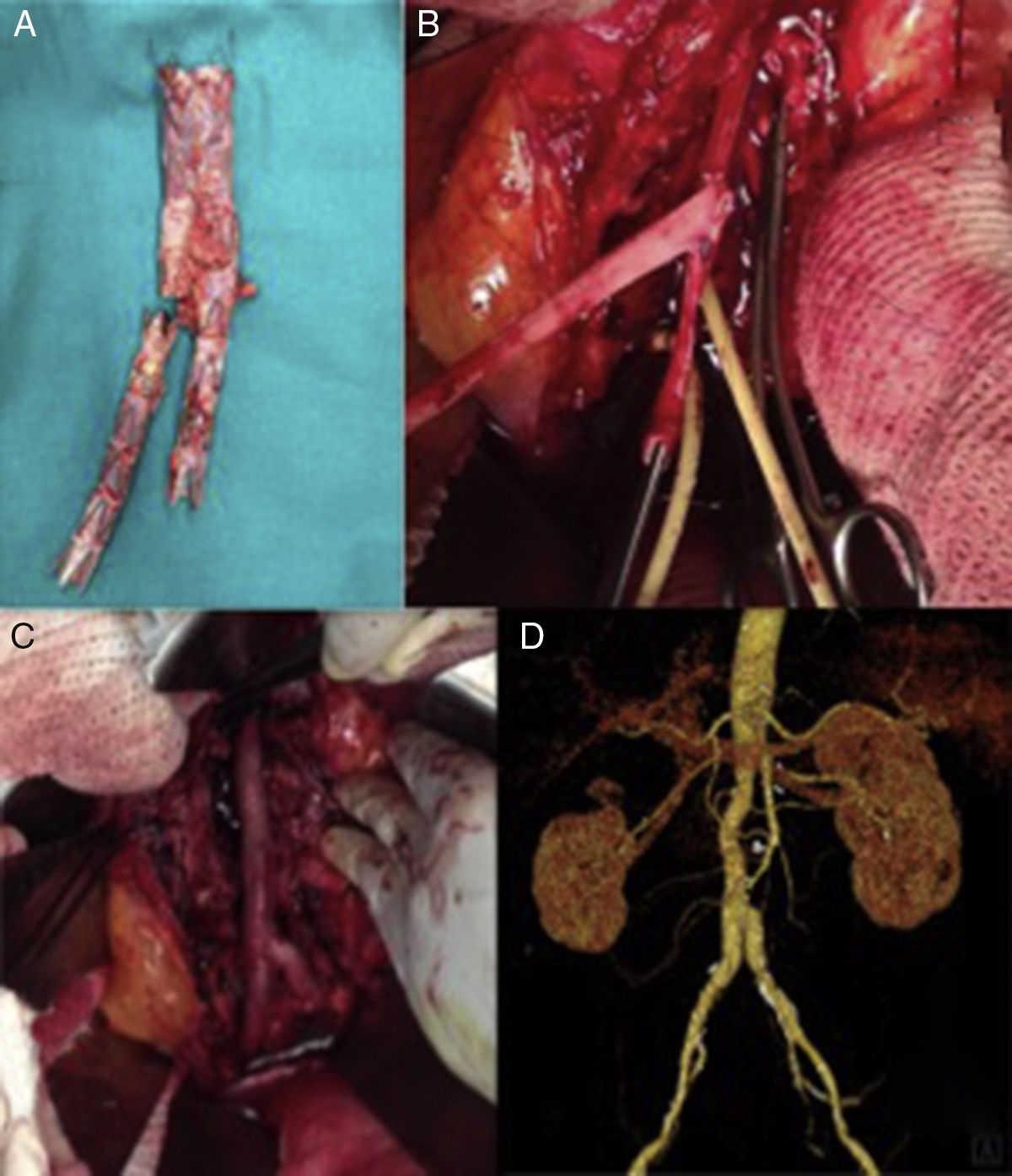
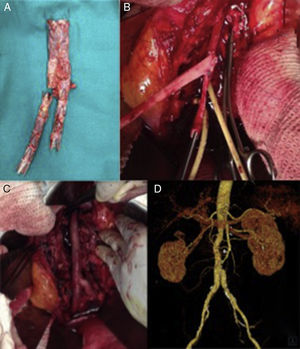
Varón de 60 años, con antecedentes de aneurisma de aorta abdominal roto tratado mediante colocación de endoprótesis bifurcada (Endurant, Medtronic, Santa Rosa, California, EE. UU.). Menos de un mes tras la intervención presentó dolor lumbar y datos de infección endoprotésica en la TAC. Se le intervino de manera programada para retirada del dispositivo. Tras aneurismorrafia se objetivó abundante salida de material purulento, así como una pared aórtica engrosada con prominente reacción inflamatoria circundante indicativa de aortitis como proceso etiológico inicial. Fue tratado mediante explante completo de la endoprótesis (fig. 3 A) e injerto aortobiiliaco con venas femorales superficiales (fig. 3 B y C). En los cultivos de la prótesis se aisló Staphilococcus aureus multisensible a los antibióticos probados. El paciente evolucionó favorablemente y sin complicaciones a 4 años de seguimiento (fig. 3 D).
Explante de endoprótesis bifurcada infectada y reconstrucción utilizando venas femorales superficiales (VFS). A) Endoprótesis infectada explantada. B) VFS preformadas en «pantalón», realizada la anastomosis proximal. C) Reconstrucción aórtica «in situ». D) Reconstrucción angiográfica a 4 años de seguimiento, sin signos de complicación.
La incidencia de la infección endoprotésica ronda en torno al 0,2-5% según las series publicadas5, siendo similar a la de cirugía abierta6. Sin embargo, la evidencia proviene de publicaciones de series de casos y escasos estudios multicéntricos que, junto con el número creciente de endoprótesis implantadas, indica una posible infra notificación y probable incremento de los números absolutos en el futuro7.
Las condiciones quirúrgicas de cirugía urgente o en sala angiográfica, así como antecedentes de infecciones perioperatorias, tanto locales o aórticas como sistémicas, procedimientos coadyuvantes por fugas u otras complicaciones (embolizaciones, extensión de la endoprótesis, trombectomía, etc.) y la presencia de trombo aórtico o hematoma de pared aórtica previos a la cirugía han sido hallados como factores de riesgo para la infección de las endoprótesis implantadas3,8. En 2 de los 3 pacientes de nuestra serie se trataba de procedimientos urgentes, precisando en el segundo caso además de embolización previa a la colocación endoprotésica y siendo el tercer caso una posible aortitis precedente.
La presentación clínica en los pacientes afectados suele ser insidiosa, siendo los síntomas de fiebre, dolor, fatiga, malestar general y pérdida de peso los más frecuentemente descritos3. A nivel analítico, como hallazgo habitual destacan la leucocitosis mantenida e incluso signos de infección sistémica y anemización en casos de rotura y sangrado o fistulización, estando esta última presente en hasta en una tercera parte de los pacientes del registro multicéntrico de Chaufour et al.4 La prueba de imagen por excelencia es la TAC por su rapidez y disponibilidad, donde destacarían los signos de presencia de líquido periprotésico, de gas o absceso adyacentes, e incluso alteración de la grasa adyacente apreciable ocasionalmente5. En caso de duda en infecciones de bajo grado, la tomografía por emisión de positrones estaría recomendada9. El tiempo transcurrido hasta el diagnóstico es variable entre series, con una media de 25 meses, con rangos desde 1 hasta 128 meses3.
Generalmente, se trata de una infección polimicrobiana siendo los Gram positivos los microorganismos más frecuentemente hallados, seguidos por los Gram negativos, anaerobios y hongos3. Desde que se plantea la sospecha clínica de infección endoprotésica se recomienda la toma de hemocultivos e inicio de terapia antibiótica de amplio espectro y posterior ajuste según los resultados en caso de que fueran positivos. En pacientes no aptos para cirugía abierta, así como en reconstrucciones con prótesis no impregnadas o extracción parcial del dispositivo, se recomienda antibioterapia continuada de por vida3-5,9. No existe un consenso global sobre la duración del tratamiento antibiótico después del explante de la endoprótesis infectada. Dada su baja incidencia y la heterogeneidad de los casos publicados, es difícil establecer unos estándares de tratamiento homogeneizados con grado de evidencia alto. Analógicamente a la endocarditis, algunos autores recomiendan terapia antibiótica durante 4-6 semanas en paciente tratados con material autólogo, presencia de gérmenes de baja virulencia y menor riesgo de reinfección4,9. Dada la menor virulencia conocida de los patógenos aislados, así como el uso de VFS y/0 PPB tubulizado en los 3 casos descritos, dichos pacientes fueron tratados con antibioterapia ajustada a cultivos durante un periodo máximo de 6 semanas.
La infección endoprotésica se puede presentar de forma aislada o en coexistencia con fístula aortoentérica (FAE) en hasta una tercera parte de los pacientes3,4. La presencia de FAE empeora significativamente los resultados y la morbimortalidad quirúrgica asociada dada su presentación mediante la anemización paulatina del paciente, con el consiguiente deterioro o incluso la hemorragia gastrointestinal masiva que podría progresar a una hemorragia exanguinante9. La hemorragia masiva en caso de FAE podría precisar la implantación emergente de una nueva endoprótesis para conseguir control temporal del sangrado, posibilitar la estabilización hemodinámica del paciente y la planificación del tratamiento definitivo. El duodeno es el órgano más frecuentemente afectado, aunque se han descrito FAE a todos los niveles del aparato gastrointestinal incluyendo el intestino delgado y grueso3-9. En presencia de FAE se requiere la reparación del aparato digestivo, que varía desde la sutura local simple hasta resección completa de la sección afectada y reconstrucción posterior3-9.
Las consecuencias de la infección endoprotésica son devastadoras, con mortalidad global de hasta el 80% en las infecciones de TEVAR y el 60% con EVAR en caso de manejo únicamente médico10, el cual en nuestra opinión debe limitarse a pacientes con riesgo quirúrgico prohibitivo. Argyriou et al. mostraron en su metaanálisis que más de la mitad de los pacientes tratados de forma conservadora morían al término del seguimiento clínico (58,6% [IC del 95% 28,8% a 83,3%]) y dichos resultados empeoraban aún más en los pacientes con fistulización3. El drenaje percutáneo, la instilación antibiótica intravenosa o a través de drenajes y la antibioterapia permanente podrían mejorar el estado séptico, pero con una progresión certera hacia la muerte en casi todos los casos4,7,8,11.
Extrapolando datos del tratamiento de infecciones en cirugía aórtica abierta, el manejo estándar en la infección de endoprótesis aórtica es el explante completo del dispositivo, desbridamiento local y reconstrucción aórtica preferiblemente mediante material autólogo, recomendando además la cobertura con omentum o fascia lata por algunos autores9,10. La retirada completa del dispositivo es mandatoria en nuestra opinión, aunque podría ser desafiante para el cirujano especialmente en dispositivos con anclaje suprarrenal donde se puede producir un daño importante a la pared aórtica o incluso lesionar al propio operador7,12. Se han descrito diversas técnicas para el explante de endoprótesis suprarrenales que varían desde el corte y la retirada de la tela dejando los stents suprarrenales hasta el uso de torniquete y pinza de Javid o jeringa de 20ml cortada para la retirada completa del dispositivo7,13. La retirada parcial se recomienda únicamente en casos de infección parcial clara (p. ej., infección iliaca) con márgenes libres confirmados intraoperatoriamente8. Aun así, la retirada parcial podría contemplarse en determinados casos con alto riesgo quirúrgico12. Mientras que el pinzamiento suprarrenal sería suficiente para la retirada completa en las endoprótesis con sellado infrarrenal, las de sellado suprarrenal requieren pinzamiento supracelíaco (mediante pinza o balón), incrementando aún más el riesgo operatorio en pacientes ya considerados de alto riesgo quirúrgico a priori10. Además, estas últimas podrían incrementar asimismo las tasas de fallo renal postoperatorio5. Tal es así que algunos autores recomiendan incluso, si fuera posible, una optimización clínica del paciente para mejorar su estado general permitiendo la actuación del tratamiento antibiótico previo a la realizar la cirugía4. Asimismo, y al contrario de lo que se pensaba originariamente, Chaufour et al. mostraron en 12 pacientes con FAE que la erosión aórtica aparecía a nivel del saco aneurismático estando en posible relación con el proceso inflamatorio o isquémico adyacentes (por embolización con coils), más que a nivel de los ganchos de la endoprótesis4,14.
La revascularización quirúrgica preferible es in situ, reservando la reconstrucción extraanatómica mediante injerto axilobifemoral y muñón aórtico para casos de alta contaminación local y abundante salida de material purulento15,16. Sin embargo, esta técnica presenta un riesgo considerable de reinfección del injerto axilobifemoral en caso de afectación de las arterias femorales, así como de amputación de miembros inferiores o incluso de rotura del muñón aórtico9,17. También se ha descrito el tratamiento endovascular para la infección endoprotésica en paciente de alto riesgo y signos de rotura inminente o sangrado, colocando una nueva endoprótesis para la estabilización del paciente y como técnica recurso. Sin embargo, los resultados a corto y medio plazo no han sido favorables3,18.
Tras el explante completo del dispositivo, se recomienda la reconstrucción aórtica utilizando material autólogo, si fuera posible19. A pesar de sus mejores resultados en cuento a tasas de reinfección, permeabilidad y durabilidad, Argyriou et al. hallaron en su reciente metaanálisis que tan solo el 11% de las reconstrucciones aórticas se realizaban con venas autólogas3. Quizás la laboriosidad del procedimiento, la prolongación de los tiempos quirúrgicos en pacientes de alto riesgo per se y una temible morbilidad venosa posterior expliquen dichos hallazgos. Sin embargo, la reconstrucción con material autólogo presenta una buena permeabilidad a largo plazo, baja tasa de amputaciones y reinfección con morbimortalidad a medio y largo plazo aceptables20-23.
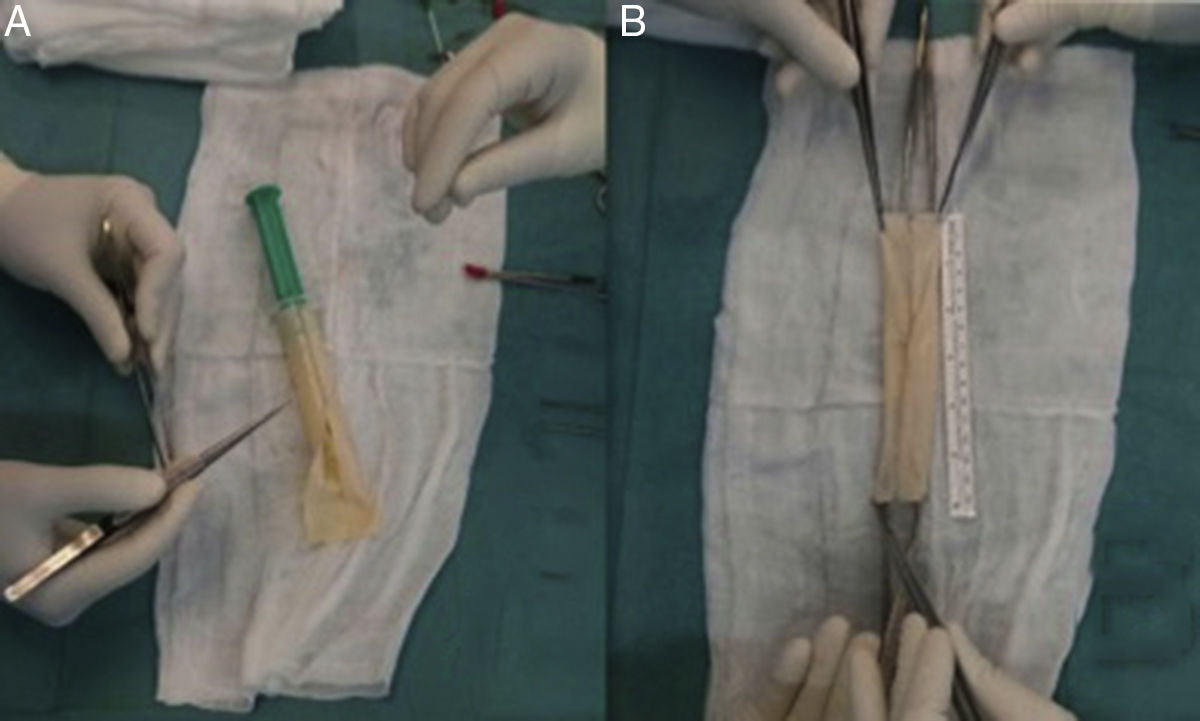
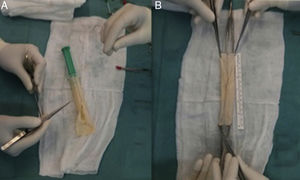
El uso de VFS para la reconstrucción de la aorta abdominal y PPB tubulizado en aorta torácica es el estándar de tratamiento en nuestro centro (fig. 4). En algunos casos donde se haya requerido reconstrucción aortobifemoral, dada la longitud de injerto requerida, hemos empleado una combinación de PPB tubulizado anastomosado a VFS como ramas iliacas. Por otro lado, para evitar la morbilidad venosa posterior a la extracción de las VFS, se aplica el uso de dispositivos de compresión neumáticas intermitente durante los días de estancia en la UCI y de compresión normal o fuerte junto con anticoagulación a dosis de tratamiento en los próximos 3 a 6 meses tras la cirugía.
El empleo de xenoinjertos (fig. 5) para la reconstrucción vascular es una alternativa razonable al material venoso autólogo. Su uso se está popularizando por su disponibilidad, fácil manejo y resistencia a las infecciones. Aunque aún no existe evidencia científica consistente sobre el uso del PPB para la reconstrucción vascular, en la actualidad ya disponemos de los primeros estudios publicados mostrando resultados favorables24-26. Asimismo, un injerto aortobifemoral de PPB preformado podría evitar la temible morbilidad venosa derivada de la extracción de las VFS acortando asimismo los tiempos quirúrgicos asociados27,28.
El uso de injertos criopreservados ha ido ganando popularidad en los centros que puedan optar a ellos por su disponibilidad en procedimientos urgentes, mayor resistencia a las reinfecciones y buenos resultados en las series publicadas hasta el momento9,29. Sin embargo, conllevan un riesgo no desestimable de degeneración aneurismática, trombosis e incluso rotura9,15. Van Zitteren et al. describieron en 2011 el empleo de la vena safena magna en espiral para la reconstrucción de la aorta abdominal30. Sin embargo, se necesitan resultados más contundentes sobre dicha técnica, que además supone mayor laboriosidad y largos tiempos quirúrgicos, así como la planificación quirúrgica y disponibilidad de material venoso uniforme y de buen calibre, siendo su aplicabilidad limitada en situaciones urgentes.
Los injertos protésicos impregnados con antibiótico o de plata son otra alternativa con alta aplicabilidad en casos urgente mostrando resultados prometedores con tasas de morbimortalidad y reinfección algo peores que los injertos autólogos3-5,9,24. Por último, se han utilizado prótesis estándar, que conllevan alto riesgo de reinfección e incluso de fistulización aortoentérica o aortoesofágica, recomendando envolverlas con omentum o fascia. Dichos injertos requerirían prolongación de la antibioterapia de por vida y, sobre todo, su uso debe ser evitado en caso de absceso adyacente o salida de abundante material purulento3-5,9.
La figura 4 muestra las preferencias de nuestro centro en cuanto a material utilizado para la reconstrucción aórtica tras infección protésica, prefiriendo, siempre que sea posible, la reconstrucción in situ. El estándar de tratamiento sería el uso de VFS autólogas en el territorio abdominal, seguido por PPB tubulizado en el territorio de la aorta torácica, o una combinación entre ambos en caso de requerir injertos aortobifemorales más largos. Basándonos en la literatura y su resistencia a las infecciones, el uso de criopreservados sería preferible frente a materiales impregnados aunque no dispongamos de los primeros a nivel local. Por último, el uso de prótesis estándar para la reconstrucción aórtica debe ser limitado por su alto riesgo de reinfección.
Existen diversos factores de riesgo que se han asociado con mayores tasas de morbimortalidad posquirúrgica tras la cirugía de endoprótesis infectada, como son los procedimientos urgentes y prolongados, las infecciones polimicrobianas e infecciones crónicas, la presencia de sepsis persistente y de insuficiencia renal crónica3,10.
Para la prevención de la infección endoprotésica se recomienda la profilaxis antibiótica antes de cualquier procedimiento dental, del tracto respiratorio, gastrointestinales o genitourinarios, así como en procedimientos dermatológicos o musculoesqueléticos si existe la posibilidad de infección o el paciente está inmunocomprometido16.
ConclusiónLa infección endoprotésica es una entidad clínica rara, aunque con alta morbimortalidad para el paciente requiriendo un diagnóstico y tratamiento precoz. Dados los buenos resultados en cuanto a permeabilidad y ausencia de reinfección, desde nuestra experiencia y siempre que sea posible recomendamos como alternativa el explante completo de la endoprótesis y la reconstrucción aórtica «in situ» con material autólogo como manejo estándar de la infección endoprotésica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.