La formación de trombo intraprótesis (TI) tras reparación endovascular de aneurismas aortoilíacos infrarrenales (EVAR) es un hallazgo frecuente cuya repercusión clínica no está definida.
ObjetivoConocer la incidencia de formación de TI, su curso clínico y la existencia de factores predisponentes.
Material y métodosDesarrollamos un estudio observacional retrospectivo. Entre febrero de 2009 y junio de 2014, realizamos 184 EVAR con endoprótesis Endurant II®, excluyendo aquellos con seguimiento inferior a 5 meses. Recogimos factores de riesgo cardiovascular, antiagregación/anticoagulación, anatomía del aneurisma, configuración y tamaño del dispositivo, ratio de diámetros distal y proximal del dispositivo, presencia de endofuga y de TI durante el seguimiento, evolución del TI, complicaciones isquémicas y reintervenciones. Analizamos variables cualitativas con tablas de contingencia y chi-cuadrado y variables continuas, con t de Student. Análisis actuarial y log-rank para supervivencia, aparición de complicaciones y reintervención.
ResultadosObtuvimos un seguimiento medio de 20,87 meses. Desarrollaron TI en 81 pacientes (44%). Solo encontramos relación con cáncer activo (p=0,003; OR 3,639; IC 95%; 1,501-8,825), tratamiento anticoagulante (p=0,006; OR 0,257; IC 95%; 0,092-0,715) y endofugas tipo II (p=0,013; OR 0,406; IC 95%; 0,197-0,836). En 6 pacientes el trombo desapareció durante el seguimiento (7%). Las tasas de complicación y reintervención en función de presencia o ausencia de TI no mostraron diferencias significativas.
ConclusiónEl TI es un hallazgo frecuente que no parece tener repercusión clínica significativa. La anticoagulación y la endofuga tipo II se presentan como factores protectores y el cáncer activo, como factor predisponente.
Although the appearance of intraprosthetic thrombus after endovascular infrarenal aortoiliac aneurysms repair is common, its clinical impact is not well defined.
ObjectiveEndoprosthetic thrombus prevalence, clinical impact and possible related factors.
Material and methodsA retrospective review was conducted on 184 Endurant type II stent grafts implanted between Feb/09 and Jun/14. Patients with a follow up less than 5 months were excluded. A record was made of cardiovascular risk factors, treatment, anatomy of aneurysms, endoprosthesis features, prosthetic thrombus appearance and behaviour, endoleaks, ischaemic events, and re-interventions.
ResultsThe mean follow up was 20.87 months. Intraprosthetic thrombus was observed in 81 patients (44%). Related factors: active cancer (P=.003; OR 3.639; 95% CI; 1.501-8.825), anticoagulation therapy (P=.006; OR 0.257; 95% CI; 0,092-0,715) and type II endoleaks (P=.013; OR 0.406; 95% CI; 0.197-0.836). The thrombus disappeared in 6 patients during follow up (7%). The thrombus group did not have a higher complication or re-intervention rate when compared with the non-thrombus group.
ConclusionIntraprosthetic thrombus occurs frequently. Its clinical behaviour seems benign. Risk factors: Active cancer. Protective factors: Anticoagulation therapy and type II endoleaks.
El uso cada vez más extendido de las técnicas endovasculares en el tratamiento de los aneurismas aortoilíacos infrarrenales hace que nos enfrentemos con frecuencia a complicaciones hasta ahora poco conocidas1.
Una de estas complicaciones es la formación de trombo en la pared interna de la endoprótesis aórtica. Varios términos han definido esta situación: trombo circular o semicircular, trombo intraluminal, trombo mural o parietal y aposición de trombo2. Su incidencia es variable según los estudios, con series que muestran afectación en más de un tercio de los pacientes3. En general, se considera que tiene un curso benigno, pero la evidencia al respecto es limitada y su repercusión clínica no está del todo definida1,3,4.
El objetivo del presente estudio es conocer la incidencia de formación de trombo intraprótesis (TI) tras reparación endovascular de aneurismas aortoilíacos infrarrenales en nuestro centro, su curso clínico y la posible relación con factores predisponentes.
Material y métodosDiseñamos un estudio de casos y controles retrospectivo, sobre una base de datos prospectiva.
Incluimos los datos de los pacientes tratados, de forma urgente o electiva, mediante reparación endovascular de aneurismas aortoilíacos infrarrenales con endoprótesis tipo Endurant II® (Medtronic AVE, Sunnyvalle, CA, EE. UU.) en nuestro centro, entre febrero de 2009 y junio de 2014. Los criterios de indicación quirúrgica de forma electiva fueron un diámetro>5,5cm en aorta o>3cm en arteria ilíaca y, en caso de crecimiento rápido, (>5mm en 6 meses o 10mm en un año).
Excluimos a pacientes con un seguimiento postoperatorio por angio-TC inferior a 5 meses, a aquellos en los que el dispositivo se implantó para tratar complicaciones de otras endoprótesis y a pacientes con afectación ilíaca o hipogástrica aislada tratada mediante extensiones ilíacas sin componente aórtico.
Recogimos características demográficas del paciente (edad y sexo), comorbilidad asociada (tabaquismo activo, HTA, DM, DL, EPOC, cardiopatía isquémica crónica, enfermedad cerebrovascular, enfermedad arterial periférica, IRC, otras enfermedades trombogénicas) y tratamiento antiagregante (doble o simple) o anticoagulante postoperatorio. Los factores de riesgo cardiovascular se evaluaron de acuerdo con las guías de práctica clínica europeas sobre prevención de enfermedad cardiovascular. Dentro de las enfermedades trombogénicas asociadas incluimos: neoplasia activa o metastásica, neoplasia resuelta o estable tras tratamiento, enfermedad inflamatoria intestinal y antecedente de enfermedad tromboembólica venosa.
Dentro de las características anatómicas del aneurisma recogimos: el diámetro máximo del saco aneurismático, el diámetro máximo y longitud del cuello proximal, la permeabilidad de ramas colaterales (arteria mesentérica inferior, lumbares y arterias hipogástricas) y el diámetro máximo de las arterias ilíacas comunes. Estos datos se extrajeron de la angio-TC preoperatoria.
Describimos datos del procedimiento como: el tipo de anestesia (general o raquídea), ASA del paciente, si fue urgente o electivo y si durante el mismo se asoció embolización hipogástrica. En cuanto a las características del dispositivo, definimos la configuración (bifurcado o aortounilíaco), la longitud y radio del cuerpo (mm), el radio distal de los componentes ilíacos, la relación de superficies proximal/distal (radio cuerpo2/radio módulo ilíaco derecho2+radio módulo ilíaco izquierdo2) y la zona de anclaje en arteria ilíaca común o externa, para cada uno de los ejes ilíacos en el caso de dispositivos bifurcados.
Realizamos seguimiento mediante angio-TC multicorte al mes, a los 6 meses y posteriormente de forma anual salvo hallazgos que a criterio del médico responsable recomendaran un seguimiento más estrecho. Registramos la presencia de TI, la fecha de la última angio-TC realizada, el fallecimiento del paciente, la presencia de endofuga, las complicaciones isquémicas de miembros inferiores y la adición de anticoagulación durante el seguimiento. Definimos el TI como aquella zona hipodensa adherida a la pared interna del dispositivo en imágenes en fase arterial de angio-TC con un grosor superior a 2mm en cuerpo y 1mm en módulos ilíacos. Describimos la incidencia de TI, su localización, el perímetro de circunferencia ocupado (<25, 25-49, 50-75 y >75%), la superficie del trombo (homogénea o heterogénea), la fecha de aparición, evolución del trombo (progresión, estabilidad o regresión) y fecha de desaparición, en su caso.
Dentro de las complicaciones isquémicas incluimos: trombosis de cuerpo protésico, trombosis de módulo ilíaco, episodios de isquemia arterial aguda tromboembólica de miembros inferiores, síndrome del dedo azul y registramos la necesidad de reintervención por las causas previas.
Realizamos un análisis descriptivo de los datos utilizando media, desviación estándar, número y porcentaje; y una comparación de variables cualitativas utilizando tablas de contingencia y chi-cuadrado, y de variables continuas utilizando t de Student, aportando la OR y su intervalo de confianza del 95%. Utilizamos Kaplan-Meyer para el cálculo del tiempo libre de trombo y de supervivencia. Se comparó con log-rank la supervivencia del grupo con TI y el grupo sin trombo. Y realizamos regresión logística para el análisis multivariante de los factores significativos en el análisis univariante.
ResultadosFueron tratados mediante reparación endovascular de aneurismas artoilíacos infrarrenales en el periodo de estudio 258 pacientes. De ellos incluimos en nuestros análisis final a 184.
Se excluyó: a 14 pacientes en los que se implantó endoprótesis diferente de Endurant®; a 37 pacientes cuyo seguimiento postoperatorio fue inferior a 5 meses; a 11 pacientes en los que se trataron complicaciones de dispositivos de implantación previa y a 12 pacientes en los que el tratamiento fue con extensiones ilíacas aisladas.
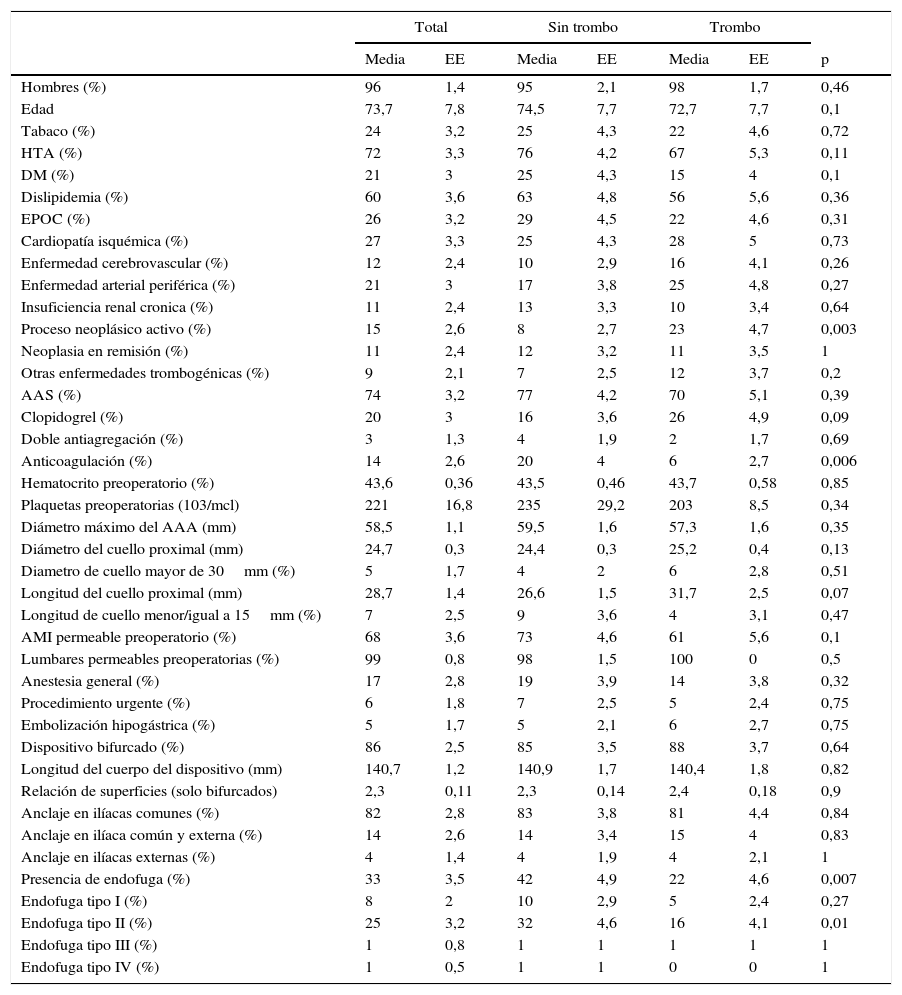
El 96% de los pacientes eran varones, con una edad media de 73,72 años. En la tabla 1 se recogen las características demográficas, comorbilidad asociada y tratamiento antiagregante o anticoagulante de los pacientes, así como los datos referentes a las características anatómicas preoperatorias del aneurisma aortoilíaco, al procedimiento y al tipo de dispositivo implantado.
Tabla de comparación de medias entre el grupo de pacientes con trombo intraprótesis y sin trombo
| Total | Sin trombo | Trombo | |||||
|---|---|---|---|---|---|---|---|
| Media | EE | Media | EE | Media | EE | p | |
| Hombres (%) | 96 | 1,4 | 95 | 2,1 | 98 | 1,7 | 0,46 |
| Edad | 73,7 | 7,8 | 74,5 | 7,7 | 72,7 | 7,7 | 0,1 |
| Tabaco (%) | 24 | 3,2 | 25 | 4,3 | 22 | 4,6 | 0,72 |
| HTA (%) | 72 | 3,3 | 76 | 4,2 | 67 | 5,3 | 0,11 |
| DM (%) | 21 | 3 | 25 | 4,3 | 15 | 4 | 0,1 |
| Dislipidemia (%) | 60 | 3,6 | 63 | 4,8 | 56 | 5,6 | 0,36 |
| EPOC (%) | 26 | 3,2 | 29 | 4,5 | 22 | 4,6 | 0,31 |
| Cardiopatía isquémica (%) | 27 | 3,3 | 25 | 4,3 | 28 | 5 | 0,73 |
| Enfermedad cerebrovascular (%) | 12 | 2,4 | 10 | 2,9 | 16 | 4,1 | 0,26 |
| Enfermedad arterial periférica (%) | 21 | 3 | 17 | 3,8 | 25 | 4,8 | 0,27 |
| Insuficiencia renal cronica (%) | 11 | 2,4 | 13 | 3,3 | 10 | 3,4 | 0,64 |
| Proceso neoplásico activo (%) | 15 | 2,6 | 8 | 2,7 | 23 | 4,7 | 0,003 |
| Neoplasia en remisión (%) | 11 | 2,4 | 12 | 3,2 | 11 | 3,5 | 1 |
| Otras enfermedades trombogénicas (%) | 9 | 2,1 | 7 | 2,5 | 12 | 3,7 | 0,2 |
| AAS (%) | 74 | 3,2 | 77 | 4,2 | 70 | 5,1 | 0,39 |
| Clopidogrel (%) | 20 | 3 | 16 | 3,6 | 26 | 4,9 | 0,09 |
| Doble antiagregación (%) | 3 | 1,3 | 4 | 1,9 | 2 | 1,7 | 0,69 |
| Anticoagulación (%) | 14 | 2,6 | 20 | 4 | 6 | 2,7 | 0,006 |
| Hematocrito preoperatorio (%) | 43,6 | 0,36 | 43,5 | 0,46 | 43,7 | 0,58 | 0,85 |
| Plaquetas preoperatorias (103/mcl) | 221 | 16,8 | 235 | 29,2 | 203 | 8,5 | 0,34 |
| Diámetro máximo del AAA (mm) | 58,5 | 1,1 | 59,5 | 1,6 | 57,3 | 1,6 | 0,35 |
| Diámetro del cuello proximal (mm) | 24,7 | 0,3 | 24,4 | 0,3 | 25,2 | 0,4 | 0,13 |
| Diametro de cuello mayor de 30mm (%) | 5 | 1,7 | 4 | 2 | 6 | 2,8 | 0,51 |
| Longitud del cuello proximal (mm) | 28,7 | 1,4 | 26,6 | 1,5 | 31,7 | 2,5 | 0,07 |
| Longitud de cuello menor/igual a 15mm (%) | 7 | 2,5 | 9 | 3,6 | 4 | 3,1 | 0,47 |
| AMI permeable preoperatorio (%) | 68 | 3,6 | 73 | 4,6 | 61 | 5,6 | 0,1 |
| Lumbares permeables preoperatorias (%) | 99 | 0,8 | 98 | 1,5 | 100 | 0 | 0,5 |
| Anestesia general (%) | 17 | 2,8 | 19 | 3,9 | 14 | 3,8 | 0,32 |
| Procedimiento urgente (%) | 6 | 1,8 | 7 | 2,5 | 5 | 2,4 | 0,75 |
| Embolización hipogástrica (%) | 5 | 1,7 | 5 | 2,1 | 6 | 2,7 | 0,75 |
| Dispositivo bifurcado (%) | 86 | 2,5 | 85 | 3,5 | 88 | 3,7 | 0,64 |
| Longitud del cuerpo del dispositivo (mm) | 140,7 | 1,2 | 140,9 | 1,7 | 140,4 | 1,8 | 0,82 |
| Relación de superficies (solo bifurcados) | 2,3 | 0,11 | 2,3 | 0,14 | 2,4 | 0,18 | 0,9 |
| Anclaje en ilíacas comunes (%) | 82 | 2,8 | 83 | 3,8 | 81 | 4,4 | 0,84 |
| Anclaje en ilíaca común y externa (%) | 14 | 2,6 | 14 | 3,4 | 15 | 4 | 0,83 |
| Anclaje en ilíacas externas (%) | 4 | 1,4 | 4 | 1,9 | 4 | 2,1 | 1 |
| Presencia de endofuga (%) | 33 | 3,5 | 42 | 4,9 | 22 | 4,6 | 0,007 |
| Endofuga tipo I (%) | 8 | 2 | 10 | 2,9 | 5 | 2,4 | 0,27 |
| Endofuga tipo II (%) | 25 | 3,2 | 32 | 4,6 | 16 | 4,1 | 0,01 |
| Endofuga tipo III (%) | 1 | 0,8 | 1 | 1 | 1 | 1 | 1 |
| Endofuga tipo IV (%) | 1 | 0,5 | 1 | 1 | 0 | 0 | 1 |
AAA: Aneurisma de aorta abdominal; AAS: spirina. AMI: Arteria mesentérica inferior; EPOC: enfermedad pulmonar obstructiva crónica; EE: error estándar; HTA: Hipertensión arterial; DM: Diabetes mellitus.
Observamos TI en 81 pacientes (44%). En el 72% apareció en cuerpo, en el 39% en rama derecha y en el 47% en rama izquierda. En cuanto al perímetro ocupado: en el 10% fue inferior a ¼ de la circunferencia; en el 20%, entre ¼ y ½; en el 19%, entre ½ y ¾; y en el 52% mayor de ¾.
En el análisis de los factores de riesgo asociados a la formación de TI encontramos una relación significativa con la presencia de cáncer activo como factor de riesgo (p=0,003; OR: 3,639; IC 95%; 1,501-8,825); y con la toma de tratamiento anticoagulante (p=0,006; OR: 0,257; IC 95%; 0,092-0,715) y la presencia de endofuga tipo II (p=0,013; OR: 0,406; IC 95%; 0,197-0,836) como factores protectores. El análisis multivariante de estos factores fue significativo para cada uno de ellos de forma independiente: cáncer activo (p=0,002; IC 95%; 1,715-11,462), anticoagulación (p=0,017; IC 95%; 0,093-0,792) y presencia de endofuga tipo II (p=0,005; IC 95%; 0,144-0,715).
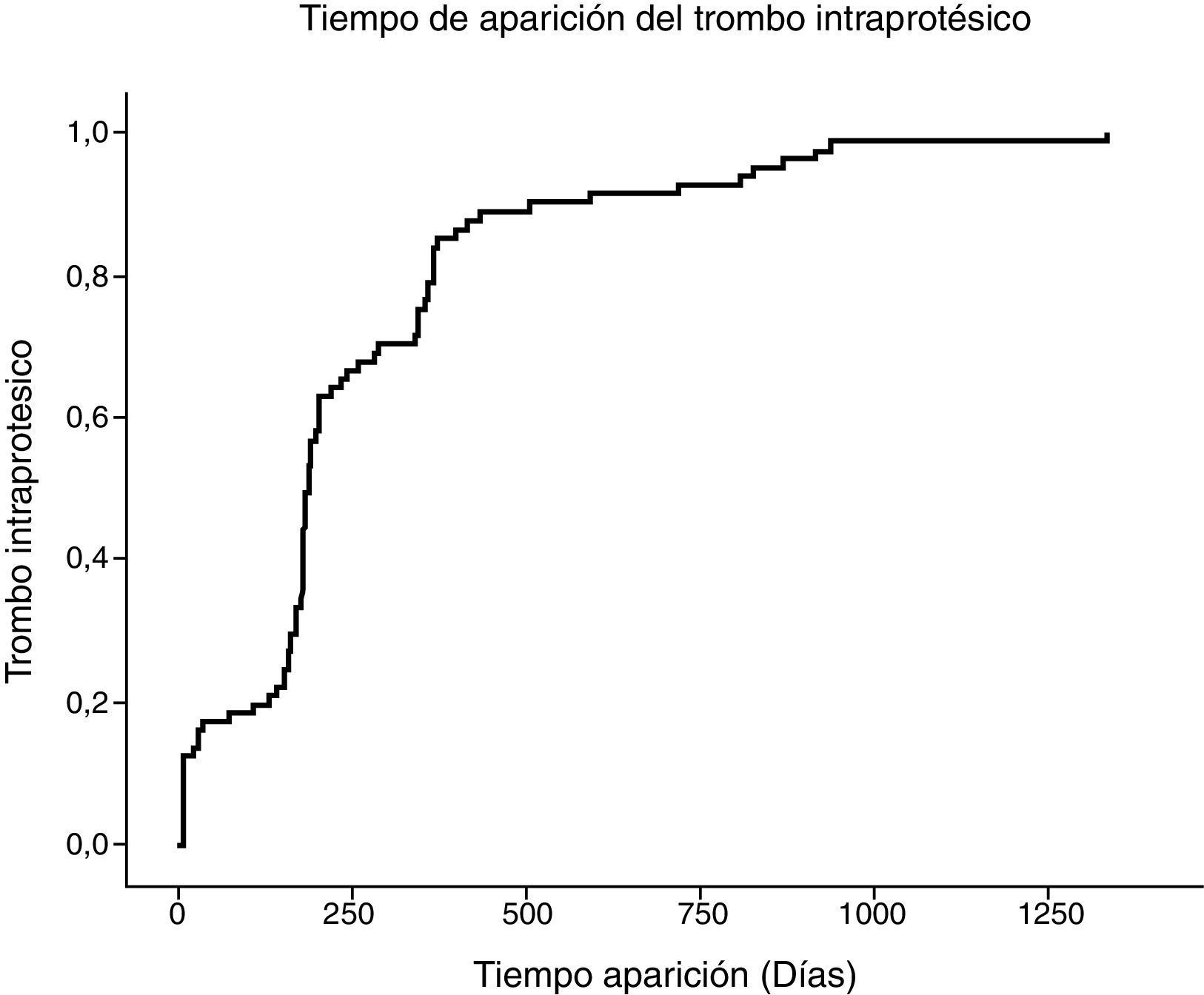
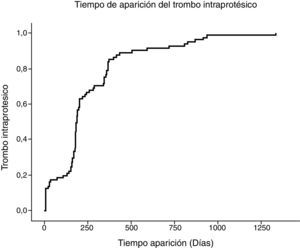
Realizamos un seguimiento medio de 20,87 meses. Entre los pacientes que desarrollaron TI, el 60% lo hizo dentro de los primeros 6 meses de seguimiento y el 83%, dentro del primer año; y observamos aparición de trombo incluso 3 años después del procedimiento. En la figura 1 se muestra la tabla de tiempo libre de desarrollo de trombo.
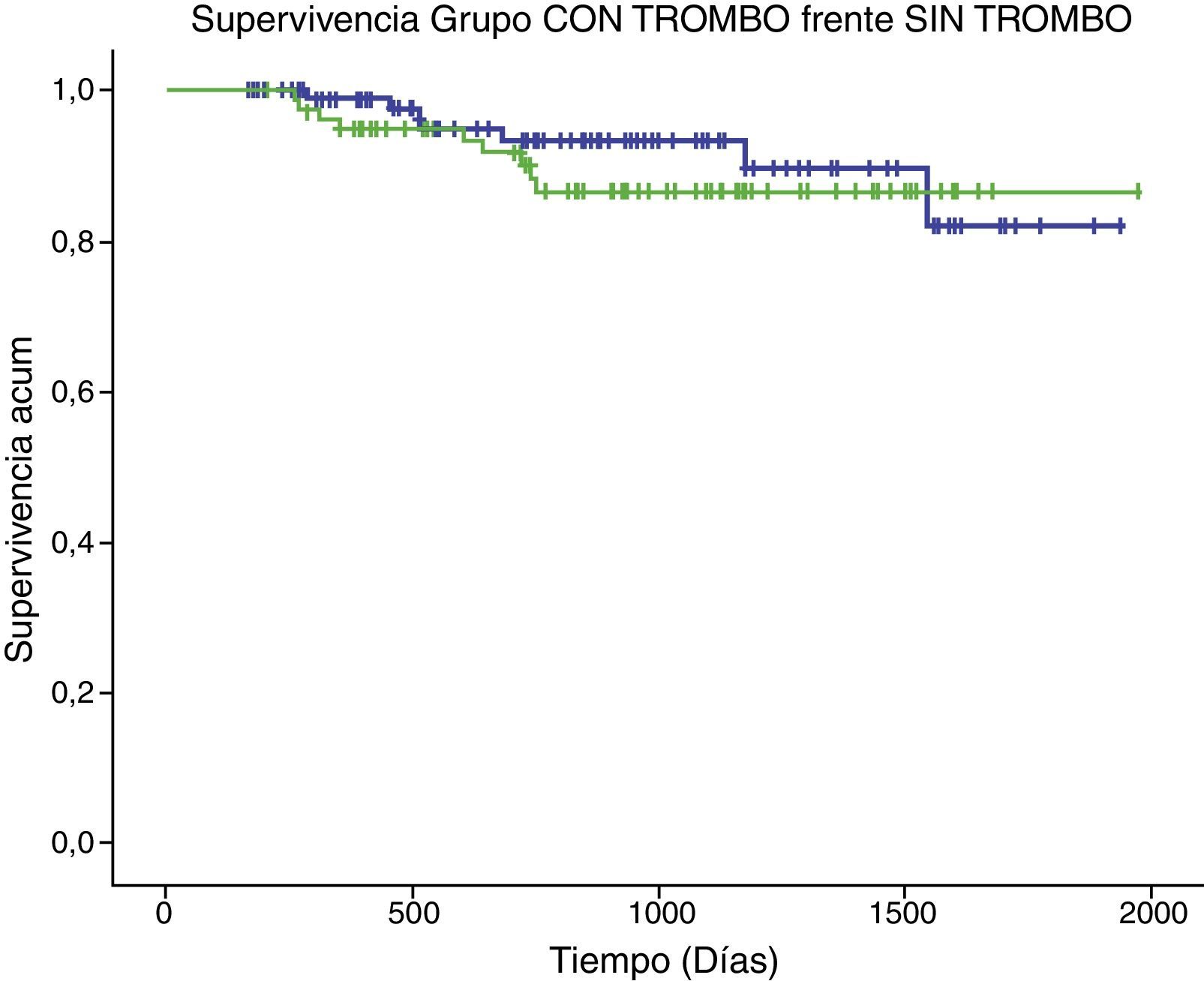
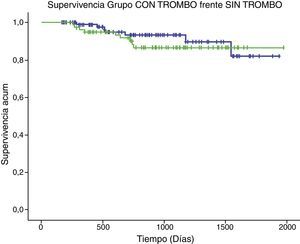
La supervivencia a medio plazo del grupo con trombo no obtuvo diferencias estadísticamente significativas con el grupo de pacientes sin trombo (p=0,472), como se muestra en la figura 2.
El comportamiento evolutivo del trombo fue hacia la estabilización en un 68%, progresión en un 25% y desaparición en un 7%. Durante el seguimiento se añadió anticoagulación oral en 4,9% de los pacientes con TI: en la mitad de los casos el TI desapareció y en el resto se mantuvo estable. En los pacientes con trombo en los que no se añadió tratamiento anticoagulante durante el seguimiento se observó desaparición en un 5%, estabilización en un 69% y progresión en el 26%. Al comparar la desaparición de TI entre los pacientes en los que se añadió anticoagulación (50%) frente a los que no (5%), obtuvimos una diferencia estadísticamente significativa (p=0,001).
En el total de la serie, se produjeron complicaciones isquémicas en 11 pacientes (6%), con trombosis de cuerpo en 2 de ellos (1%), trombosis de módulo en 4 (2%) y en el resto complicaciones isquémicas agudas en miembros inferiores sin trombosis del dispositivo. En 10 casos se precisó reintervención por estas complicaciones (5,4%). Entre los pacientes con TI hubo complicaciones isquémicas en el 7,4% (6/81 pacientes) y necesidad de reintervención en el 6,2% (5/81 pacientes). Entre los pacientes sin trombo hubo complicaciones isquémicas y necesidad de reintervención en el 4,8% (5/103 pacientes). La presencia de TI no se relaciona con la aparición de complicaciones isquémicas (OR: 1,57; IC 95%; 0,46-5,33), de trombosis de cuerpo (OR: 0,98; IC 95%; 0,95-1,01), de trombosis de módulo (OR: 0,42; IC 95%; 0,04-4,08) ni de reintervención por causa isquémica (OR: 1,29; IC 95%; 0,36-4,62).
El dispositivo bifurcado (frente al aortomonoilíaco) se presenta como un factor protector para el desarrollo de complicaciones (OR: 0,24; IC 95%; 0,06-0,89) y reintervención por causa isquémica (OR: 0,21; IC 95%; 0,05-0,79).
La presencia de enfermedad arterial periférica, tanto suprainguinal como infrainguinal, favorece la trombosis aguda de módulo ilíaco de forma significativa (OR: 12,43; IC 95%; 1,25-123,1).
DiscusiónNuestro trabajo sobre endoprótesis tipo Endurant II® muestra que la formación de TI es frecuente (44%) en nuestro medio, y que su curso clínico a corto-medio plazo es benigno.
Esta incidencia es llamativamente superior a la encontrada por otros autores: entre un 15,6 y un 24%1,4. Si bien es difícil comparar la incidencia entre los diferentes grupos ya que en las series publicadas no encontramos unos criterios claros que definan el TI2–5, excepto en el trabajo de Nelson et al., cuyos criterios son similares a los utilizados por nuestro grupo5. Además, los criterios de inclusión y de exclusión no son superponibles entre los diferentes trabajos, habiendo grupos que excluyen a pacientes con una ocupación por trombo inferior al 25% de la circunferencia (que nuestro grupo incluye)5 y otros que excluyen a pacientes con un seguimiento inferior a 24 meses (que nuestro grupo incluye)2.
Otra posible explicación a nuestra mayor incidencia de TI puede estar en el tipo de dispositivo utilizado. Implantamos en todos los pacientes endoprótesis tipo Endurant II®, cuyo material de recubrimiento es poliéster. Esta mayor tendencia a la formación de trombo en endoprótesis de poliéster frente a las de PTFE ya se expone en los estudios de Maleux et al. (33% de trombo en las de poliéster, frente a un 17% en las de PTFE)6, de Calvin et al. (60% en las de poliéster, frente a un 40% en las de PTFE)1, de Nelson et al.5 y de Mestres et al.2.
En la mayoría de los pacientes (83%), el trombo aparece durante el primer año de seguimiento; sin embargo, observamos su aparición hasta 3 años después de implantado el dispositivo. Esta aparición tardía con posibilidad de complicación se observa en el estudio de Katsargyris et al. con una oclusión de arteria renal 30 meses después del implante del dispositivo3. Esto contrasta con los resultados de otros estudios en los que la aparición es muchos más precoz: 89% en los primeros 6 meses2 o incluso 100% en los primeros 6 meses1.
Hemos observado que la presencia de cáncer activo es un factor favorecedor del desarrollo de TI, mientras que el tratamiento anticoagulante se presenta como un factor protector. Ambos hallazgos parecen fácilmente explicables por el estado protrombótico asociado a los procesos neoplásicos y el poder antitrombótico de los anticoagulantes. Sin embargo, un hallazgo sorprendente y que no hemos observado en la bibliografía consultada es que la presencia de endofuga tipo II es también un factor protector, con clara significación estadística en el análisis univariante (p=0,013; OR: 0,406; IC 95%; 0,197-0,836), para el desarrollo de TI, significación que mantiene, como factor independiente, tras el análisis multivariante (p=0,005; IC 95%; 0,144-0,715). Con los datos de este trabajo no podemos explicar la razón de esta asociación, pero creemos que puede dar pie a nuevas líneas de investigación que intenten relacionar ciertos estados pro- o anticoagulantes con el desarrollo de endofugas tipo II.
Cabe destacar que el tratamiento anticoagulante no es solo protector de cara al desarrollo del TI, sino que favorece su estabilización o desaparición. En nuestra serie de pacientes con trombo en los que se añadió anticoagulación no observamos progresión del trombo en ningún caso.
No encontramos relación entre el desarrollo de TI y el diámetro y longitud del cuello proximal del aneurisma, longitud y configuración del dispositivo, relación de superficies proximal/distal o el anclaje distal en arteria ilíaca externa. Nelson et al. tampoco encuentran relación con el anclaje en arteria ilíaca externa, ni con el tipo de dispositivo, pero señalan que cuellos de diámetros mayores y más cortos sí que favorecerían su aparición5. Esta última asociación también la describen Mestres et al., que además encuentran asociación con la configuración aortomonoilíaca2. Calvin et al., por su parte, encuentran solo asociación con el ratio en las endoprótesis bifurcadas1. No hemos valorado la asociación con trombo en aorta nativa, relación que se indica en la bibliografía revisada2,5.
En cuanto a la evolución clínica, el TI muestra un comportamiento benigno: no aumenta la mortalidad, el número de complicaciones isquémicas durante el seguimiento ni la reintervención por causa isquémica. Esto ha sido indicado también por diferentes autores, con periodos de seguimiento medio entre 1 y 4 años1,4–7.
Hemos encontrado relación entre la enfermedad arterial periférica y la trombosis de módulo ilíaco, como ya recogen algunos estudios4,8. La enfermedad arterial periférica empeora el flujo de salida del dispositivo, lo que favorecería la trombosis8. La influencia de las alteraciones hemodinámicas en la formación de trombo en el interior de las endoprótesis las señalan Chuh et al. en su estudio sobre modelos experimentales (geometría arterial, cuello angulado, tortuosidad y kinking ilíacos, diseño de endoprótesis, estenosis entre módulos y la sobredimensión excesiva)9.
En cuanto a su evolución tomográfica, también parece tener un comportamiento benigno, con tendencia a la estabilización e incluso a la desaparición (7%). Esta posibilidad de desaparición ya se recoge en la literatura5.
Nuestro trabajo presenta limitaciones entre las que destacamos que excluimos un número importante de pacientes, que es un estudio retrospectivo y que el seguimiento es solo a corto y medio plazo. No obstante, y teniendo en cuenta los pocos trabajos sobre TI realizados previamente, creemos que los hallazgos que hemos descrito en relación con la incidencia de TI, los factores asociados a su formación y su evolución son útiles para la práctica clínica y suponen un buen punto de partida para futuras investigaciones con un número de pacientes y un seguimiento más amplios.
ConclusionesEl TI es un hallazgo frecuente en nuestro medio que tiene un comportamiento clínico y tomográfico benigno a corto y medio plazo.
La anticoagulación y la presencia de endofuga tipo II se presentan como factores protectores, mientras que la neoplasia activa es un factor predisponente.
Además, la anticoagulación favorece la estabilización del TI una vez formado. Por ello, en caso de observar su progresión durante el seguimiento habitual de estos pacientes, creemos recomendable la adición de tratamiento anticoagulante.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNo tenemos conflicto de interés.
AgradecimientosMostramos nuestro agradecimiento a la SEACV y al II Curso Cómo escribir y publicar un artículo científico; a la Dra. Melina Vega de Ceniga, al Dr. Sergi Belmunt Montoya y a la Dra. Estrella Blanco Cañibano.