Resumen. Introducción. Las anomalías congénitas de la vena cava inferior (VCI), como la ausencia o la hipoplasia, son defectos poco frecuentes resultado de un probable desarrollo aberrante durante la embriogénesis. Estas anomalías parecen favorecer la estasis venosa y el desarrollo de una trombosis venosa profunda (TVP). Caso clínico. Mujer de 27 años con un episodio de TVP hace 10 años, sin alteraciones en el estudio trombofilico. El estudio posterior reveló una hipoplasia del segmento perirrenal de la VCI con una hipertrofia del sistema ácigos y hemiácigos. La paciente no ha vuelto a presentar nuevos episodios de TVP a pesar de no estar anticoagulada. Conclusiones. La ausencia de VCI es una anomalía congénita rara, considerada un factor de riesgo importante para el desarrollo de una TVP. Debe sospecharse su existencia en casos de TVP en personas jóvenes sin otra causa aparente, y deben realizarse pruebas de imagen (tomografia computarizada o resonancia magnética) para su diagnóstico. El tratamiento y el pronóstico de estos pacientes no se han esclarecido todavía. [ANGIOLOGÍA 2008; 60: 55–9]
Summary. Introduction. Congenital abnormalities of the inferior vena cava (IVC), such as absence or hypoplasia, are infrequent defects that are probably the result of aberrant development during embryogenesis. These abnormalities seem to favour both venous stasis and the development of deep vein thrombosis (DVT). Case report. A 27-year-old female with an episode of DVT 10 years before, and no alterations in the thrombophilic study. A later study revealed hypoplasia in the perirenal segment of the IVC with hypertrophy of the azygos and hemiazygos system. The patient has had no new episodes of DVT despite not being on anticoagulant therapy. Conclusions. The absence of IVC is a rare congenital anomaly, and is considered to be an important risk factor for developing DVT. Its existence should be suspected in cases of DVT in young people where there is no other apparent cause; imaging tests (computerised axial tomography or magnetic resonance) must be performed to be able to diagnose it. The treatment and prognosis of these patients are still largely unknown. [ANGIOLOGÍA 2008; 60: 55–9]
La incidencia de trombosis venosa profunda (TVP) se estima en 1 caso de cada 1.000 habitantes al año, y es 10 veces menor en adultos entre 20 y 40 años [1, 2].
Las malformaciones congénitas de la vena cava inferior (VCI) están presentes en el 0,3-0,5% de los individuos sanos y en el 0,6-2% de los pacientes con otras anomalías cardiovasculares [3-5]. Las más frecuentes son la presencia de una VCI izquierda y la duplicación de la VCI (0,2-3%) [3, 6]. La agenesia de la VCI tiene una incidencia de 0,0005-1% en la población general y algunos estudios recientes parecen confirmar su papel como un importante factor de predisposición para el desarrollo de una TVP en personas jóvenes. Algunos autores estiman su prevalencia en un 5% [2, 3].
Presentamos el caso de una mujer de 27 años con una hipoplasia de la VCI infrarrenal con antecedentes de TVP, sin otros factores de riesgo asociados.
Caso clínicoMujer de 27 años, sin factores de riesgo conocidos, que acudió a nuestra consulta por una clínica flebostática en los miembros inferiores, más importante en el miembro inferior derecho, de largo tiempo de evolución. La paciente refirió haber sufrido un episodio de TVP en el miembro inferior derecho hace 10 años, diagnosticado por eco-Doppler, sin causa etiológica aparente (traumatismo, cirugía, fármacos) y con estudio trombofílico (antitrombina III, proteína C, resistencia a la proteína C activada, proteína S libre, anticuerpos anticardiolipínicos inmunoglobulinas G y M, A2 antiplasmina, plasminógeno y fibrinógeno) dentro de la normalidad. Fue tratada con anticoagulación durante tres meses, medidas posturales y soporte elástico, sin realizarse otros estudios complementarios.
En la exploración física presentaba un edema moderado y un aumento de calibre en el miembro inferior derecho, varices tronculares infrageniculares, colateralidad venosa inguinal y desarrollo de la circulación colateral en la pared abdominal.
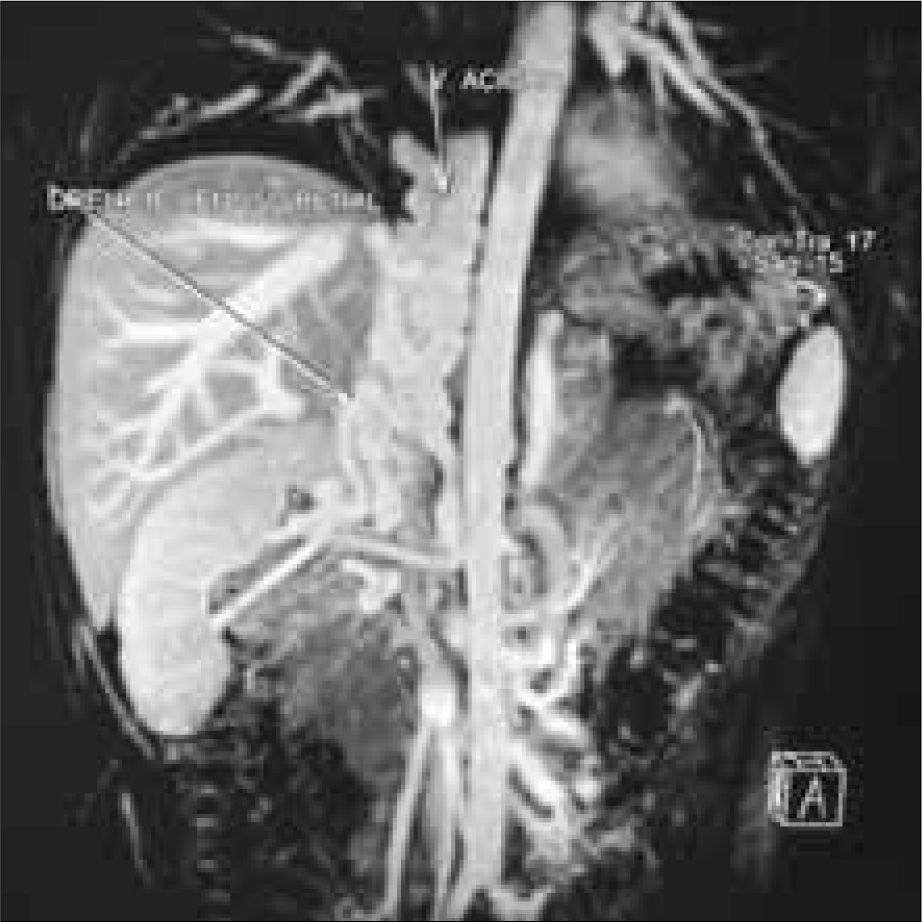
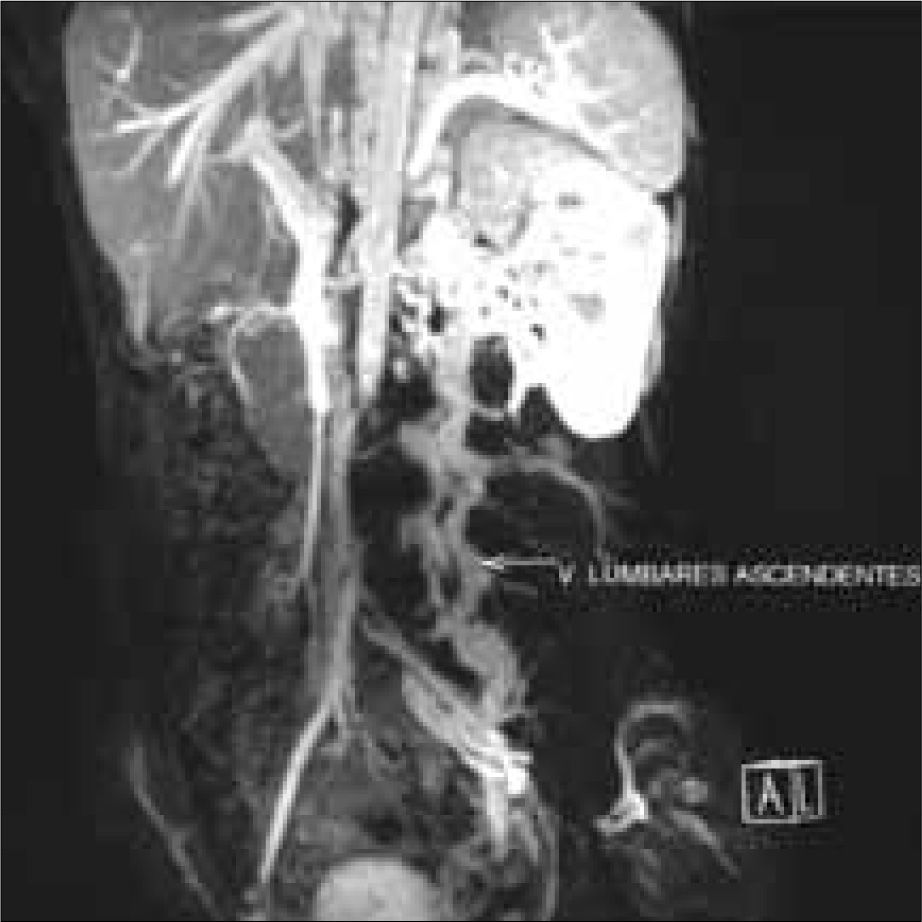
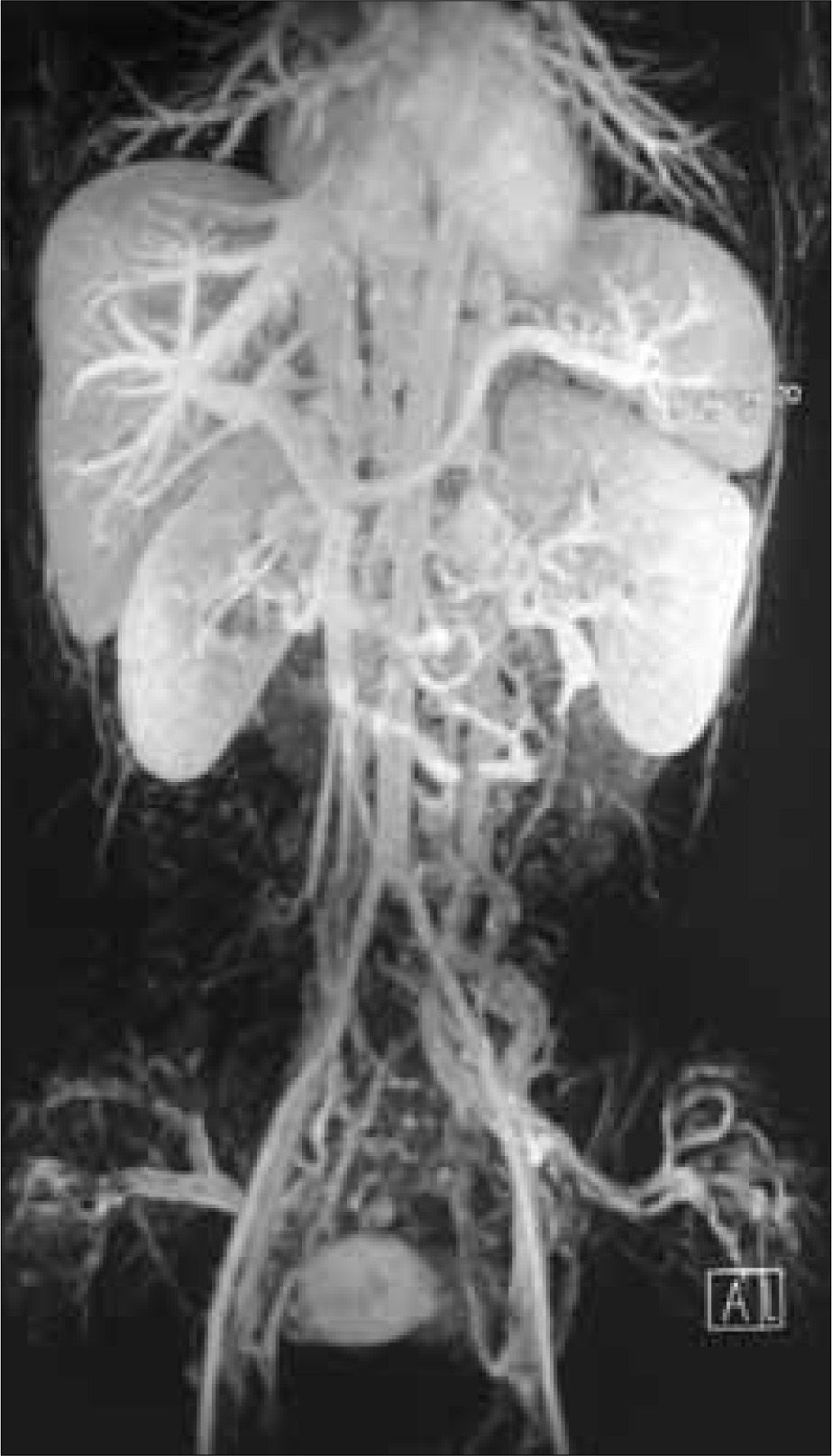
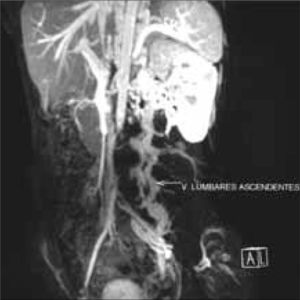
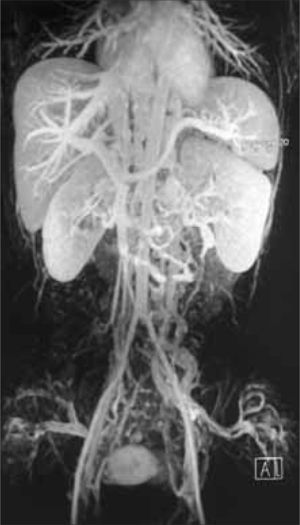
Se realizó un nuevo estudio trombofílico, que fue normal. En la angiorresonancia magnética se objetivó un temprano contraste de las venas renales bilaterales, las cuales formaban un conglomerado de venas varicosas que desembocaban en un sistema de la vena ácigos y hemiácigos, ambas hipertrofiadas y permeables en todo su recorrido prevertebral, junto con una hipertrofia de las venas lumbares. También se observó la hipoplasia de la VCI desde unos centímetros distal al nivel de la arteria renal derecha, cranealmente, hasta poco antes de su porción intrahepática. Las venas suprahepáticas y el eje esplenoportal no mostraron hallazgos patológicos. No se objetivaron anomalías en el sistema arterial (Figs. 1, 2 y 3).
Se realizó un seguimiento clínico de la paciente cada seis meses. Dado que la paciente no había vuelto a presentar nuevos episodios de TVP, se decidió un tratamiento con soporte elástico, medidas posturales y ejercicio, sin asociar ninguna anticoagulación en el momento actual.
DiscusiónLa VCI se desarrolla en un complicado proceso embriológico entre la sexta y la octava semana de gestación, por fusión y regresión de tres pares de venas del sistema cardinal: supracardinal, cardinal posterior y subcardinal. La ausencia de la VCI suprarrenal ocurre como resultado del fallo en la formación de la vena subcardinal derecha: el segmento hepático drena directamente en la aurícula derecha y la sangre de la VCI infrarrenal drena a través de las venas ácigos y hemiácigos; se asocia con otras anomalías cardíacas y viscerales. La ausencia de la VCI infrarrenal, con preservación del segmento suprarrenal, implica un fallo en el desarrollo de la vena supracardinal derecha. La ausencia completa de la VCI implica un fallo en el desarrollo de los tres pares venosos [3, 5, 7]. De los casos con malformación congénita de VCI, el 90% afecta a la porción suprarrenal, mientras que sólo el 6% lo hace al segmento renal o infrarrenal [5, 7, 8]. Las razones para este fallo en el desarrollo no están claras y aunque la mayoría cree que la causa es una disgenesia embrionaria de los segmentos o de la totalidad de la VCI, otros autores sugieren que la ausencia infrarrenal de la VCI no se debe a un fallo embrionario en su origen, sino al resultado de trombosis intrauterinas o perinatales [5].
Algunos artículos recientes han enfatizado el papel de las anomalías genéticas de la VCI como factor de riesgo potencial para el desarrollo de TVP en personas jóvenes. Aunque la ausencia o hipoplasia de la VCI congénita puede ser asintomática, esta anomalía causa una estasis venosa y una posterior TVP, incluso si se asocia con una hipertrofia del sistema ácigos y hemiácigos [4, 9]. El porcentaje de agenesia de la VCI en pacientes menores de 30 años con TVP se estima en torno al 5–6,7% [2, 5], con afectación bilateral en el 0,8-8.6% de éstos [1]. Así, la presencia de una agenesia o hipoplasia de la VCI debe considerarse en pacientes jóvenes con TVP idiopática, recurrente y/o bilateral. La ausencia de factores desencadenantes o defectos en los factores de la coagulación que predispongan un estado de hipercoagulabilidad también aboga a favor de que la agenesia de la VCI podría ser una causa suficiente para el desarrollo de una TVP.
La ecografía Doppler es el principal test diagnóstico para la TVP, con una sensibilidad de hasta el 97%, según las series, en pacientes sintomáticos [10]. En caso de sospecha de posibles anomalías de VCI asociadas, es preciso la realización de una angiotomografía computarizada o una angiorresonancia magnética [5]. Si estas pruebas no son concluyentes y la sospecha es alta, podría estar indicada la realización de una cavografía [10].
No existen datos suficientes para establecer cuál es el manejo adecuado de la TVP asociada con anomalías de la VCI. En el momento agudo es necesaria la anticoagulación (heparina sódica, heparina de bajo peso molecular), aunque la duración del tratamiento anticoagulante no está establecida. Se recomienda una duración del tratamiento entre seis semanas y tres meses tras un episodio inicial de TVP de causa reversible y limitada en el tiempo. En TVP idiopáticas, generalmente se recomienda un tratamiento de seis meses; si se asocia un déficit de proteínas de la coagulación, se recomienda continuar el tratamiento durante largos períodos, incluso posiblemente de por vida. Se recomienda mantener un tratamiento indefinido en la TVP recurrente y en la TVP asociada a una neoplasia activa [10]. En los casos de TVP asociados a anomalías de la VCI, la mayoría de autores opta por la anticoagulación de por vida, basándose en el riesgo de recurrencia de la TVP, aunque éste no esté completamente establecido. Existe otro caso descrito en la bibliografía en el que sólo se asoció anticoagulación durante seis meses y el paciente se encontraba asintomático a los 22 meses [1]. En nuestro caso, la paciente llevaba 10 años sin presentar nuevos episodios de TVP, por lo que se decidió mantenerla sin anticoagulación. En los casos de TVP iliofemoral se ha propuesto la fibrinólisis como opción terapéutica; sin embargo, en aquellos casos de TVP iliofemoral asociados a una agenesia de la VCI, esta técnica no ha obtenido buenos resultados (tres casos descritos con fallo del tratamiento en dos de ellos) [5]. Se debe asociar el uso de soporte elástico, medidas posturales, ejercicio y evitar todos los factores de riesgo adicionales, como la inmovilización prolongada y el uso de anticonceptivos. Se desconoce el pronóstico a largo plazo de estos pacientes, aunque se cree que probablemente tengan una tasa de supervivencia normal [3].
En conclusión, las anomalías de la VCI son una patología rara, que se ha descrito como un factor asociado al desarrollo de TVP. En aquellos pacientes jóvenes con TVP, sin factores de riesgo asociados, debe sospecharse la posible existencia de una agenesia de la VCI y ampliar el estudio con una prueba de imagen (tomografía computarizada o resonancia magnética). No hay datos suficientes para establecer el tratamiento de estos pacientes, aunque la mayoría aboga por la anticoagulación de por vida.